Tratamiento hospitalario de la bronquiolitis moderada-grave: ¿suero salino hipertónico o fisiológico? Análisis de factores de riesgo asociados al reingreso
Mario Ferrer Vázqueza, Marta Álvarez Martína, Ana Delgado Vicentea, Laura Álvarez Chamorrob, Ricardo Tosca Seguraa
aUnidad de Neumología y Alergia Pediátricas. Hospital General Universitario de Castellón. Castellón de la Plana. España.
bPediatra. CS Cariñena. Vilarreal. Castellón. España.
Correspondencia: M Ferrer . Correo electrónico: maferrer@uji.es
Cómo citar este artículo: Ferrer Vázquez M, Álvarez Martín M, Delgado Vicente A, Álvarez Chamorro L, Tosca Segura R. Tratamiento hospitalario de la bronquiolitis moderada-grave: ¿suero salino hipertónico o fisiológico? Análisis de factores de riesgo asociados al reingreso. Rev Pediatr Aten Primaria. 2019;21:e31-e40.
Publicado en Internet: 17-06-2019 - Número de visitas: 36834
Resumen
Introducción: a pesar de los numerosos estudios publicados hasta la fecha sobre el tratamiento hospitalario de la bronquiolitis y de la prometedora eficacia del suero salino hipertónico, lo cierto es que existe controversia al respecto.
Material y métodos: estudio observacional prospectivo que evalúa la eficacia del suero salino hipertónico al 3% frente al suero fisiológico en el tratamiento hospitalario de la bronquiolitis, en términos de reducción de estancia y de puntuación de escala clínica de gravedad; en una segunda fase se analizan factores de riesgo asociados al reingreso por broncoespasmo de los mismos pacientes.
Resultados: se analizan 67 de los 73 pacientes ingresados por bronquiolitis, de los cuales 9 recibieron fisiológico y 58 hipertónico, con o sin broncodilatador asociado. La estancia hospitalaria fue de 6,07 ± 3,12 días para el grupo fisiológico, y de 6,67 ± 4,36 días para el grupo con hipertónico. La media de la puntuación (Wood-Downes modificado por Ferrés) para el grupo con fisiológico fue de 3,67 ± 1,1 y de 3,16 ± 1,1 para los que recibieron hipertónico. Para la segunda fase se obtiene una tasa de reingresos del 8,2%.
Conclusiones: no encontramos diferencias significativas entre ambos grupos en tiempo de hospitalización ni en mejoría de escala clínica y días de oxigenoterapia. Pese al reducido tamaño muestral no observamos ninguna tendencia a favor de diferencias significativas en nuestra muestra. Los factores más relacionados con el reingreso han sido la edad menor a 6 meses, el sexo masculino, el tener hermanos mayores y el tabaquismo familiar.
Palabras clave
● Broncoespasmo ● Bronquiolitis ● Nebulizadores ● Pediatría ● Solución salina hipertónicaINTRODUCCIÓN
Las infecciones respiratorias agudas constituyen las enfermedades infecciosas más frecuentes en el ser humano1. En lo referente a la Pediatría, la bronquiolitis aguda (BA) es la infección del tracto respiratorio inferior más frecuente en el lactante2, siendo la principal causa de ingreso por infección respiratoria aguda de vías bajas en menores de dos años3. Especialmente importante en menores de seis meses, teniendo este rango de edad hasta el 93% del total de ingresos por BA en algunas series4. Por tanto, su importancia radica en la elevada morbilidad, así como en los costes sociales y económicos que genera5.
Los criterios diagnósticos más aceptados según los consensos actuales son los clásicos propuestos por McConnochie, que considera la BA el primer episodio agudo de dificultad respiratoria con sibilancias, precedido por un cuadro catarral de vías altas (rinitis, tos, con/sin fiebre), que afecta a niños menores de dos años, aunque preferentemente se da en el primer año de vida y muchos autores se centran más en ese periodo3,4. El segundo o ulteriores episodios, constituyen un cuadro denominado lactante sibilante recurrente, o broncoespasmo (BE) de repetición6.
Es importante diferenciar la BA de los BE de repetición porque, a pesar de poder estar relacionadas debido a factores de riesgo asociados (mayor probabilidad de ser lactante sibilante recurrente en pacientes con BA)5,7,8, el manejo terapéutico va a ser diferente según las características del paciente.
Existen numerosos estudios de intervención para mejorar el tratamiento de la BA, pero todavía existe mucha controversia, y falta de pruebas sobre cuál es el mejor tratamiento para los niños hospitalizados con bronquiolitis moderada-grave9. La mayoría de las discrepancias radican en el empleo de broncodilatadores (salbutamol y adrenalina) inhalados o nebulizados utilizando soluciones salinas como vehículo: suero salino fisiológico (SSF) (0,9%) o suero salino hipertónico (SSH) 3%9,10, así como en el uso de corticoides sistémicos11,12 o la utilización del SSH como tratamiento sin broncodilatador13,14.
Partimos de un estudio inicial, retrospectivo observacional, en nuestro centro, comprendiendo los periodos de enero de 2013 a marzo de 201415. Incluíamos en él a pacientes ingresados por BA, separando en dos grupos según recibieron SSH 3% o SSF, con o sin broncodilatadores. Valoramos la estancia media hospitalaria, no encontrando diferencias significativas entre ambos grupos en términos de medias de estancia hospitalaria, 5,93 días (± 3 desviaciones estándar [DE]) para el grupo de SSH y 5,96 (± 2,64 DE) para el de SSF.
MATERIAL Y MÉTODOS
Objetivos
El objetivo principal de la primera fase de este estudio es valorar si existe mayor eficacia del SSH 3% frente al SSF en el tratamiento de la BA, en términos de reducción de estancia hospitalaria. Como objetivos secundarios: valorar si existe mayor efectividad del SSH 3% frente al SSF en términos de reducción de la sintomatología, mediante la medición de escalas de valoración clínica al ingreso y diariamente.
El objetivo principal de la segunda fase del estudio es descubrir los factores de riesgo asociados a los BE de repetición16,17, así como la tasa de reingresos.
Diseño del estudio
Estudio longitudinal observacional prospectivo de cohortes no intervencionista, en condiciones de práctica clínica habitual. Se realiza en dos fases:
- Primera fase: pacientes que ingresan con el diagnóstico de BA en el periodo del estudio, divididos en dos cohortes: aquellos que recibieron tratamiento nebulizado con SSH 3% y aquellos que recibieron tratamiento nebulizado clásico con SSF. En ambos se pudieron pautar otros tratamientos y añadir o no broncodilatadores a la nebulización, a criterio facultativo. La nebulización, ya sea con o sin broncodilatador, se realizó con mascarilla hospitalaria y aire medicinal (salvo en aquellos pacientes que precisaban oxigenoterapia), a flujos entre 6-8 lpm, y con un volumen total de SSH 3% o SSF de 3 ml.
- Segunda fase: reingresos de aquellos pacientes inicialmente estudiados en la primera fase, por episodios de BE, dentro del periodo del estudio. Se analizaron los posibles factores de riesgo para el reingreso, así como posibles tratamientos de base o circunstancias concomitantes.
La asignación de un paciente a una estrategia terapéutica concreta no está decidida de antemano por el protocolo del estudio, sino que está determinada por la práctica habitual, y la decisión de prescribir un medicamento determinado está claramente disociada de la decisión de incluir al paciente en el estudio. No se aplicó a los pacientes ninguna intervención, ya sea diagnóstica o de seguimiento, que no sea la habitual de la práctica clínica.
El estudio fue aprobado por el comité de ética e investigación clínica local.
Periodo de estudio
Se recogieron datos desde el 1 septiembre de 2015, hasta el 30 de marzo de 2016 para la primera fase, periodo de mayor incidencia de patología respiratoria, y hasta el 30 de junio de 2016 para la segunda fase. Para esta última se alargó el periodo de estudio para intentar reclutar la mayor cantidad de pacientes posibles por curso escolar completo, que precisaron reingreso en el Servicio de Pediatría del Hospital General Universitario de Castellón.
Población de estudio y selección de pacientes
Criterios de inclusión en la primera fase: 1) pacientes menores de dos años que ingresan en nuestro servicio con el diagnóstico de BA, según los criterios clásicos aceptados en el consenso nacional3; y 2) inicio de tratamiento nebulizado a criterio facultativo.
Se realizó, por disponibilidad y protocolo de ingreso, determinación de virus respiratorio sincitial (VRS) en aspirado nasal.
En la segunda fase incluimos a los mismos pacientes del ingreso previo, menores de tres años en este caso que, tras su seguimiento durante el periodo de estudio, reingresaron con el diagnóstico de broncoespasmo, bronquitis espástica, bronquitis obstructiva o patología asociada a hiperreactividad bronquial secundaria.
Variables principales y secundarias
En la primera fase del estudio la variable principal fueron los días de estancia hospitalaria.
Se recogieron otras variables:
- Cualitativas dicotómicas: aerosolterapia, empleo de otros tratamientos (broncodilatadores, antibioterapia, corticoterapia), características demográficas (presencia de tabaquismo familiar, antecedentes personales o familiares de atopia, asma, prematuridad 35-32 semanas, displasia broncopulmonar, tratamiento con palivizumab, infección por VRS, sexo, hacinamiento, asistencia a guardería, peso al nacimiento menor de 2500 g, edad materna menor de 25 años y hermanos mayores).
- Cualitativas categóricas: etnia, trimestre de nacimiento.
- Cualitativas ordinales: puntuación de la escala de valoración clínica (escala de Wood Downes modificada por Ferrés); aunque no existe evidencia suficiente que avale el uso de un sistema de puntuación de gravedad en los pacientes con bronquiolitis, está muy extendido el uso de esta escala18, motivo por el que la utilizamos en nuestro estudio.
- Cuantitativas discretas: días de oxigenoterapia y edad (en meses).
En la segunda fase la variable principal fue el número de reingresos hospitalarios. Se analizaron los resultados teniendo en cuenta las variables anteriores, analizándolas como factores de riesgo y añadiendo la presencia o no de tratamiento de base y la media de estancia hospitalaria en el primer ingreso.
Ambas fases, aunque pudieron coexistir en el tiempo, se analizaron por separado.
Análisis estadísticos
Para la primera fase se realizó una descripción de las variables mediante porcentajes o medias o medianas. Se tomó como H0 la no diferencia de la media de estancia hospitalaria en ambos grupos. Se estudió la normalidad de la muestra mediante test de Kolmogorov-Smirnov.
Se valoró, inicialmente, mediante un análisis bivariante, la posible relación entre la utilización de SSF y SSH en la mejoría clínica (puntuación escala de gravedad), se aplicó el test t de Student. Después se analizó la relación entre los factores de riesgo y la estancia hospitalaria. En las variables cualitativas se realizó una prueba de t de Student y en las cuantitativas una regresión lineal. Se realizó una regresión lineal multivariante para evaluar los factores de riesgo, que influyen en la estancia hospitalaria, con el cálculo de la odds ratio. Se controlaron los posibles factores de confusión y las interacciones.
Para la segunda fase dado el escaso tamaño de la muestra se realizó un estudio descriptivo de los niños que reingresaron.
Los valores estadísticos se dieron con intervalos de confianza del 95%. Se aceptó una significación estadística <0,05. Se utilizó el paquete estadístico SPSS® versión 22.
RESULTADOS
Datos generales
Desde el 1 septiembre de 2015, hasta el 30 de marzo de 2016, ingresaron en nuestro centro 73 pacientes menores de dos años con el diagnóstico de BA. De ellos 46 pacientes eran varones (63%) y 27 mujeres (37%). Ampliando el periodo de estudio hasta el 30 de septiembre del 2016, reingresaron por BE 6 pacientes (un 8,2 %).
Primera fase
En la Tabla 1 se recogen los factores de riesgo y datos epidemiológicos de los pacientes. Ningún paciente de nuestra muestra tenía antecedente de prematuridad menor de 32 semanas, malformación pulmonar, fibrosis quística, inmunodeficiencia, displasia broncopulmonar, enfermedad neuromuscular o metabólica.
| Tabla 1. Datos epidemiológicos de la muestra | |||||||
|---|---|---|---|---|---|---|---|
| N | % | N | % | ||||
| Sexo | Varón Mujer |
46 27 |
63 37 |
Cardiopatía significativa | 4 | 5,5 | |
| Edad | <6 meses 6-12 meses >12 meses |
63 9 1 |
86,3 12,3 5,4 |
Edad materna <25 años | 6 | 8,2 | |
| Trimestre de nacimiento | 1.º trimestre 2.º trimestre 3.º trimestre 4.º trimestre |
11 7 18 37 |
15,1 9,6 24,7 50,7 |
Hacinamiento social | 7 | 9,6 | |
| Etnia | Árabe Caucásica Gitana Latinoamericana |
6 61 5 1 |
8,2 83,6 6,8 1,4 |
Antecedentes de atopia | Personal Familiar |
7 19 |
9,6 26 |
| Asistencia a guardería | 8 | 11 | Antecedentes familiares de asma | 22 | 30,1 | ||
| Tabaquismo familiar | 32 | 43,8 | Infección por VRS | 43 | 58,9 | ||
| Hermanos mayores | 45 | 61,6 | Profilaxis con palivizumab | 3 | 4,1 | ||
| Prematuridad 35-32 s | 8 | 11 | Ingreso en UCI | 3 | 4,1 | ||
| Peso al nacimiento <2500 g | 14 | 19,2 | |||||

En la Tabla 2 se recogen los principales tratamientos empleados en la fase aguda de la bronquiolitis. Seis pacientes recibieron ambos sueros, por lo que se han considerado perdidos para el análisis de la primera fase, no así para la segunda. Se recogen aquellos con SSF y SSH 3% con o sin broncodilatador asociado y el tipo de este, entre otros tratamientos. Oxigenoterapia con gafas nasales o mascarilla tipo Venturi.
| Tabla 2. Tratamientos empleados | ||||||
|---|---|---|---|---|---|---|
| N | % | N | % | |||
| Sueroterapia | SSF SSH Pérdidas |
9 58 6 |
13,4 86,6 |
Solo SSH | 17 | 25 |
| Adrenalina + SSH | 25 | 37,3 | Macrólidos | 9 | 12,3 | |
| Adrenalina + SSF | 2 | 3 | Corticoides parenterales | 3 | 4,1 | |
| Salbutamol + SSH | 16 | 23,9 | Oxigenoterapia | 36 | 49,3 | |
| Salbutamol + SFF | 7 | 10,4 | Otros antibióticos | 12 | 16,4 | |
| Solo SSF | 0 | 0 | ||||

Se recogieron las puntuaciones de la escala de gravedad clínica Wood Downes modificada por Ferrés18 (al ingreso, del primer al cuarto día de estancia y la media), días de oxigenoterapia y estancia hospitalaria. Destacamos como más relevante la puntuación medida al segundo día de ingreso, dado que nos aporta más información sobre la respuesta al tratamiento, y es más homogénea en su determinación.
Si analizamos la puntuación de la escala de gravedad y la edad de los pacientes, 23 ingresaron con bronquiolitis leve (puntuación 1-3 puntos), 43 pacientes con moderada (puntuación 4-7 puntos) y tres como grave (puntuación 8-14 puntos). Tras realizar el test ANOVA, observamos que al ingreso los pacientes con bronquiolitis leve tenían una media de edad de menos de tres meses, bronquiolitis moderada una media de cinco meses y bronquiolitis grave, menos de dos meses, pero sin una relación estadísticamente significativa (p = 0,74).
En la Tabla 3 se muestra la estancia hospitalaria en relación con los factores de riesgo de bronquiolitis y tratamientos recibidos. No existen diferencias estadísticamente significativas en cuanto a la estancia en función del tratamiento con SSF o SSH. Destacamos que, en nuestro estudio, la presencia de VRS no influye en los días de estancia hospitalaria.
| Tabla 3. Factores de riesgo relacionados con la estancia hospitalaria | ||||
|---|---|---|---|---|
| Media (días ingreso) ± DE | p | IC 95 | ||
| Aerosolterapia | SSH SSF |
6,07 días ± 3,12 6,67 días ± 4,36 |
0,99 | -2,44 a 2,42 |
| Adrenalina | Sí No |
8,19 ± 4,07 4,93 ± 1,99 |
0,0005 | -4,95 a -1,5 |
| Salbutamol | Sí No |
5,81 ± 3,33 6,33 ± 3,32 |
0,52 | -1,09 a 2,12 |
| Corticoides parenterales | Sí No |
10,33 ± 2,52 5,96 ± 3,23 |
0,024 | -8,15 a -0,59 |
| Antibióticos no macrólidos | Sí No |
8,50 ± 4,23 5,67 ± 2,92 |
0,045 | -5,58 a -0,07 |
| Género | Varón Mujer |
6,11 ± 3,48 6,19 ± 3,05 |
0,92 | -1,68 a 1,5 |
| Hermanos mayores | Sí No |
6,73 ± 3,34 5,18 ± 3,08 |
0,05 | -3 a 0 |
| Prematuridad 32-35 s | Sí No |
7,13 ± 4,58 6,02 ± 3,14 |
0,52 | -4,596 a 2,45 |
| Tabaquismo | Sí No |
6,53 ± 3,57 5,83 ± |
0,37 | -2,26 a 0,86 |
| VRS | Sí No |
6,72 ± 3,14 5,3 ± 3,02 |
0,07 | -2,96 a 0,12 |
| Atopia | Sí No |
6,19 ± 3,27 6,11 ± 3,36 |
0,92 | -1,7 a 1,5 |
| Peso al nacer <2500 g | Sí No |
7,14 ± 3,92 5,9 ± 3,14 |
0,21 | -3,19 a 0,709 |
| Edad maternal <25 años | Sí No |
7 ± 3 6,06 ± 3,34 |
0,51 | -3,76 a 1,83 |
| Antecedentes familiares de asma | Sí No |
6,32 ± 3,87 6,06 ± 3,07 |
0,76 | -1,95 a 1,4 |
| Hacinamiento | Sí No |
6,8 ± 2,85 6,06 ± 3,36 |
0,55 | -3,43 a 1,83 |

Se ha estudiado la efectividad del SSH y del SSF. En la Tabla 4 se observa que no existen diferencias estadísticamente significativas en ambos sueros en términos de reducción de la sintomatología de bronquiolitis, mediante la medición de la puntuación de la escala clínica (Wood-Downes modificada por Ferrés) al ingreso y diarios; y días en los que se ha precisado oxigenoterapia.
| Tabla 4. Sueroterapia-mejoría clínica (en términos de puntuación escala WDM) | ||||
|---|---|---|---|---|
| Media ± DE | p | IC 95 | ||
| Puntuación al ingreso | SSF SSH |
4,33 puntos ± 1,32 4,12 puntos ± 1,76 |
0,73 | -1,01 a 1,43 |
| Puntuación media | SSF SSH |
3,67 puntos ± 1,1 3,16 puntos ± 1,1 |
0,2 | -0,28 a 1,30 |
| Oxigenoterapia | SSF SSH |
2,33 días ± 2,06 2,34 días ± 3,55 |
0,99 | -2,44 a 2,42 |

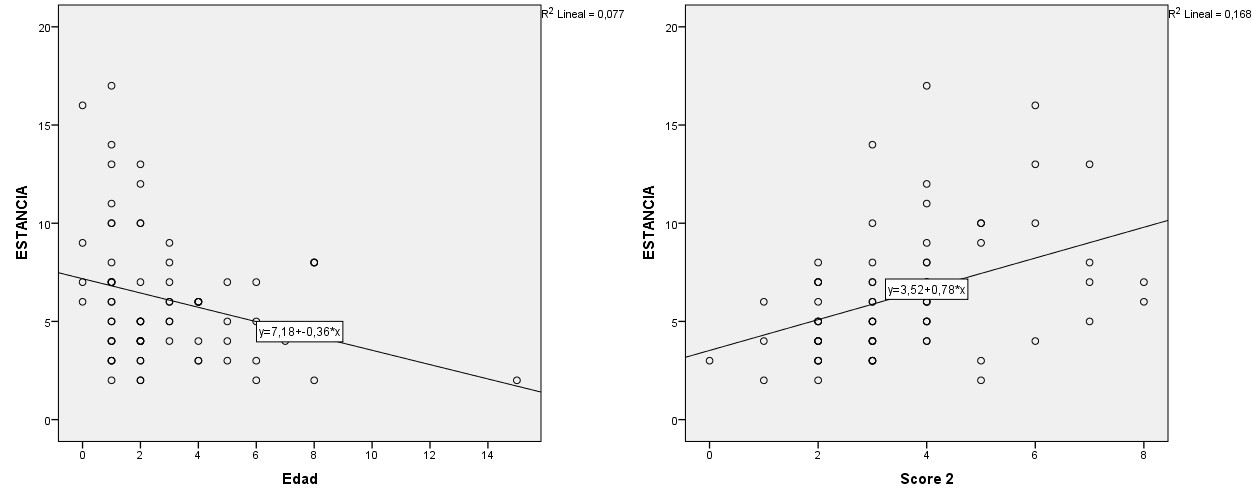
Se ha realizado un análisis bivariante en el que se comparó cómo influyen los factores de riesgo en la estancia hospitalaria y se observó que son la edad y la puntuación clínica el segundo día de ingreso los que influyen: a menor edad y más alta puntuación el segundo día de ingreso, mayor estancia hospitalaria; este último es estadísticamente significativo.
En la Fig. 1 se plasma la relación lineal que se establece entre la edad y puntuación clínica al segundo día y la estancia hospitalaria: conforme aumenta la edad de los pacientes (expresado en meses), disminuye la estancia hospitalaria; y conforme la puntuación de la escala es más grave aumenta la estancia. Por cada mes de edad, se reduce la estancia hospitalaria 0,36 días (intervalo de confianza del 95% [IC 95]: 0,66 a 0,07, p = 0,02) y por cada punto de la escala aumenta la estancia 0,78 días (IC 95: 0,36 a 1,21).
En el análisis multivariante se han introducido las variables más significativas y se mantiene la influencia de la edad y la puntuación clínica en el segundo día de ingreso. No se ha encontrado relación con el resto de las variables, tampoco con el tipo de tratamiento (SSF frente a SSH).
Hemos analizado la puntuación clínica el segundo día de ingreso, considerándola como la más representativa, dado que está presente en prácticamente la totalidad de la muestra, y se calcula con un tratamiento ya iniciado.
Segunda fase
De los 73 pacientes que ingresaron en la primera fase del estudio, reingresaron seis de ellos en el periodo establecido. Las principales características demográficas de estos pacientes se exponen en la Tabla 5. Como datos destacables, solo uno de ellos presentó infección por VRS en el primer ingreso y ninguno de ellos llevaba tratamiento de mantenimiento. La mediana de estancia en el primer ingreso de estos seis pacientes fue de cinco días y la mediana de puntuación de la escala clínica en su primer ingreso fue de tres (coincide con la del segundo día).
| Tabla 5. Datos epidemiológicos reingresos | ||||
|---|---|---|---|---|
| N | % | <6 meses | Sexo V/M | |
| Edad <6 meses | 4 de 6 | 66,66% | 3/1 | |
| Cuarto trimestre | 3 de 6 | 50% | 3 de 3 (100%) | 3/0 |
| Sexo varón | 5 de 6 | 83,33% | 3 de 5 | |
| Guardería | 1 de 6 | 16,67% | no | 1/0 |
| Hermanos mayores | 4 de 6 | 66,67% | 3 de 4 | 3/1 |
| Prematuridad >32 | 0 | 0 | 0 | 0 |
| Prematuridad <32 | 0 | 0 | 0 | 0 |
| Peso <2500 g | 2 de 6 | 33,33% | 2 de 2 (100%) | 1/1 |
| Cardiopatía significativa | 0 | 0 | 0 | 0 |
| Edad materna <25 años | 0 | 0 | 0 | 0 |
| Hacinamiento | 1 de 6 | 16,67% | 1 de 1 | 1/0 |
| AP de atopia | 0 | 0 | 0 | 0 |
| AF de atopia | 3 de 6 | 50% | 2 de 3 | 3/0 |
| Tabaquismo | 4 de 6 | 66,67% | 3 de 4 | 3/1 |
| AF de asma | 2 de 6 | 33,33% | 2 de 2 | 2/0 |
| SSH | 4 de 6 | 66,66% | 3 de 4 | 4/0 |
| SSF | 2 de 6 | 33,33% | 1 de 2 | 1/1 |
| Palivizumab | 0 | 0 | 0 | 0 |

DISCUSIÓN
Todavía existe mucha controversia y falta de pruebas sobre cuál es el mejor tratamiento para los niños hospitalizados con bronquiolitis, lo que hace necesaria la intervención local y el estudio interhospitalario de cada cohorte de pacientes, para aportar esos datos a futuros estudios multicéntricos o revisiones sistemáticas.
En una revisión sistemática19 acerca del SSH, publicada en 2013, los primeros resultados se antojaban prometedores; parecía así que se había encontrado un tratamiento eficaz, seguro y económico. Pero posteriormente reaparecía la controversia sobre su uso rutinario en diversas guías y estudios20-23.
En la actualidad, dentro de la práctica clínica habitual en los distintos centros hospitalarios, y concretamente en el nuestro, se encuentra la utilización con prueba terapéutica de los broncodilatadores nebulizados, con SSF o SSH al 3%, o bien la utilización de nebulizaciones sin broncodilatadores; además de las terapias de sostén como oxigeno fluyente, alto flujo y adaptación de la alimentación e hidratación.
Primera fase
El 83% de los ingresos por BA eran menores de seis meses, como cabía esperar. Dada la edad de los pacientes y el hecho de que la administración de sueroterapia dependía del médico responsable, el 86% recibieron tratamiento con SSH del 3%. El tamaño muestral reducido del estudio, así como la diferencia entre el número de pacientes que recibieron SSH del 3% frente al SSF, dificulta encontrar diferencias estadísticamente significativas, así como extrapolar los resultados a la población general. No obstante, consideramos que la elaboración de muestras propias y los resultados de estas, aportan mucho al manejo de la patología en nuestros pacientes ingresados, así como al resto de centros y estudios, que pueden beneficiarse de estos resultados.
Cuando estudiamos los factores epidemiológicos relacionados con la estancia hospitalaria, no encontramos diferencias estadísticamente significativas, ni siquiera cuando estudiamos la influencia del VRS, pero hay que destacar que la presencia de hermanos mayores influía casi de forma significativa, con una mayor estancia hospitalaria que los que no tenían hermanos. Por otro lado, cuando analizamos los tratamientos recibidos, encontramos una mayor estancia en los pacientes que recibieron nebulizaciones adrenalina, corticoides parenterales y antibióticos no macrólidos. Esto probablemente se deba a que los pacientes que recibieron este tratamiento eran más pequeños y presentaban una puntuación en la escala clínica más alta, y por tanto estaban más graves. Se observó que la edad y la puntuación el segundo día de ingreso son los factores que más influyen en la estancia hospitalaria: a menor edad y más alta puntuación el segundo día de ingreso, mayor estancia hospitalaria.
Segunda fase
Analizamos los episodios de broncoespasmo recurrente, frecuentes tras una bronquiolitis. Dada la prevalencia y la importante repercusión que supone el reingreso hospitalario, es importante estudiar en profundidad los factores de riesgo asociados a los mismos, que generan dicho ingreso.
En el Hospital de Cabueñes (Gijón), se realizó en el 2006 un estudio prospectivo observacional17 con el objetivo de determinar los factores de riesgo de mala evolución y reingreso de los episodios sibilantes de los lactantes. En el grupo de pacientes que reingresaron, encontraron mayor porcentaje de niñas (dato discordante con otros datos de la bibliografía y con nuestro estudio), padres fumadores y una estancia hospitalaria prolongada en el primer ingreso, adquiriendo estos resultados significación estadística. La tasa de reingreso para el periodo de observación del citado estudio fue de 5,8%17.
En nuestra muestra, de los 73 pacientes que ingresaron inicialmente, seis de ellos reingresaron, lo que nos da una tasa de reingreso del 8,2%, ligeramente superior. Los factores epidemiológicos más frecuentemente implicados en el reingreso en nuestra muestra fueron el sexo varón, la edad <6 meses, el tabaquismo familiar y la existencia de hermanos mayores.
Los datos encontrados en nuestro estudio son bastante concordantes con los existentes en la bibliografía24. Entre los factores de riesgo de reingreso no se encuentra en nuestro estudio la atopia, que si bien se considera un marcador de respuesta a cierto tipo de terapias (salbutamol, glucocorticoides inhalados), no parece serlo para el reingreso, especulando la existencia de un comportamiento fisiopatológico diferenciado de los pacientes atópicos que les hace más vulnerables al desarrollo de asma pero, en contrapartida, con mayor respuesta a los corticoides inhalados, lo que repercutiría en un mejor manejo y menor tasa de reingresos. Conceptos estos en continuo debate y estudio.
CONCLUSIONES
Existen aún más sombras que luces en el manejo de la BA, sin encontrarse un tratamiento realmente efectivo o generalizable. En nuestra reducida muestra, no hallamos diferencias significativas entre la utilización de SSH frente a al SSF en tiempo de hospitalización ni en términos de mejoría de la puntuación de las escalas clínicas de gravedad diarias. A pesar del tamaño muestral, no observamos ninguna tendencia en nuestros resultados a favor de diferencias significativas entre los dos tratamientos. Por último, los factores más relacionados con el reingreso han sido la edad menor a 6 meses, el sexo masculino, el tener hermanos mayores y el tabaquismo familiar.
A la espera de nuevas terapias de eficacia y efectividad demostradas, basadas en el tratamiento antiviral, inmunoterápico o fenotípico, es coherente realizar estudios que analicen correctamente el tratamiento de sostén y sintomático existente en la actualidad, encaminados a mejorar la sintomatología de nuestros pacientes y a predecir, prevenir y tratar las recidivas.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
BA: bronquiolitis aguda · BE: broncoespasmo · DE: desviación estándar · IC 95: intervalo de confianza del 95% · SSF: suero salino fisiológico · SSH: suero salino hipertónico · VRS: virus respiratorio sincitial.
BIBLIOGRAFÍA
- Calvo Rey C, García García ML, Casas Flecha I, Pérez Breña IP. Infecciones respiratorias virales. En: Asociación Española de Pediatría [en línea] [consultado el 07/06/2019]. Disponible en www.aeped.es/sites/default/files/documentos/irsv.pdf
- American Academy of Pediatrics Subcommittee on Diagnosis and Management of Bronchiolitis. Diagnosis and management of bronchiolitis. Pediatrics 2006;118:1774-93.
- Ochoa Sangrador C, González de Dios J, Grupo de Revisión del Proyecto aBREVIADo. Conferencia de consenso sobre bronquiolitis aguda (II): epidemiología de la bronquiolitis aguda. Revisión de la evidencia científica. An Pediatr (Barc). 2010;72:222.e1-222.e26.
- Ramos-Fernández JM, Pedrero-Segura E, Gutiérrez-Bedmar M, Delgado-Martín B, Cordón-Martínez AM, Moreno-Pérez D, et al. Epidemiología de los ingresos por bronquiolitis en el sur de Europa. An Pediatr (Barc). 2017;87:260-8.
- González de Dios J, Ochoa Sangrador C, Grupo de Revisión del Proyecto aBREVIADo. Conferencia de consenso sobre bronquiolitis aguda (I): metodología y recomendaciones. An Pediatr (Barc). 2010;72:221.e1-221.e33.
- Sigurs N, Gustafsson PM, Bjarnason R, Lundberg F, Schmidt S, Sigurbergsson F, et al. Severe respiratory syncytial virus bronchiolitis in infancy and asthma and allergy at age 13. Am J Respir Crit Care Med. 2005;171:137-41.
- Stein RT, Sherrill D, Morgan WJ, Holberg CJ, Halonen M, Taussig LM, et al. Respiratory syncytial virus in early life and risk of wheeze and allergy by age 13 years. Lancet. 1999;354:541-5.
- González de Dios J, Ochoa Sangrador C, Grupo de Revisión de Proyecto aBREVIADo. Conferencia de Consenso sobre bronquiolitis aguda (IV): tratamiento de la bronquiolitis aguda. Revisión de la evidencia científica. An Pediatr (Barc). 2010;72:285.e1-285.e42.
- Ipek IO, Yalcin EU, Sezer RG, Bozaykut A. The efficacy of nebulized salbutamol, hypertonic saline and salbutamol/hypertonic saline combination in moderate bronchiolitis. Pulm Pharmacol Ther. 2011;24:633-7.
- Hartling L, Fernandes RM, Bialy L, Milne A, Johnson D, Klassen TP, et al. Steroids and bronchodilators for acute bronchiolitis in the first two years of life: systematic review and meta-analysis. BMJ. 2011;342:d1714.
- Ochoa Sangrador C, González de Dios J. Broncodilatadores y corticoides en la bronquiolitis aguda: adrenalina nebulizada y poco más. Evid Pediatr. 2011;7:42.
- Zhang L, Mendoza-Sassi RA, Klassen TP, Wainwright C. Nebulized hypertonic saline for acute bronchiolitis: a systematic review. Pediatrics. 2015;136:687-701..
- Florin TA, Shaw KN, Kittick M. Nebulized hypertonic saline for bronchiolitis in the emergency department: a randomized clinical trial. JAMA Pediatr. 2014;168:664-70.
- Wu S, Baker C, Lang ME. Nebulized hypertonic saline for bronchiolitis: a randomized clinical trial. JAMA Pediatr. 2014;168:657-63.
- Delgado A, Álvarez L, Álvarez M, Ferrer-Vázquez M. Suero salino hipertónico en el tratamiento de la bronquiolitis. ¿La nebulización ideal o una más? Bol Soc Val Pediatr. 2014;34:41.
- Gómez Carrasco JA. El asma en los primeros años de la vida y su relación con las infecciones virales. Rev Pediatr Aten Primaria. 2006;8:453-75.
- Fernández Fernández EM. Características epidemiológicas del lactante con primer episodio sibilante: ¿podemos identificar al niño con riesgo de episodio grave o de recidiva? Rev Esp Pediatr. 2008;64:447-51.
- Pérez Rodríguez MJ, Otheo de Tejada Barasoain E, Ros Pérez P. Bronquiolitis en Pediatría: puesta al día. Inf Ter Sist Nac Salud. 2010;34:311.
- Zang L, Mendoza-Saai RA, Wainwright C, Klassen TP. Nebulized hypertonic saline for acute bronchiolitis: a systematic review. Pediatrics. 2015;136(4):687-701.
- Ralston SL, Lieberthal AS, Meissner HC, Alverson BK, Baley JE, Gadomski AM, et al. American Academy of Pediatrics. Clinical practice guideline: the diagnosis, management, and prevention of bronchiolitis. Pediatrics. 2014;134:e1474-502.
- Fuentes C, Cornejo G, Bustos R. Actualización en el tratamiento de bronquiolitis aguda: menos es más. Neumol Pediatr. 2016;11:65-70.
- National Collaborating Centre for Women’s and Children's Health (UK). Bronchiolitis: Diagnosis and Management of Bronchiolitis in Children. En: National Institute for Health and Care Excellence [en línea] [consultado el 07/06/2019]. Disponible en www.neumologia-pediatrica.cl/wp-content/uploads/2017/07/tratamiento-broncoquiolitis.pdf
- Friedman JN, Rieder MJ, Walton JM; Canadian Paediatric Society, Acute Care Committee, Drug Therapy and Hazardous Substances Committee. Bronchiolitis: recommendations for diagnosis, monitoring and management of children one to 24 months of age. Paediatr Child Health. 2014;19:485-98.
- Pérez Cid L, San José Valiente B, Quintero Calcaño V, Díaz López G, Mesa Guzmán J, Cañete Díaz A, et al. La bronquiolitis grave en lactantes menores de seis meses es un factor de riesgo para las sibilancias recurrentes. Rev Pediatr Aten Primaria. 2013;15:229-37.