Vol. 26 - Num. 102
Originales
Marcha atópica en una consulta de Atención Primaria
Silvia Manzanares Santosa, Lucía Tainta Leónb, Alberto Bercedo Sanzc
aPediatra. CS La Carlota. La Carlota. Córdoba. España.
bPediatra. CS La Calzada. Gijón. Asturias. España
cPediatra. CS Los Castros. Santander. Cantabria. España.
Correspondencia: S Manzanares . Correo electrónico: silvsms@gmail.com
Cómo citar este artículo: Manzanares Santos S, Tainta León L, Bercedo Sanz A. Marcha atópica en una consulta de Atención Primaria . Rev Pediatr Aten Primaria. 2024;26:127-36. https://doi.org/10.60147/24a7ffe3
Publicado en Internet: 20-05-2024 - Número de visitas: 19871
Resumen
Introducción: la prevalencia de enfermedades atópicas en la infancia ha aumentado en los últimos años. El objetivo de este estudio es describir la epidemiología de las diferentes enfermedades atópicas en una consulta de Pediatría de Atención Primaria.
Material y métodos: estudio transversal y descriptivo realizado en niños entre 0 y 14 años de un cupo de Pediatría de Atención Primaria (624 niños). Se recopiló información sobre diferentes variables relacionadas con las enfermedades atópicas. Los datos se analizaron con el software IBM SPSS Statistics versión 25. Se determinó la existencia de asociación entre variables mediante la prueba de ji-cuadrado (significación estadística si p <0,05).
Resultados: el 51% de la muestra presentó alguna de las enfermedades atópicas. La prevalencia acumulada de dermatitis atópica, alergia alimentaria, rinitis alérgica y asma por diagnóstico médico fue del 27,2%, 3%, 11,7%, y 33%, respectivamente. El 48,8% de los niños con dermatitis atópica asoció asma. De los niños con alergia alimentaria, el 47,4% desarrolló asma. El 57,5% de los pacientes con rinitis alérgica presentó también asma. Se encontró asociación estadísticamente significativa entre el diagnóstico de cualquiera de las enfermedades atópicas y el antecedente de atopia en progenitores (p <0,05).
Conclusiones: las enfermedades atópicas son una de las patologías más prevalentes en las consultas de Pediatría de Atención Primaria. La asociación de las enfermedades atópicas entre sí es muy relevante. Los antecedentes familiares se asocian de forma significativa con la presencia de las enfermedades atópicas en el cupo de niños estudiado.
Palabras clave
● Alergia ● Asma ● Dermatitis atópica ● Marcha atópica ● Prevalencia ● Rinitis alérgicaINTRODUCCIÓN
El término atopia hace referencia a la capacidad de producir anticuerpos IgE tras la exposición a proteínas que se inhalan, ingieren o que contactan con la superficie cutánea, manifestándose con una clínica muy variable, desde una sensibilización asintomática hasta el desarrollo de una o más de las enfermedades alérgicas mediadas por IgE (atópicas) como dermatitis atópica (DA), alergia alimentaria (AA), asma, rinitis/rinoconjuntivitis alérgica (RA/RCA) e incluso anafilaxia. En estudios recientes se ha objetivado un incremento en la prevalencia de las enfermedades atópicas, encontrándose en un 15-35% de los niños1.
La dermatitis atópica afecta al 15-20% de los niños2. La prevalencia de alergia alimentaria presenta su pico al año de vida, siendo del 6-8%3. En España un 20,4% de los niños de 6-7 años y un 35,2% de 13-14 años refieren haber tenido síntomas de rinitis alérgica durante el último año4. La prevalencia del asma en la edad pediátrica en España es del 15,3% a los 13-14 años y del 10,4% a los 6-7 años, con variaciones geográficas según los datos del estudio GAN (Global Asthma Network)5,6.
La “marcha atópica” hace referencia al carácter progresivo de las diferentes manifestaciones atópicas, desde la aparición de dermatitis atópica y alergia alimentaria en lactantes y preescolares, hasta el desarrollo de asma y rinitis alérgica en la etapa escolar y adolescencia7.
De esta manera, la presencia y gravedad de la dermatitis atópica incrementa el riesgo de desarrollar una alergia alimentaria y esta, a su vez, supone un factor de riesgo en el desarrollo de asma y rinitis alérgica8,9. Por otro lado, la dermatitis atópica supone un riesgo para desarrollar asma y rinitis alérgica10. Además, la rinitis alérgica se considera un factor de riesgo para el desarrollo de asma11.
El objetivo de este estudio es describir la prevalencia actual y características epidemiológicas de las diferentes enfermedades atópicas en una consulta de Pediatría de Atención Primaria (AP).
MATERIAL Y MÉTODOS
Estudio transversal y descriptivo cuya población de estudio corresponde a los niños de 0 a 14 años de un cupo de Pediatría de Atención Primaria (624 niños). El estudio se llevó a cabo mediante la revisión de historias clínicas electrónicas. Se recopiló información acerca de las siguientes enfermedades atópicas: alergia alimentaria, dermatitis atópica, rinitis/rinoconjuntivitis alérgica y asma. Algunas de las variables a estudio más relevantes han sido las siguientes: presencia de patología atópica, antecedentes familiares, tratamiento, gravedad, pruebas complementarias y exposición a tabaco, entre otras. Los datos se analizaron con el software IBM SPSS Statistics versión 25. Se determinó la existencia de asociación entre variables mediante el test estadístico ji-cuadrado de Pearson (X2), estableciendo el umbral de significación estadística en p <0,05.
RESULTADOS
Se analizaron las historias clínicas electrónicas de 624 niños. La edad media fue de 6,7 años (DE 4,2 y mediana 7 años). El 47,6% de los niños fueron varones y el 52,4%, mujeres. Se encontró alguna de las enfermedades atópicas en el 51% de la muestra.
Las prevalencias acumuladas obtenidas para las diferentes enfermedades atópicas analizadas fueron las siguientes: alergia alimentaria 3%, dermatitis atópica 27,2%, rinitis alérgica 11,7% y asma 33%.
La prevalencia de la tríada atópica (DA, RA y asma) fue del 3,5% (6,9% de los pacientes atópicos). Si se añade la alergia alimentaria a la tríada anterior, la prevalencia fue del 0,6% (1,3% de los pacientes atópicos).
Se estudió la presencia de antecedentes de atopia en los progenitores de los niños de la muestra. En el 7,4% se encontró antecedente de alguna de las enfermedades atópicas en al menos uno de los progenitores. El 5% no presentaba antecedentes de patología atópica en sus progenitores. En los casos restantes no se pudo obtener esta información, por no estar recogida en la historia clínica electrónica.
El 82,6% de los niños con atopia documentada en algún progenitor desarrolló patología atópica. En contraposición, el 61,3% de aquellos niños sin antecedentes de atopia en sus progenitores desarrolló también patología atópica.
A continuación, se desglosa por separado la información obtenida para cada una de estas patologías.
Dermatitis atópica
El 27,2% de los niños presentó DA y un 48,8% asociaba asma. Se encontró asociación estadísticamente significativa entre la presencia de DA y el antecedente de atopia en progenitores (X2 8,1, p = 0,02) y hermanos (X2 4,5, p = 0,03).
Alergia alimentaria
El 3% de la muestra presentó alguna alergia alimentaria. La mayoría de los casos (89,5%) correspondieron a niños menores de 4 años. De los niños con AA, el 47,4% desarrolló también asma. Junto con las alergias IgE mediadas se ha incluido la alergia a proteínas de leche de vaca (APLV) no mediada por IgE debido a su elevada prevalencia y su posible relación futura con enfermedades atópicas12.
En la Figura 1 se muestra el número de alergias a cada grupo alimentario. El 10,5% de los pacientes alérgicos presentaba alergia a dos alimentos diferentes y el 5,3%, a tres alimentos.
| Figura 1. Porcentaje y número de alergias de cada grupo alimentario. Se muestra el valor absoluto en el eje de ordenadas y el porcentaje relativo en cada barra (porcentaje que supone dentro del total de alergias detectadas) |
|---|
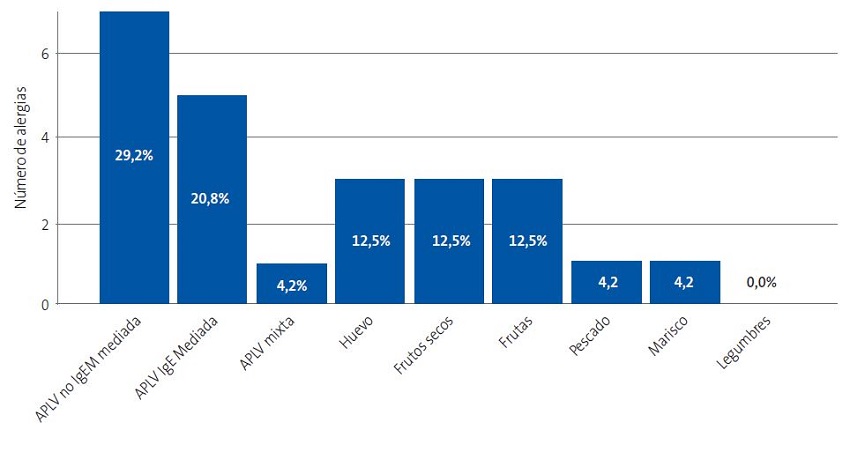 |

Se encontró asociación estadísticamente significativa entre la presencia de AA y el antecedente de atopia en progenitores (X2 16,1, p <0,001).
Rinitis y rinoconjuntivitis alérgica
El 11,7% de la muestra presentó RA y el 8,7%, RCA. La edad media de los niños con RA fue de 9,7 años (DT 3,1, mediana 10 años) y la mayor parte de los casos corresponde a niños de 7 años en adelante (60 niños, 82,2%).
El 65,8% presentó rinitis intermitente; el 31,5% presentó rinitis persistente leve y el 2,7% presentó rinitis persistente moderada-grave.
De los pacientes con RA, el 57,5% presentó también asma y el 50% tenía antecedentes de DA.
Se encontró asociación estadísticamente significativa entre la presencia de RA y el antecedente de atopia en progenitores (X2 15,7, p <0,001). También se halló asociación estadísticamente significativa entre la gravedad de la RA y el antecedente de atopia en progenitores y hermanos (X2 11,7, p = 0,02 y X2 11,4, p = 0,003, respectivamente).
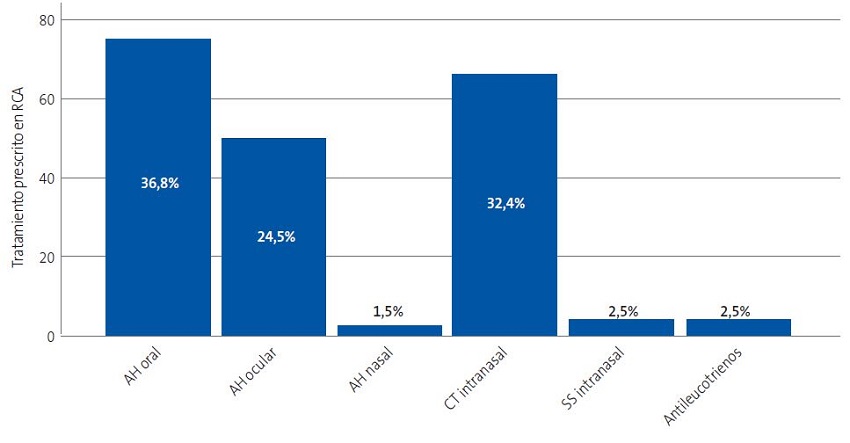
El tratamiento más utilizado fue el antihistamínico oral, en un 36,8% de los casos. Le siguen el corticoide nasal, prescrito en un 32,4% de los casos, y el antihistamínico ocular, pautado en un 24,5%. En la Figura 2 se muestran estos datos.
| Figura 2. Tratamientos prescritos en el manejo de la rinoconjuntivitis alérgica. Se muestra el valor absoluto en el eje de ordenadas y el porcentaje relativo en cada barra (porcentaje que supone respecto al total de tratamientos prescritos) |
|---|
 |

Asma
El 33% de la muestra fue diagnosticado de asma. La prevalencia acumulada de asma por grupos de edad fue la siguiente: 7,9% en 0-3 años de edad, 4,6% en 4-5 años y 20,5% en niños de >6 años. La prevalencia de asma activo en el último año (en relación con la presencia de síntomas de asma y/o tratamiento de control de asma) fue del 6,7% en el grupo de 0-3 años de edad, 3% en niños de 4-5 años y 7,5% en niños de >6 años. La media de edad de los niños asmáticos fue de 7,3 años (DT 3,9, mediana 8 años).
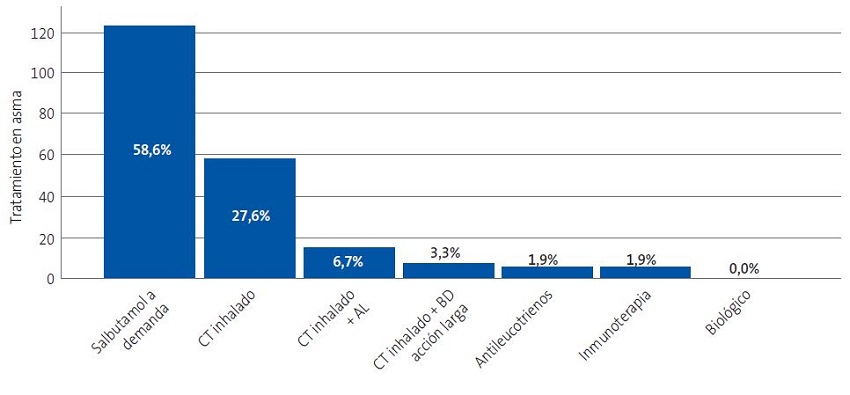
Los tratamientos más utilizados fueron el salbutamol a demanda (58,6%) y el corticoide inhalado en monoterapia (27,6% de los casos). Estos datos se representan en la Figura 3.
| Figura 3. Tratamientos prescritos en el manejo del asma. Se muestra el valor absoluto en el eje de ordenadas y el porcentaje relativo en cada barra (porcentaje que supone cada tratamiento respecto al total de tratamientos prescritos) |
|---|
 |

Se clasificaron los pacientes asmáticos en función de la necesidad de tratamiento para el control de los síntomas. Los pacientes quedaron distribuidos como refleja la Tabla 1.
| Tabla 1.Clasificación de la gravedad del asma de los pacientes según la necesidad de tratamiento para el buen control de los síntomas. Se expone el valor absoluto de pacientes en cada categoría, el porcentaje que supone respecto al total de la muestra de su grupo etario (% total) y el porcentaje que supone respecto al total de pacientes asmáticos de su grupo etario (% relativo) | ||||||
|---|---|---|---|---|---|---|
| Clasificación de la gravedad del asma | <6 años | ≥6 años | ||||
| N | % total | % relativo | N | % total | % relativo | |
| Intermitente | 38 | 13,9% | 48,7% | 85 | 24,3% | 66,4% |
| Persistente leve | 14 | 5,1% | 17,9% | 28 | 8% | 21,9% |
| Persistente moderada | 22 | 8% | 28,2% | 13 | 3,7% | 10,2% |
| Persistente grave | 4 | 1,5% | 5,1% | 2 | 0,6% | 1,6% |

La prevalencia conjunta de asma y RA fue del 6,7% (13,2% de los pacientes atópicos), siendo la asociación entre ambas patologías estadísticamente significativa (X2 22,5, p <0,001). La asociación entre la gravedad del asma y la presencia de RA también resultó estadísticamente significativa (X2 17,9, p <0,001).
Se encontró asociación estadísticamente significativa entre la presencia de asma y el antecedente de atopia en progenitores y hermanos (X2 14,5, p <0,001 y X2 36,6, p <0,001, respectivamente).
Se realizaron pruebas para determinar la sensibilización a neumoalérgenos (IgE específica y/o prick test) en el 16,9% de los pacientes con RA y/o asma. En AP se determinó IgE específica al 11,8% de los pacientes con RA y/o asma, sin posibilidad de realizar prick test por no estar disponible para AP en la zona de realización del estudio. En atención especializada (AE) se realizó prick test al 5,5% de los pacientes con RA y/o asma y prick test junto a IgE específica a otro 5,5%. Al 5,5% de los pacientes con RA y/o asma se les realizó espirometría, siendo el 84,6% realizadas en AE.
El 50% de los pacientes presentó sensibilización a un solo alérgeno y el resto, a más de uno. La mayoría de las sensibilizaciones fueron frente al olivo. El perfil de sensibilizaciones se recoge en la Tabla 2.
| Tabla 2. Perfil de sensibilización a neumoalérgenos de los pacientes con rinitis alérgica y/o asma. Se expone el valor absoluto, el porcentaje que supone respecto al total de la muestra (% total) y el porcentaje que supone respecto al total de sensibilizaciones detectadas (% relativo) | |||
|---|---|---|---|
| Sensibilización a neumoalérgenos | N | % total | % relativo |
| Olivo | 21 | 3,4% | 32,8% |
| Gramíneas | 16 | 2,6% | 25% |
| Alternaria | 11 | 1,8% | 17,2% |
| Dermatophagoides | 8 | 1,3% | 12,5% |
| Epitelio de gato | 4 | 0,6% | 6,3% |
| Epitelio de perro | 2 | 0,3% | 3,1% |
| Plátano de sombra | 1 | 0,2% | 1,6% |
| Ciprés | 1 | 0,2% | 1,6% |

Por otro lado, un 44% de la muestra estuvo expuesta al humo de tabaco en sus hogares. En un elevado porcentaje (25,8%), este dato no estaba registrado en la historia clínica.
DISCUSIÓN
La prevalencia de las enfermedades atópicas ha aumentado de forma rápida y universal en las últimas décadas1, aunque actualmente existe controversia sobre la posibilidad de que se esté llegando a la prevalencia máxima potencial en zonas de alta prevalencia, como demuestran los estudios epidemiológicos del ISAAC-III y GAN realizados en nuestro país, que objetivan una estabilización en las cifras de asma y RA en escolares y un ligero aumento en adolescentes4,5.
En el estudio realizado, el 51% de la muestra presenta alguna de las enfermedades atópicas, una cifra superior a la obtenida en otros estudios publicados en nuestro país, que no están basados en la historia clínica de AP, sino en la Encuesta Nacional de Salud13.
Una historia familiar de atopia supone el principal factor de riesgo para el desarrollo de las enfermedades atópicas, especialmente en los progenitores14. Los datos lo confirman, al objetivar que el 82,6% de los niños con antecedente familiar de atopia desarrollan también patología atópica. Sin embargo, más de la mitad (61,3%) de aquellos que no presentan antecedentes familiares, sí desarrollan patología atópica, con lo que se comprueba que la historia familiar negativa no descarta la posibilidad de atopia. Es destacable que, en un porcentaje cercano al 88%, no se encuentran recogidos los antecedentes familiares en las historias clínicas, lo que hace que muchos de los datos de prevalencia relacionados con esta variable estén infraestimados. Es necesario realizar una adecuada historia clínica que incluya los antecedentes familiares para poder identificar a los niños de riesgo.
En la muestra estudiada, la asociación de las enfermedades atópicas es muy relevante. El 48,8% de los niños con DA asocian asma. De los niños con AA, el 47,4% asocian asma. El 57,5% de los pacientes con RA presentan también asma y el 50% de los pacientes diagnosticados de RA tiene antecedentes de DA. En este sentido, es aconsejable un abordaje conjunto de las enfermedades atópicas para un correcto tratamiento y control de las mismas, dada la relación tan estrecha entre ellas.
La rinoconjuntivitis alérgica fue el principal motivo por el que los niños consultaron en una unidad de alergología según el estudio nacional Alergológica 2015, siendo la RA la enfermedad respiratoria más frecuente y un importante factor de riesgo para el desarrollo del asma2. En España, un 20,4% de los niños de 6-7 años y un 35,2% de 13-14 años refieren haber tenido síntomas de RA durante el último año11,15. En este estudio se obtiene una prevalencia inferior, de 11,7%. Es posible que la falta de diagnóstico médico y la baja frecuentación de los niños por su rinitis, probablemente por su sintomatología estacional y de poca gravedad, sean motivos que expliquen esta diferencia.
En relación al tratamiento de la RA, los corticoides nasales (CN) son la medicación más efectiva y el resto de fármacos deberían ser considerados como alternativas cuando no existe una respuesta adecuada11. En ese caso está indicado asociar un antihistamínico oral (AHO) o intranasal (AHIN), siendo este último más eficaz sobre la congestión nasal, con un comienzo de acción más rápido11. En este estudio, el tratamiento más pautado es el AHO (36,8% de los pacientes con RA), seguido del CN (32,4%). Es llamativo el escaso número de AHIN pautado (1,5%), siendo incluso superado por montelukast (2,5%), cuyos efectos son similares o inferiores a los de los antihistamínicos.
Con respecto al asma bronquial, en el informe Alergológica 2015 se sitúa como la segunda enfermedad más frecuente estudiada en las consultas de alergia, por detrás de la RA, como se confirma con los datos españoles de prevalencia de asma del estudio GAN en la edad pediátrica en España, que son del 15,3% a los 13-14 años y del 10,4% a los 6-7 años y con variaciones geográficas según el área estudiada2.
En este estudio se evidencia una prevalencia acumulada de asma del 33% para todas las edades, con una prevalencia de asma activo del 17,2% (7,5% en mayores de 6 años). La prevalencia acumulada de asma obtenida es alta y además superior a la prevalencia de RA (11,7%), en contraposición con lo objetivado en estudios recientes2,4,5, pero que puede ser explicado por el efecto confusión que provocan las sibilancias del lactante y preescolar en los diagnósticos recogidos en la historia clínica.
En este sentido, con respecto al asma del lactante y niños menores de 3 años, basado en la presencia de >3 episodios de sibilancias, a pesar de la controversia de la definición de asma en estas edades, se detectó un 6,7% de niños con el diagnóstico de asma (inferior al 7,7% encontrada en los menores de 2 años en otros estudios de proximidad geográfica realizados en el 2002). Son escasos los estudios recientes de prevalencia de asma en los primeros años de vida, a excepción del Estudio Internacional de Sibilancias del Lactante en el primer año, donde 1 de cada 3 lactantes presentaron al menos un episodio de sibilancias y 1 de cada 7-8 presentaron tres o más episodios, independientemente del lugar de residencia16,17.
Por otro lado, en este estudio se ha confirmado una prescripción correcta del tratamiento farmacológico de asma según el nivel de gravedad, de acuerdo con las recomendaciones de las guías de práctica clínica del asma18,19.
Solamente se realizaron pruebas de alergia al 16,9% de los pacientes con RA y/o asma. En AP solo se realizó la determinación de IgE específica por no disponer de prick test, a pesar de ser el método de elección para el estudio inicial de las enfermedades alérgicas. Las sensibilizaciones más frecuentes del cupo estudiado (polen de olivo, gramíneas, Alternaria y ácaros del polvo doméstico) están en consonancia con el mapa de sensibilización alergológica de Andalucía2. Es imprescindible conocer el perfil de sensibilización del paciente atópico, así como la disponibilidad de pruebas de alergia en las consultas de AP necesarias para su diagnóstico, de forma que permitan poner en marcha las medidas de educación y control ambiental adecuadas.
En cuanto a la espirometría, se realizó únicamente al 5,5% de los pacientes con RA y/o asma, destacando que la mayoría, el 84,6%, se realizó en AE. Estos hallazgos hacen evidente la necesidad del uso de la espirometría en AP como prueba de apoyo para confirmar el diagnóstico de asma, mejorar el manejo clínico y el seguimiento del paciente asmático. Además, es una herramienta muy útil para complementar la educación sanitaria del niño asmático, así como para ayudar a mejorar el bienestar psicosocial de los padres20.
Se objetivó que casi la mitad del cupo, un 44%, estaba expuesta al humo de tabaco en sus hogares, porcentaje que podría incrementarse al existir un 25,8% de la muestra que no tenía recogido el hábito tabáquico familiar en su historia clínica. El efecto del tabaquismo pasivo y de las enfermedades respiratorias en la infancia está bien establecido, con aumento en las infecciones respiratorias, otitis y asma en la infancia21,22. Por ello, el pediatra de AP tiene un papel primordial en el abordaje del tabaquismo pasivo, recogiendo este hábito en las historias clínicas de los pacientes, y así poder identificar a la población de riesgo.
El pediatra de AP desarrolla un papel fundamental en la prevención terciaria de las patologías alérgicas, es decir, una vez que el individuo las padece (que es cuando el paciente consulta mayoritariamente). Debe adoptar estrategias que intenten impedir la aparición de sintomatología como las medidas de evitación de alérgenos y tabaquismo, la educación del paciente y su familia o la instauración de tratamiento farmacológico de control1.
Por otro lado, el asma y las enfermedades alérgicas asociadas tienen un impacto negativo en la calidad de vida de los niños y adolescentes, así como en sus familias, con una peor percepción de su salud física y mental, restricciones en las actividades diarias y un mayor uso de los servicios de salud, según los datos de la Encuesta Nacional de Salud13. Por ello, es necesario impulsar programas de salud específicos en AP, dirigidos a mejorar el diagnóstico, tratamiento y seguimiento de estos pacientes.
El estudio presentó algunas limitaciones. Se trata de un estudio unicéntrico realizado, además, sobre una población con necesidades de transformación social. Por ello, la muestra no es representativa de toda la población infantil. Debido a su carácter retrospectivo existen limitaciones en la recogida de datos. Al ser un estudio transversal, no puede establecerse que las asociaciones encontradas sean realmente causales.
Finalmente, aunque el estudio realizado presenta limitaciones, los hallazgos encontrados pueden servir para reflexionar sobre el abordaje de estas patologías en las consultas de AP.
CONCLUSIONES
La mitad de la población infantil de la consulta de AP estudiada (51%) ha presentado alguna enfermedad alérgica, con una prevalencia acumulada por diagnóstico médico de DA, AA y RA del 27,2%, 3% y 11,7%, respectivamente. En el caso del asma, la prevalencia acumulada de los niños con >6 años fue de 20,5%, encontrando un 7,5% de estos niños con asma activo en el último año. En la muestra estudiada, la asociación significativa de las enfermedades alérgicas entre ellas y con los antecedentes familiares obliga a una búsqueda activa de las mismas ante la presencia de cualquiera de ellas en la población infantil y en sus familiares, con un abordaje conjunto que permita un correcto tratamiento y control de las mismas. Por otro lado, los tratamientos prescritos en los niños asmáticos mayores de 6 años están en consonancia con el nivel de gravedad, mientras que en el caso de la RA se detecta una menor adecuación a las guías clínicas. Es necesario aumentar la capacidad diagnóstica de la patología alérgica y asmática en AP dada la baja realización de las pruebas de alergia y espirometrías realizadas. En definitiva, el abordaje integral de las enfermedades alérgicas desde AP es un objetivo que conseguir, dado el impacto en la calidad de vida que producen en los niños y adolescentes y sus familias.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
RESPONSABILIDAD DE LOS AUTORES
Todos los autores han contribuido de forma equivalente en la elaboración del manuscrito publicado.
ABREVIATURAS
AA: alergia alimentaria · AE: atención especializada · AHIN: antihistamínico intranasal · AHO: antihistamínico oral · AP: Atención Primaria · APLV: alergia a proteínas de leche de vaca · CN: corticoides nasales · DA: dermatitis atópica · GAN: Global Asthma Network · RA: rinitis alérgica · RCA: rinoconjuntivitis alérgica.
BIBLIOGRAFÍA
- Ridao Redondo M, Fernández Alonso JE. Orientación diagnóstica de alergia a través de la historia clínica. ¿Cuándo se debe sospechar etiología alérgica? Evolución de la enfermedad alérgica en la edad pediátrica. Protoc Diagn Ter Pediatr. 2019;2:1-15. En: AEP [en línea] [consultado el 09/05/2024]. Disponible en www.aeped.es/sites/default/files/documentos/01_orientacion_diagnostica.pdf
- Ojeda P, Ibáñez MD, Olaguibel JM, Sastre J, Chivato T; investigators participating in the National Survey of the Spanish Society of Allergology and Clinical Immunology Alergológica 2015. Alergológica 2015: A National Survey on Allergic Diseases in the Spanish Pediatric Population. J Investig Allergol Clin Immunol. 2018 Oct;28(5):321-9. https://doi.org/10.18176/jiaci.0308
- Escarrer Jaume M, Juliá Benito JC, Quevedo Teruel S, Prieto del Prado A, Sandoval Ruballos M, Quesada Sequeira F, et al. Cambios en la epidemiologia y en la práctica clínica de la alergia mediada por IgE en pediatría. An Pediatr. 2021 Jul;95(1): 56.e1-56.e8. https://doi.org/10.1016/j.anpedi.2021.04.014
- Bercedo Sanz A, Martínez-Torres A, López Silvarrey Varela A, Pellegrini Belinchón FJ, Aguinaga Ontoso I, González Díaz C, et al. Prevalence and time trends of symptoms of allergic rhinitis and rhinoconjunctivitis in Spanish children: Global Asthma Network (GAN) study. Allergol Immunopathol. 2023;51(5):1-11. https://doi.org/10.15586/aei.v51i1.711
- Bercedo Sanz A, Martínez-Torres A, González Díaz C, López-Silvarrey Varela A, Pellegrini Belinchóng FJ, Aguinaga-Ontoso I, et al. Grupo GAN España. Prevalencia y evolución temporal de síntomas de asma en España. Estudio Global Asthma Network (GAN). An Pediatr (Barc) 2022;97:161-7. https://doi.org/10.1016/j.anpedi.2021.10.007
- Moral Gil l, Asensi Monzó M, Juliá Benito JC, Ortega Casanueva C, Paniagua Calzón NM, Pérez García MI, et al. Asma en pediatría: Consenso REGAP. An Pediatr (Barc), 2021; 95: 125.e1-125.e11. https://doi.org/10.1016/j.anpedi.2021.02.009
- Yang l, Fu J, Zhou Y. Research Progress in Atopic March. Front Immunol. 2020;11:1907. https://doi.org/10.3389/fimmu.2020.01907
- Tran MM, Lefebvre DL, Dharma C, Dai D, Lou WYW, Subbarao P, et al. Predicting the atopic march: results from the Canadian Healthy Infant Longitudinal Development Study. J Allergy Clin Immunol. 2018;141(2):601-7. https://doi.org/10.1016/j.jaci.2017.08.024
- Paller AS, Spergel JM, Mina-Osorio P, Irvine AD. The atopic march and atopic multimorbidity: Many trajectories, many pathways. J Allergy Clin Immunol. 2019;143(1):46-55. https://doi.org/10.1016/j.jaci.2018.11.006
- Tsuge M, Ikeda M, Matsumoto N, Yorifuji T, Tsukahara H. Current Insights into Atopic March. Children (Basel). 2021;8(11):1067. https://doi.org/10.3390/children8111067
- Bercedo Sanz A, Guerra Pérez MT, Callén Blecua MT. Rinitis alérgica. El Pediatra de Atención Primaria y la rinitis alérgica. Protocolos del GVR (publicación P-GVR-6) [en línea] [consultado el 09/05/2024]. Disponible en www.aepap.org/sites/default/files/documento/archivos-adjuntos/rinitis_alergica_p_gvr_6_2016.pdf
- Bahceci S, Töz PK, Celik FC, Can D. A different starting line for allergic march: food protein-induced allergic proctocolitis. Allergol Immunopathol (Madr). 2023;51(4):40-5. https://doi.org/10.15586/aei.v51i4.872
- González de Paz l, Valdesoiro Navarrete l, Roma J, Blat Guimerà E, Benavent Areu J, Bartra J, et al. Prevalence and Impact of Asthma and Allergy on Daily Life, Health Outcomes and Use of Healthcare Services in Children: A Population-Based Study. Arch Bronconeumol. 2023;59(8):481-7. https://doi.org/10.1016/j.arbres.2023.05.005
- Crnković HT, Bendelja K, Šimić Klarić A, Tomić Rajić M, Drkulec V, Aberle N. Family history and cord blood eosinophil count as predictors for atopic manifestations. Cent Eur J Public Health. 2019;27(4):267-71. https://doi.org/10.21101/cejph.a5601
- Strachan DP, Rutter CE, Asher MI, Bissell K, Chiang CY, El Sony A, et al; Global Asthma Network Phase I Study Group. Worldwide time trends in prevalence of symptoms of rhinoconjunctivitis in children: Global Asthma Network Phase I. Pediatr Allergy Immunol. 2022;33(1):e13656. https://doi.org/10.1111/pai.13656
- Bercedo Sanz A, Lastra Martínez l, Pellegrini Belinchon J, Vicente Galindo E, Lorente Toledano F, García Marcos l. Wheezing and risk factors in the first year of life in Cantabria, Spain. The EISL study. Allergol Immunopathol (Madr). 2015;43:543-52. https://doi.org/10.1016/j.aller.2014.09.001
- Pellegrini Belinchon J, Miguel Miguel G, Dios Martín B, Vicente Galindo E, Lorente Toledano F, García Marcos l. Study of wheezing and its risk factors in the first year of life in the Province of Salamanca, Spain. The EISL Study. Allergol Immunopathol (Madr). 2012;40:164-71. https://doi.org/10.1016/j.aller.2011.03.014
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. En: GINA [en línea] [consultado el 09/05/2024]. Disponible en https://ginasthma.org/2023-gina-main-report/
- Grupo de trabajo de la Guía Española para el Manejo del Asma. GEMA 5.3. 2023. En: SEMG [en línea] [consultado el 09/05/2024]. Disponible en www.semg.es/index.php/consensos-guias-y-protocolos/399-gema-5-3-guia-espanola-para-el-manejo-del-asma
- Boonjindasup W, Marchant JM, McElrea MS, Yerkovich ST, Masters IB, Chang AB. Does routine spirometry impact on clinical decisions and patient-related outcome measures of children seen in respiratory clinics: an open-label randomised controlled trial. BMJ Open Respir Res. 2023;10(1). https://doi.org/10.1136/bmjresp-2022-001402
- Duelo Marcos M, Moneo Hernández MI; Grupo de Vías Respiratorias. El pediatra de AP y el tabaco. Protocolo del GVR (publicación P-GVR-8) [en línea] [consultado el 09/05/2024]. Disponible en www.aepap.org/sites/default/files/documento/archivos-adjuntos/pediatra-y-tabaquismo-2018.pdf
- Córdoba García R, García Sánchez N, Suárez López de Vergara RG, Galván Fernández C. Exposición al humo ambiental de tabaco en la infancia. An Pediatr (Barc). 2007;67(2):101-3. https://doi.org/10.1016/S1695-4033(07)70568-4





