Vol. 17 - Num. 24
Flashes pediátricos AEPap en patología infecciosa
Faringoamigdalitis no estreptocócicas ¿hay “algo” más allá de las guías clínicas?
Pilar Cocho Gómeza, I Rivero Calleb
aPediatra. Centro Salud Segovia 3. Segovia. España.
bHospital Clínico Universitario Santiago de Compostela. A Coruña. España.
Cómo citar este artículo: Cocho Gómez P, Rivero Calle I. Faringoamigdalitis no estreptocócicas ¿hay “algo” más allá de las guías clínicas? Rev Pediatr Aten Primaria. 2015;(24):43-52.
INTRODUCCIÓN
La faringoamigdalitis aguda (FA) es una de las enfermedades más comunes en la infancia y supone una gran cantidad de consultas en Atención Primaria, alrededor de un 20% en España1.
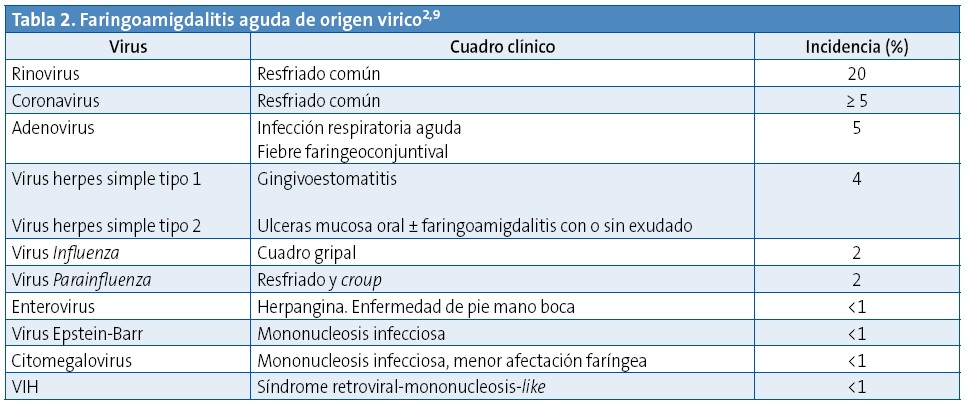
La etiología vírica es la más frecuente, causando un 50% de los casos en niños y hasta un 70% en los menores de tres años1,2. El rinovirus origina un 20% de los casos y el coronavirus más de un 5%. Otros virus -adenovirus, virus de Epstein-Barr (VEB), citomegalovirus (CMV), virus de la inmunodeficiencia humana (VIH)- son una causa menos habitual de faringoamigdalitis, pero a tener en cuenta porque tienen un curso clínico difícilmente distinguible de las bacterianas. De entre las FA bacterianas la más frecuente es la causada por el estreptococo del grupo A, responsable de alrededor de un 30% de los casos en niños de 3 a 13 años de edad2. El resto de las bacterias causantes de FA -Mycoplasma pn. Fusobacteria, etc.-son mucho menos frecuentes. A pesar de esto, en los últimos años se han publicado artículos alertando de la existencia de FA causadas por estas bacterias ya que pueden provocar un cuadro de mayor morbilidad e incluso mortalidad y son más difíciles de confirmar mediante pruebas complementarias4,5. Los adolescentes son el grupo de edad en el que, sobre todo, debemos plantearnos estas posibilidades diagnósticas6.
Como ya se ha planteado desde este grupo ante una faringoamigdalitis aguda debemos en primer lugar plantearnos el diagnóstico diferencial entre la etiología vírica y bacteriana. Recomendamos utilizar una escala clínica ya validada como la Regla de Predicción de CENTOR (tabla 1).
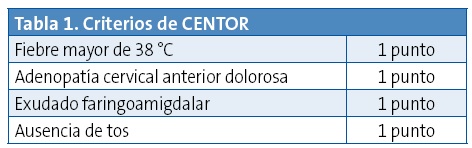
Ante una puntuación > o igual a tres, la probabilidad de causa bacteriana es mayor y recomendamos como grupo la realización del test de detección rápida del estreptococo del grupo A (TDRA) para establecer la pauta diagnóstica y terapéutica inicial. Existe controversia en la actualidad entre las distintas guías clínicas: así las guías NICE, SIGN y ESCMID no apoyan su uso y hasta otras ocho guías sí lo hacen. El valor predictivo positivo de la clínica y la exploración no supera el 50%, por tanto desde nuestro grupo apoyamos y propugnamos el uso de TDRA3.
¿QUÉ OTRAS CAUSAS NOS DEBEMOS PLANTEAR ANTE UN CUADRO DE FARINGOAMIGDALITIS AGUDA?
Virus
Detallaremos los más importantes, el resto aparecen en la Tabla 2.
Adenovirus
Son virus ADN de doble cadena, muy estables a cambios de pH y temperatura que producen infecciones estacionales y ocasionalmente brotes epidémicos7. Pueden dar lugar a un cuadro de fiebre alta, amígdalas con exudado y adenopatías anterocervicales, indistinguible del cuadro causado por el estreptococo del grupo A2,8. Es el agente causal del 5% de las faringoamigdalitis2 y la causa más frecuente de faringoamigdalitis en menores de tres años9. El método diagnóstico de referencia es el cultivo. También son de utilidad los test rápidos para la detección de antígenos virales que se realizan mediante enzimainmunoanálisis e inmunofluorescencia en secreciones respiratorias. Estos test son más rápidos que el cultivo, pero menos sensibles y no válidos para pacientes inmunocomprometidos10. Su especificidad es mayor de 95%7.
Virus de Epstein-Barr y citomegalovirus: mononucleosis infecciosa
El virus de Epstein-Barr es el virus herpes tipo 4 y causa el 90% de los casos de mononucleosis infecciosa. Da lugar a una infección de alta prevalencia. Estudios realizados en España muestran una prevalencia de anticuerpos del 73,5% en alumnos entre 13 y 14 años de edad11, con una distribución bimodal según la edad: un pico de incidencia entre los dos y cuatro años y otro entre los 14 y 18 años12. Este virus es el responsable de menos del 1% de los casos de faringoamigdalitis2, pero puede presentar una clínica indistinguible de la faringoamigdalitis estreptocócica. Los datos diferenciales son la hepatoesplenomegalia, las adenopatías laterocervicales múltiples o generalizadas, el edema palpebral y la presentación en la adolescencia9. La sensibilidad y la especificidad de los síntomas no son suficientes para realizar su diagnóstico y precisamos de pruebas de laboratorio para llegar a él13.
Pruebas no específicas:
- Hemograma: leucocitosis con linfocitosis relativa. Linfocitos atípicos > 10%.
- Bioquímica: elevación de GOT/GPT/LDH.
- Anticuerpos heterófilos: son anticuerpos tipo IgM que aglutinan hematíes de otras especies de mamíferos. En niños mayores, adolescentes y adultos tienen una sensibilidad del 85-90%, 50% en la primera semana de la enfermedad y 60-90% en la segunda y tercera semana. Su especificidad es de 98-100%14,15. Las debilidades del test son la baja sensibilidad en niños menores de cuatro años: niños de 2-4 años es de un 50% y en menores de dos años es de 10-30%. Aunque la especificidad es muy elevada, puede haber falsos positivos en otras infecciones víricas, en enfermedades autoinmunes y en neoplasias13.
Pruebas específicas:
- Serología: es el método diagnóstico de referencia. Se realiza mediante inmunofluorescencia, enzimainmunoanálisis, ELISA, inmunoanálisis de quimioluminiscencia y múltiple de flujo14. Su sensibilidad y especificidad en la población general es de 95-100% y del 86-100% respectivamente15. De forma rutinaria y en pacientes inmunocompetentes se realiza la siguiente serología (Tabla 3):
- IgM antiantígeno de la cápside viral (ACV): es un buen marcador de infección aguda. Está presente desde el inicio de la clínica y desciende a partir de las 4-6 semanas de evolución. Desaparece alrededor del tercer mes16. Es poco específica y puede ser positiva en las infecciones por otros virus del grupo herpes y en enfermedades con gran respuesta inmune como las autoinmunes. La sensibilidad en niños mayores y adultos es de un 90%. En menores de dos años es de 60%.
- IgG anti-ACV: puede aparecer desde el inicio de la clínica debido al largo periodo de incubación de esta infección. Aparece en el 100% de los casos y se mantiene de por vida. Es un marcador de haber padecido la infección.
- IgG antiantígeno nuclear (AN): Aparece entre la semana 6 y 12 del inicio de los síntomas y generalmente persiste de por vida. Si aparece en una serología inicial indica que los síntomas actuales no se pueden atribuir al VEB.
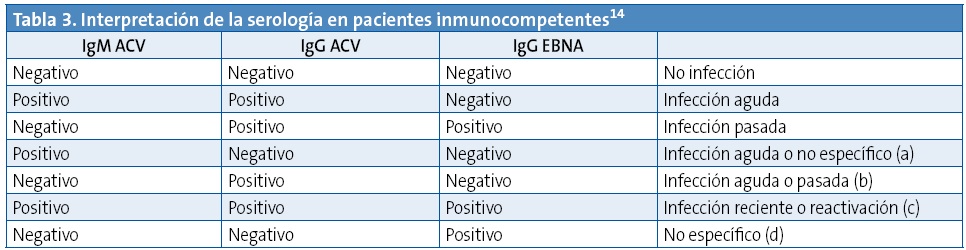
(a) Estadio muy reciente de la infección, hay que descartar un falso positivo por factor reumatoide u otros auto-anticuerpos. Posible reacción cruzada con la IgM anti parvovirus B19 y anti-CMV.
(b) Podría ocurrir en una fase aguda de la infección en la que ya no se detecta la IgM porque ha descendido a niveles no detectables. A veces la IgM puede aparecer hasta dos semanas después de la IgG. Podría darse en una infección pasada sin producción de IgG anti-AN, lo que ocurre en el 5% de los casos. También podría ser por la pérdida de nivel de IgG anti-AN, esto ocurre con frecuencia en inmunodeprimidos, menos frecuente en inmunocompetentes.
(c) Indica infección reciente en los últimos meses. También puede indicar la reactivación de la infección. Esta última situación tiene poca relevancia clínica en personas inmunocompetentes, no así en inmunodeprimidos.
(d) Teóricamente no se podría dar. En la practica un 1,7% de las positividades de IgG anti-AN son aisladas. Para saber si es un falso positivo o una infección pasada se utiliza la PCR para detección de ADN viral y el inmunoblotting. Es esencial en inmunodeprimidos y en receptores de trasplante para conocer su susceptibilidad a la infección por este virus.
El citomegalovirus (herpes tipo 5) y el herpes tipo 6 son los responsables del 10% restante de mononucleosis infecciosas. Los rasgos diferenciales con la producida por el virus de Epstein-Barr son la menor frecuencia de exudado faringoamigdalar y el predominio de los síntomas sistémicos17. En la actualidad el método diagnóstico de elección es la PCR tanto cualitativa como cuantitativa, esta última muy importante en pacientes inmunodeprimidos y trasplantados18.
La serología sigue siendo el arma diagnostica de uso más frecuente en nuestro ámbito de la Atención Primaria. La técnica más utilizada es el ELISA, aunque también se realiza mediante inmuofluorescencia, hemaglutinación indirecta y aglutinación en látex.
- IgM anti-CMV: aparece en las dos primeras semanas de la enfermedad y puede persistir hasta 4-6 meses después. Su presencia puede indicar tanto infección reciente como reactivación de una infección adquirida en el pasado. También existen falsos positivos. Por tanto, por sí sola no es diagnostica de infección primaria por CMV.
- IgG anti-CMV: generalmente son detectables a partir de la 2.ª-3.ª semana de la clínica y persisten durante toda la vida.
- Infección reciente: se considera probable cuando se detecta IgM anti-CMV y además una seroconversión con aumento en los títulos IgG anti-CMV en dos muestras separadas de dos a cuatro semanas.
- Infección pasada: cualquier título de IgG anti-CMV.
La serología no tiene ningún papel en el diagnostico en pacientes inmunocomprometidos17.
Infección por VIH
La infección primaria por VIH puede causar un síndrome mononucleosis-like: fiebre, faringoamigdalitis con o sin exudado, adenopatías generalizadas, exantema y pérdida de peso. Se debe sospechar en adolescentes sexualmente activos y en niños víctimas de abusos sexuales. El inicio de los síntomas ocurre a los días-semanas de la exposición. Cursa con linfopenia y elevación de transaminasas(9).
Bacterias (tabla 3)
Infección por estreptococo del grupo C y G
Bacterias gram positivas que producen hemolisis tipo β en las placas de Agar-sangre y que se clasifican en tipo C y G según el polisacárido de la pared celular. Son poco frecuentes como causa de enfermedad en niños, afectando sobre todo a adolescentes y adultos19,20. Son las responsables de un 5% de las faringoamigdalitis agudas2. Ambas bacterias pueden causar tanto epidemias con brotes en colegios o instituciones cerradas como brotes esporádicos, aunque en estos casos su implicación es controvertida20. Son flora comensal, colonizadoras habituales de la rinofaringe y por tanto además del cultivo de frotis faríngeo, se necesita demostrar una respuesta inmune, elevación de ASLO, para establecer causalidad21. Los síntomas son parecidos a la faringoamigdalitis por estreptococo del grupo A pero más leves. No se detectan con los test rápidos de SGA y no se conoce ningún caso de fiebre reumática tras una infección por estos estreptococos. Son sensibles a penicilina y la duración del tratamiento, si se precisa, sería menor de diez días por no ser reumatógenos.
Infección por Mycoplasma pneumoniae
Es la bacteria más pequeña que existe, carece de una pared celular rígida lo que impide la tinción de gram y la clasifica como atípica. Aunque clásicamente no se consideraba parte de la flora normal del ser humano, sí que existen portadores asintomáticos que pueden ser fuente de contagio22. Es responsable de un porcentaje bajo de faringoamigdalitis, según algunos autores de menos del 1% de los casos2 y de un 5-16% de los casos según otros9. Podría estar relacionado con cuadros de larga duración y recurrentes pero existe una gran controversia respecto a la implicación de esta bacteria como agente causal de la faringoamigdalitis23. El grupo de Esposito la otorga un papel importante en los cuadros recurrentes y recomiendan considerarla24. En España un estudio realizado en 2006 y publicado en 2009 encuentra una baja prevalencia de infección por este patógeno25. Los métodos de diagnóstico clásicos ofrecen muchos inconvenientes ya que el cultivo es lento y difícil de realizar y la serología precisa de dos muestras seriadas. Las técnicas de PCR a tiempo real son más rápidas y sensibles que los métodos clásicos, aunque más caras y todavía no utilizadas de forma generalizada22. Según un estudio realizado en Holanda y publicado en 2013 ninguno de los métodos anteriores permite diferenciar el estado de portador y la infección de vías respiratorias superiores por esta bacteria26. La última revisión Cochrane (2010)27 concluye que todavía no está establecida esta relación y no se recomienda el tratamiento cuando la clínica se localiza en las vías respiratorias superiores. Esta revisión recomienda la realización de ensayos clínicos aleatorizados, a doble ciego de alta calidad para evaluar la eficacia y la seguridad de los antibióticos para las infecciones respiratorias secundarias a M. pneumoniae en los niños.
Infección por Fusobacterium necrophorum
Bacilo gram-negativo, anaerobio estricto. Se encuentra como comensal en la faringe, con un porcentaje de portadores entre un 7 y 21% según estudios realizados mediante PCR a tiempo real en frotis faríngeos6. Es un patógeno importante en los adolescentes y adultos jóvenes, ya que es el causante del 10% de las FA en este grupo de edad6,28 y la causa más frecuente de absceso periamigdalar y del síndrome de Lemierre (hasta en un 80%). Jensen, et al realizaron un estudio en adultos jóvenes y concluyeron que el 48% de las faringitis no causadas por el estreptococo del grupo A eran causadas por esta bacteria29. Los cultivos rutinarios no identifican esta bacteria y es preciso utilizar medios de cultivo para anaerobios o técnicas de PCR real en los frotis faríngeos. El tratamiento de elección es la penicilina y también es sensible a las cefalosporinas de primera generación28. El síndrome de Lemierre consiste en una faringoamigdalitis necrotizante inicial con tromboflebitis séptica de la vena yugular interna y posteriores abscesos a distancia sobre todo a nivel pulmonar. Produce hasta un 5% de mortalidad. Su diagnóstico inicial es clínico y se debe sospechar ante una FA asociada a edema unilateral de cuello. Se confirma tras el aislamiento del Fusobacteriun nc. en los cultivos de sangre para anaerobios.
Infección por Arcanobacterium haemolyticum
Bacilo gram positivo aerobio o anaerobio facultativo. Es comensal humano, se encuentra en faringe y piel. Se transmite por vía aérea mediante gotitas de saliva. Causa menos del 1% de faringoamigdalitis en la edad pediátrica2, pero es una causa a tener en cuenta en adolescentes y adultos jóvenes, en los que puede llegar al 10-25%30. El cuadro clínico se parece mucho al causado por estreptococo del grupo A (SGA) con fiebre, hiperemia faringoamigdalar con exudado en un 70% de los casos31, adenopatía anterocervical y exantema escarlatiniforme en las superficies extensoras de brazos que posteriormente se extiende a tronco y cuello, aparece en la mitad de los casos31. El diagnóstico se realiza mediante cultivo en placas de agar-sangre. Tiene un crecimiento lento y produce una hemolisis tardía (72 h). El tratamiento de elección para la FA por esta bacteria son los macrólidos (eritromicina).
Otras bacterias poco frecuentes pero asociadas a factores de riesgo muy claros son: Neisseria gonorrhoeae (adolescentes sexualmente activos), Corynebacterium diphteriae (población de países con baja cobertura vacunal o viaje reciente a esos países, sobre todo la antigua Unión Soviética, África o Asia). Tularemia: Ambiente epidémico. Contacto con roedores. Ingesta de leche o carne contaminada.
¿Y SI NOS ENFRENTAMOS A UN PACIENTE CON FARINGOAMIGDALITIS DE REPETICIÓN Y SIN CAUSA INFECCIOSA DEMOSTRABLE?
Síndrome PFAPA
El síndrome PFAPA es una enfermedad autoinflamatoria, probablemente la más frecuente, que cursa con fiebre periódica; en la que se sospecha etiología inmune y en la que no se ha demostrado base genética32.
¿Qué sabemos sobre su epidemiología?
Descrito por primera vez por Marshall y colaboradores en 198733, quienes acuñaron el acrónimo FPAPA (periodic fever, adenopathy, pharingitis and afthae)34. En España los primeros casos fueron publicados en el año 200035.
La etiología es desconocida aunque se sospecha que existe una desregulación de la respuesta inmune a algún agente infeccioso capaz de inducir una rápida activación de las células de la inmunidad innata a través de la vía de Th136, detectándose elevación de interferón (IFN), interleucina tipo 6 (IL-6), y factor de necrosis tumoral (TNF) durante los episodios febriles33.
No se han encontrado factores genéticos, aunque se han descrito algunos casos con agregación familiar36. La edad típica de comienzo se sitúa entre los dos y los cinco años aunque se han descrito casos en niños desde los 11 meses37 y en la edad adulta38.
¿Cómo se manifiesta?
La fiebre es condición necesaria para el diagnóstico, se caracteriza por ser muy elevada, presenta mala respuesta a antitérmicos y antiinflamatorios no esteroideos (AINE) y aparece en presencia de otros signos como faringitis (pultácea o no), adenopatías cervicales y aftas orales, que definen el cuadro39,40. Puede acompañarse de síntomas constitucionales, dolor abdominal, cefalea, artralgias, tos, náuseas, diarrea o exantema36,41.
Es característica la periodicidad de los episodios cada 3-9 semanas (aproximadamente uno al mes), que se suceden sin predominio estacional durante un periodo de tiempo limitado (habitualmente 4-8 años), haciéndose cada vez más infrecuentes hasta su desaparición. Cada episodio es autolimitado y tiene una duración aproximada de unos 3-6 días (media de 4,6 días).
¿Cómo diagnosticamos el síndrome de PFAPA en un niño con amigdalitis de repetición?
El diagnóstico de este síndrome es fundamentalmente clínico ante pacientes que presentan los signos y síntomas referidos42-45. Es importante tener presente que el niño con síndrome PFAPA mantiene una adecuada curva ponderoestatural (a diferencia de algunos síndromes de fiebre periódica hereditarios, como el síndrome de hiper-IgD (HIDS), y permanece asintomático entre episodios46.
Criterios diagnósticos de Thomas del síndrome PFAPA39
- Episodios de fiebre recurrente de inicio antes de los cinco años.
- Síntomas constitucionales en ausencia de infección de vías respiratorias altas con al menos uno de los siguientes: estomatitis aftosa, linfadenitis cervical, faringitis.
- Exclusión neutropenia cíclica.
- Ausencia de síntomas entre episodios.
- Crecimiento y desarrollo normales.
Criterios diagnósticos de Padeh del síndrome PFAPA47
- Fiebre recurrente a cualquier edad.
- Posible estomatitis aftosa.
- Linfadenopatía cervical.
- Cultivo exudado faríngeo negativo.
- Completamente asintomático entre los episodios.
- Rápida respuesta a una dosis única de corticoides.
¿Qué pruebas complementarias debemos solicitar ante una sospecha?
Sería razonable comenzar el estudio de primer nivel con un hemograma (puede haber leucocitosis y neutrofilia durante el episodio) y marcadores de inflamación como proteína C reactiva (PCR) y velocidad de sedimentación globular (VSG), tanto en crisis como intercrisis (en la que deben normalizarse los parámetros de inflamación), asociado a estudio microbiológico negativo (frotis faríngeo) durante el episodio. En general la procalcitonina no presenta alteraciones relevantes.
Como exploraciones de segundo nivel, cuantificación de inmunoglobulinas plasmáticas, G, A, M, incluida la IgD.
¿Con qué entidades debe establecerse el diagnóstico diferencial?44,45
- Cuadros infecciosos de repetición en niños sanos sobre todo al inicio de la escolarización.
- Faringoamigdalitis infecciosas, víricas y bacterianas.
- Infecciones recurrentes o crónicas como brucelosis o borreliosis.
- Inmunodeficiencias.
- Neutropenia cíclica.
- Enfermedad de Behçet.
- Síndromes hereditarios de fiebre periódica.
- Enfermedades autoinmunes (por ejemplo, lupus eritematoso sistémico).
- Artritis idiopática juvenil.
- Patología tumoral.
¿En qué circunstancias debemos dudar del diagnóstico?
- Si se comprueba neutropenia.
- Si aparece sintomatología o se evidencia elevación de reactantes de fase aguda entre los episodios.
- Historia familiar de fiebre recurrente. En estos casos debemos descartar otros síndromes autoinflamatorios hereditarios.
¿Cómo se trata?
Existen tres pilares básicos a tener en cuenta a la hora de tratar a estos pacientes:
- Lograr un adecuado control de los síntomas del episodio agudo. Este síndrome se caracteriza por presentar una respuesta incompleta al tratamiento antipirético o antiinflamatorio con fármacos habituales como el ibuprofeno o paracetamol. Además, es importante recalcar que al no tratarse de una enfermedad infecciosa, los antibióticos resultan completamente ineficaces43. El uso de esteroides constituye el tratamiento de elección logrando el cese de la sintomatología en las siguientes 2-4 horas32.
- Hallar un tratamiento que acorte la duración de los episodios. Se emplea principalmente prednisona o prednisolona, dosis única de 1-2 mg/kg o dosis de 1 mg/kg los primeros dos días y posteriormente mitad de dosis el tercer y cuarto día41. Otra opción descrita es betametasona a 0,3 mg/kg por su vida media larga46. Los síntomas desaparecen de forma progresiva, aunque la estomatitis aftosa suele ser la manifestación más lenta en hacerlo47. Por otro lado, aunque permite disminuir la duración del episodio, también se ha descrito la posibilidad de acortar los periodos asintomáticos48.
- Conseguir disminuir la frecuencia de los episodios, o idealmente, descubrir un tratamiento curativo. Se han empleado de forma profiláctica por su efecto inmunomodulador la cimetidina y la colchicina, en pacientes con episodios de PFAPA frecuentes (un episodio cada 14 días o menos); lográndose hasta en el 30% de los pacientes la prevención de nuevos episodios49.
- Por último, existen estudios que abogan por la amigdalectomía (con o sin adenoidectomía), presentando resultados variables (fracasos en el 25% de los casos); además hay que tener en cuenta el riesgo de una anestesia general50,51.
¿Cúal es su pronóstico?
La recurrencia mensual de este síndrome produce absentismo escolar y por tanto interfiere en la calidad de vida del paciente. Sin embargo, el desarrollo ponderoestatural no se ve afectado y se trata de un cuadro de carácter benigno y autolimitado que se resuelve espontáneamente en la mayoría de los pacientes antes de llegar a la edad adulta36.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: AINE: antiinflamatorios no esteroideos; AN: antígeno nuclear; AVC: antígeno de la cápside viral; CMV: citomegalovirus; FA: faringoamigdalitis aguda; FPAPA: periodic fever, adenopathy, pharingitis and afthae; HIDS: síndrome de hiper-IgD; IFN: interferón; IL-6: interleucina tipo 6; PCR: proteína C reactiva; SGA: estreptococo del grupo A; TDRA: test de detección rápida del estreptococo del grupo A; TNF: factor de necrosis tumoral; VEB: virus de Epstein-Barr; VIH: virus de la inmunodeficiencia humana; VSG: velocidad de sedimentación globular.
BIBLIOGRAFÍA
- Bercedo Sanz A, Cortés Rico O, García Vera C, Montón Álvarez JL. Normas de calidad para el diagnóstico y tratamiento de la faringoamigdalitis aguda en Pediatría de Atención Primaria. Protocolos drGVR. En: AEPap [en línea] [consultado el 01/06/2015]. Disponible en www.aepap.org/gvr/protocolos.htm
- Piñeiro Pérez R, Hijano Bandera F, Álvez González F, Fernández Landaluce A, Silva Rico JC, Pérez Cánovas C, et al. Documento de consenso sobre el diagnóstico y tratamiento de la faringoamigdalitis aguda. An Pediatr (Barc). 2011;75:e1-342.e13.
- García Vera C. Grupo de patología Infecciosa de la asociación de pediatría de atención Primaria. Utilidad del test rápido de detección de antígeno estreptocócico (TDRA) en el abordaje de la faringoamigdalitis aguda en pediatría. En: AEPap [en línea] [consultado el 01/06/2015]. Disponible en www.aepap.org/grupos/grupo-de-patología-infecciosa/contenido
- Centor RM, Samlowski R. Editoral: avoiding sore throat morbidity and mortality: when is it not “just a sore throat?” Am Fam Physician 2011;83:26-8.
- Hedin K, Bieber L, Lindh M, Sundqvist M. The aetiology of pharyngotonsillitis in adolescents and adults -Fusobacterium necrophorum is commonly found. Clin Microbiol Infect. 2015;1:263.e1-7
- Mitchell MS, Sorrentino A, Centor RM. Adolescent pharyngitis: A review of bacterial causes. Clin Pediatr (Phila). 2011;50:1091-5.
- Díez Domingo J, Ballester A. Infecciones por adenovirus. Enfermedades Infecciosas en Pediatría. Madrid: Mc Graw-Hill/Interamericana de España; 2009.
- Domínguez O, Rojo P, de las Heras S, Folgueira D, Contreras JR. Clinical presentation and characteristics of pharyngeal adenovirus infections. Pediatr Infect Dis J. 2005;24:733-4.
- Wald ER. Approach to diagnosis of acute infectious pharyngitis in children and adolescents. En: UpToDate [en línea] [consultado el 01/06/2015]. Disponible en http://www.uptodate.com/contents/approach-to-diagnosis-of-acute-infectious-pharyngitis-in-children-and-adolescents
- Muñoz FM, Flomenberg Ph. Diagnosis, treatment, and prevention of adenovirus infection. En: UpToDate [en línea] [consultado el 01/06/2015]. Disponible en http://www.uptodate.com/contents/diagnosis-treatment-and-prevention-of-adenovirus-infection
- Martínez JA, Gimeno C, González A, Calvo MJ, Caballero LL. Seroprevalencia de tres tipos de virus hepatotropos en población adolescente de la provincia de Guadalajara. Rev Salud Pública. 2001;75:151-8.
- Pariente M, Bartolomé J, Lorente S, Crespo MD. Distribución por edad de los patrones serológicos de infección por el virus de Epstein-Barr: revisión de resultados de un laboratorio de diagnóstico. Enferm Infecc Microbiol Clin 2007;25:108-10.
- Oumade JA, kristin A, Hogguist H, Balfour A. Progress and problems in understanding and managing primary Epstein-Barr virus infections. Clin Microbiol Rev Jan. 2011:193-209.
- Paschale M, Clerici P. Serological diagnosis of Epstein-Barr virus infection: problems and solutions. World J Virol. 2012;1:31-43.
- Bruu AL, Hjetland R, Holter E, Mortensen L, Natas O, Petterson W, et al. Evaluation of 12 commercial test for detection of Epstein-Barr virus -specific and heterophile antibodies. Clin Diagn Lab Inmunol. 2000;7:451-6.
- Epstein-Barr virus and infectious mononucleosis En: CDC [en línea] [consultado el 01/06/2015]. Disponible en http://www.cdc.gov/Epstein-barr.htlm
- Martín Peinador Y, Grupo de Patología Infecciosa AEPap. Aproximación diagnostica a la infección por citomegalovirus. 2014. En: AEPap [en línea] [consultado el 01/06/2015]. Disponible en www.aepap.org/grupos/grupo-de-patologia-infecciosa/contenido/documentos-del-gpi
- Caliendo AM. Overview of diagnostic test for cytomegalovirus infection. En: UpToDate [en línea] [consultado el 01/06/2015]. Disponible en http://www.uptodate.com/contents/overview-of-diagnostic-tests-for-cytomegalovirus-infection
- Faden H. Group C and G streptococcal disease among children. Pediatric Infectious Dis. 2005;24:1014-5.
- Zaoutis T, Attia M, Gross R, Klein J. The role of group C and group G streptococci in acute pharyngitis in children. Clin Microbiol Infect. 2004;10:37-40.
- Fretzayas A, Moustaki M, Kitsiou S, Nychtari G, Nicolaidou P. The clinical patternof group C streptococcal pharyngitis in children. J Infect Chemother. 2009;15:228-32.
- Waites KB, Atkinson TP. The role of Mycoplasma in upper respiratory infections. Current Infectious Disease Reports. 2009;11:198-206.
- ESCMID Sore Throat Guideline Group, Pelucchi C, Grigoryan L, Galeone C, Esposito S, Huovinen P, et al. Guideline for the management of acute sore throat. Clin Microbiol Infect. 2012;18:1-28.
- Esposito S, Bosis S, Begliati E, Droghetti R, Tremolati E, Tagliabue C, et al. Acute tonsillopharyngitis associated with atypical bacteria infection in children: natural history and impact of macrolide therapy. Clin Infect Dis 43:206-9.
- Fernández de Sevilla M, Alayeto J, Fernández Y, Muñoz-Almagro C, Luaces C, García-García JJ. Baja prevalencia de la infección por Mycoplasma pneumoniae en niños con faringoamigdalitis aguda. Enferm Infecc Microbiol Clin. 2009;27:403-5.
- Spuesens EBM, Fraaij PLA, Visser EG, Hoogenboezem T, Hop WCJ, et al. (2013) Carriage of Mycoplasma pneumoniae in the upper respiratory tract of symptomatic and asymptomatic children: an observational study. PLoS Med 10(5):e1001444.
- Mulholland S, Gavranich J, Chang A. Antibióticos para las infecciones respiratorias bajas adquiridas en la comunidad secundarias a Mycoplasma pneumoniae en niños. Cochrane Database Syst Rev. 2015 Jan 8;1:CD004875.
- Centor RM, Atkinson TP, Ratliff AE, Xiao L, Crabb DM, Estrada CA, et al. The clinical presentation of Fusobacterium-positive and Steptococcal-positive pharyngitis in a university health clinic. Ann Intern Med. 2015;162:241-7.
- Jensen A, Hagelskjaer L, Prag J. Detection of Fusobacterium necrophorum subs. Funduliforme in tonsillitis in young adults by real-time PCR. Clin Microbiol Infect. 2007;13:695-701.
- Puerto Alonso JL, García-Martos P, Girón González JA. Infecciones por Arcanobacterium haemolyticum: un patógeno emergente. An Med Interna. 2002;19:473-6.
- Kyle LH, Dirk ME, et al. Arcanobacterium Haemolyticum Clinical Presentation. En: Medscape [en línea]. Disponible en
- Calvo Rey C, Soler-Palacín P, Merino Muñoz R, Saavedra Lozano J, Antón López J, Aróstegui JL, et al. Documento de Consenso de la Sociedad de Infectología Pediátrica y la Sociedad de Reumatología Pediátrica sobre el diagnóstico diferencial y el abordaje terapéutico de la fiebre recurrente. An Pediatr (Barc). 2011;74:194.e1-194.e16.
- Marshall GS, Edwards KM, Butler J, Lawton AR. Syndrome of periodic fever, pharyngitis, and aphthous stomatitis. J Pediatr. 1987;110:43-6.
- Marshall GS, Edwards KM, Lawton AR. PFAPA syndrome. Pediatr Infect Dis J. 1989;8:658-9.
- Ramos Amador JT, Rodríguez Cerrato V, Bodas Pinedo A, Carnicero Pastor MJ, Jiménez Fernández F, Rubio Gribble B. Fiebre periódica, estomatitis aftosa, faringitis y adenitis cervical: a propósito de 3 casos. An Pediatr (Barc). 2000;52:59-61.
- Jiménez Treviño S, Ramos Polo E. De la fiebre periódica a los síndromes autoinflamatorios. Bol Pediátrico. 2011;51:194-203.
- Førsvoll J, Kristoffersen EK, Øymar K. Incidence, clinical characteristics and outcome in Norwegian children with periodic fever, aphthous stomatitis, pharyngitis and cervical adenitis syndrome; a population-based study. Acta Paediatr. 2013;102:187-92.
- Padeh S, Stoffman N, Berkun Y. Periodic fever accompanied by aphthous stomatitis, pharyngitis and cervical adenitis syndrome (PFAPA syndrome) in adults. Isr Med Assoc J. 2008;10:358-60.
- Thomas KT, Feder HM Jr, Lawton AR, Edwards KM. Periodic fever syndrome in children. J Pediatr. 1999;135:15-21.
- Padeh S, Brezniak N, Zemer D, Pras E, Livneh A, Langevitz P, et al. Periodic fever, aphthous stomatitis, pharyngitis, and adenopathy syndrome: clinical characteristics and outcome. J Pediatr. 1999;135:98-101.
- Villanueva Rodríguez C, Caballero Soler J. El síndrome de Marshall o PFAPA debe ser sospechado en la consulta de Atención Primaria. Rev Pediatr Aten Primaria. 2009;44:613-7.
- Vigo G, Zulian F. Periodic fevers with aphtous stomatitis, pharyngitis, and adenitis (PFAPA). Autoimmunity Review. 2012;12:52-5.
- Solís Gómez B, Molins Castiella T, Rupérez García E, Gembero Esarte E, Molina Garicano J. Síndrome PFAPA, un reto para el pediatra. An Pediatr (Barc). 2007;66:631-2.
- Gattorno M, Caorsi R, Meini A, Cattalini M, Federici S, Zulian F, et al. Differentiating PFAPA syndrome from monogenic periodic fevers. Pediatrics. 2009;124:e721-e728.
- Kallinich T, Gattorno M, Grattan CE, de Koning HD, Traidl-Hoffmann C, Feist E, et al. Unexplained recurrent fever: when is autoinflammation the explanation? Allergy. 2013;68:285-96.
- Guerrero-Fernández J. Síndrome de PFAPA. En: Revista Web Pediátrica [en línea] [consultado el 01/06/2015]. Disponible en http://webpediatrica.com/casosped/pdf/82_PFAPA.pdf
- Padeh S. Periodic fever syndromes. Pediatr Clin North Am. 2005;52:577-609.
- Hashkes P, Zedek S. Periodic fever, aphtous stomatitis, pharyngitis adenitis syndrome. EN: American College of Rheumatology Pediátrica [en línea] [consultado el 01/06/2015]. Disponible en http://www.rheumatology.org/Practice/Clinical/Patients/Diseases_And_Conditions/Periodic_Fever,_Aphthous_Stomatitis,_Pharyngitis,_Adenitis_Syndrome_%28PFAPA%29_%28Juvenile%29/
- Tasher D, Stein M, Dalal I, Somekh E. and adenitis episodes. Colchicine prophylaxis for frequent periodic fever, aphthous stomatitis, pharyngitis and adenitis episodes. Acta Paediatr. 2008;97:1090-2.
- Renko M, Salo E, Putto-Laurila A, Saxen H, Mattila PS, Luotonen J, et al. A randomized, controlled trial of tonsillectomy in periodic fever, aphthous stomatitis, pharyngitis, and adenitis syndrome (PFAPA). J Pediatr. 2007;151:289-92.
- Garavello W, Romagnoli M, Gaini RM. Effectiveness of adenotonsillectomy in PFAPA syndrome: a randomized study. J Pediatr. 2009;155:250-3.





