Posible relación entre alopecia areata e infecciones por enterovirus
Santiago Conde Barreiroa, Beatriz González Pelegrínb, Eduardo Clemente Roldánc, Maria Pilar Rodrigo Vald, Alfredo Yuste Arae
aPediatra. CS de Barbastro. Barbastro. Huesca. España.
bEnfermera. Hospital de Barbastro. Barbastro. Huesca. España.
cMedicina Preventiva. Hospital de Barbastro. Barbastro. Huesca. España.
dEspecialista en Medicina Preventiva. Dirección General de Salud Pública del Gobierno de Aragón. Zaragoza. Zaragoza. España.
eTécnico Informático. Hospital de Barbastro. Barbastro. Huesca. España.
Correspondencia: S Conde. Correo electrónico: santycon@terra.com
Cómo citar este artículo: Conde Barreiro S, González Pelegrín B, Clemente Roldán E, Rodrigo Val M, Yuste Ara A. Posible relación entre alopecia areata e infecciones por enterovirus. Rev Pediatr Aten Primaria. 2014;16:e87-e93.
Publicado en Internet: 07-10-2014 - Número de visitas: 48581
Resumen
Introducción: la alopecia areata es una enfermedad autoinmune de etiología desconocida que se asocia a otras enfermedades autoinmunes. La enfermedad mano-pie-boca es una infección viral frecuente en la edad pediátrica, causada por diferentes serotipos de enterovirus y que en ocasiones asocia onicomadesis. El presente estudio pretende comprobar un incremento de los casos de alopecia areata tras un brote de enfermedad mano-pie-boca en nuestro entorno.
Material y métodos: identificación de los pacientes menores de 14 años diagnosticados de enfermedad mano-pie-boca y/o alopecia areata en un área de salud entre el 1 de enero de 2011 y el 31 de diciembre de 2012. Revisión de historias clínicas, recogiendo fecha de nacimiento y diagnóstico, edad al diagnóstico y características clínicas.
Resultados: se encontraron 49 pacientes diagnosticados de enfermedad mano-pie-boca y siete diagnosticados de alopecia areata. Se confirmó un brote de enfermedad mano-pie-boca con 42 casos en un periodo de ocho semanas. Se observó un incremento posterior de los casos de alopecia areata (cuatro casos en las cuatro semanas siguientes, frente a tres casos a lo largo de los 11 meses previos y ninguno durante el año anterior).
Conclusiones: tras un brote de enfermedad mano-pie-boca se observó un incremento del número de casos de alopecia areata. Este hecho, unido a la asociación de la alopecia areata con otras enfermedades autoinmunes y a la relación encontrada entre infecciones por enterovirus y procesos autoinmunes como la diabetes mellitus tipo 1, plantea una posible relación causal entre infecciones por enterovirus y alopecia areata, así como un posible componente de autoinmunidad en la onicomadesis asociada a la enfermedad mano-pie-boca.
Palabras clave
● Alopecia areata ● Autoinmunidad ● Enfermedad mano-pie-boca ● Enterovirus ● Onicomadesis ● PediatríaINTRODUCCIÓN
La alopecia areata se considera una enfermedad autoinmune de etiología desconocida, probablemente multifactorial. En su origen se han implicado factores genéticos, inmunológicos, infecciosos, circulatorios, neurológicos y psicógenos. Es frecuente su asociación a otras enfermedades autoinmunes como el vitíligo, la diabetes mellitus tipo 1, la tiroiditis de Hashimoto, la enfermedad de Addison o la anemia perniciosa, y también a enfermedades relacionadas con hipersensibilidad inmunitaria como el asma y el eccema atópico1-3.
Hasta un 20-30% de los pacientes presentan antecedentes familiares de la enfermedad, y esta proporción es mayor cuando la enfermedad debuta precozmente. Se ha postulado que estos factores genéticos irían probablemente asociados a los genes del sistema HLA, habiéndose descrito haplotipos predisponentes para la enfermedad4.
En cuanto a factores infecciosos, se ha descrito su posible asociación con infecciones por el virus de Epstein-Barr, el citomegalovirus, el virus herpes varicela-zóster, el virus de la gripe porcina y el Helicobacter pylori, si bien no se ha confirmado esta relación5-7. No se ha descrito previamente en la literatura relación entre alopecia areata e infecciones por enterovirus, aunque se sospecha que algunos de estos virus pueden estar implicados en la etiopatogenia de enfermedades autoinmunes como la diabetes mellitus tipo 18-9.
La enfermedad mano-pie-boca (EMPB) es un cuadro infeccioso frecuente en la edad pediátrica, caracterizado por la aparición de fiebre, aftas en la cavidad oral y exantema vesiculopapular predominante en áreas distales de las extremidades (manos y pies). El cuadro es producido por diferentes enterovirus, típicamente coxsackie A16 y EV71, pero también coxsackie A5, A7, A9, A10, B1, B2, B3 y B510 y Echovirus E3, E4 y E911. La enfermedad puede presentarse de forma esporádica o en pequeños brotes epidémicos en guarderías y escuelas, generalmente al final de la primavera y en otoño. En los últimos años se han descrito brotes de la enfermedad en relación con coxsackie A6, a menudo de características clínicas atípicas, como diferente distribución de las lesiones, mayor tamaño de las mismas en algunos pacientes (con existencia de cuadros de afectación cutánea extensa como el eccema coxsackium) y mayor afectación en adultos12-14, así como brotes causados por EV71 en el sureste asiático, revestidos de mayor gravedad y con casos de fallecimiento debidos a la infección15.
Además, en los últimos años se ha comprobado la asociación entre la EMPB y la onicomadesis. Este hallazgo, basado en la observación de casos de onicomadesis ocurridos poco después de brotes de EMPB en áreas geográficas concretas, fue comunicado inicialmente en Chicago10 y confirmado posteriormente a nivel mundial16,12,14, incluyendo algunas regiones españolas11,17-19. La onicomadesis suele producirse en niños menores de tres años, entre cuatro y ocho semanas después de la EMPB19, con mayor frecuencia cuando esta es causada por coxsackie A612,14. También se han descrito casos en niños mayores e incluso en adultos que habían estado expuestos a virus coxsackie A620. Por el momento se desconoce el mecanismo etiopatogénico de la onicomadesis, si bien se ha sugerido que podría estar causada por lesión directa del virus sobre las células de la matriz ungueal14, detención del crecimiento de las uñas por la inflamación existente en lesiones papulovesiculares en las proximidades del lecho ungueal, impacto sistémico de la enfermedad o incluso por daño secundario a un exceso de higiene sobre las zonas afectadas, que daría lugar a sobreinfección fúngica21.
En nuestra área de salud observamos durante el otoño de 2012 un brote de EMPB de características atípicas y posteriormente un aumento del número de casos diagnosticados de alopecia areata en pacientes de edad pediátrica.
El presente estudio tiene por objetivo comprobar si ha existido un incremento del número de casos diagnosticados de alopecia areata tras un brote de EMPB en nuestro entorno y describir las características de los casos observados, de cara a plantear una posible asociación entre ambos procesos.
MATERIAL Y MÉTODOS
Se realizó un estudio descriptivo. Se llevó a cabo una búsqueda en la base de datos donde se recoge la historia clínica informatizada de Atención Primaria (OMI-AP) de todos los pacientes menores de 14 años diagnosticados de EMPB y/o de alopecia en nuestra área de salud entre el 1 de enero de 2011 y el 31 de diciembre de 2012. Se revisaron las historias clínicas de los pacientes identificados y su evolución hasta el 30 de junio de 2013 (seis meses después de la finalización del periodo de estudio). En los casos de alopecia, se seleccionaron únicamente aquellos que por sus características clínicas eran sugestivos de alopecia areata, excluyendo otros tipos de alopecia (tricotilomanía, caída de cabello sin áreas de alopecia, etc.). Se recogieron como variables la fecha de nacimiento, la fecha de diagnóstico y la edad al diagnóstico. Se valoraron las características de los casos descritas en la historia clínica, así como los estudios microbiológicos realizados. Análisis estadístico: Se estudió la distribución de frecuencias de los casos por años y semanas, la edad media al diagnóstico y el rango de edad al diagnóstico para los casos de EMPB descritos dentro del brote epidémico y para los casos de alopecia areata descritos en las semanas posteriores al mismo, utilizando los programas estadísticos Excel® 97 y SPSS® 15.0.
RESULTADOS
Se encontraron un total de 49 pacientes de edad pediátrica diagnosticados de EMPB y siete pacientes diagnosticados de alopecia areata a lo largo del periodo de estudio.
Se identificaron tres pacientes diagnosticados de EMPB, y ninguno de alopecia areata durante el año 2011, frente a 46 pacientes diagnosticados de EMPB y siete diagnosticados de alopecia areata durante 2012.
Se confirmó la existencia de un brote de EMPB con un total de 42 pacientes diagnosticados dentro de un periodo de ocho semanas (15 de octubre-5 de diciembre de 2012), encontrando el número máximo de casos en la cuarta semana del brote (10 casos) (Fig. 1). La edad media de los pacientes fue de 21 meses (desviación estándar: 12,21 meses; rango: 8-59 meses).
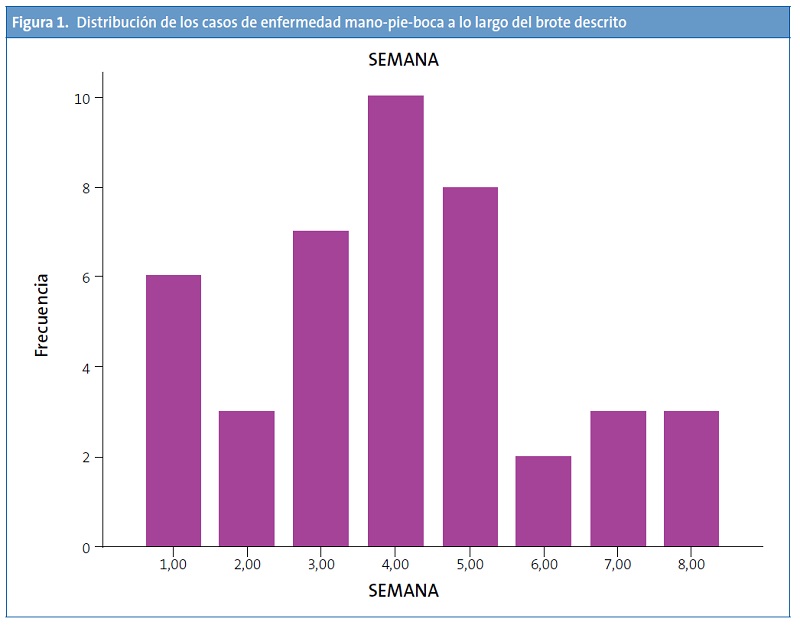
El brote de EMPB afectó principalmente a niños asistentes a guarderías. La enfermedad cursó generalmente con características atípicas, como el predominio de las lesiones en la región perianal y las ingles (más que en los pies), y predominio de lesiones peribucales sobre las orales. En muchos de los pacientes afectados por el brote se pudo identificar onicomadesis en los 2-3 meses posteriores al padecimiento de la enfermedad.
Se realizó estudio microbiológico (cultivo de virus en muestra de saliva durante la fase aguda) únicamente en uno de los pacientes, identificándose enterovirus coxsackie, sin especificación del serotipo concreto.
En las semanas siguientes al brote de EMPB se observó un número mayor de lo habitual de casos de alopecia areata en pacientes pediátricos del área de salud (cuatro casos en las cuatro semanas posteriores, frente a tres casos diagnosticados a lo largo de los 11 meses previos y ninguno durante el año anterior).
Los casos diagnosticados de alopecia areata tras el brote de EMPB tuvieron una edad media de diez años y nueve meses (desviación estándar: 41,28 meses; rango: 5 años y 9 meses-13 años y 5 meses). Ninguno de los casos de alopecia areata había sido diagnosticado de EMPB en los meses previos. Todos los casos de alopecia areata fueron autolimitados, desapareciendo las placas de alopecia en los meses siguientes, tras tratamiento con corticoides tópicos o actitud expectante. Ninguno de los casos presentó afectación ungueal ni patología autoinmune.
DISCUSIÓN
El presente estudio está basado en una observación clínico-epidemiológica, y presenta limitaciones metodológicas debidas principalmente a la necesidad de identificar a los pacientes a partir de las etiquetas diagnósticas escogidas. Probablemente existieron más casos de la EMPB que no requirieron asistencia sanitaria o no fueron registrados como tales en OMI-AP. Del mismo modo es posible que a lo largo del periodo de estudio hayan existido más casos de alopecia areata que no hayan sido diagnosticados. No fue posible realizar el estudio estadístico de las características clínicas de los casos (localización de las lesiones cutáneas, existencia de lesiones orales y periorales, temperatura máxima, existencia de onicomadesis posterior, etc.), ya que estos datos no siempre estaban detallados en las historias clínicas, al igual que el antecedente de asistencia a guardería. Además, se recogieron únicamente los datos de pacientes diagnosticados en edad pediátrica, si bien durante el brote de EMPB se comunicó la existencia de algunos casos de la enfermedad en pacientes adultos.
Los estudios microbiológicos muestran que los serotipos de enterovirus causantes de EMPB predominantes en España durante el año 2012 fueron coxsackie A6 y A1622. Aunque en el brote del presente estudio no se identificó el serotipo (o serotipos) de enterovirus implicados, las características atípicas de la EMPB y la existencia de casos en adultos hacen sospechar la posible presencia de algún serotipo emergente como coxsackie A6.
A pesar de las limitaciones reseñadas, en el estudio se confirma que tras el brote de EMPB en nuestro área de salud se diagnosticó un número de casos de alopecia areata superior al habitual en pacientes de edad pediátrica.
La secuencia temporal descrita no implica en ningún caso causalidad, ya que el número de casos es limitado y no se han realizado estudios microbiológicos ni serológicos en los pacientes diagnosticados de alopecia areata.
Sin embargo, la asociación de la alopecia areata con otras enfermedades autoinmunes y alteraciones inmunológicas, así como la relación encontrada entre infecciones por enterovirus y procesos autoinmunes como la diabetes mellitus tipo 1, nos llevan a plantear una posible relación causal entre infecciones por enterovirus responsables de la EMPB y alopecia areata.
La lesión inmunológica descrita en la alopecia areata consiste en un infiltrado perifolicular e intrafolicular de linfocitos T (CD4+ y CD8+) en los folículos pilosos de las áreas afectadas4, con capacidad reactiva frente a autoantígenos foliculares, y un patrón alterado de señalización inmunológica con afectación de diversas interleucinas, interferón-γ, TNF-α y TGF-β23-25. Alteraciones inmunológicas similares se describen en otras patologías autoinmunes mediadas por células T, en cuya patogenia podrían jugar un papel importante determinadas infecciones virales26.
Uno de los mecanismos propuestos para explicar la relación entre infecciones víricas y autoinmunidad es que una infección inicial pudiese inducir inmunidad frente al agente causal (virus en este caso), pero sucesivas reinfecciones (en ocasiones poco sintomáticas) o exposiciones repetidas a agentes similares (por ejemplo, serotipos virales diferentes) podrían dar lugar a una respuesta inmunitaria anormal dirigida contra el propio huésped, que iniciaría un proceso inflamatorio autoinmune en determinados órganos diana. Este proceso se produciría únicamente en pacientes con una predisposición genética concreta (asociada a polimorfismos en genes del sistema HLA, del receptor de vitamina D, CTLA4, etc.), y podría estar modulado por otros factores ambientales (niveles de vitamina D, factores nutricionales, factores climatológicos, otras infecciones, etc.).
Este mecanismo patogénico se ha comprobado en el caso dengue hemorrágico, en el que, a pesar de ser una enfermedad de etiología vírica, las manifestaciones más graves se producen por mecanismos de autoinmunidad desencadenados por episodios de reinfección27, y se ha sugerido también en enfermedades autoinmunes como la diabetes mellitus tipo 128,29.
En el caso del presente estudio, este mecanismo de reinfección/reexposición explicaría, tras un brote de EMPB en niños de edad preescolar, la aparición de los casos de alopecia areata en pacientes de mayor edad, que probablemente ya hubiesen sufrido infecciones por enterovirus con anterioridad. De este modo, la mayor circulación de enterovirus durante el brote de EMPB condicionaría en las semanas siguientes la aparición de un número de casos de alopecia areata superior a lo habitual.
Del mismo modo queremos apuntar a la posible existencia de un componente de autoinmunidad en la onicomadesis asociada a la EMPB, ya que también en la alopecia areata se describen con frecuencia alteraciones ungueales, entre ellas la onicomadesis30.
Sería interesante tener en cuenta estas hipótesis de cara a futuras investigaciones, pudiendo plantearse la realización de estudios microbiológicos o serológicos a pacientes recientemente diagnosticados de alopecia areata, de cara a comprobar la existencia de infecciones recientes o previas frente a diferentes serotipos de enterovirus.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: EMPB: enfermedad mano-pie-boca • OMI-AP: historia clínica informatizada de Atención Primaria.
BIBLIOGRAFÍA
- Cunliffe WJ, Hall R, Stevenson CJ, Weightman, D. Alopecia areata thyroid disease and autoimmunity. Br J Dermatol. 1969;81:877-81.
- Hordinsky M, Ericson M. Autoimmunity: Alopecia areata. J Investig Dermatol Symp Proc. 2004;9:73-8.
- Muller SA, Winkelmann RK. Alopecia areata. Arch Dermatol. 1963;88:290-7.
- Alzolibani AA. Epidemiologic and genetic characteristics of alopecia areata (part 1). Acta Dermatovenerol Alp Panonica Adriat. 2011;20:191-8.
- Dudda-Subramanya R, Alexis AF, Siu K, Sinha AA. Alopecia areata: genetic complexity underlies clinical heterogeneity. Eur J Dermatol. 2007;17:367-74.
- Ito T, Tokura Y. Alopecia areata triggered or exacerbated by swine flu virus infection. Dermatol. 2012;39:863-4.
- Hayderi LE, Nikkels-Tassoudji N, Nikkels AF. Hair loss after varicella zoster virus infection. Case Rep Dermatol. 2013;5:43-7.
- Hyöty H, Hiltunen M, Knip M, Laakkonen M, Vähäsalo P, Karjalainen J, et al. A prospective study of the role of coxsackie B and other enterovirus infections in the pathogenesis of IDDM. Childhood Diabetes in Finlan (DiMe) Study Group. Diabetes. 1995;44:652-7.
- Yeung WC, Rawlinson WD, Craig ME. Enterovirus infection and type 1 diabetes mellitus: systematic review and meta-analysis of observational molecular studies. BMJ. 2011;342:d35.
- Clementz GC, Mancini AJ. Nail matrix arrest following handfoot-mouth disease: a report of five children. Pediatr Dermatol. 2000;17:7-11.
- Davia JL, Bel PH, Ninet VZ, Bracho MA, González-Candelas F, Salazar A, et al. Onychomadesis outbreak in Valencia, Spain associated with hand, foot, and mouth disease caused by enteroviruses. Pediatr Dermatol. 2011;28:1-5.
- Wei SH, Huang YP, Liu MC, Tsou TP, Lin HC, Lin TL. An outbreak of coxsackievirus A6 hand, foot, and mouth disease associated with onychomadesis in Taiwan, 2010. BMC Infect Dis. 2011;11:346.
- Fujimoto T, Iizuka S, Enomoto M, Abe K, Yamashita K, Hanaoka N. Hand, foot, and mouth disease caused by coxsackievirus A6, Japan, 2011. Emerg Infect Dis. 2012;18:337-9.
- Osterback R, Vuorinen T, Linna M, Susi P, Hyypia T, Waris M. Coxsackievirus A6 and hand, foot, and mouth disease, Finland. Emerg Infect Dis. 2009;15:1485-8.
- Wu Y, Yeo A, Phoon MC, Tan EL, Poh CL, Quak SH, The largest outbreak of hand; foot and mouth disease in Singapore in 2008: the role of enterovirus 71 and coxsackievirus A strains. Int J Infect Dis. 2010;14:e1076-81.
- Bernier V, Labrèze C, Bury F, Taïeb A. Nail matrix arrest in the course of hand, foot and mouth disease. Eur J Pediatr. 2001;160:649-51.
- Bracho MA, Gonzalez-Candelas F, Valero A, Cordoba J, Salazar A. Enterovirus co-infections and onychomadesis after hand, foot, and mouth disease, Spain, 2008. Emerg Infect Dis. 2011;17:2223-31.
- Redondo Granado MJ, Torres Hinojal MC, Izquierdo López B. Brote de onicomadesis posvirica en Valladolid. An Pediatr (Barc). 2009;71:436-9.
- Guimbao J, Rodrigo P, Alberto MJ, Omeñaca M. Onychomadesis outbreak linked to hand, foot, and mouth disease, Spain, July 2008. Euro Surveill. 2010;15: pii:19663.
- Kaminska K, Martinetti G, Lucchini R, Kaya G, Mainetti C. Coxsackievirus A6 and Hand, Foot and Mouth Disease: Three Case Reports of FamilialChild-to-Immunocompetent Adult Transmission and a Literature Review. Case Rep Dermatol. 2013;5:203-9.
- Haneke E. Onychomadesis and hand, foot and mouth disease, is there a connection? Euro Surveill. 2010;15:pii: 19664.
- Cabrerizo M, Tarragó D, Muñoz-Almagro C, Del Amo E, Domínguez-Gil M, Eiros JM, et al. Molecular epidemiology of enterovirus 71, coxsackievirus A16 and A6 associated with hand, foot and mouth disease in Spain. Clin Microbiol Infect. 2014;20:150-6.
- Bertolini M, Gilhar A, Paus R. Alopecia areata as a model for T cell-dependent autoimmune diseases. Exp Dermatol. 2012;21:477-9.
- Gregoriou S, Papafragkaki D, Kontochristopoulos G, Rallis E, Kalogeromitros D, Rigopoulos D. Cytokines and other mediators in alopecia areata. Mediators Inflamm. 2010:928030.
- Ito T. Recent Advances in the Pathogenesis of Autoimmune Hair Loss Disease Alopecia Areata. Clin Dev Immunol. 2013:348546.
- Pender MP. CD8+ T-Cell Deficiency, Epstein-Barr Virus Infection, Vitamin D Deficiency, and Steps to Autoimmunity: A Unifying Hypothesis. Autoimmune Dis. 2012:189096.
- Malavige GN, Ogg G. Pathogenesis of severe dengue infection. Ceylon Med J. 2012;57:97-100.
- Tracy S, Drescher KM, Chapman NM. Enteroviruses and type 1 diabetes. Diabetes Metab Res Rev. 2011;27:820-3.
- Sarmiento L, Cubas-Dueñas I, Cabrera-Rode E. Evidence of association between type 1 diabetes and exposure to enterovirus in Cuban children and adolescents. MEDICC Rev. 2013;15:29-32.
- Tosti A, Morelli R, Bardazzi F, Peluso AM. Prevalence of nail abnormalities in children with alopecia areata. Pediatr Dermatol. 1994;11:112-5.






