Vol. 12 - Num. 46
Originales
Valoración del estudio alérgico en niños con atopia
Josefina Caro Rebolloa, M.ª Isabel Moneo Hernándezb, MJ Cabañas Bravoc, AL Garín Morenod, Pilar Oliván Otale, M.ª Teresa Cenarro Guerrerof
aPediatra. CS Oliver. Servicio Aragonés de Salud. Zaragoza. España.
bPediatra. CS Torre Ramona. Zaragoza. España.
cPediatra. CS Delicias Sur. Servicio Aragonés de Salud. Zaragoza. España.
dPediatra. CS Fuentes Norte. Servicio Aragonés de Salud. Zaragoza. España.
ePediatra. CS Canal Imperial. Servicio Aragonés de Salud. Zaragoza. España.
fPediatra. CS Ruiseñores. Zaragoza. España.
Correspondencia: J Caro. Correo electrónico: jcaro@salud.aragon.es
Cómo citar este artículo: Caro Rebollo J, Moneo Hernández MI, Cabañas Bravo MJ, Garín Moreno AL, Oliván Otal P, Cenarro Guerrero MT. Valoración del estudio alérgico en niños con atopia. Rev Pediatr Aten Primaria. 2010;12:227-37.
Publicado en Internet: 30-06-2010 - Número de visitas: 22675
Resumen
Introducción: la atopia se define como la tendencia a producir anticuerpos IgE específicos frente a alérgenos y se expresa clínicamente como dermatitis-eccema, asma y rinoconjuntivitis. En los últimos años se ha documentado el aumento de la prevalencia de atopia en los países desarrollados. La detección de los alérgenos implicados es necesaria para unas medidas terapéuticas óptimas. El objetivo del estudio es describir el perfil de sensibilizaciones en los niños con atopia del municipio de Zaragoza.
Material y métodos: durante el verano de 2009 se revisaron las historias clínicas de los niños de 0-14 años, de las consultas de 6 pediatras de Atención Primaria. Se obtuvo una muestra de 194 niños con clínica y estudio alérgico positivo en los últimos 5 años.
Resultados: distribución por sexo: 62,9% varones y 37,1% mujeres. Hallazgos clínicos: asma 78%, rinitis 68%, conjuntivitis 50% y dermatitis 29%; con frecuencia se asociaron diferentes diagnósticos. Los alérgenos positivos fueron: gramíneas 48%, hongos 35%, árboles 34%, animales 26%, alimentos 24%, ácaros 19% y malezas 18%.
Conclusiones: las causas más importantes de sensibilización en nuestro estudio son primero las gramíneas y luego la Alternaria; olivo, animales, ácaros y malezas les siguen por este orden. En nuestra zona geoclimática, si hay síntomas en invierno o al final del verano se debe estudiar el ciprés, plátano de sombra, Chenopodium y Salsola. La alta sensibilización a alimentos encontrada se corresponde con otros estudios. La identificación de las sensibilizaciones permite relacionarlas con la clínica, tomar las medidas terapéuticas oportunas y mejorar la calidad de vida de los niños.
Palabras clave
● Alternaria ● Asma ● Gramíneas ● Rinitis ● Salsola ● Sensibilización alérgicaNota:
Algunos datos de este estudio fueron presentados en forma de póster en la 5.ª Reunión Anual de la AEPap y 5.ª Reunión de la ArAPAP en Zaragoza los pasados 13 y 14 de noviembre de 2009.
Introducción
La atopia es definida por la Academia Europea de Alergia como la tendencia personal o familiar a producir anticuerpos IgE específicos en respuesta a dosis bajas de alérgenos, normalmente proteínas (sensibilización) y que clínicamente (alergia) se expresa como dermatitis-eccema, asma bronquial y rinoconjuntivitis1. El contacto con los alérgenos puede ser vía inhalatoria (neumoalérgenos) o digestiva (trofoalérgenos).
La secuencia cronológica, tanto de la clínica, que comienza con dermatitis y posteriormente rinoconjuntivitis y asma, como de las sensibilizaciones, primero a alimentos y después a neumoalérgenos, se denomina marcha atópica2. La presencia de sensibilización a alérgenos alimentarios en los primeros años de vida es un marcador de atopia y, aunque no llegue a dar síntomas, constituye un factor pronóstico para el desarrollo en un futuro de asma y de su persistencia.
En los últimos años se ha documentado el aumento de la prevalencia de atopia en los países desarrollados3,4. Las enfermedades atópicas afectan al 25-30% de la población pediátrica: dermatitis atópica: 15-20%, asma: 7-10% y la rinitis y conjuntivitis alérgica: 15-20%. El asma es la segunda enfermedad crónica infantil en los países desarrollados5 y dos tercios de los niños con asma tienen sensibilización alérgica6.
Para su buen manejo es necesario saber qué alérgenos están implicados y poder tomar medidas terapéuticas óptimas que incluyan: evitación, educación, farmacoterapia y desensibilización7.
En cada zona geoclimática se deben conocer los alérgenos más prevalentes. La Sociedad de Alergia e Inmunología Clínica (SEAIC) a través de su página web (www.pólenes.com) informa de las concentraciones de pólenes (medias diarias y totales anuales) por estaciones aerobiológicas.
El objetivo de nuestro trabajo es conocer el perfil de sensibilizaciones de los niños con atopia en el municipio de Zaragoza.
Revisamos los estudios alérgicos realizados, los alérgenos prevalentes en nuestra zona geoclimática y comparamos los resultados con otros trabajos.
Material y métodos
Tipo de estudio: estudio observacional retrospectivo descriptivo. Ámbito: consultas de 6 pediatras de 5 centros de salud de la ciudad de Zaragoza (España) dependientes del Gobierno de Aragón.
Los pacientes objeto del estudio son los niños de 0-14 años de esas consultas y que constituyen una población de 6.230 niños. En verano de 2009 se revisaron las historias clínicas con los diagnósticos de: asma, rinitis alérgica, conjuntivitis alérgica y dermatitis atópica. De este grupo se seleccionaron los que en los últimos 5 años tenían hecho estudio alérgico con resultado positivo; la muestra fue de 194 niños.
De cada niño identificado se recogieron los siguientes datos: centro de salud, fecha de nacimiento, sexo, clínica (asma, rinitis, conjuntivitis y dermatitis atópica), método de estudio alérgico (Phadiatop®, prick, UniCAP®), sensibilizaciones a ácaros, gramíneas, malezas (Artemisia, Parietaria, Chenopodium y Salsola), árboles (olivo, plátano de sombra y ciprés), hongos (Alternaria), animales (gato y perro) y alimentos (huevo, leche y frutos secos) y nivel de sensibilización (tabla 1).

La variable edad se clasificó en dos categorías, mayores y menores de 6 años.
El estudio alérgico se realizó por diferentes métodos: Phadiatop® al 39%, prick al 54% y determinación de IgE específica por el método UniCAP® al 52%, y a varios niños se les hizo más de un método. El Phadiatop® en nuestro laboratorio incluye: Dermatophagoides pteronyssinus, Lolium perenne, Artemisia, Olea, Alternaria, gato, perro, clara y yema de huevo, leche de vaca, trigo, cacahuete, soja y avellana. El prick se practicó en consultas de alergología sin especificar la rutina de neumoalérgenos incluidos, y no en todos los casos se incluyeron alimentos. La determinación de IgE específica con tecnología UniCAP® se utilizó para solicitar alérgenos no incluidos en el Phadiatop®, para valorar los prick positivos o directamente para los alérgenos seleccionados sin realizar Phadiatop® o prick.
Los alérgenos estudiados no fueron completos en todos los niños y en algunos pacientes se incluyeron otros alérgenos, según la historia alérgica personal.
No se recogió la nacionalidad, ni el lugar de realización del estudio alérgico, bien en consulta de Atención Primaria (AP), consulta hospitalaria y/o consulta privada. Todos los Phadiatop® se solicitaron desde las consultas de AP.
La información se registró en hoja Excel®. Se hizo un análisis descriptivo para cada una de las variables estudiadas mediante el cálculo de proporción y porcentajes.
Resultados
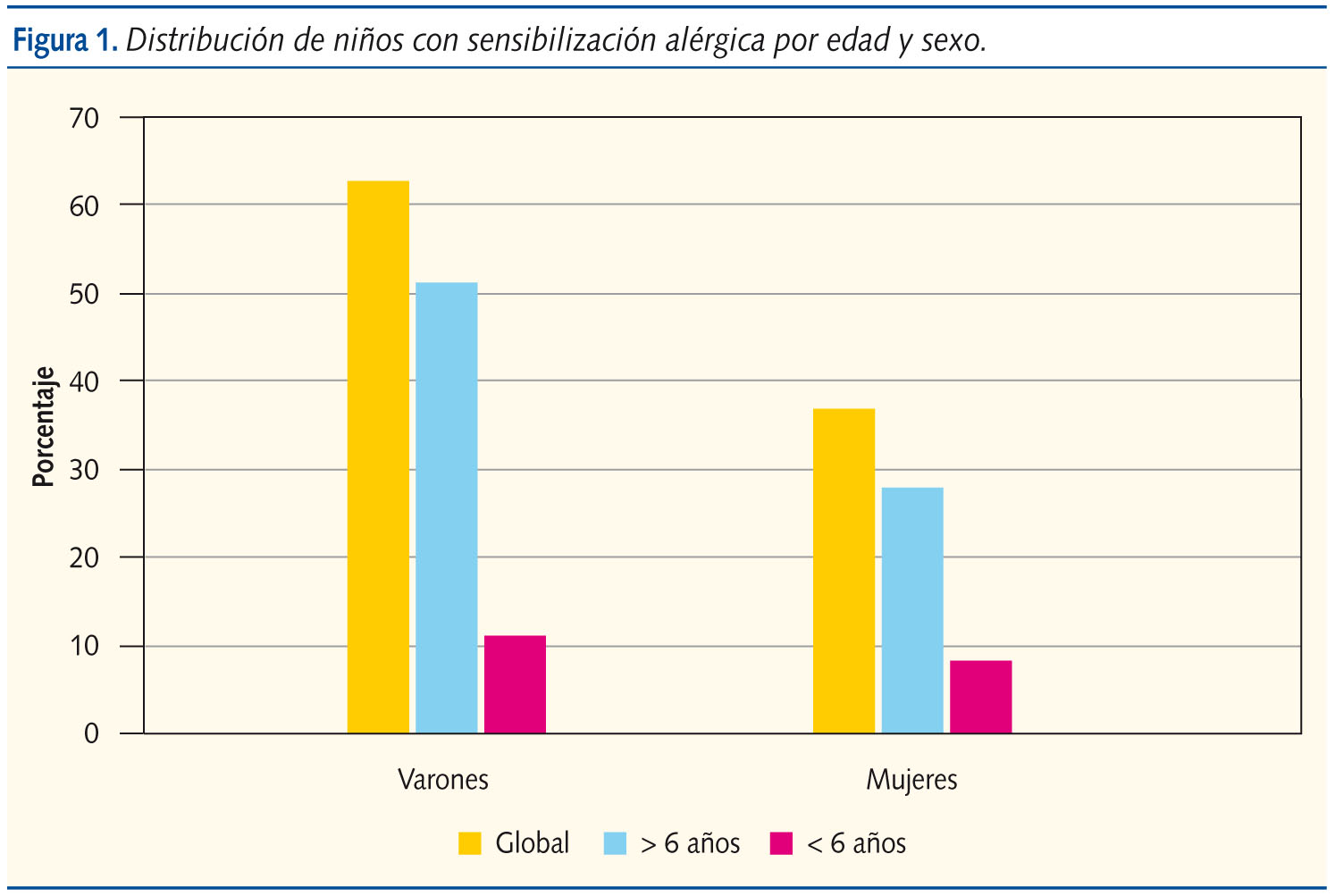
En la distribución por edad y sexo (figura 1) encontramos mayor afectación de varones, sobre todo mayores de 6 años, con una relación varón/mujer de 1,7/1. En total eran 122 varones (62,9%) y 72 mujeres (37,1%); y por edades, 100 varones (51,5%) y 55 mujeres (28,5%) mayores de 6 años y 22 varones (11,3%) y 17 mujeres (8,7%) menores de esta edad.
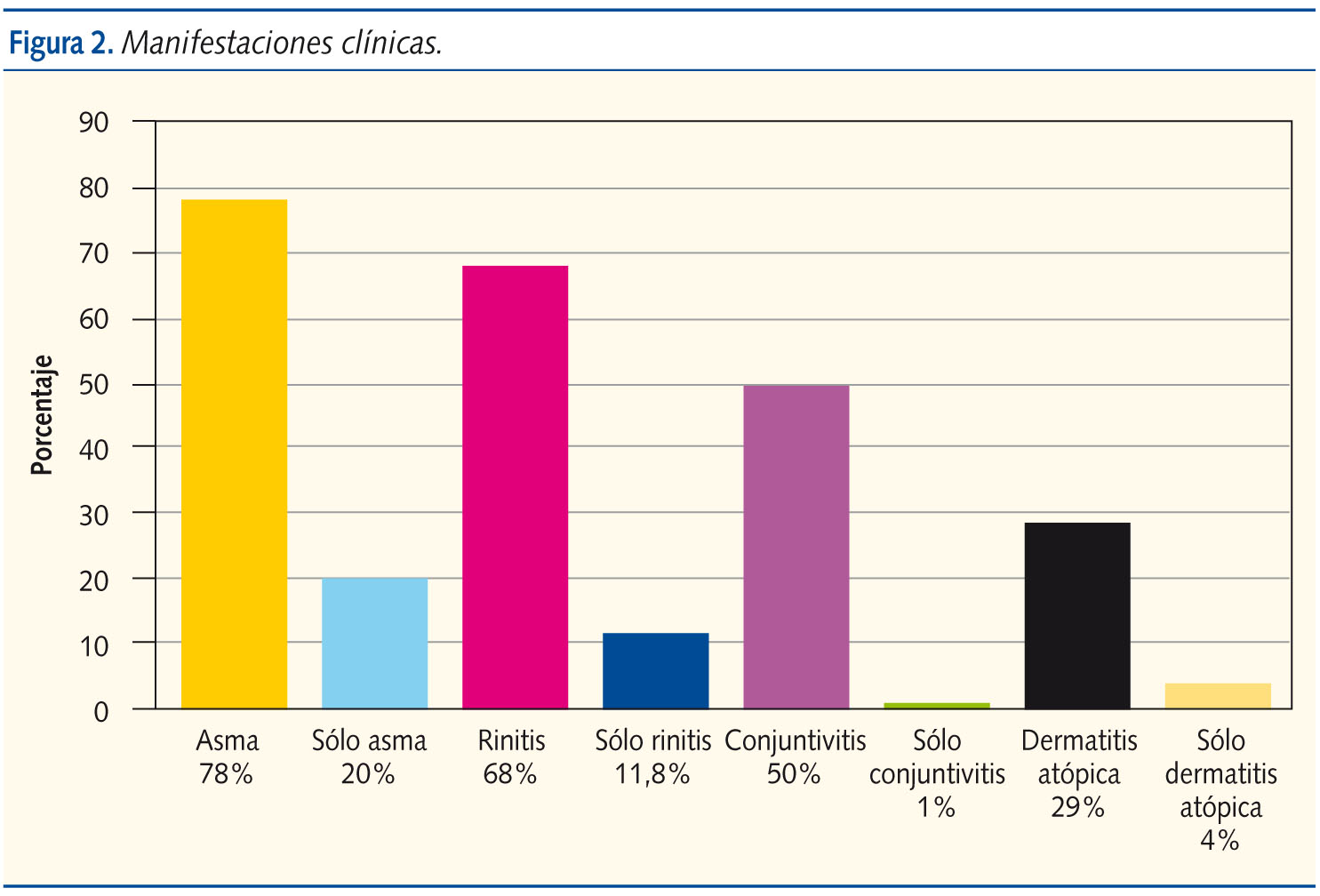
Las manifestaciones clínicas (figura 2) que presentaban fueron: asma, 153 (78%); rinitis, 132 (68%); conjuntivitis, 98 (50%); y dermatitis atópica, 57 (29%). Destaca la alta prevalencia de asma y rinitis; y lo habitual es que se asocien las diferentes manifestaciones clínicas y es poco frecuente presentarlas de forma exclusiva: sólo asma, 39 (20%); sólo rinitis, 23 (11,8%); sólo conjuntivitis, 3 (1%), y sólo dermatitis atópica, 9 (4%).
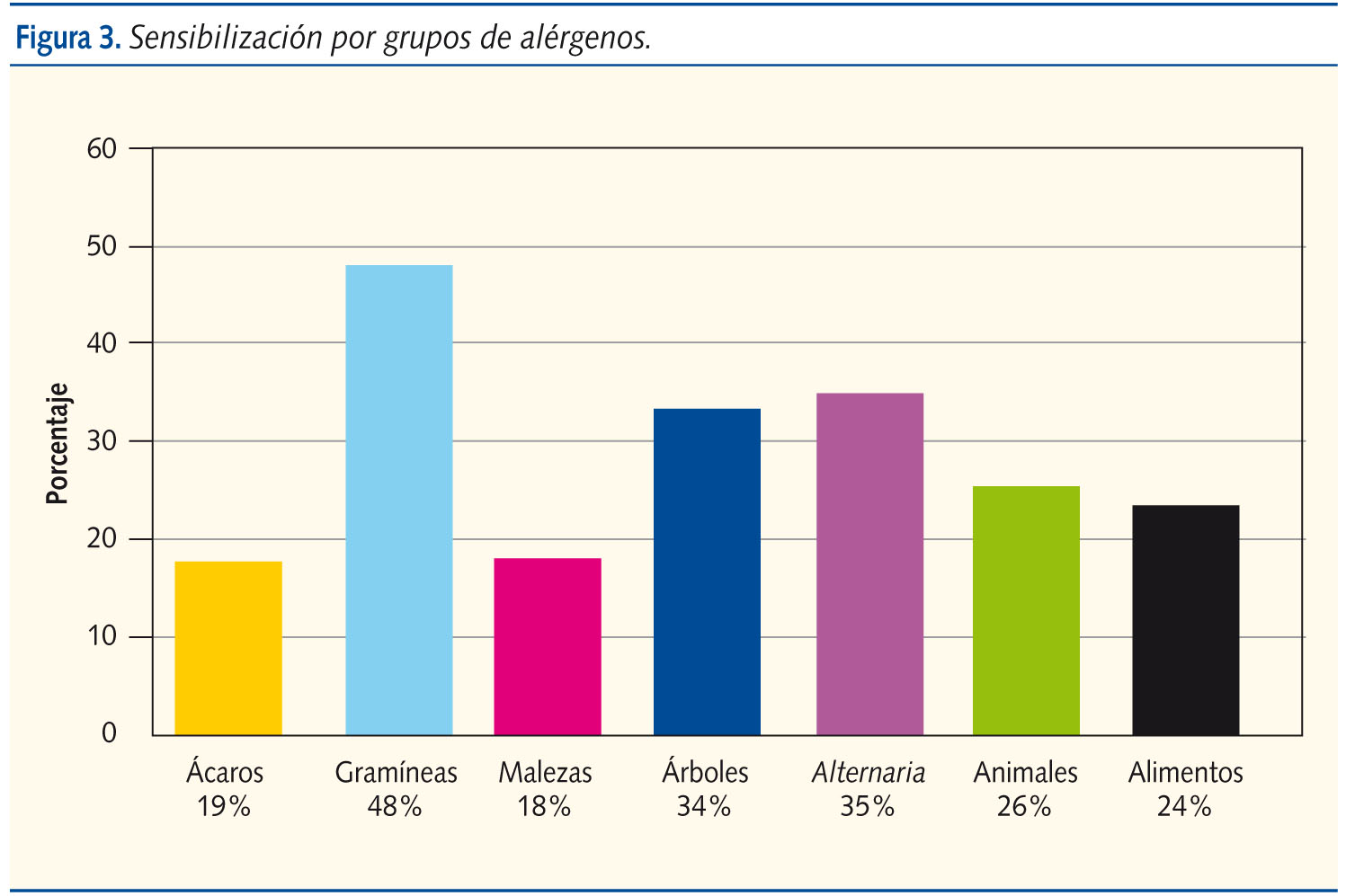
La figura 3 muestra las sensibilizaciones encontradas. La primera causa de sensibilización a neumoalérgenos son los pólenes (gramíneas, 48%; malezas, 18%; y árboles, 34%); la segunda la Alternaria (35%); la tercera los animales, (26%); y la cuarta los ácaros, (19%). Tienen sensibilización a alimentos el 24%.
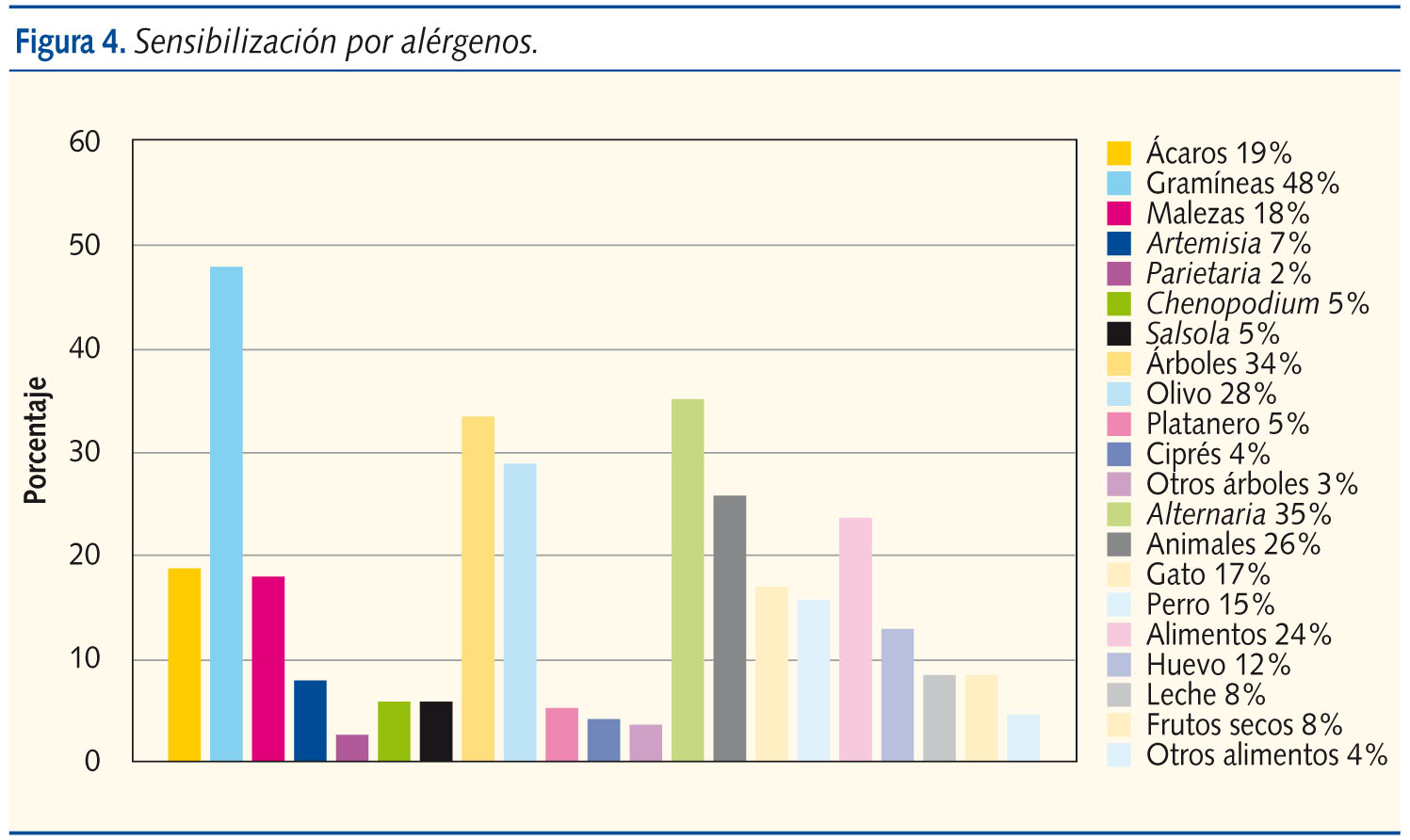
Si desglosamos los grupos de alérgenos (figura 4), dentro de los neumoalérgenos la primera causa son las gramíneas (48%), seguidas de Alternaria (35%), olivo (28%), gato (17%) y perro (15%). Los demás alérgenos están por debajo del 7%. Hay que recordar que no se estudiaron en todos los pacientes: Parietaria, Chenopodium y Salsola, de las malezas, y plátano y ciprés, de los árboles. En los trofoalérgenos se encontró sensibilización a huevo (12%), leche (8%), frutos secos (8%) y a otros alimentos (4%). No se estudió por sistema el pescado.
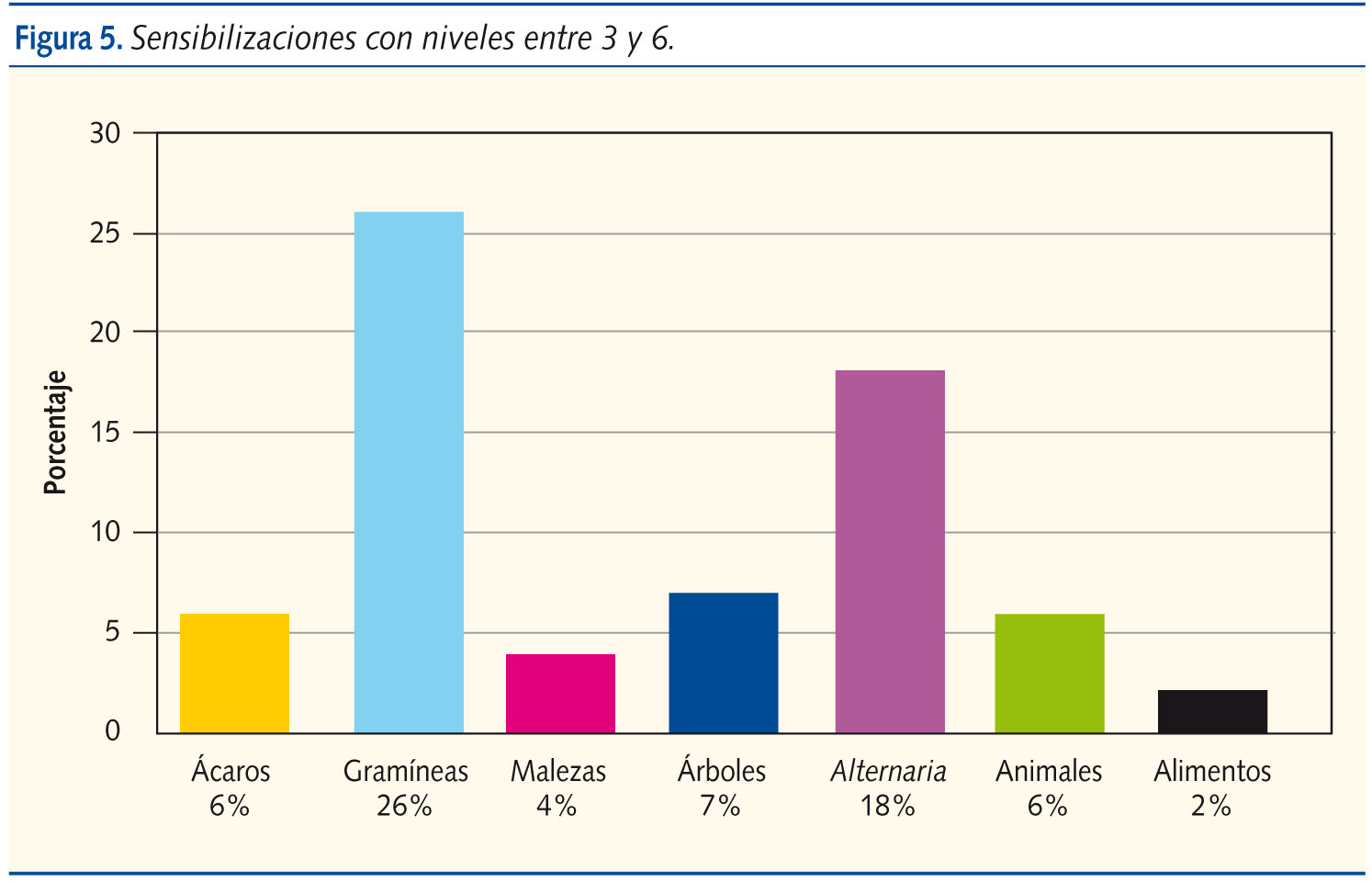
La figura 5 enseña los alérgenos que han producido alta sensibilización (niveles 3-6) y destacan: gramíneas (26%) y Alternaria (18%).
La tabla 2 enumera los casos con sensibilización a otros alérgenos menos frecuentes.

Discusión
La distribución por sexos (varón/mujer, 1,7/1) coincide con otros estudios nacionales e internacionales; casi 2 de cada 3 alérgicos en edad pediátrica son varones8-11.
La presentación clínica de asma en el 78% y rinitis en el 68%, también es equiparable a otros estudios en la alta frecuencia de asma y la relación entre prevalencia de asma y rinitis3,12,13.
La distribución de sensibilización a neumoalérgenos encontrada: 1.º pólenes, 2.º alternaria, 3.º animales y 4.º ácaros, y dentro de los pólenes: 1.º gramíneas, 2.º olivo y 3.º malezas, es típica de la España continental y confirma los datos de la SEAIC14,15. Las gramíneas suponen un 48% de sensibilizaciones. Dentro de los árboles encontramos alta sensibilización a olivo (28%, se estudia en todos los casos) y baja sensibilización a ciprés (4%) y plátano (5%). A pesar de que los recuentos polínicos en Zaragoza son medios para ciprés y altos para plátano, no se han estudiado sistemáticamente. Dentro de las malezas encontramos baja sensibilización a Chenopodium (5%) y Salsola (5%), e igualmente, aunque sus recuentos polínicos son medios en nuestra ciudad, no se han estudiado en todos los niños.
Coincidiendo con otros estudios, lo frecuente son las polisensibilizaciones a pólenes y, salvo para las gramíneas, son excepcionales las monosensibilizaciones. En nuestro estudio hay un niño monosensibilizado a Salsola, que no se hubiera detectado de no estudiar ese alérgeno. El ciprés poliniza en invierno y las chenopodiáceas al final del verano y su sensibilización explica los síntomas en estas épocas del año. La Alternaria (35%), es un alérgeno intra y extradomiciliario, supera la media de sensibilización en España que es del 20%, en nuestra ciudad es la segunda causa de sensibilización tras las gramíneas y se asocia a asma grave16. Los animales suponen un 26%, generalmente por la presencia de mascotas en viviendas urbanas y en nuestra ciudad casi exclusivamente gatos y perros. Los ácaros suponen un 19% y, a pesar de que es una prevalencia baja típica de zona continental, esperábamos encontrar menos, quizá porque hayamos detectado pacientes sensibilizados en otros hábitats.
Al comparar nuestros resultados con otros estudios: encontramos dos realizados en población adulta en nuestra ciudad por la SEAIC, en 199817,18 y en 200315, en los que el porcentaje de sensibilizaciones es superior a los encontrados en nuestro estudio. En el estudio de Asturias 200319 hecho en población pediátrica predominan los ácaros, típico de la zona atlántica, y en el estudio de Huesca 200120, zona similar a la nuestra, encuentran menos sensibilización a ácaros (10,65% frente a 19%) y a Alternaria (24,2% frente a 35%) y más a malezas (31,8% frente a 18%), diferencia que puede explicarse por incluir la investigación de Chenopodium y Salsola en todos los niños. En el estudio de tesis doctoral realizado en Zaragoza 200921, en niños de 10-12 años, las sensibilizaciones en los asmáticos son por este orden: gramíneas, 33,9%; Olea, 26,3%; Alternaria, 26,3%; Salsola, 16,1%; ciprés, 16,1%; ácaros, 16,1%; platanero, 11%; gato, 12,7%; parietaria, 9,3%; y perro, 7,6%, destacando la sensibilización más alta a ciprés, Salsola y platanero que en nuestro estudio.
Están sensibilizados a alimentos el 24%, a pesar de no haberlos estudiado en todos y tampoco incluir por sistema el pescado. Predominan: huevo (12%), leche (8%) y frutos secos (8%). No se valoró cuántos eran sintomáticos (síntomas cutáneos, respiratorios, gastrointestinales, síndrome de alergia oral y urticaria-angioedema-anafilaxia).
La SEAIC ha creado la Red “Vegetalia” para estudiar la alergia alimentaria, y en el informe de 200522 encuentra que el 30-40% de polínicos tienen pruebas cutáneas a alimentos positivas, sólo el 20% tiene síntomas al ingerir los alimentos y en los menores de 2 años predominan el huevo, leche y pescado y en adultos frutas, frutos secos, vegetales y leguminosas. Nuestros resultados son acordes con estos datos.
El estudio APIA22, que estudia sensibilizaciones en niños menores de 5 años con atopia, el 25% está sensibilizado a alimentos, porcentaje similar al nuestro.
El estudio IRENE23, en niños de 1-14 años con asma con Inmunocap Rapid®, que detecta solamente leche y huevo, encontró un 6,5% de sensibilizaciones, más baja que en nuestro estudio, quizá al no contemplar sensibilizaciones a otros alimentos.
Conclusiones
Somos conscientes de las limitaciones de este estudio retrospectivo y de que el método de detección y el perfil de alérgenos estudiados no han sido homogéneos. A pesar de ello, los resultados son comparables con otros estudios.
Las causas más importantes de sensibilización alérgica en nuestra población son primero gramíneas y segundo Alternaria, tanto por su prevalencia como por su intensidad, siguiendo por orden el olivo, animales, ácaros y malezas.
Al no estudiar por sistema ciprés, plátano de sombra, Chenopodium y Salsola, puede haber algún niño alérgico que no esté perfectamente diagnosticado. Como se ha reflejado en estudios anteriores20,21, estas sensibilizaciones no son anecdóticas y explicarían síntomas en invierno y al final del verano, y por tanto se deberían incluir en la rutina diagnóstica.
Queremos que este trabajo ayude a mejorar el diagnóstico alérgico de los niños y por tanto su manejo terapéutico.
Bibliografía
- European Academy of Allergy and Clinical Immunology. Position paper: a revised nomenclature for allergy. EAACI position statement. Allergy. 2001;56:813-24.
- Martínez F. Definition, risk factors and early natural history. Am J Resp Crit Care Med. 1995;151:s1-s244.
- The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. World-wide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. Lancet. 1998:351:1225-32.
- García-Marcos L, Blanco Quirós A, García Hernández G, Guillén-Grima F, Díaz CG, Ureña IC, et al. Stabilization of asthma prevalence among adolescents and increase among schoolchildren (ISAAC phases I and III) in Spain. Allergy. 2004:59:1301-7.
- Serra-Majem LI, Ribas L, Arancena J, Pérez-Rodrigo Saavedra P, Peña L. Obesidad infantil y juvenil en España. Resultados del Estudio enKid (1998-2000). Med Clin (Barc). 2003;121:725-32.
- Illi S, Von Mutius E, Lau S, Nickel R, Nigaemann B, Sommerfeld C, et al. The pattern of atopic sensitization is associated with the development of asthma in childhood. J Allergy Clin Inmunol. 2001;108:709-14.
- Host A, Andrae S, Charkin S, Díaz-Vázquez C, Dreborg S, Eigenmann P, et al. Allergy testing in children: why, who, when and how? Allergy. 2003;58:559-69.
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. NHLBI/WHO Workshop Report. National Heart, Lung and Blood Institute. Bethesda: National Institutes of Health; 2002. [Consultado el 07/03/ 2010]. Disponible en www.ginasthma.com.
- Grupo Regional de Trabajo sobre el Asma Infantil en Atención Primaria de Asturias. Prevalencia de asma diagnosticado en la población infantil en Asturias. An Esp Pediatr. 1999;51:479-84.
- Cortés X, Soriano JB, Sánchez-Ramos JL, Azofra J, Almar E, Ramos J. Estudio Europeo del Asma. Prevalencia de atopia en adultos jóvenes de 5 áreas españolas. Med Clin (Barc). 1998;111:573-7.
- Fernández García JR, Pavón Lebrero R, Ruiz Jiménez MA, Martínez Nieto JM. Estudio USFAM: Prevalencia de las enfermedades alérgicas en la población escolar de la provincia de Cádiz. Parte I. An Esp Pediatr. 1996;44:445-7.
- Sly M MD. Changing prevalence of allergic rhinitis and asthma. Ann Allergy Asthma Immunol. 1999;82:233-52.
- Bousquet J, van Cauwenberge P, Khaltaev N, in collaboration with the World Health Organization. Allergic Rhinitis and Its Impact on Asthma. J Allergy Clin Immunol. 2001;108 (part 2):147-334.
- Alergológica. Factores epidemiológicos clínicos y socioeconómicos de las enfermedades alérgicas en España. Madrid: Sociedad Española de Alergología e Inmunología Clínica y Alergia e Inmunología Abelló, S.A.; 1995.p.55-114.
- Subiza Garrido-Lestache FJ, Pola Pola J, Feo Brito F, Moral de Gregorio AJ. Pólenes de interés en alergología en nuestro medio. En: SEIAC. Estudio multicéntrico 2003. [Consultado el 08/03/2010]. Disponible en www.polenes.com/Estmulticen2003.pdf.
- Zureik M, Neukirch C, Leynaert B, Liard R, Bousquet J, Neukirch F. Sensibilitation to airborne moulds and severity of asthma: cross sectional study from European Community respiratory health survey. BMJ. 2002;325:411-4.
- Pola Pola J, Zapata Jiménez C, Sanz Turón E. Polinosis en el área de Zaragoza. Rev Esp Alergol Inmunol Clin. 1998;13:135-9.
- Subiza J, Feo Brito F, Pola J, Moral A, Fernández J, Jerez M, y cols. Pólenes alergénicos y polinosis en 12 ciudades españolas. Rev Esp Alergol Inmunol Clín. 1998;13:45-58.
- Díaz Vázquez CA, Rodríguez García J, Sánchez Iglesias G. Perfil de sensibilización a neumoalérgenos en niños con asma y rinoconjuntivitis en una zona de salud de Asturias. Bol Pediatr. 2003;43:3-12.
- Fuertes Fernández-Espinar J, Meriz Rubio J, Pardos Martínez C, López Cortés V, Ricarte Díez J, González Pérez-Yarza E. Prevalencia actual de asma, alergia e hiperrespuesta bronquial en niños de 6 a 8 años. An Esp Pediatr. 2001;54:18-26.
- Segura Arauzi N. Epidemiología y estudio del asma y la atopia infantil en la ciudad de Zaragoza. Tesis doctoral. Zaragoza: Universidad de Zaragoza; 2009. [Consultado el 08/03/2010]. Disponible en www.unizar.es.
- Alergológica. Factores epidemiológicos clínicos y socioeconómicos de las enfermedades alérgicas en España. Madrid: Sociedad Española de Alergología e Inmunología Clínica y Alergia e Inmunología Abelló, S.A.; 2005.p.372-7.
- Carvajal Urueña I, Díaz Vázquez C, Cano Garcinuño A, García Merino A, Morell Bernabé JJ, Pascual Pérez JM, y cols. Perfil de sensibilización alérgica en niños de 0 a 5 años con sibilancias o dermatitis atópica. An Pediatr (Barc). 2010;72:30-41.
- Díaz-Vázquez C, Torregrosa-Bertet MJ, Carvajal-Urueña I, Cano-Garcinuño A, Fos-Escrivá E, García-Gallego A, et al. Accuracy of ImmunoCAP® Rapid in the diagnosis of allergic sensibilitation in children between 1 and 14 years with recurrent wheezing: The IReNE study. Pediatr Allergy Immunol. 2009;20:601-9.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflicto de intereses en relación con la preparación y publicación de este artículo.





