Vol. 23 - Num. 30
Seminarios
Fiebre sin foco
Josefa Ares Álvareza, Beatriz Morillo Gutiérrezb
aPediatra. CS Virxen Peregrina. Pontevedra. España .
bPediatra. CS Aracena. Huelva. España.
Cómo citar este artículo: Ares Álvarez J, Morillo Gutiérrez B. Fiebre sin foco. Rev Pediatr Aten Primaria. Supl. 2021(30):19-28.
Publicado en Internet: 30-11--0001 - Número de visitas: 739228
Resumen
La fiebre sin foco (FSF) es uno de los motivos de consulta más frecuentes en Pediatría, y generalmente se debe a procesos infecciosos banales que no van a requerir realización de pruebas complementarias ni tratamiento antibiótico. Es por ello que conocer la etiología, diferente según la edad del paciente y el estado de inmunización y medio donde nos encontremos, así como realizar una correcta anamnesis y exploración física, con apoyo de los algoritmos disponibles, es imperativo para identificar aquellos pacientes que estén en riesgo de padecer una infección bacteriana grave (IBG). En ellos, habrá que hacer una petición justificada de pruebas complementarias y tratar de acuerdo con la etiología más frecuente. En los pacientes con bajo riesgo de IBG, que serán la mayoría, es preciso tranquilizar a los cuidadores, explicando los signos y síntomas de alerta de progresión o gravedad, combatir la fiebrefobia, prescribiendo antitérmicos para tratar el malestar asociado, y reevaluar cuando sea preciso.
FIEBRE Y CONCEPTOS RELACIONADOS
La fiebre es uno de los motivos de consulta más frecuente en Pediatría, especialmente entre los 3-36 meses de vida, y hasta un 65% de los menores de dos años consultarán por este motivo. Supone entre un 10-20% de los procesos agudos en Atención Primaria y hasta un 30% en Urgencias Hospitalarias, en especial en invierno1, coincidiendo con las epidemias de virus respiratorios y gastrointestinales. Cada niño presenta entre cuatro y seis episodios de fiebre al año y en la mayoría son procesos virales benignos y autolimitados. Sin embargo, alrededor de un 7-11%2 presentarán una infección bacteriana grave (IBG), que puede complicarse e incluso producir la muerte. Aproximadamente en el 20% no se encontrará un foco después de la anamnesis y exploración física minuciosa.
Aunque las enfermedades infecciosas son la causa más frecuente de fiebre, otros procesos no infecciosos también pueden presentarla, incluso como primer y único síntoma al comienzo del cuadro: enfermedades autoinflamatorias –incluyendo enfermedad de Kawasaki–, autoinmunes, metabólicas, neoplasias. Generalmente las características de la fiebre, su duración, periodicidad, y la aparición de otros síntomas permitirán diferenciar estos cuadros.
Control de la temperatura corporal y fiebre
Los humanos somos homeotermos; esto es, dentro del rango térmico que podemos soportar, mantenemos una temperatura corporal constante e independiente de la ambiental, que contribuye al trabajo óptimo de nuestros sistemas enzimáticos3. El centro regulador de esta homeotermia es el hipotálamo, que produce oscilaciones en la temperatura central entre los 36,5-37,5 °C a lo largo del día, según los ritmos circadianos y diferentes factores fisiológicos (ejercicio, menstruación). Los niños presentan cierta inmadurez en estos ritmos, que no se estabilizan hasta el final de la adolescencia.
La entrada de microorganismos, la generación de complejos inmunitarios y otras causas, como insultos físicos, desencadenan la liberación de sustancias inflamatorias, como citoquinas, por parte de neutrófilos y macrófagos. Estas actúan como pirógenos endógenos y desencadenan mecanismos que conllevan una elevación del punto de ajuste (set point) del termostato hipotalámico. A su vez, esto pone en marcha una serie de procesos, cuyo objetivo será el aumento de la temperatura corporal (temblor involuntario, contracciones musculares –escalofríos–, aumento del metabolismo celular y vasoconstricción). La medición de este aumento de calor corporal es la fiebre. Posteriormente, se desarrollarán mecanismos contrarreguladores para favorecer la pérdida del calor y volver a la homeotermia, como vasodilatación y sudoración4.
A lo largo de la historia de la medicina se ha visto a la fiebre como síntoma y a la vez como enfermedad, como algo maligno o mortal o como una respuesta beneficiosa. Actualmente, pese a ser tan frecuente, es una causa de máxima preocupación para los padres. La fiebre es percibida por las familias como un problema en sí misma, que debe ser eliminado, visión promulgada en ocasiones por los profesionales sanitarios. De ahí el acuñamiento del vocablo “fiebrefobia” para describir este posicionamiento.
La fiebre per se es autolimitada. El ajuste hipotalámico evita superar los 42 °C, temperatura por debajo de la cual no se perjudican las funciones metabólicas del organismo. Por el contrario, se han evidenciado múltiples beneficios de la fiebre, entre ellos, favorecer el correcto desarrollo de algunas funciones inmunológicas y limitar el crecimiento de algunas bacterias5. La morbilidad y mortalidad asociadas a la fiebre se deben, sin duda, a la enfermedad subyacente5.
¿Qué temperatura consideramos fiebre?
La temperatura rectal se considera el estándar oro para la medición de la temperatura porque se aproxima a la temperatura corporal central. Por este método, se considera fiebre a la temperatura mayor de 38 °C. Por practicidad, las medidas usadas más comúnmente son la axilar y oral6, donde la temperatura suele ser algo menor aunque no existe una regla de conversión estandarizada entre estas y la temperatura rectal. La vía timpánica, aunque usada en investigación con resultados prometedores, no se recomienda en el ámbito domiciliario por la escasa fiabilidad de los dispositivos utilizados. Hoy en día, creemos que no faltamos a la verdad si decimos que no existe una uniformidad ni en la recomendación en cuanto a dispositivos, ni en grado de temperatura con estos, a nivel práctico, fuera de la vía rectal.
Tipos de fiebre
El objeto de este tema es la fiebre sin foco (FSF), que se define como aquella fiebre que dura menos de cinco días –aunque hay autores que amplían a menos de diez días esta definición– y cuya etiología no aparece tras una adecuada historia clínica y una exhaustiva y minuciosa exploración física. En no pocas ocasiones será de reciente aparición, menor de 6-12 horas.
Otros tipos de fiebre que deberemos distinguir son:
- Fiebre prolongada o continua: aquella que aparece todos los días, sin que haya periodos de temperatura normal, y que dura más de cinco días.
- Fiebre recurrente o cíclica: alternancia de episodios de fiebre con temperatura normal.
- Fiebre de origen desconocido (FOD): proceso febril que cumpla:
- Temperatura ≥38 °C, objetivada (comprobada por personal sanitario).
- Más de 2-3 semanas de duración.
- Ausencia de diagnóstico tras una semana de estudio (ambulatorio u hospitalario).
- Hipertermia fisiológica (especialmente en lactantes): producida por exceso de abrigo, ambiente térmico elevado, escaso aporte de líquidos, alimentación hiperconcentrada.
Conceptos importantes en relación con la fiebre sin foco
Se resumen en la Fig. 1:
| Figura 1. Definiciones de procesos que pueden debutar como fiebre sin foco |
|---|
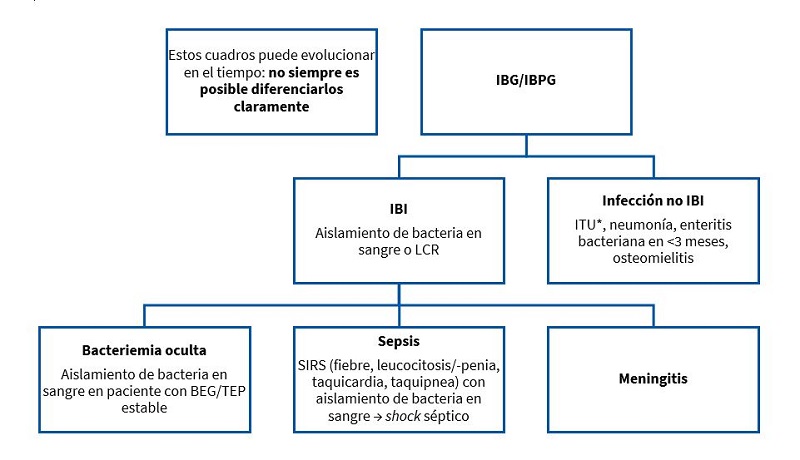 |

- Infección bacteriana invasiva (IBI): aislamiento de una bacteria patógena en un líquido estéril (sangre, líquido cefalorraquídeo [LCR], pleura, líquido articular).
- Infecciones bacterianas graves: infecciones bacterianas potencialmente graves que son, además de las IBI, la infección del tracto urinario (ITU), que es la más frecuente, y la gastroenteritis aguda bacteriana en menores de tres meses.
- Bacteriemia oculta (BO): aislamiento de una bacteria patógena en sangre con buen estado general y sin ningún otro síntoma: FSF con un triángulo de evaluación pediátrica (TEP) normal.
Es importante destacar que, en un niño con FSF, la magnitud de la fiebre no se correlaciona adecuadamente con el riesgo de presentar una IBG. Con una temperatura corporal >40°, la probabilidad posprueba aumenta hasta el 17%, pero con una sensibilidad muy baja para diagnosticar una IBG (8%)7. Sin embargo, el grado de temperatura ayuda a estratificar a los pacientes con fiebre y determina, como veremos más adelante, a quién y qué pruebas haremos en nuestro medio y según determinados escenarios clínicos.
El abordaje diagnóstico de un niño con FSF va a depender, en primer lugar, de la edad. En general es suficiente una buena anamnesis y una exploración física detalladas, pero, en ciertos grupos de pacientes, es aconsejable realizar diferentes pruebas complementarias y una observación continuada, ya sea en el hospital o en su propio domicilio. Los menores de 36 meses son los que representan el mayor reto diagnóstico, siendo los menores de tres meses los de mayor riesgo de IBG. Esto justifica hacer una valoración estratificada por edad. La aproximación diagnóstica será más cauta y más intervencionista en el lactante pequeño que en el niño mayor. Otros factores que hay que tener en cuenta para el abordaje son:
- Expresividad clínica, menor sobre todo en procesos poco evolucionados o en neonatos y lactantes pequeños.
- Alteración del sistema inmune: mayor inmadurez en neonatos y en aquellos con inmunodeficiencias primarias o secundarias.
- Vacunación ausente o incompleta.
Se abordarán por separado los cuatro grupos siguientes: neonatos menores de 21 días, (aunque algunos autores siguen considerando para el manejo de FSF a todos los neonatos menores de 28 días), lactantes entre 1-3 meses, lactantes y niños entre 3-36 meses y, finalmente, niños mayores de 36 meses.
FIEBRE SIN FOCO
Epidemiología: gérmenes y factores de riesgo
Los agentes etiológicos aislados en pacientes con FSF varían según la edad del paciente (Tabla 1).
| Tabla 1. Agentes etiológicos más frecuentemente aislados en pacientes con fiebre sin foco, por grupos de edad | |||
|---|---|---|---|
| <28 días | 1-3 meses | > 3 meses | |
| Etiología más frecuente | Enterovirus | Parechovirus (serotipo 3) |
Enterovirus Adenovirus HHV-6 |
| Probabilidad BO | 20-28% | 9-14% | <0,5% |
| Bacterias |
SGB E. coli Enterococcus spp. L. monocytogenes |
E. coli |
S. pneumoniae (79,1%) S. aureus (7,5%) N. meningitidis B (4,5%) K. kingae y M. catarrhalis (1,5%) Otros: E. coli, S. pyogenes, Salmonella spp. |

Hay varios factores que van a determinar las diferencias en los gérmenes responsables según el grupo de edad. Los virus son los agentes más frecuentes: en los menores de 3 meses, el parechovirus y especialmente el serotipo 3; y en niños mayores de 3 meses, enterovirus, adenovirus y herpesvirus humano 6 (HHV-6)8. Es rara la coexistencia de viremia y bacteriemia en un mismo paciente, pudiéndose asumir que aquellos pacientes con viremia tienen un menor riesgo de IBG concurrente9,10; sin embargo, esto no es asumible en detecciones virales locales (respiratorias, fecales). Por ejemplo, en lactantes con ITU, la detección local de rinovirus o coronavirus no disminuye el riesgo de ITU concomitante a cualquier edad ni el riesgo de IBI en los menores de 28 días, debido a sus periodos largos de excreción en secreciones respiratorias11.
En cuanto a entidades clínicas, las que pueden cursar como FSF son, por orden de frecuencia: la ITU, generalmente causada por Escherichia coli, con o sin bacteriemia, la BO, en la cual nos centraremos, y la neumonía oculta.
Neonatos. Son los de mayor riesgo de IBG, que se desarrolla en el 20-28% de los bebés menores de 28 días con FSF, favorecida por la mayor inmadurez de su sistema inmune12, y, en especial, en los menores de 21 días. Sin embargo, también las infecciones víricas pueden ser graves, con secuelas importantes como la meningoencefalitis por virus del herpes simple (VHS), o cuadros similares a sepsis por enterovirus.
Entre las bacterias, encontraremos en general las procedentes del canal del parto por transmisión vertical, como estreptococo del grupo B (SGB) o Streptococcus agalactiae, E. coli, enterococos y Listeria monocytogenes. Con el abordaje actual de la colonización por SGB, han disminuido las infecciones causadas por esta bacteria y, secundariamente, por Listeria, que casi ha desaparecido como causa de sepsis por transmisión vertical, y que a veces está asociada a brotes alimentarios con afectación materna. Actualmente, E. coli es la bacteria más frecuentemente aislada en sangre (60%) y orina (87%), con tasas de resistencia a la penicilina crecientes en relación con el uso y duración de la antibioterapia materna. El SGB se mantiene como el más frecuentemente aislado en el LCR, causando los cuadros más graves, como meningitis (39%), focos no meníngeos de infección (10%) y sepsis precoz (7%)11. Enterococos y neumococo son causas muy raras, pero graves; una neumonía neumocócica a esta edad presenta una tasa de mortalidad del 14%2.
Lactantes 1-3 meses. La prevalencia de IBG es del 9-14%. E. coli es la bacteria aislada con más frecuencia, en descenso el SGB y muy rara la Listeria. La ITU es la IBG más frecuente (75-84%), producida principalmente por E. coli, seguida de la BO (6-13%), producida por E. coli (42%), SGB (23%) y neumococo (6%). Respecto a los virus, cabe mencionar que la ITU se ha asociado de forma concurrente y significativa en bebés con bronquiolitis. Sin embargo, los estudios publicados más recientes no apoyan firmemente esta idea13,14. Por lo tanto, la realización de uroanálisis y urocultivo en un niño pequeño, febril con bronquiolitis, debe individualizarse según las circunstancias y clínica del paciente.
Lactantes-niños 3-36 meses. La introducción de las vacunas, como la conjugada frente a Haemophilus influenzae b (Hib) de manera sistemática en España en 1997 y, posteriormente, las vacunas antineumocócicas conjugadas (VNC) 7, 10 y 13 valentes, han modificado el panorama actual15,16: la bacteriemia por Hib ha desaparecido virtualmente en vacunados12. En cuanto al neumococo, aunque sigue siendo el más aislado en bacteriemias, el número relativo y absoluto de episodios causados por él ha disminuido considerablemente. Se considera inmunización correcta cuando se han recibido al menos dos dosis de VNC y de Hib. Aunque los no vacunados puedan beneficiarse del efecto rebaño, siguen teniendo un riesgo mayor de bacteriemia y, por tanto, el manejo tiende a diferenciarse según el estado de vacunación. En cuanto al meningococo, este presenta una tendencia decreciente como responsable de BO y, secundariamente, sepsis y meningitis meningócocicas, alcanzando actualmente el mínimo histórico en décadas, debido en parte a las vacunas antimeningocócicas –C y B–, pero también a otros factores dependientes del germen12.
Teniendo en cuenta estas consideraciones la BO ha llegado a disminuir su incidencia hasta menos del 1%, e incluso menos del 0,5% de las FSF17, siendo las bacterias más frecuentemente aisladas en un estudio reciente español16: neumococo (79,1%), Staphylococcus aureus (7,5%), meningococo B (4,5%), Kingella kingae y Moraxella catharralis (1,5%). Otros gérmenes aislados en estudios internacionales son: E. coli, Streptococcus pyogenes y Salmonella spp.
Niños mayores de 36 meses. A partir de los 3 años decae el riesgo de asociación de FSF con IBG, ya que la mayoría cursarán con síntomas de focalidad: neumonías, meningitis, infecciones osteoarticulares, ITU.
Clínica
Fiebre. Es cualquier elevación de la temperatura corporal ≥38 °C. Tradicionalmente se consideraba la fiebre ≥39,5 °C de mayor riesgo de IBG, por su relación con el germen más frecuente en mayores de 3 meses, el neumococo18. Sin embargo, esta relación no es tan constante con otras bacterias, pudiendo presentarse bacteriemias por E. coli, meningococo o Salmonella con picos febriles de menor magnitud y, por el contrario, podemos encontrar infecciones víricas con fiebre de alto grado. La duración no guarda relación con el riesgo de BO. Sin embargo, con una duración de FSF mayor de cinco días debe considerarse la enfermedad de Kawasaki y realizar las pruebas complementarias adecuadas.
Estado general. No hay ningún síntoma o signo acompañante de la FSF que por sí mismo permita descartar o confirmar una IBG y, mucho menos, apuntar hacia el agente causal. Los enterovirus, por ejemplo, pueden presentarse como cuadros sépticos clásicamente bacterianos. Además, la expresividad clínica de la FSF es muy variable según la edad. Así, en los menores de tres meses, y sobre todo en neonatos, es escasa. Pueden presentar síntomas inespecíficos como letargia, rechazo de alimentación, vómitos, llanto inconsolable o irritabilidad, etc.19.
Se debe realizar una anamnesis completa sobre exposición a contactos enfermos en el hogar o la guardería, enfermedades previas, inmunización y uso reciente de antibióticos. Se debe obtener una historia prenatal, perinatal y neonatal, sobre todo en los más pequeños. Hay que preguntar específicamente y buscar aquellos síntomas o signos de focalidad que hayan podido pasar desapercibidos a los padres: otalgia –o irritabilidad en el lactante pequeño–, tiraje o tos, o falta de movilidad de un miembro en caso de infecciones osteoarticulares, que nos orienten a una causa específica que pueda ser tratada. La exploración física completa ayudará a confirmar o descartar la presencia de foco.
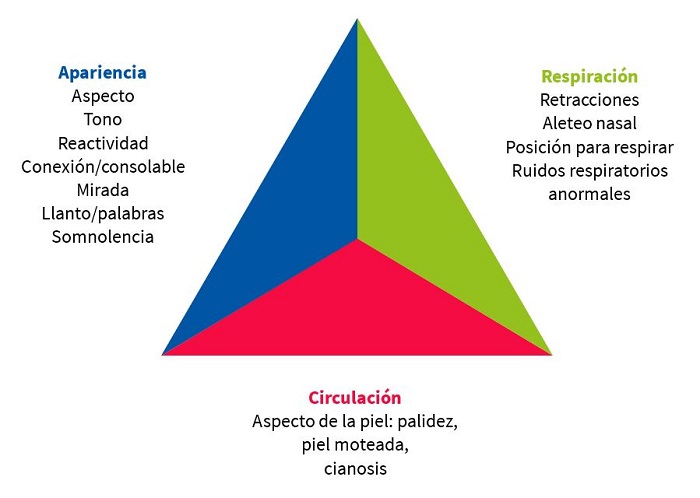
Hay que familiarizarse con el triángulo de evaluación pediátrica (TEP) (Fig. 2), que valora la apariencia general, el nivel de actividad, el color, tono, actitud, estado de alerta. La irritabilidad, el llanto inconsolable, la mala perfusión, el tono deficiente, la disminución de la actividad o el letargo pueden ser signos de una infección grave.
Igualmente hay que tomar constantes, oximetría de pulso, frecuencia cardiaca (FC), respiratoria (FR) y presión arterial (PA) (Tabla 2). Una FC de más de 160 latidos por minuto en los lactantes y una FR de más de 60 respiraciones por minuto se asocian con un mayor riesgo de mortalidad, y a menudo señalan el desarrollo de sepsis20.
| Tabla 2. Constantes por edad | |||
|---|---|---|---|
| FC | FR | TAS | |
| Recién nacido-3 meses | 100-160 | 30-60 | >60 |
| 3 meses-2 años | 90-150 | 24-40 | >70 |
| Preescolar | 80-140 | 22-34 | >75 |
| Escolar | 70-120 | 18-30 | >80 |
| Adolescente | 60-100 | 12-16 | >90 |

El paciente con mal estado general o aspecto tóxico, con signos de meningococemia, como un exantema petequial, debe ser enviado urgentemente a un centro hospitalario, con inicio de antibioterapia sin demora, con medidas y pruebas que no son el objeto de este documento.
Es el paciente con buen o incluso “aceptable” estado general el que plantea el reto, con síntomas inespecíficos acompañantes –vómitos, coriza leve, cierto malestar general– mínimos o ausentes.
Pruebas complementarias
Las pruebas que pueden resultar de utilidad en determinados pacientes son:
- Tira reactiva de orina y urocultivo por técnica estéril. Es la prueba inicial en la mayoría de las guías y algoritmos, para descartar ITU como causa bacteriana más frecuente de FSF, y que tiene mayor disponibilidad y facilidad para realizarse. Generalmente se recomienda: en niñas menores de 2 años y niños menores de1 año, con fiebre ≥39 °C, en aquellos con uropatías o nefropatías previas o en caso de FSF de duración mayor de 48 horas, aunque el pico febril sea menor de 39 °C17,21.
- Hemograma. No está recomendado generalmente de inicio, salvo en menores de 3 meses, en niños vacunados con afectación moderada-grave del estado general, en los que tienen fiebre ≥40,5 °C, en no vacunados o inmunocomprometidos. Una leucocitosis ≥15 000/mm3 con neutrofilia ≥10 000/mm3 orienta hacia una infección neumocócica. En BO por meningococo o Salmonella, un número elevado de pacientes pueden presentar valores en rango normal o mínimamente elevado21.
- Reactantes de fase aguda. Los marcadores más utilizados en la actualidad son la proteína C reactiva (PCR) y la procalcitonina (PCT). La sensibilidad de la PCT es ligeramente superior a la PCR a la hora de predecir IBG y sobre todo IBI22, pero, sobre todo, es útil porque se eleva más rápidamente. Ambas tienen más especificidad que la leucocitosis en el caso de estar elevadas para detectar IBG. Sin embargo, carecen de suficiente sensibilidad por sí mismas o incluso de manera combinada para descartar una IBG en el caso de presentar niveles por debajo del punto de corte, por lo que es necesario poner el valor en el contexto clínico del paciente22.
- Hemocultivo. Debido al descenso de la incidencia de BO, presentan un bajo rendimiento, si se realizan de rutina, y deben restringirse a menores de tres meses, por mayor riesgo de IBI a esa edad, cuando se sospeche una BO o antes de iniciar tratamiento antibiótico empírico. El tiempo de crecimiento impide tomar decisiones rápidas.
- Otras pruebas microbiológicas. La reacción en cadena de la polimerasa de neumococo y meningococo o enterovirus en sangre permiten obtener resultados rápidos23. En muestras no invasivas (respiratorias, heces), el test de influenza o virus respiratorio sincitial (VRS), especialmente en temporada epidémica, aunque no permiten descartar una IBI, pueden evitar otras pruebas más invasivas en niños de bajo y moderado riesgo. Dadas las circunstancias actuales, en 2020 se recomienda, igualmente, en niños con FSF la realización de pruebas rápidas de infección activa del SARS-CoV-2, aunque esta determinación viene dada por la importancia del control de la pandemia, y un resultado positivo ni descarta una IBI ni debe limitar el estudio de FSF en aquellos niños que presenten datos de alarma o riesgo24.
- Radiografía de tórax. Está recomendada en sospechas de neumonía oculta, con fiebre de >39-40 °C (dependiendo del autor) y leucocitosis ≥20 000/mm3, que generalmente están ocasionadas por neumococo21.
- Punción lumbar. Está desterrada prácticamente de la batería de pruebas rutinarias, salvo en niños con TEP alterado o clínica o exploración sugestiva de meningitis o encefalitis, o en cualquier lactante menor de tres meses que no cumpla los criterios de bajo riesgo (en este grupo se incluiría a todos los niños menores de 21 días)25,26.
Escalas y recursos
Se han desarrollado diferentes aproximaciones diagnósticas con el objetivo de identificar a aquellos niños con menor riesgo de IBG para evitar no diagnosticar a aquellos que la tienen, pero también para reducir punciones lumbares innecesarias, hospitalizaciones, exposición a antibióticos y el daño iatrogénico. Ninguna tiene suficiente sensibilidad para descartar totalmente la presencia de IBG en los pacientes catalogados como de bajo riesgo. No obstante, creemos recomendado utilizar aquellas validadas en la misma población, basadas en la evidencia y que permitan sistematizar las actuaciones que, generalmente, carecen de uniformidad entre centros e incluso entre profesionales en el mismo equipo.
Neonatos. La mayoría de las escalas siguen estableciendo 28 días/un mes, para considerar a este grupo como factor de riesgo y aplicar un abordaje diagnóstico completo (sepsis workup), con ingreso, analítica de sangre, urinoanálisis, urocultivo, hemocultivo y punción lumbar. Sin embargo, el riesgo en este grupo no es homogéneo. Algunos grupos promueven rebajar a 15 días la edad para clasificar al lactante de alto riesgo27, permitiendo un manejo ambulatorio en pacientes mayores de 15 días, seleccionados, que cumplan criterios de bajo riesgo28. Sin embargo, García et al.29 evaluaron el riesgo de IBG entre la primera y cuarta semanas de vida, concluyendo que los lactantes menores de tres semanas (hasta 21 días) presentaban un riesgo similar de IBG. Por lo tanto, serán considerados de alto riesgo para el manejo de la FSF los neonatos menores de 21 días.
Lactantes de 1-3 meses. En 1985 se publicaron los criterios de Rochester26 (combinando criterios clínicos y analíticos) para establecer dos categorías: niños de bajo y alto riesgo de IBG con un valor predictivo negativo (VPN) muy alto (99%). Desde la década de los 80 varias aproximaciones diagnósticas han salido a la luz, todas con una finalidad común: estratificar el riesgo en los niños febriles con IBG, sobre todo IBI, con buena apariencia. Las escalas clínicas en este grupo de edad pierden utilidad en las ITU febriles porque, en muchas ocasiones, no provocan una afectación del estado general, presentando un escaso VPN en todos aquellos pacientes con buena apariencia.
Entre las más recientes están: Lab-score27, PECARN30 y Step-by-Step; hemos escogido este último protocolo porque ha sido validado en población española, incluye factores clínicos, tira de orina/urinoanálisis y criterios analíticos (PCT, PCR y neutrófilos, step by step)31. Ha sido elaborado en forma de árbol de decisiones, en el que se van aplicando los diferentes criterios clínicos y analíticos y, como resultado, la toma de decisiones. Siempre va precedido de una evaluación inicial que clasifica a los pacientes en estables o inestables según el TEP. Considera a los bebés de bajo riesgo, si cumplen los siguientes criterios:
- No presentan un aspecto tóxico (TEP).
- Edad mayor de 21 días.
- Ausencia de leucocituria.
- PCT <0,5 ng/ml.
- PCR <20 mg/l.
- Neutrófilos <10 000/mm3.
Se le añade, además, un periodo de observación clínica en el hospital durante 12- 24 horas desde el inicio de la fiebre. Hoy en día es la escala más precisa, de mayor sensibilidad, mayor VPN y mayor likelihood ratio negativo.
La escala de colores de la guía NICE7, basada en la evidencia, con una alta sensibilidad, establece tres grupos de riesgo: bajo, moderado y alto. Cualquier niño con fiebre de menos de tres meses será considerado de alto riesgo (columna roja), aplicándole siempre todas las decisiones de esa columna.
Lactantes-niños 3-36 meses. Para este grupo también se han desarrollado escalas, tanto clínicas, como la escala de Yale32 o el código de colores de la guía NICE33, como otras que integran las pruebas complementarias en el algoritmo, como el Lab-score34 o Feverkidstool35, PECARN… y el más reciente y próximo, ya comentado, Step-by-Step28, que también recomendamos para este grupo de edad.
Manejo
Lo importante, ante la duda de si existe una BO, es determinar a quién debemos ingresar o tratar con antimicrobianos: quién presenta factores de riesgo de IBG (menor edad, no vacunados, inmunodeprimidos) y qué queremos evitar: progresión de la BO en el niño asintomático a una IBI. Es importante conocer la progresión natural según el germen; por ejemplo, mientras que la mayoría de las BO por neumococo tienden a la resolución espontánea, las BO por meningococo pueden evolucionar hacia enfermedad invasora con carácter fulminante en un 50% de los casos, como sepsis o meningitis. La antibioterapia empírica, en caso de iniciarse, debe basarse en las guías existentes y ajustarse conforme al patrón de resistencias locales.
Neonatos. Los neonatos de menos de 21 días con aspecto tóxico recibirán tratamiento antibiótico empírico inmediato. Habrá que realizar estudio completo de sepsis, pero sin retraso en la instauración de antibioterapia, generalmente ampicilina, cefotaxima y aciclovir, o bien, ampicilina y gentamicina en aquellos de bajo riesgo. En los que presentan un TEP normal, criterios analíticos normales y cultivos negativos a las 36 horas, se podría valorar retirar la antibioterapia e, incluso, dar el alta hospitalaria. La evidencia reciente indica que, con las bacterias patógenas presentes en la actualidad, el 96% los hemocultivos serán positivos en 36 horas y el 91% a las 24 horas12.
Lactante 21 días- 3 meses. Según criterios clínicos y analíticos se pueden establecer los siguientes niveles:
- Lactante con mal aspecto: se considerará que tiene una sepsis y se procederá a una valoración dirigida y actuación según los hallazgos con estudio de sepsis completo. Se ingresará y se iniciará tratamiento antibiótico empírico inmediato, generalmente con cefotaxima y vancomicina (15 mg/kg/6 horas). En caso de alta prevalencia de meningitis por monocytogenes o Enterococcus se recomienda asociar ampicilina (75 mg/kg/6 horas).
- Lactante con buen aspecto: según la escala elegida se realizará un manejo más o menos conservador o agresivo. Existe uniformidad en la realización del análisis de orina o cultivo de orina y pruebas sanguíneas. Descartar una ITU es prioritario e incuestionable, ya que es el foco más común de IBG. Puede considerarse la adición de pruebas virológicas moleculares, para VRS o virus influenza, en temporada epidémica. Según resultados, se considerará bien manejo domiciliario, siempre y cuando se asegure el seguimiento médico en 24 horas y los padres sean fiables, o bien, observación hospitalaria, con o sin antibióticos26. En el enfoque Step by Step17 se considera:
- Candidato a tratamiento con una dosis de ceftriaxona (50 mg/kg/i.v.) y seguimiento ambulatorio si: PCT <0,5 ng/ml, leucocituria negativa, PCR ≥20 mg/l o neutrófilos ≥10 000/mm3, con un periodo de observación en urgencias de 12-24 h desde el inicio de la fiebre y control por su pediatra en 24 h frente a ingreso, en función de la evolución clínica.
- Si no presenta leucocituria y la PCT ≥0,5 ng/ml, se ingresará y se valorará hacer una punción lumbar, especialmente, en caso de iniciar antibioterapia empírica.
- Si no hay datos de ITU y la analítica es normal, se puede dar el alta después de 12-24 horas de observación en Urgencias desde el inicio de la fiebre y control asegurado por su pediatra en 24 horas.
Lactante-niño 3-36 meses. En el momento actual y en nuestro entorno, con coberturas vacunales adecuadas e incidencia muy baja de BO, su búsqueda activa no es coste-efectiva. Como ejemplo de manejo nacional y actualizado, en el último protocolo de la Sociedad Española de Urgencias de Pediatría, ante FSF no se recomienda tratamiento empírico en pacientes vacunados y con buen estado general, salvo que tengan PCT ≥0,5 ng/ml, PCR ≥20 mg/l, leucocitos ≥15 000/mm3 o neutrófilos ≥10 000/mm317. En estos casos, las recomendaciones son: considerar observación hospitalaria, si hay elevación de la PCT, o alta domiciliaria, previa administración de ceftriaxona 50 mg/kg (máx. 2 g), con control clínico en 24 horas y explicando a los cuidadores las pautas de vigilancia y actitud que deben tomar ante signos de empeoramiento.
En todo caso, el papel de la antibioterapia empírica con alta domiciliaria hasta la espera de resultados del hemocultivo se reduce cada vez más a casos muy seleccionados18, enfatizándose la importancia de la vigilancia ante la aparición de síntomas o signos de alarma, con búsqueda rápida, en este caso, de atención médica.
Niño mayor de 36 meses. Dado el bajo riesgo de IBG, en el niño con buen estado general y TEP normal, en el que tras una exploración minuciosa sigue sin presentar ningún foco y, en especial ningún dato de alarma36, puede ser observado en domicilio explicando signos de alarma y aconsejando medidas de manejo de la fiebre. No se recomienda iniciar antibioterapia empírica.
Los datos de alarma a tener en cuenta son:
- Alteración del nivel de conciencia.
- Mala perfusión (relleno capilar mayor de 2 segundos).
- Trastornos del ritmo respiratorio (hipo- o hiperventilación).
- Alteración de signos vitales (FC, PA).
- Cianosis.
- Exantema maculoso o petequial sugestivos de enfermedad meningocócica.
- Dolor o tumefacción osteoarticular o limitación de la movilidad.
En caso de observarse alteraciones en el TEP o datos de alarma, debe ser derivado a un centro hospitalario con rapidez para evaluación y valoración de pruebas complementarias, ante sospecha de sepsis: hemograma, PCT o PCR, según disponibilidad, hemocultivo y técnicas microbiológicas disponibles (reacción en cadena de la polimerasa para neumococo o meningococo), tira reactiva de orina, LCR, según clínica, y radiografía de tórax, si tiene un hemograma con ≥20 000 leucocitos/mm3. Cuando hay sospecha de sepsis, debe actuarse según ABCD y con instauración de antibioterapia precoz, generalmente cefalosporina de 3.ª generación por vía parenteral, en el caso del niño previamente sano.
ANEXO. MANEJO DE LA FIEBRE COMO SÍNTOMA
La presencia de fiebre alta no es sinónimo de gravedad en sí misma, ni de riesgo de convulsiones febriles, ni de daño cerebral, salvo temperaturas anormalmente altas (≥42 °C). Tampoco lo es la falta de respuesta a antitérmicos o la presencia de picos febriles muy frecuentes. El objetivo del tratamiento debe ser mejorar el malestar asociado a la fiebre y no simplemente disminuir la temperatura, ya que esto último crea una falsa sensación de seguridad o control ante la infección.
- Medidas no farmacológicas. Los paños tibios o baños no se recomiendan rutinariamente por poder aumentar el malestar general. Se evitará el exceso de abrigo –pero no desabrigar–, y se ofrecerán líquidos.
- Medidas farmacológicas. Los únicos fármacos recomendados como antipiréticos son el paracetamol y el ibuprofeno. La edad mínima de administración y posología varían en función de las guías existentes37 en los distintos países:
- Paracetamol: la edad mínima de administración varía desde el nacimiento –como en España– o a partir de 2-3 meses. Dosis: 10-15 o 15 mg/kg/dosis. Intervalos: cada 4, 4-6 horas o 6 horas; dosis máxima diaria: 60 mg/kg/día a 90 mg/kg/día.
- Ibuprofeno: la edad mínima de administración varía desde los 2-3 meses de edad, a 6 meses. Dosis: 5-10 o 10 mg/kg/dosis, intervalos entre dosis: cada 6 o 6-8 horas. La dosis máxima diaria suele establecerse en 40 mg/kg/día.
A la pregunta de cuándo combinar antipiréticos -administración conjunta de los dos fármacos- o alternar: el mecanismo tras esta recomendación es la sinergia de ambos fármacos, que tienen mecanismos de acción diferentes. En los estudios, la combinación o alternancia es más efectiva cuando se trata de disminuir el pico febril. Sin embargo, este hecho es clínicamente irrelevante, ya que el malestar, que es el síntoma principal a tratar, no mejora. Aunque no se haya encontrado un aumento significativo de efectos indeseables con la combinación o alternancia de antipiréticos, sí podrían darse malentendidos con la posología (dosis máxima, intervalo entre dosis). Por lo tanto, y en general, no se recomienda nunca la combinación. La alternancia puede considerarse puntualmente en aquellos casos con picos febriles frecuentes o altos con malestar general importante, pero no de manera rutinaria38.
Se recomienda cuidado especial al administrar cualquiera de ellos en pacientes con condiciones crónicas preexistentes, como hepáticas o renales, diabetes, cardiopatías o malnutrición grave.
Medidas de seguimiento (hojas explicativas de signos de alarma a padres, citas para control clínico en 24-48 horas, posibilidad de contacto telefónico…). Ya hemos comentado cómo, en nuestro medio y en pacientes vacunados con buen estado general, un hemograma puede no aportar información –pensemos en el caso de BO por meningococo con hemograma normal– y sí transmitir una falsa sensación de control. Es más importante explicar, sin alarmar, los datos ante los que deben consultar rápidamente y evitar contribuir a la fiebrefobia.
Lo que puede hacerse o no debe hacerse
- Debe explicarse brevemente el mecanismo y significado de la fiebre a los padres o cuidadores, insistiendo en que la fiebre es un síntoma y lo importante es descartar que sea debida a una enfermedad potencialmente grave.
- Debe evitarse contribuir a la “fiebrefobia”: no deben administrarse antitérmicos sistemáticamente, por ejemplo, en triaje, a los pacientes que consulten por este motivo, no debemos esperar a que el paciente esté afebril para dar de alta si, por lo demás, tiene buen estado general, ni prescribir antitérmicos pautados solo para bajar la fiebre.
- Deben explicarse con lenguaje claro y sencillo los signos y síntomas de alarma ante los cuales volver a consultar urgentemente, aportando esta información, igualmente, por escrito e incluso que incluya la posología de los fármacos para evitar errores. Es deseable asegurar, que los padres o cuidadores, han entendido esta información dada y que el manejo domiciliario sea el adecuado. Entre los signos de alarma se deben incluir:
- Empeoramiento del estado general.
- Signos de hipoperfusión: piel moteada, palidez, frialdad, cianosis, pulso débil, etc.
- Exantema petequial generalizado.
- Afectación del nivel de consciencia: decaimiento, irritabilidad, somnolencia.
- Signos de dificultad respiratoria: tiraje, ruidos respiratorios anómalos, taquipnea.
Si no se asegura un manejo adecuado domiciliario, es preferible hacer observación hospitalaria durante unas horas, sin tratamiento, a instaurar antibioterapia domiciliaria “por si acaso” y alta sin más seguimiento.
CONFLICTO DE INTERESES
Las autoras declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
BO: bacteriemia oculta · FSF: fiebre sin foco · HHV-6: herpesvirus humano 6 · Hib: Haemophilus influenzae b · IBG: infección bacteriana grave · IBI: infección bacteriana invasiva · ITU: infección del tracto urinario · LCR: líquido cefalorraquídeo · PCR: proteína C reactiva · PCT: procalcitonina · SGB: estreptococo del grupo B · TEP: triángulo de evaluación pediátrica · VHS: virus del herpes simple · VNC: vacunas antineumocócicas conjugadas · VPN: valor predictivo negativo · VRS: virus respiratorio sincitial.
BIBLIOGRAFÍA
- Mintegi S, González M, Pérez A, Pijoán JI, Capapé S, Benito J. Lactante de 3-24 meses con fiebre sin foco en urgencias: características, tratamiento y evolución posterior. An Pediatr (Barc.). 2005;62:522-8.
- Dorney K, Bachur RG. Febrile infant update. Curr Opin Pediatr. 2017;29:280-5.
- Hormonas hipotalámicas e hipofisarias. En: Mezquita C, Mezquita J, Mezquita B, Mezquita P, (eds.). Fisiología Médica: del razonamiento fisiológico al razonamiento clínico. Madrid: Editorial Médica Panamericana; 2011. p. 208-16.
- Regulación hipotalámica de las funciones hormonales. En: Barret KM, Barman SM, Boitano S, Brooks HL (eds.). Ganong Fisiología Médica. 25.ª ed. México: McGraw-Hill; 2017. p. 307-20.
- El-Radhi ASM. Fever management: Evidence vs current practice. World J Clin Pediatr. 2012;1:29-33.
- Kurnat-Thoma E, Edwards V, Emery K. Axillary, Tympanic, and Temporal Thermometry Comparison in a Community Hospital Pediatric Unit. Pediatric Nursing. 2018;44:235-46.
- Aizpurua Galdeano P, Gimeno Díaz de Atauri A. En niños con fiebre, la temperatura corporal es un mal predictor de infección bacteriana grave. Evid Pediatr. 2016;12:10.
- Lafolie J, Labbé A, L’Honneur AS, Madhi F, Pereira B, Decobert M, et al. Assessment of blood enterovirus PCR testing in paediatric populations with fever without source, sepsis-like disease, or suspected meningitis: a prospective, multicentre, observational cohort study. Lancet Infect Dis. 2018;18:1385-96.
- L’Huillier AG, Mardegan C, Cordey S, Luterbacher F, Papis S, Hugon F, et al. Enterovirus, parechovirus, adenovirus and herpes virus type 6 viraemia in fever without source. Arch Dis Child. 2020;105:180-6.
- Paioni P, Barbey F, Relly C, Meyer Sauteur P, Berger C. Impact of rapid enterovirus polymerase chain reaction testing on management of febrile young infants <90 days of age with aseptic meningitis. BMC Pediatr. 2020;20:166.
- Nigrovic LE, Mahajan PV, Blumberg SM, Browne LR, Linakis JG, Ruddy RM, et al. The Yale Observation Scale Score and the risk of serious bacterial infections in febrile infants. Pediatrics. 2017;140:e20170695.
- Cioffredi LA, Jhaveri R. Evaluation and management of febrile children: a review. JAMA Pediatr. 2016;170:794-800.
- McDaniel CE, Ralston S, Lucas B, Schroeder AR. Association of diagnostic criteria with urinary tract infection prevalence in bronchiolitis: a systematic review and meta-analysis. JAMA Pediatr. 2019;173:269-77.
- Hendaus MA. Why are children with bronchiolitis at risk of urinary tract infections? Risk Manag Healthc Policy. 2019;12:251-4.
- Hernández-Bou S, Trenchs V, Batlle A, Gene A, Luaces C. Occult bacteraemia is uncommon in febrile infants who appear well, and close clinical follow-up is more appropriate than blood tests. Acta Paediatr. 2015;104:e76-81.
- Hernández-Bou S, Gómez B, Mintegi S, García-García JJ; Bacteraemia Study Working Group of the Infectious Diseases Working Group of the Spanish Society of Paediatric Emergencies (SEUP). Occult bacteremia etiology following the introduction of 13-valent pneumococcal conjugate vaccine: a multicenter study in Spain. Eur J Clin Microbiol Infect Dis. 2018;37:1449-55.
- Mintegi S, Gómez B. Lactante febril. En: Sociedad Española de Urgencias de Pediatría (SEUP) [en línea] [consultado el 27/04/2021]. Disponible en https://seup.org/pdf_public/pub/protocolos/11_Lactantes.pdf
- Ishimine P. Fever without source in children 0 to 36 months of age. Pediatr Clin North Am. 2006;53:167-94.
- Gould JM. Fever in the Infant and toddler differential diagnoses. En: Medscape [en línea] [consultado el 27/04/2021]. Disponible en https://emedicine.medscape.com/article/1834870-differential
- Fernández JL. Aproximación y estabilización inicial del niño enfermo o accidentado. Triángulo de evaluación pediátrica. ABCDE. En: Sociedad Española de Urgencias de Pediatría [en línea] [consultado el 27/04/2021]. Disponible en https://seup.org/pdf_public/pub/protocolos/2_Estabilizacion.pdf
- Baraff LJ. Management of infants and young children with fever without source. Pediatr Ann. 2008;37:673-9.
- Trippella G, Galli L, De Martino M, Lisi C, Chiappini E. Procalcitonin performance in detecting serious and invasive bacterial infections in children with fever without apparent source: a systematic review and meta-analysis. Expert Rev Anti Infect Ther. 2017;15:1041-57.
- Arora R, Mahajan P. Evaluation of child with fever without source: review of literature and update. Pediatr Clin North Am. 2013;60:1049-62.
- Manejo pediátrico en Atención Primaria del COVID-19 (Documento técnico). En: Ministerio de Sanidad, Consumo y Bienestar Social [en línea] [consultado el 27/04/2021]. Disponible en www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/Manejo_Pediatría_ap.pdf
- Aronson PL, Wang ME, Shapiro ED, Shah SS, DePorre AG, McCulloh RJ, et al. Risk stratification of febrile infants ≤60 days old without routine lumbar puncture. Pediatrics. 2018;142:e20181879 [en línea] [consultado el 17/12/2020]. Disponible en https://pediatrics.aappublications.org/content/142/6/e20181879
- Mintegi S, Gómez B, Martínez-Virumbrales L, Morientes O, Benito J. Outpatient management of selected young febrile infants without antibiotics. Arch Dis Child. 2017;102:244-9.
- Bressan S, Andreola B, Cattelan F, Zangardi T, Perilongo G, Da Dalt LD. Predicting severe bacterial infections in well-appearing febrile neonates: laboratory markers accuracy and duration of fever. Pediatr Infect Dis J. 2010;29:227-32.
- Kadish HA, Loveridge B, Tobey J, Bolte RG, Corneli HM. Applying outpatient protocols in febrile infants 1-28 days of age: can the threshold be lowered? Clin Pediatr (Phila). 2000;39:81-8.
- García S, Mintegi S, Gómez B, Barron J, Pinedo M, Barcena N, et al. Is 15 days an appropriate cut-off age for considering serious bacterial infection in the management of febrile infants? Pediatr Infect Dis J. 2012;31:455-8.
- Kuppermann N, Dayan PS, Levine DA, Vitale M, Tzimenatos L, Tunik MG, et al. A clinical prediction rule to identify febrile infants 60 days and younger at low risk for serious bacterial infections. JAMA Pediatr. 2019;173:342-51.
- Gómez B, Mintegi S, Bressan S, Da Dalt L, Gervaix A, Lacroix L, et al. Validation of the "Step-by-Step" Approach in the management of young febrile infants. Pediatrics. 2016;138:e20154381.
- Asociación Andaluza de Pediatría de Atención Primaria. Escalas - Calculadoras - Algoritmos - APPS móviles y Webs. En: Ayupedia, ayudas a la consulta pediátrica [en línea] [consultado el 27/04/2021]. Disponible en www.pediatrasandalucia.org/ayupedia/index.php/escalasalgoritmos/
- Davis T. NICE guideline: feverish illness in children - assessment and initial management in children younger than 5 years. Arch Dis Child Educ Pract Ed. 2013;98:232-5.
- Galetto-Lacour A, Zamora SA, Andreola B, Bressan S, Lacroix L, Da Dalt L, et al. Validation of a laboratory risk index score for the identification of severe bacterial infection in children with fever without source. Arch Dis Child. 2010;95:968-73.
- Nijman RG, Vergouwe Y, Moll HA, Smit FJ, Weerkamp F, Steyerberg EW, et al. Validation of the Feverkidstool and procalcitonin for detecting serious bacterial infections in febrile children. Pediatr Res. 2018;83:466-76.
- García JM, Fernández E, Garrido FJ, Hernández MD, Marfil S, Sánchez R. Proceso asistencial integrado fiebre en la infancia. 2.ª ed. En: Junta de Andalucía, Consejería de Salud [en línea] [consultado el 27/04/2021] Disponible en www.juntadeandalucia.es/organismos/saludyfamilias/areas/calidad-investigacion-conocimiento/gestion-conocimiento/paginas/pai-fiebre-infancia.html
- Chiappini E, Bortone B, Galli L, de Martino M. Guidelines for the symptomatic management of fever in children: systematic review of the literature and quality appraisal with AGREE II. BMJ Open. 2017;7:e015404.
- Trippella G, Ciarcià M, de Martino M, Chiappini E. Prescribing controversies: an updated review and meta-analysis on combined/alternating use of ibuprofen and paracetamol in febrile children. Front Pediatr. 2019;7:217.