Vol. 19 - Num. 76
Originales
Repercusión de la desfinanciación de la vacuna antineumocócica en una población con recursos bajos
Adrián Abbasi Péreza, María Aparicio Rodrigob, Carlos Ochoa Sangradorc
aEstudiante de Medicina. Universidad Complutense. Madrid. España.
bPediatra. CS Entrevías. Facultad de Medicina. Universidad Complutense de Madrid. Madrid. España.
cServicio de Pediatría. Hospital Virgen de la Concha. Zamora. España.
Cómo citar este artículo: Abbasi Pérez A, Aparicio Rodrigo M, Ochoa Sangrador C. Repercusión de la desfinanciación de la vacuna antineumocócica en una población con recursos bajos. Rev Pediatr Aten Primaria. 2017;19:329-36.
Publicado en Internet: 26-10-2017 - Número de visitas: 15853
Resumen
Introducción: en junio de 2010, la Comunidad de Madrid incluyó en el calendario vacunal infantil la vacuna neumocócica conjugada tridecavalente. Por razones presupuestarias, se retiró de la financiación en julio de 2012 y hasta enero de 2015. Nuestro objetivo fue evaluar cómo influyó este hecho en la cobertura vacunal y en la incidencia de enfermedad neumocócica invasiva, neumonía y otitis media aguda en una población de recursos económicos bajos y compararlo con los mismos datos publicados para el conjunto de la región.
Material y métodos: estudio de cohortes retrospectivo de los casos de enfermedad neumocócica y cobertura vacunal en los niños nacidos entre mayo de 2012 y octubre de 2014 del centro de salud Entrevías (Madrid, España).
Resultados: se encuentra una menor cobertura vacunal (66%; IC 95: 57,3 a 71,4) respecto a la media de la Comunidad de Madrid (77%). No hubo casos de enfermedad neumocócica invasiva y la incidencia de neumonías y otitis fue independiente del estado vacunal. El único factor asociado a la incidencia de otitis fue la asistencia a guardería.
Conclusiones: la desfinanciación de la vacuna neumocócica conjugada condicionó la disminución de la cobertura vacunal por debajo de la media regional en una población de bajos recursos. No se encontró aumento de incidencia de enfermedad neumocócica, probablemente debido a la persistencia del efecto rebaño o a un tamaño muestral insuficiente.
Palabras clave
● Cobertura de vacunación ● Infecciones neumocócicas ● Neumonía neumocócica ● Otitis media ● Vacunas neumocócicasINTRODUCCIÓN
El neumococo, Streptococcus pneumoniae, es un coco grampositivo del que se conocen más de 90 serotipos. Tiene como único reservorio la nasofaringe, que se coloniza especialmente en niños menores de cuatro años, siendo menos frecuente en el adulto. El neumococo puede causar infecciones locales de mucosas (neumonías, otitis media aguda [OMA] o sinusitis) o puede propagarse por vía sanguínea produciendo enfermedad neumocócica invasiva (ENI) (neumonía neumocócica, meningitis, bacteriemia [forma más frecuente de ENI] o sepsis)1.
La primera vacuna contra el neumococo fue una vacuna polisacarídica que se aprobó en 1977 en EE. UU. para pacientes mayores de dos años con riesgo de infección neumocócica. En menores de dos años, grupo de edad con mayor incidencia deENI,espobrementeinmunógena.
En el año 2000 se completaron los ensayos clínicos con la primera vacuna neumocócica conjugada (VNC) que incluía los siete serotipos más prevalentes (VNC7)2. Esta mostró una excelente efectividad frente a la ENI causada por los serotipos contenidos en la vacuna2. La efectividad frente a las formas no invasivas, como la OMA y la neumonía, fue mucho más baja3.
Antes de la llegada de la VNC7, la incidencia de ENI en España oscilaba entre 60 y 170 casos por 100 000 niños menores de dos años de edad. La vacunación universal con VNC7 disminuyó la incidencia, pero dio lugar a un incremento de formas invasoras producidas por otros serotipos (19A, 1, 7F, 3 y 6A).
En el año 2010 se comenzó a comercializar la vacuna conjugada tridecavalente (VNC13), que incorpora los serotipos de la VNC7 junto a seis serotipos más (1, 3, 5, 6A, 7F y 19A). En la Comunidad de Madrid (CM) se inició la vacunación con VNC13, sustituyendo a la VNC7, en junio de 2010. Desde entonces se ha producido una disminución de la ENI en menores de 15 años desde 17 casos a 7,7 casos por cada 100 000 habitantes (una reducción del 57%). En este mismo periodo la disminución de empiema, neumonía bacteriémica y meningitis neumocócica fueron del 46, 71 y 55% respectivamente. Resultados similares se han obtenido en otros países4-6.
En julio de 2012, por razones presupuestarias, se excluyó la VCN13 del calendario de vacunaciones sistemáticas infantiles de la CM, manteniéndose para grupos de riesgo, hasta enero de 2015, cuando volvió a introducirse. En este periodo, según el Boletín Epidemiológico de la CM, se produjo un descenso en la cobertura vacunal desde el 99,8% en el año 2011 al 77,1% en 2013, sin datos segregados por áreas básicas de salud5. Aunque los datos publicados recientemente por la CM indican que no ha habido un aumento global de la incidencia de ENI se desconoce la repercusión de esta medida en zonas de la región más desfavorecidas4.
El objetivo de este estudio fue analizar el efecto de la desfinanciación de la VCN13 sobre la cobertura vacunal y la incidencia de enfermedad neumocócica en una zona básica de la CM con muy bajos recursos económicos y la comparación de estas cifras con los datos globales oficiales.
MATERIAL Y MÉTODOS
Se contó con el informe favorable de la Comisión Local de Investigación Sureste, siguiendo el protocolo establecido para acceder a los datos de las historias clínicas con fines de investigación.
El estudio incluyó a todos los pacientes nacidos entre mayo de 2012 y octubre de 2014 asignados a un cupo de Pediatría del centro de salud (CS) Entrevías (Madrid, España). Se eligió este periodo porque fue la cohorte de niños a los que la CM excluyó de la financiación la vacuna VCN13 (de julio de 2012 a enero de 2015). El listado de pacientes se obtuvo de la base de datos Cibeles, que incluye a toda la población de la CM con tarjeta sanitaria (con derecho a atención sanitaria). En esta población se determinó la cobertura con la vacuna VCN13 y la incidencia de enfermedad neumocócica invasiva y no invasiva (OMA y neumonías).
Los datos se obtuvieron de las historias clínicas informatizadas del programa AP-Madrid®. De cada paciente incluido en el listado, se registró la fecha de nacimiento, edad gestacional, sexo y asistencia o no a guardería. En relación con la vacunación se registraron las dosis de vacuna VCN13 puestas y las fechas de administración de cada una. Solo se tuvieron en cuenta las dosis administradas entre el 1 de julio de 2012 y el 31 de diciembre de 2014. Se consideraron vacunados los niños que recibieron las dosis de vacunas correspondientes a su edad según ficha técnica (Prevenar13®), incluyendo en este grupo a los pacientes que recibieron las dosis a la edad habitual de vacunación cuando la vacuna estaba financiada y a los que las recibieron con retraso. Se consideraron no vacunados los pacientes que no recibieron ninguna dosis de vacuna VCN13 y los que recibieron una vacunación incompleta según la ficha técnica del producto.
Se registró la presencia o ausencia de enfermedades subyacentes que hicieran al paciente más susceptible de padecer enfermedad neumocócica: afectaciones pulmonares crónicas, cardiopatías congénitas cianóticas, síndrome de Down, diabetes mellitus, hepatopatías crónicas, fístulas del espacio subaracnoideo, asplenia y estados de inmunosupresión.
Se registraron los episodios codificados como OMA u otitis media supurada, incluyendo fecha del diagnóstico, nivel de atención al diagnóstico (primaria/hospitalario), otoscopia sugestiva de OMA, presencia o no de fiebre y datos clínicos compatibles con otitis. Se consideró el diagnóstico de OMA en el caso de la presencia sintomática de exudado en el oído medio (generalmente mucopurulento) (criterios diagnósticos del consenso de OMA)7.
Se registraron los episodios codificados como neumonía, incluyendo fecha del diagnóstico, datos sobre el nivel de atención al diagnóstico (primaria/hospitalario) y el tipo de diagnóstico (radiológico/clínico/laboratorio). Se consideró neumonía una infección aguda del tracto respiratorio inferior con una duración inferior a 14 días, adquirida en la comunidad, que produce tos o dificultad respiratoria y con evidencia radiológica de infiltrado pulmonar agudo (criterios diagnósticos del consenso de neumonía adquirida en la comunidad)8. Además, se registraron los episodios compatibles con ENI (meningitis, septicemia).
A su vez, se extrajeron datos del Registro del Conjunto Mínimo Básico de Datos de Altas Hospitalarias y Cirugía Ambulatoria (CMBD) de la CM a través de la aplicación informática consult@web de Atención Primaria para la misma población seleccionado los siguientes códigos específicos de enfermedad neumocócica invasora que se recogen en la CIE-9-MC: 481 (neumonía neumocócica), 320.1 (meningitis neumocócica), 038.2 (septicemia neumocócica) y 567.1 (peritonitis neumocócica), registrados como diagnóstico principal o en el primer diagnóstico secundario y también los códigos 382.0, 382.4, 382.9 (otitis media aguda) y 482.9 (otras neumonías bacterianas), 485 (bronconeumonía organismo sin especificar), 486 (neumonía organismos no especificado). Con el mismo programa se obtuvo el listado de episodios registrados entre septiembre de 2012 y enero de 2015 en la historia clínica informatizada de Atención Primaria (programa AP-Madrid®) relacionados con infección neumocócica con los códigos CIAP: neumonía (R81), otitis (H71), meningitis (N71), sepsis y los episodios que, aunque tuvieran diferente codificación, incluyeran en su descripción alguna de las patologías señaladas. Estos datos se contrastaron con los obtenidos directamente de la historia clínica del paciente para evitar pérdida de datos.
Se comparó la cobertura vacunal con VCN13 en el CS Entrevías con la cobertura vacunal con VCN13 en la CM durante el periodo de estudio. También se comparó la incidencia de enfermedad potencialmente causada por neumococo en pacientes no vacunados en relación con los pacientes vacunados, teniendo en cuenta el número de dosis de vacuna recibidos antes del diagnóstico.
Se realizó un estudio de estadística descriptiva con estimación de frecuencias absolutas y relativas de variables cualitativas y medidas de tendencia y dispersión de variables cuantitativas. Se calcularon intervalos de confianza de las principales medidas. Se exploró la asociación entre variables cualitativas mediante el test de χ2 o pruebas exactas. Además, se realizó el análisis de supervivencia para estimar la asociación de tiempo hasta la aparición de una primera otitis por el método de Kaplan Meier y Log-Rank (resultados no publicados).
El tamaño de la muestra se calculó para estimar la proporción de sujetos vacunados, con una precisión del 10% y un intervalo de confianza del 95% (IC 95), con una proporción esperada del 50% (la situación más desfavorable), resultando 96 sujetos.
RESULTADOS
Se seleccionó una muestra inicial de 201 niños. Se excluyeron siete pacientes por carecer de datos en la historia clínica. Finalmente se estudiaron un total de 194 pacientes. La edad media de la población fue de 17 meses (IC 95: 16 a 19), con una mediana de 18 meses y un límite inferior de 0 y superior de 30 meses.
El 66% de los pacientes fue adecuadamente vacunado (en la fecha correspondiente o con desfase respecto al calendario habitual). El IC 95 de la cobertura vacunal fue de 57,3 a 71,4%. No hubo diferencias en cuanto al sexo, edad gestacional o asistencia a guardería del grupo de niños vacunados respecto a los no vacunados, aunque la edad de los niños vacunados fue menor que la de los no vacunados (Tabla 1).
| Tabla 1. Características generales de los pacientes vacunados con VCN13 y no vacunados | |||
|---|---|---|---|
| Vacunados (n = 126) | Vacunación ausente o incompleta (n = 65) | ||
| Sexo varón/mujer | 63/63 (50%) | 36/29 (55%) | p = 0,48 |
| Meses de edad: media (desviación estándar) | 16,22 (8,77%) | 19,6 (9,65%) | p = 0,016 |
| < 37 semanas de edad gestacional | 11/126 (5%) | 50/65 (4%) | p = 1,000 |
| Asistencia a guardería (sobre 170) | 49/119 (41%) | 19/51 (37%) | p = 0,731 |

No hubo ningún caso de ENI. Se registraron un total de 48 OMA en la población de estudio durante el periodo analizado: 33 casos entre los vacunados (26,2% de este grupo) y 15 casos entre los no vacunados (23,1% de este grupo). La edad media fue de 13 meses (IC 95: 11 a 14). La edad de comienzo de OMA fue a los tres meses. El 35,4% (17 casos) se produjo antes de la vacunación, un 33,3% (16 casos) tras la primovacunación (tres dosis en el primer año) y antes de la dosis de recuerdo y un 31,3% (15 casos) tras la vacunación completa (Fig. 1). No hubo diferencias significativas entre los grupos. La incidencia de otitis fue independiente del estado de vacunación, la edad gestacional y el sexo.
| Figura 1. Prevalencia de OMA en niños vacunados con la vacuna conjugada neumocócica tridecavalente (antes de vacunar, tras la primovacunación, después de la vacunación completa para su edad) y los niños no vacunados durante el periodo de estudio |
|---|
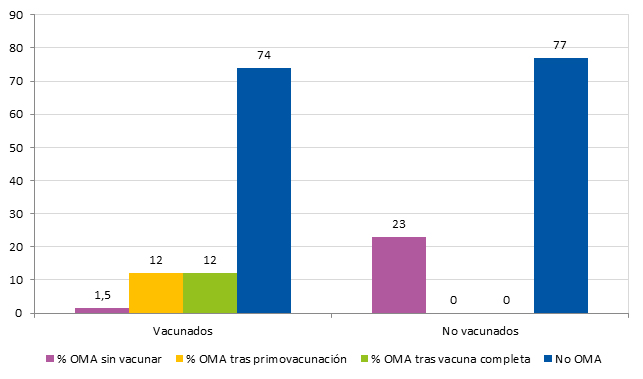 |

La asistencia a la guardería se asoció a una mayor incidencia de OMA: un 36,8% (25/68) en niños que fueron a guardería frente a un 20,6% (21/102) en niños que no fueron (p = 0,02; riesgo relativo [RR]: 1,78; IC 95: 1,09 a 2,92). No se dispone de datos sobre asistencia a guardería en 24 casos. En la <Tabla 2 se puede ver la incidencia acumulada de OMA a diferentes edades y su relación con asistencia o no a guardería previamente a la OMA. La edad de la primera OMA fue significativamente menor (p = 0,031) en los expuestos previamente a guardería (mediana: 12 meses; rango intercuartílico: 6) que en los que no (mediana: 18 meses; rango intercuartílico: 9).
| Tabla 2. Incidencia acumulada de otitis a diferentes edades según la asistencia o no a guardería previa a la otitis | ||||
|---|---|---|---|---|
| Periodo de edad | OMA en niños con guardería previa OMA/total (%) |
OMA en niños sin guardería previa OMA/total (%) |
% de niños que iban a la guardería | p |
| < 6 meses | 0/3 (0,0%) | 3/167 (1,8%) | 1,8% | p = 1 |
| < 12 meses | 5/24 (20,8%) | 16/146 (11,0%) | 14,1% | p = 0,031 |
| < 18 meses | 18/49 (36,7%) | 21/121 (17,4%) | 28,8% | p = 0,006 |
| < 24 meses | 22/57 (38,6%) | 22/113 (19,5%) | 33,5% | p = 0,007 |

Catorce niños (29%) tuvieron OMA de repetición: seis tuvieron dos episodios, siete tuvieron tres episodios y uno tuvo cuatro episodios. De ellos, diez no acudían a la guardería, diez estaban vacunados y solo uno de los vacunados tuvo la OMA de repetición antes de la vacunación.
Se diagnosticaron seis neumonías, dos de ellas antes de la vacunación, dos tras la primovacunación y dos después de la vacunación completa. Tres de los seis niños iban a la guardería. Las diferencias no fueron estadísticamente significativas.
DISCUSIÓN
Tras la desfinanciación de la VCN13 en la CM, coincidiendo con los recortes presupuestarios de 2012, en el CS Entrevías se registró una reducción significativa de la cobertura vacunal, desde un 98% a un 64,9% (IC 95: 57,3 a 71,4), siendo la del conjunto de la CM del 77,1%5.
No se encontró un aumento de la patología relacionada con el neumococo. Una explicación a este hecho podría ser la persistencia del efecto rebaño de una vacuna recién desfinanciada. Si la medida se hubiera mantenido en el tiempo es posible que los resultados hubieran sido distintos.
Estudios realizados en Kenia y en Massachusetts9 concluyen que se consigue mantener la inmunidad de grupo cuando las tasas vacunales en niños menores de dos años son al menos del 65%. Algunos autores3 sugieren que podría haber algún grado de protección indirecta con coberturas tan bajas como el 40%.
Para que se produzca este efecto, es clave la reducción de portadores nasofaríngeos. La VCN13 reduce alrededor del 50% la tasa de colonización nasofaríngea de los serotipos 1, 6A, 7F y 19A en comparación con la VCN7, pero no afecta a la colonización por el serotipo 3 al no alcanzar títulos protectores de anticuerpos. El mayor descenso en las tasas de colonización se produce en el 19A, y es posible que este hecho se relacione con la excelente efectividad que la VCN13 ha mostrado frente a este serotipo en la CM. El nicho ecológico creado por la desaparición de estos serotipos en la faringe es ocupado por otros serotipos no-VNC13, aunque parecen tener menor capacidad invasiva que los serotipos VNC133. La VNC13 reduce la colonización nasofaríngea no solo en los niños vacunados sino también en los niños no vacunados y en adultos3.
La inmunización infantil protege indirectamente a grupos que no reciben la vacuna mediante la reducción de la circulación de los serotipos contenidos en la misma. La prevención de la enfermedad invasiva por neumococo en adultos a través de la inmunidad de grupo se ha demostrado beneficiosa y poderosamente rentable10.
Dada la baja incidencia de ENI (7,7 casos por cada 100 000 habitantes < 15 años)11, era esperable que no encontráramos casos en nuestro estudio. En 2007, la CM acordó iniciar un sistema de vigilancia epidemiológica de ENI, publicándose anualmente sus resultados a través del estudio Heracles. Las conclusiones de este6,11 y de estudios similares2,12 evidencian una disminución significativa de la tasa de incidencia acumulada de ENI producida por los serotipos contenidos en la vacuna en los niños de todas las edades. En nuestra región, pese a la suspensión de la vacunación universal con VCN13, la disminución de ENI ha continuado. Con unas coberturas estimadas del 70% la reducción de la tasa de ENI por cualquier serotipo y por los serotipos vacunales ha sido 68 y 84% respectivamente con respecto al periodo anterior al uso de la vacuna3. En contraste, la efectividad de la vacuna en la enfermedad no invasiva es más difícil de valorar y existen menos estudios que lo analicen.
La principal limitación de este estudio a la hora de valorar la enfermedad no invasiva por neumococo se debe a que en estas enfermedades no se realiza habitualmente estudio microbiológico, ni aun en el caso de que el paciente resulte hospitalizado. Así, a la hora de valorar la diferencia en la incidencia de OMA y neumonías entre los niños vacunados y no vacunados, encontramos la limitación de la incertidumbre etiológica.
Para disminuir el sesgo de error diagnóstico, dado que los criterios diagnósticos son clínicos, se tuvieron en cuenta los contemplados en los consensos de la Asociación Española de Pediatría para otitis7 y neumonías8. Se recogieron los datos de la historia clínica relacionados con ellos y solo se consideraron los diagnósticos que los incluyeron.
El hecho de no encontrar diferencias significativas en la incidencia de OMA entre niños vacunados y no vacunados, a pesar de que la cohorte de no vacunados fue de mayor edad (mayor tiempo de exposición a otitis), reflejaría el modesto beneficio (de entre 0-9% en ensayos clínicos aleatorizados y de 17-23% en no aleatorizados) de las vacunas conjugadas para prevenir esta enfermedad en pacientes de bajo riesgo, como sugieren algunos estudios, probablemente por incluir un número limitado de serotipos13.
Fortanier et al.14 realizaron en 2014 un metanálisis de 11 ensayos aleatorizados que incluían 48 426 niños de hasta siete años vacunados con la VCN7, con conclusiones similares.
Los serotipos adicionales incluidos en la VCN13 (particularmente el 19A) proveen de protección adicional contra la OMA. En EE. UU. la proporción de aislamiento de neumococo del oído medio de los serotipos vacunales se redujo del 50% en 2011 al 29% en 2013; el serotipo 19A pasó del 34 al 10%15.
Otros estudios revelan mejores datos. En Israel el uso de VNC7 seguido de VNC13 ha conseguido la disminución de la OMA causada por los serotipos vacunales y de todas las OMA del 77% y 60% respectivamente16.
Estudios a largo plazo17 han mostrado una disminución de casos de otitis media complicada y crónica con la VCN13, así como una reducción de la inserción de tubos de ventilación. Los autores de la revisión reconocen que los resultados de los estudios incluidos son variables debidos en parte a criterios de medición diferentes y por tanto los datos deben interpretarse con cautela.
Nuestros resultados muestran una menor incidencia de neumonía en niños vacunados respecto a no vacunados, pero el reducido tamaño de la muestra y de casos (cuatro casos en niños parcialmente o no vacunados frente a dos en niños con vacunación completa) no permite sacar conclusiones. Para las neumonías con consolidación radiológica, la VNC13 tiene una efectividad que oscila entre el 15 y el 40%3 y reduce tanto las hospitalizaciones como las visitas al Servicio de Urgencias por neumonía en un 27 y un 8%, respectivamente, según los datos de un estudio en EE. UU. tras dos años de la introducción de la VNC1318.
Si bien es cierto que la falta de diferencias respecto a la incidencia de enfermedad no invasiva por neumococo puede ser debida al tamaño de la muestra, calculada para demostrar diferencias en la cobertura vacunal, no debemos olvidar, tanto para las OMA como las neumonías, el efecto rebaño que podría ser el causante de esta ausencia de diferencias. Los resultados de estudios recientes realizados en nuestra comunidad11 apoyaríanestahipótesis.
Análogamente, se registró la edad gestacional de cada niño para estudiar la prematuridad como un posible factor de riesgo en el desarrollo de enfermedad neumocócica, pero no se encontraron diferencias en la incidencia de OMA o neumonías al comparar los niños mayores y menores de 37 semanas de edad gestacional.
En nuestro estudio se encontró una mayor incidencia de OMA en niños que fueron a guardería, dato que coincide con el de estudios publicados previamente19. El neumococo se transmite por mecanismo directo de persona a persona como consecuencia de un contacto íntimo prolongado. La cohabitación en espacios reducidos (prisiones, campamentos, refugios…) se asocia con epidemias4 y la asistencia a guarderías se asocia a un incremento de riesgo de OMA y de OMA con derrame19.
La desfinanciación de la VCN13 en la CM conllevó una disminución de la cobertura vacunal en una zona económicamente desfavorecida respecto a la media regional. Si bien estos datos no parecen tener implicaciones clínicas, deben ser considerados por las administraciones a la hora de tomar decisiones sobre la financiación de vacunas.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
CM: Comunidad de Madrid • CMBD: Conjunto Mínimo Básico de Datos de Altas Hospitalarias y Cirugía Ambulatoria • CS: centro de salud • ENI: enfermedad neumocócica invasiva • IC: intervalo de confianza del 95% • OMA: otitis media aguda • VNC: vacuna neumocócica conjugada • VNC13: vacuna neumocócica conjugada tridecavalente • VNC7: vacuna neumocócica conjugada heptavalente.
BIBLIOGRAFÍA
- Van Hoek AJ, Sheppard CL, Andrews NJ, Waight PA, Slack MPE, Harrison TG, et al. Pneumococcal carriage in children and adults two years after introduction of the thirteen valent pneumococcal conjugate vaccine in England. Vaccine. 2014;32:4349-55.
- Zangeneh TT, Baracco G, Al-Tawfiq JA. Impact of conjugate pneumococcal vaccines on the changing epidemiology of pneumococcal infections. Expert Rev Vaccines. 2011;10:345-53.
- Comité Asesor de Vacunas de la AEP. Neumococo. En: Manual de vacunas en línea de la AEP [en línea] [consultado el 24/10/2017]. Disponible en http://vacunasaep.org-documentos/manual/cap-31
- Enfermedad invasora por Streptococcus pneumoniae. En: Servicio Madrileño de Salud [en línea] [consultado el 24/10/2017]. Disponible en https://goo.gl/KwN2us
- Enfermedad neumocócica invasora en la Comunidad de Madrid. Año 2014. Bol Epidemiol Comunidad de Madrid. 2015;21:5-55.
- Picazo J, Ruiz-Contreras J, Casado-Flores J, Giangaspro E, García-de-Miguel MJ, Hernández-Sampelayo T, et al. Impact of introduction of conjugate vaccines in the vaccination schedule on the incidence of pediatric invasive pneumococcal disease requiring hospitalization in Madrid 2007 to 2011. Pediatr Infect Dis J. 2013;32:656-61.
- Del Castillo Martín F, Baquero Ortigao F, Calle Cabrera T, López Robles M, Ruiz Canela J, Alfayate Migueleza S, et al. Documento de consenso sobre etiología, diagnóstico y tratamiento de la otitis media aguda. An Pediatr (Barc). 2012;77:345.e1-e8.
- Andrés Martín A, Moreno Pérez D, Alfayete Miguélez S, Couceiro Gianzo JA, García García ML, Korta Muruac J, et al. Etiología y diagnóstico de la neumonía adquirida en la comunidad y sus formas complicadas. An Pediatr (Barc). 2012;76:162.e1-e18.
- Klugman KP. Herd protection induced by pneumococcal conjugate vaccine. Lancet Glob Health. 2014;2:e365-66.
- Loo J, Conklin L, Fleming-Dutra KE, Knoll N, Park DE, Kirk J. Systematic review of the indirect effect of pneumococcal conjugate vaccine dosing schedules on pneumococcal disease and colonization. Pediatr Infect Dis J. 2014;33:161-71.
- Picazo J, Ruiz-Contreras J, Casado-Flores J, Negreira S, García-de-Miguel MJ, Hernández-Sampelayo T, et al. Expansion of serotype coverage in the universal pediatric vaccination calendar: short-term effects on age- and serotype-dependent incidence of invasive pneumococcal clinical presentations in Madrid, Spain. Clin Vaccine Immunol. 2013;20:1524-30.
- Waight PA, Andrews NJ, Ladhani NJ, Sheppard CL, Slack MP, Miller E. Effect of the 13-valent pneumococcal conjugate vaccine on invasive pneumococcal disease in England and Wales 4 years after its introduction: an observational cohort study. Lancet Infect Dis. 2015;15:629-33.
- Taylor S, Marcjisio P, Vergison A, Harriague J, Hausdorff WP, Haggard M. Impact of pneumococcal conjugate vaccination on otitis media: a systematic review. Clin Infect Dis J. 2012;54:1765-73.
- Fortanier AC, Venekamp RP, Boonacker CWB, Hak E, Schilder AGM, Sanders EAM, et al. Pneumococcal conjugate vaccines for preventing otitis media (review). Cochrane Database Syst Rev. 2014:3-17.
- Cohen R, Levy C, Bingen E, Koskas M, Nave I, Varon E. Impact of the 13-valent pneumococcal conjugate vaccine on pneumococcal nasopharyngeal carriage in children with acute otitis media. Pediatr Infect Dis J. 2012;31:297-301.
- Ben-Shimol S, Givon-Lavi N, Leibovitz E, Raiz R, Greenberg D, Dagan R. Near-elimination of otitis media caused by 13-valent pneumococcal conjugate vaccine (PCV) serotypes in Southern Israel shortly after sequential introduction of 7-valent/13-valent vaccine. Clin Infect Dis. 2014;59:1724-32.
- Dagan R, Pelton S, Bakaletz L, Cohen R. Prevention of early episodes of otitis media by pneumococcal vaccines might reduce progression to complex disease. Lancet Infect Dis. 2016;16:480-92.
- Griffin MR, Mitchel E, Moore MR, Whitney CG, Grijalva CG. Declines in pneumonia hospitalizations of children aged <2 years associated with the use of pneumococcal conjugated vaccines. MMWR Morb Mortal Wkly Rep. 2014;63:995-8.
- Ochoa Sangrador C. ¿Cuánto aumenta el riesgo de otitis media aguda la asistencia a guardería? Evid Pediatr. 2007;3:108.





