Vol. 26 - Num. 104
Originales
Etiología y resistencia a los antibióticos en la infección urinaria pediátrica. Estudio multicéntrico desde Atención Primaria
M.ª Rosa Albañil Ballesterosa, Ana Cubero Santosb, M.ª José Martínez Chamorroc, M.ª Eulalia Muñoz Hiraldod, Josefa Ares Álvareze, Beatriz Morillo Gutiérrezf, M.ª Ángeles Suárez Rodríguezg, Rafael Jiménez Alésh
aPediatra. CS Cuzco . Fuenlabrada. Madrid. España. Miembro GPI AEPap.
bPediatra. CS San Roque. Badajoz. España. Miembro GPI AEPap.
cPediatra. CS Polanco. Cantabria. España. Miembro GPI AEPap.
dPediatra. CS Dr. Castroviejo. Madrid. España. Miembro GPI AEPap.
ePediatra. CS Virgen Peregrina. Pontevedra. España. Miembro GPI AEPap.
fServicio de Pediatría. Hospital de Riotinto. Huelva. España. Miembro GPI AEPap.
gPediatra.CS La Palomera. León. España. Miembro GPI AEPap.
hPediatra. CS Puente Genil. Córdoba. España. Miembro GPI AEPap.
Correspondencia: MR Albañil. Correo electrónico: mralba100@hotmail.com
Cómo citar este artículo: Albañil Ballesteros MR, Cubero Santos A, Martínez Chamorro MJ, Muñoz Hiraldo ME, Ares Álvarez J, Morillo Gutiérrez B, et al. Etiología y resistencia a los antibióticos en la infección urinaria pediátrica. Estudio multicéntrico desde Atención Primaria . Rev Pediatr Aten Primaria. 2024;26:361-72. https://doi.org/10.60147/5d2a9a33
Publicado en Internet: 13-11-2024 - Número de visitas: 12197
Resumen
Introducción: el tratamiento empírico de la infección urinaria (IU) requiere conocer las resistencias a antibióticos de los uropatógenos más frecuentes. El objetivo de este estudio fue identificar los patógenos responsables de IU pediátricas comunitarias, analizar sus resistencias a antibióticos y su relación con las variables estudiadas.
Pacientes y métodos: estudio descriptivo, longitudinal, prospectivo y multicéntrico de ámbito nacional realizado desde las consultas de Pediatría de Atención Primaria. Se recogieron los episodios de IU identificados en los cupos pediátricos (0 a 15 años) de 187 colaboradores (187 058 pacientes), independientemente del lugar en el que se diagnosticaron o trataron, entre el 1/10/2019 y el 31/12/2020.
Resultados: se registraron 588 episodios de IU. Escherichia coli fue el patógeno más frecuente (79,67%), seguido de Proteus spp., Klebsiella spp. y Enterococcus spp. En el 1,50% de los casos, se aislaron enterobacterias productoras de betalactamasas de espectro extendido (BLEE). Los antibióticos orales con menor porcentaje de resistencia fueron cefalosporinas de tercera generación, cefuroxima y fosfomicina (3,88%, 4,81% y 6,30%, respectivamente). Las resistencias a cefalosporinas de primera generación, gentamicina y amikacina fueron 8,69%, 7,55% y 3,23%, respectivamente. Las resistencias a amoxicilina-clavulánico fueron del 23,85% (34,51% en varones) y del 23,40% a cotrimoxazol.
Conclusiones: E. coli fue el patógeno más frecuentemente aislado. Amoxicilina-clavulánico y cotrimoxazol no deben utilizarse empíricamente. Cefalosporinas de segunda y tercera generación y fosfomicina podrían ser (según la edad y el tipo de infección) el antibiótico empírico de elección. Es necesario testar la sensibilidad local a cefalosporinas de primera generación.
Palabras clave
● Infección del tracto urinario ● Programa optimización antimicrobianos ● Resistencia a antibióticosINTRODUCCIÓN
La infección urinaria (IU) se define como el crecimiento de microorganismos en la vía urinaria, acompañado de síntomas clínicos compatibles1. Es una de las infecciones bacterianas más comunes en Pediatría. Alrededor del 2% de los varones y del 8% de las mujeres experimentarán al menos un episodio de IU en los primeros 7 años de vida2. Se observa una mayor incidencia en varones menores de 6 meses y en mujeres a partir del primer año de vida1-4. Las tasas de recurrencia, especialmente notables en lactantes menores de un año y en aquellos con malformaciones en la vía urinaria, alcanzan el 10-15% en los primeros 6-12 meses tras el episodio inicial.
Además de la edad y el sexo, se describen otros factores de riesgo que incluyen anomalías congénitas en el riñón y/o tracto urinario (CAKUT), condiciones que afectan el flujo urinario, reflujo vesicoureteral, fimosis en lactantes varones, sinequias en niñas, disfunción miccional, estreñimiento, vejiga neurógena, instrumentación de la vía urinaria, nefrourolitiasis y actividad sexual en mujeres adolescentes1,3-5. El diagnóstico de IU no está exento de controversia. La definición del número significativo de unidades formadoras de colonias (UFC) carece de consenso. Aunque nuestro estudio sigue los criterios del documento Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria6, otros documentos más recientes reducen dicho número en casos de “alta verosimilitud”1,7, introduciendo un componente subjetivo. Existe consenso para no considerar muestras adecuadas para el urocultivo las obtenidas con bolsa adhesiva.
El tratamiento de la IU suele ser empírico antes de conocer el patógeno y su antibiograma. Por ello, es crucial actualizar periódicamente las resistencias de los uropatógenos comunes en infecciones comunitarias, considerando variaciones según edad, sexo, fiebre o factores de riesgo3. El objetivo de este estudio fue identificar los patógenos responsables de la IU pediátrica desde Atención Primaria (AP) y evaluar su perfil de resistencia a antibióticos.
PACIENTES Y MÉTODOS
Se llevó a cabo un estudio observacional, descriptivo, longitudinal, prospectivo y multicéntrico a nivel nacional, realizado desde las consultas de Pediatría de Atención Primaria (PAP). La participación de los colaboradores se logró mediante una carta de invitación distribuida entre los miembros de la Asociación Española de Pediatría de Atención Primaria (AEPap) y los integrantes de PEDIAP (lista de distribución de correo de REDIRIS), que contaban con 4009 socios y 1020 miembros, respectivamente, en el momento de la distribución.
Se siguieron desde el 1/10/2019 al 31/12/2020 un total de 187 cupos de Pediatría de 15 comunidades autónomas (CC. AA.) distintas. Los colaboradores tenían instrucciones para recoger cualquier episodio diagnosticado de IU en pacientes de su cupo, tanto los diagnosticados por ellos mismos, como en cualquier otro ámbito (hospital, servicios de urgencias o asistencia privada).
Madrid y Castilla y León fueron las CC. AA. más representadas (37,22% y 19,44%, respectivamente), seguidas de Galicia (6,67%), Canarias (6,11%), Aragón (5,57%) y Andalucía (5%). No hubo colaboradores de Murcia, Baleares, Ceuta y Melilla. Todos los participantes ejercían en el sistema público, y el 76,33% lo hacía en entornos urbanos. El número medio de pacientes asignado a cada colaborador era de 1039, 21 pacientes (mediana 1020), atendiendo en conjunto a 187 058 pacientes.
Criterios de inclusión
La población objetivo fueron niños de 0 a 15 años, atendidos en algún momento del proceso diagnóstico, terapéutico o evolutivo en consultas de PAP, independientemente del lugar del diagnóstico. Se recopilaron los episodios diagnosticados como IU según los criterios del documento Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria: clínica compatible más el crecimiento de microorganismos en orina recogida de forma estéril, según cifras detalladas en la Tabla 16.
| Tabla 1. Criterios de bacteriuria significativa | |
|---|---|
| Tipo de muestra | Recuento de colonias (UFC/ml) |
| Punción suprapúbica | Cualquiera |
| Sondaje vesical | ≥10 000 |
| Micción espontánea | ≥100 000 Considerar 10 000-50 000 si hay alta probabilidad clínica de infección urinaria (fiebre + piuria-bacteriuria o en casos de nefropatía) |
|
Tabla tomada de Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria6. |
|

Criterios de exclusión
Episodios de pacientes que no pertenecían al cupo del colaborador, en los que no fue posible realizar seguimiento y en los que no se obtuvo consentimiento informado (CI).
El registro de datos se llevó a cabo de manera anonimizada a través de un formulario de Google.
Las pruebas complementarias recogidas (urocultivo en todos los casos; tira reactiva, análisis sistemático y sedimento de orina) se realizaron en los centros de salud y servicios de Microbiología de referencia, siguiendo los procedimientos habituales en cada centro.
Se registraron como variables: edad, sexo, presencia de fiebre (temperatura axilar >38 °C), factores de riesgo, toma de antibióticos en el mes previo, profilaxis, patógeno identificado y antibiograma. Como factores de riesgo se incluyeron: reflujo vesicoureteral, nefropatía, malformación renal, sondaje vesical, disfunción vesical, estreñimiento, fimosis, sinequias, antecedente de IU previa e hipercalciuria. En la literatura8,9 se refieren posibles diferencias en la etiología y las tasas de resistencia en IU en pacientes con patología nefrourológica. Por ello, y para poder analizar estas posibles diferencias en nuestra serie, consideramos de forma independiente los episodios que presentaron factores de riesgo potencialmente relacionados con patología nefrourológica (grupo 1); se consideró un segundo grupo de episodios en los que figuraba otro factor de riesgo (grupo 2) y un tercer grupo en el que no constaban factores de riesgo.
Se analizaron y compararon las bacterias aisladas y sus tasas de resistencia según edad, sexo, presencia de fiebre y factores de riesgo.
Análisis estadístico
Se utilizó el programa JASP v.0.18.3, expresando las variables cuantitativas en porcentajes, medias y desviación estándar (DS). Para el contraste entre variables cualitativas, la significación estadística se calculó mediante la prueba χ2. En el caso de variables dicotómicas, se empleó la prueba exacta de Fisher.
Aspectos éticos
El estudio, de acuerdo con los postulados de la Declaración de Helsinki, recibió la aprobación del Comité de Ética del Hospital de Fuenlabrada, Madrid (APR 19/03). La inclusión de pacientes se llevó a cabo mediante la obtención del CI de los padres/tutores y de los pacientes mayores de 12 años.
RESULTADOS
Se documentaron un total de 588 episodios, correspondientes a 519 pacientes. En 12 episodios se identificaron dos patógenos, siendo uno de ellos Escherichia coli. De estos 12 episodios, 9 correspondieron a mayores de 2 años, 7 a mujeres, 8 se produjeron en episodios afebriles, 4 en episodios sin factores de riesgo y 10 en el primer episodio recogido en el paciente. Se obtuvieron en total 600 aislamientos. A lo largo del estudio, se registraron 69 episodios sucesivos (más de un episodio en el mismo paciente). Las características clínicas de los episodios y de los pacientes se muestran en la Tabla 2.
| Tabla 2. Características clínicas de los episodios confirmados de IU y los pacientes en los que se presentan | |||
|---|---|---|---|
| Episodios de IU confirmada | Pacientes con IU confirmada | ||
| N | N: 588 (%) | N: 519 (%) | |
| Sexo | Mujeres | 439 (74,66) | 380 (73,21) |
| Edad | <2 años | 189 (32,14) | 176 (33,91) |
|
55 (9,35) | 53 (10,21) | |
|
99 (16,84) | 93 (17,92) | |
|
35 (5,95) | 30 (5,78) | |
| >2 años | 399 (67,86) | 343 (66,09) | |
|
202 (34,35) | 171 (32,95) | |
|
160 (27,21) | 140 (26,98) | |
|
37 (6,29) | 32 (6,17) | |
| Media edad +/- DS (meses) | 56,34 +/- 47,26 | 55,35 +/- 47,56 | |
| Continencia | Continentes | 377 (64,12) | 329 (63,39) |
| Incontinentes por causa patológica | 6 (1,02) | 3 (0,58) | |
| Incontinentes por edad | 205 (34,86) | 187 (36,03) | |
| Factores de riesgo | Total | 258 (43,88) | 198 (38,16) |
| RVU | 39 (6,63) | 24 (4,62) | |
| Malformación renal | 36 (6,12) | 28 (5,39) | |
| ITU previa | 161 (27,38) | 106 (20,42) | |
| Estreñimiento /encopresis | 51 (8,67) | 43 (8,29) | |
| Disfunción vesical | 27 (4,59) | 13 (2,50) | |
| Sondaje vesical | 4 (0,68) | 1 (0,19) | |
| Sinequias | 12 (2,73)* | 10 (2,63)* | |
| Fimosis | 47 (31,97)** | 44 (32,12)** | |
| Hipercalciuria | 3 (0,51) | 2 (0,39) | |
| FR grupo 1 | 123 (20,92) | 90 (17,34) | |
| FR grupo 2 | 135 (22,96) | 108 (20,81) | |
| No FR | 330 (56,12) | 321 (61,85) | |
| Fiebre | 203 (34,52) | ||
| Infecciones mixtas | 12 (2,04) | 12 (2,31) | |
| Episodio único | 519 (88,27) | 464 (89,40) | |
| Profilaxis previa | 25 (4,25) | ||
| Antibiótico mes previo | 76 (12,93) | ||
|
*Respecto al total de mujeres; **Respecto al total de hombres. |
|||

Patógenos más frecuentes
En todos los grupos analizados E. coli fue el patógeno más frecuente. En la muestra global, en ambos sexos, mayores de 2 años y episodios afebriles, los siguientes en frecuencia fueron Proteus spp., Klebsiella spp. y Enterococcus spp.
En pacientes sin factores de riesgo o con factores de riesgo del grupo 2, Proteus spp. fue también el segundo patógeno más frecuente.
En menores de 2 años, episodios febriles y pacientes con factores de riesgo del grupo 1, Klebsiella spp. fue el segundo patógeno en frecuencia.
En 10 episodios se aisló Staphylococcus saprophyticus. Todos en episodios afebriles y en pacientes mayores de 2 años, 8 en mujeres y todos en pacientes sin factores de riesgo, excepto una infección mixta en paciente con antecedentes de IU previas, disfunción vesical, retención urinaria y estreñimiento/encopresis. Todos los aislamientos tuvieron nitritos negativos en el sistemático.
La distribución de los patógenos en todos los grupos se detalla en las Tablas 3 y 4.
| Tabla 3. Patógenos aislados en el total de episodios, según sexo y según edad | |||||
|---|---|---|---|---|---|
| Aislamientos en muestra global | Aislamientos según sexo N: 598† | Aislamientos según edad N: 600 | |||
| Patógeno | N: 600 | Hombre | Mujer | <2 años | >2 años |
| 152 | 446 | 192 | 408 | ||
| Total (%) | Total (%) | Total (%) | Total (%) | Total (%) | |
| E. coli | 478 (79,67) | 107 (70,39) | 369 (82,74)** | 162 (84,38) | 316 (77,45) |
| Proteus spp. | 44 (7,33) | 19 (12,5)* | 25 (5,61) | 3 (1,56) | 41 (10,05)*** |
| Klebsiella spp. | 30 (5) | 8 (5,26) | 22 (4,93) | 16 (8,33)* | 14 (3,43) |
| Enterococcus spp. | 18 (3) | 7 (4,61) | 11 (2,47) | 4 (2,08) | 14 (3,43) |
| S. saprophyticus | 10 (1,67) | 2 (1,32) | 8 (1,79) | 0 (0) | 10 (2,45)* |
| Citrobacter spp. | 6 (1) | 3 (1,97) | 3 (0,67) | 2 (1,04) | 4 (0,98) |
| Otros BGN | 9 (1,5) | 5 (3,29)* | 4 (0,91) | 5 (2,60) | 4 (0,98) |
| Otros cocos GP | 5 (0,83) | 1 (0,66) | 4 (0,91) | 0 (0) | 5 (1,23) |
|
†En dos pacientes no se registró el sexo. *p <0,05; **p <0,005; ***p < 0,001. |
|||||

| Tabla 4. Frecuencia de patógenos aislados en episodios febriles y no febriles y según la presencia de factores de riesgo | |||||
|---|---|---|---|---|---|
| Patógenos | Aislamientos según existencia de fiebre | Aislamientos según factores de riesgo | |||
| En episodios afebriles | En episodios febriles | En episodios con factores de riesgo grupo 1 | En episodios con factores de riesgo grupo 2 | En episodios sin factores de riesgo | |
| N: 393 | N: 207 | N: 128 | N: 138 | N: 334 | |
| Total (%) | Total (%) | Total (%) | Total (%) | Total (%) | |
| E. coli | 298 (75,83) | 180 (86,96)** | 93 (72,66) | 111 (80,43) | 274 (82,04) |
| Proteus spp. | 41 (10,43)** | 3 (1,45) | 6 (4,69) | 12 (8,70) | 26 (7,78) |
| Klebsiella spp. | 17 (4,33) | 13 (6,28) | 11 (8,59)* | 9 (6,52) | 10 (2,99) |
| Enterococcus spp. | 13 (3,31) | 5 (2,42) | 8 (6,25)* | 2 (1,45) | 8 (2,40) |
| S. saprophyticus | 10 (2,54)* | 0 | 1 (0,78) | 0 | 9 (2,69) |
| Citrobacter spp. | 4 (1,01) | 2 (0,97) | 2 (1,56) | 1 (0,72) | 3 (0,90) |
| Otros BGN | 6 (1,53) | 3 (1,45) | 4 (3,13)* | 3 (2,17) | 2 (0,60) |
| Otros cocos GP | 4 (1,02) | 1 (0,48) | 3 (2,34) | 0 | 2 (0,60) |
|
*p <0,05; **p <0,001. Se consideran factores de riesgo del grupo 1 uno o más de: reflujo vesicoureteral, nefropatía, malformación renal, sondaje vesical, disfunción vesical o estreñimiento. Se consideran factores de riesgo del grupo 2 uno o más de: fimosis, sinequias, antecedente de ITU previa o hipercalciuria. |
|||||

Cifras de resistencias microbianas
Las tasas de resistencia a los antibióticos más utilizados en el tratamiento de la IU se presentan en las Tablas 5 y 6 y la Figura 1, tanto para el total de episodios como por grupos y para el agente etiológico más frecuente (E. coli).
| Tabla 5. Resistencias a antibióticos en el total de episodios, según sexo y edad | |||||
|---|---|---|---|---|---|
| Resistencias en muestra global | Resistencias según sexo | Resistencias según edad | |||
| Antibiótico | N: 600 | Hombre N: 152† | Mujer N: 446† | <2 años N: 192 | >2 años N: 408 |
| Antibiogramas (% R) | Antibiogramas (% R) | Antibiogramas (% R) | Antibiogramas (% R) | Antibiogramas (% R) | |
| Amoxicilina | 517 (46,42%) | 123 (54,47%)* | 392 (43,88%) | 166 (51,20%) | 351 (44,16%) |
| Amox-clav | 457 (23,85%) | 113 (34,51%)** | 343 (20,41%) | 148 (28,38%) | 309 (21,68%) |
| Piper-tazobactam | 94 (4,26%) | 26 (7,69%) | 68 (2,94%) | 31 (0%) | 60 (6,67%) |
| Cefalotina/Cefazolina | 69 (8,69%) | 17 (11,76%) | 52 (7,69%) | 24 (12,5%) | 45 (6,67%) |
| Cefoxitina | 106 (7,55%) | 28 (7,41%) | 78 (7,69%) | 34 (14,71%) | 72 (4,17%) |
| Cefuroxima | 478 (4,81%) | 112 (6,25%) | 364 (4,40%) | 156 (4,49%) | 322 (4,97%) |
| Cefotaxima ceftriaxona |
258 (3,88%) | 72 (2,78%) | 185 (4,32%) | 96 (3,13%) | 162 (4,32%) |
| Ceftazidima | 154 (3,90%) | 39 (5,13%) | 115 (3,48%) | 58 (3,45%) | 96 (4,17%) |
| Cefepime | 148 (2,70%) | 35 (5,71%) | 112 (1,79%) | 49 (2,04%) | 99 (3,03%) |
| Fosfomicina | 524 (6,30%) | 118 (9,32%) | 404 (5,45%) | 157 (3,82%) | 367 (7,36%) |
| Nitrofurantoina | 478 (8,37%) | 108 (14,81%)* | 368 (6,52%) | 148 (5,41%) | 330 (9,70%) |
| Cotrimoxazol | 513 (23,40%) | 124 (29,84%) | 387 (21,45%) | 160 (25,63%) | 353 (22,38%) |
| Trimetoprim | 44 (18,18%) | 10 (30,00%) | 34 (14,71%) | 18 (22,22%) | 26 (15,38%) |
| Ciprofloxacino ofloxacina |
314 (9,87%) | 68 (10,29%) | 245 (9,80%) | 97 (6,19%) | 217 (11,52%) |
| Norfloxacino | 160 (13,13%) | 34 (8,82%) | 126 (14,29%) | 46 (10,87%) | 114 (14,04%) |
| A. Nalidíxico | 88 (23,86%) | 15 (26,67%) | 72 (23,61%) | 26 (19,23%) | 62 (25,81%) |
| Amikacina | 93 (3,23%) | 23 (4,35%) | 70 (2,86%) | 34 (0%) | 59 (5,08%) |
| Gentamicina | 477 (7,55%) | 121 (10,74%) | 354 (6,50%) | 160 (6,25%) | 317 (8,20%) |
| Vancomicina | 25 (8,00%) | 4 (0%) | 21 (9,52%) | 11 (9,09%) | 14 (7,14%) |
| Meropenem | 128 (2,34%) | 31 (3,23%) | 97 (2,06%) | 48 (0%) | 80 (3,75%) |
| Ticarcilina | 30 (40%) | 7 (42,86%) | 23 (39,13%) | 14 (21,43%) | 16 (56,25%) |
| BLEE | 9 (1,50%) | 3 (2,08%) | 6 (1,40%) | 5 (2,70%) | 4 (1,03%) |
|
†En dos pacientes no se registró el sexo. *p <0,05; **p <0,005. BLEE: cepa productora de betalactamasas de espectro extendido; R: resistencia. |
|||||

| Tabla 6. Resistencias a antibióticos según existencia de fiebre y factores de riesgo | |||||
|---|---|---|---|---|---|
| Resistencias según existencia de fiebre | Resistencias según factores de riesgo | ||||
| Antibióticos | Aislamientos en episodios febriles N: 207 |
Aislamientos en episodios afebriles N: 393 |
Aislamientos en episodios con factores de riesgo grupo 1 N: 128 |
Aislamientos en episodios con factores de riesgo grupo 2 N: 138 |
Aislamientos en episodios sin factores de riesgo N: 334 |
| Antibiogramas (% R) | Antibiogramas (% R) | Antibiogramas (% R) | Antibiogramas (% R) | Antibiogramas (% R) | |
| Amoxicilina | 179 (47,49%) | 338 (45,86%) | 110 (57,27%)* | 120 (37,50%) | 287 (45,99%) |
| Amox-clav | 157 (26,11%) | 300 (22,67%) | 97 (26,80%) | 104 (22,12%) | 256 (23,44%) |
| Piperacilin-tazobactan | 37 (2,70%) | 57 (5,26%) | 22 (9,09%) | 23 (0%) | 49 (4,08%) |
| Cefalotina/Cefazolina | 31 (6,45%) | 38 (10,53%) | 15 (13,33%) | 14 (14,29%) | 40 (5,00%) |
| Cefoxitina | 36 (13,89%) | 70 (4,29%) | 18 (11,11%) | 26 (7,69%) | 62 (6,45%) |
| Cefuroxima | 167 (5,99%) | 311 (4,18%) | 97 (9,28%)* | 110 (2,73%) | 271 (4,06%) |
| Cefotaxima ceftriaxona |
103 (5,83%) | 155 (2,58%) | 52 (5,77%) | 58 (3,45%) | 148 (3,38%) |
| Ceftazidima | 66 (7,58%) | 88 (1,14%) | 35 (5,71%) | 36 (0%) | 83 (4,82%) |
| Cefepime | 60 (6,67%)* | 88 (0%) | 30 (6,67%) | 37 (0%) | 81 (2,47%) |
| Fosfomicina | 175 (2,86%) | 349 (8,02%)* | 107 (9,35%) | 118 (2,54%) | 299 (6,69%) |
| Nitrofurantoína | 162 (4,32%) | 316 (10,44%)* | 91 (8,79%) | 114 (7,02%) | 273 (8,79%) |
| Cotrimoxazol | 167 (20,96%) | 346 (24,57%) | 101(29,70%) | 116 (17,24%) | 296 (23,65%) |
| Trimetoprim | 23 (21,74%) | 21 (14,29%) | 5 (20,00%) | 11 (9,09%) | 28 (21,43%) |
| Ciprofloxacino ofloxacino |
111 (7,21%) | 203 (11,33%) | 58 (5,17%) | 81 (13,58%) | 175 (9,71%) |
| Norfloxacino | 55 (14,55%) | 105 (12,39%) | 27 (7,41%) | 42 (19,05%) | 91 (12,09%) |
| A. Nalidíxico | 37 (16,22%) | 51 (29,41%) | 12 (25,00%) | 16 (37,50%) | 60 (20,00%) |
| Amikacina | 39 (7,70%) | 54 (0%) | 20 (10,00%) | 21 (0%) | 52 (1,92%) |
| Gentamicina | 168 (7,14%) | 309 (7,77%) | 102 (8,82%) | 113 (7,08%) | 262 (7,25%) |
| Vancomicina | 10 (20%) | 15 (0%) | 5 (20,00%) | 2 (0%) | 18 (5,56%) |
| Meropenem | 55 (5,45%) | 73 (0%) | 31 (6,45%) | 28 (0%) | 69 (1,45%) |
| Ticarcilina | 19 (26,32%) | 11 (63,64%) | 6 (50,00%) | 6 (16,67%) | 18 (44,44%) |
| BLEE | 4 (2,02%) | 5 (1,33%) | 1 (0,82%) | 3 (2,29%) | 5 (1,55%) |
|
*p <0,05. Se consideran factores de riesgo del grupo 1 uno o más de: reflujo vésicoureteral, nefropatía, malformación renal, sondaje vesical, disfunción vesical o estreñimiento. Se consideran factores de riesgo del grupo 2 uno o más de: fimosis, sinequias, antecedente de ITU previa o hipercalciuria. BLEE: cepa productora de betalactamasas de espectro extendido; R: resistencia. |
|||||

| Figura 1. Antibiogramas en aislamientos de E. coli. La línea roja marca la cifra del 15% de resistencias, cifra por encima de la cual se desaconseja la utilización empírica de un antibiótico |
|---|
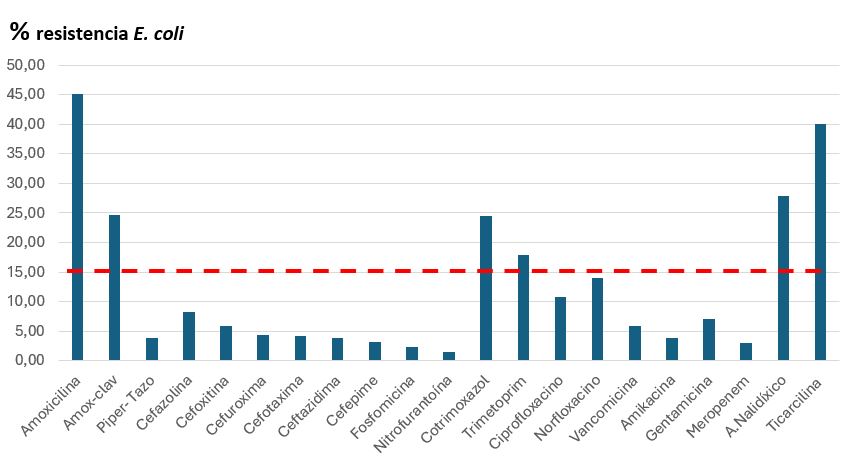 |

En el conjunto de episodios, las cefalosporinas de tercera generación, cefuroxima y fosfomicina fueron los antibióticos orales con menor porcentaje de resistencias (3,88%, 4,81% y 6,30%, respectivamente).
La tasa de resistencia a amoxicilina-clavulánico fue del 23,85%, (34,51% en varones) y del 23,40% frente a cotrimoxazol. Las resistencias a cefalosporinas de primera generación fueron del 8,69%; a nitrofurantoína, del 8,37% (14,81% en varones); a gentamicina, del 7,55%; y a amikacina, del 3,23%.
Según los grupos considerados, se detectó que en varones las cifras de resistencias a amoxicilina, amoxicilina-clavulánico y nitrofurantoína fueron significativamente más elevadas que en el resto. En episodios afebriles fueron significativamente más elevadas frente a fosfomicina y nitrofurantoína; en episodios febriles frente a cefepime y en pacientes con factores de riesgo potencialmente relacionados con nefropatía las resistencias fueron significativamente más elevadas frente a cefuroxima y amoxicilina.
No se encontraron diferencias significativas en relación con la edad.
En 9 aislamientos (1,5% de los episodios), se identificaron enterobacterias productoras de betalactamasas de espectro extendido (BLEE). Solo una corresponde a un episodio en el que el paciente mantenía profilaxis y había recibido antibiótico en el mes previo.
En 96 episodios (16,33% del total), los pacientes referían tratamiento antibiótico en el mes anterior y/o profilaxis antibiótica. En 20 episodios (3,40% del total), el paciente recibía profilaxis, pero no antibiótico en el mes anterior. Y en 71 episodios (12,07% del total), recibió antibiótico previo, pero no profilaxis.
Las cifras de resistencias también se calcularon en las distintas CC. AA., pero el reducido número de muestras en algunas impide la obtención de datos valorables.
DISCUSIÓN
En este estudio realizado desde AP en el que se estudian 588 episodios de IU pediátrica, los resultados obtenidos confirmaron a E. coli como el principal uropatógeno, responsable de casi el 80% de los episodios de IU. Estos hallazgos están en línea con publicaciones recientes en España que informan del 80,75%10 y 76,9%11, respectivamente, y superan las cifras de estudios previos (58,9-64%)12-15. Este aumento podría vincularse a un mayor porcentaje de casos procedentes de AP en nuestra serie (65,40%) en comparación con otros estudios (53%13 y 55,1%12). Los siguientes en frecuencia, Proteus spp. y Klebsiella spp., concuerdan con otras publicaciones españolas10-12.
Cabe señalar que si bien E. coli fue el uropatógeno más frecuente en todos los grupos considerados, hubo un porcentaje de IU, variable según el grupo considerado y que alcanza casi el 30% en varones y en episodios con factores de riesgo del grupo 1, en el que el patógeno responsable fue otro.
En nuestro estudio, no se definió el criterio de localización de la IU (alta o baja), pero sí la presencia de fiebre (episodios febriles y no febriles). Como en otras series10, la mayoría de los casos de IU febril fueron causados por E. coli (86,96%), seguido de Klebsiella spp., superando ampliamente a otros patógenos.
E. coli se aisló en el 72,66% de los episodios en pacientes con factores de riesgo del grupo 1, seguido por Klebsiella spp. (8,59%), Enterococcus spp. (6,25%) y Proteus spp. (4,69%). Estos resultados coinciden con la distribución publicada por Chamorro y cols.8, y difieren de la serie de Oltra-Benavent y cols., donde se observó un mayor número de episodios producidos por microorganismos distintos a E. coli (46,8%)9. Ambas series corresponden a pacientes con pielonefritis y patología nefrourológica, pero en la última, el 25,5% de los episodios presenta antecedentes de cirugía urológica.
No se observaron diferencias significativas en los aislamientos en niños con o sin fimosis.
S. saprophyticus representó el 1,67% de los aislamientos. Dada su infrecuente formación de nitritos y mayor frecuencia en adolescentes sexualmente activas16, se sugiere considerar la realización de urocultivos ante la sospecha de IU en este grupo, incluso en ausencia de nitritos en la tira reactiva de orina.
En el 2,04% de los episodios, se aislaron dos patógenos. Aunque la presencia de dos patógenos en un cultivo de orina sugiere contaminación4,5, según la literatura se recomienda valorar estos cultivos como verdadera IU, teniendo en cuenta datos clínicos: IU complicada o no, técnica de obtención de muestra, tipo de aislados (uropatógeno o saprófito), presencia de piuria, etc.5,17. Nuestro valor es ligeramente superior al referido en otro estudio español11.
Las resistencias a amoxicilina-clavulánico y cotrimoxazol fueron muy importantes (23,85% y 23,40%) y, por tanto, no se deberían emplear empíricamente salvo disponer de datos locales de resistencia inferiores. El mejor perfil de sensibilidad correspondió a cefuroxima, cefixima y fosfomicina, que podrían ser (según edad y tipo de infección) el antibiótico de elección hasta conocer el antibiograma.
Nuestros datos en relación con el porcentaje de resistencias coincidieron y, en algunos casos, superaron las cifras de resistencias previamente publicadas11-16,18. Es relevante destacar la elevada cifra de resistencias a amoxicilina-clavulánico, superando el 30% en algún grupo, probablemente debido a un uso generalizado del mismo, ya sea por elección inadecuada o por desabastecimiento de otros antibióticos de menor espectro. Esta cifra lo descartaría para su uso empírico en IU, atendiendo a la recomendación de evitar aquellos antibióticos que superen el umbral del 15% de resistencias1. Según nuestros datos, amoxicilina, amoxicilina/clavulánico, cotrimoxazol, trimetoprima y ácido nalidíxico no deben utilizarse como tratamiento empírico de la IU.
Las opciones terapéuticas para la IU están limitadas por problemas recurrentes de abastecimiento de cefuroxima axetilo y las restricciones para utilizar tanto fosfomicina, con buen perfil de sensibilidad, pero recomendada solo para mayores de 12 años19, como nitrofurantoina (solo admitida por la Agencia Española de Medicamentos y Productos Sanitarios para el tratamiento de cistitis no complicada en mujeres mayores de 3 meses)20. Esto obligaría a recurrir en menores de 12 años a cefalosporinas de tercera generación como tratamiento empírico de elección, incluso para el tratamiento de IU de vía baja.
En este contexto, resulta interesante señalar las cifras de resistencia a cefalosporinas de primera generación, inferiores a las publicadas previamente13,18, aunque el bajo número de antibiogramas en que se testaron (67 en comparación a 474 para cefalosporinas de segunda generación) requiere precaución y la necesidad de realizar nuevos estudios que aporten datos locales, a los cuales debe ajustarse la prescripción empírica, tal y como recomienda la Guía de Práctica Clínica recientemente publicada en nuestro país21.
También se observó una menor tasa de resistencia a amikacina (3,33%) que a gentamicina (7,55%), posiblemente debido a su uso más restringido.
En cuanto a las quinolonas, a pesar de su indicación excepcional en Pediatría, se observa una cifra de resistencias significativa.
Un aspecto particular dentro del problema de las resistencias a antimicrobianos es el aumento de infecciones urinarias por E. coli productor de BLEE adquiridas en la comunidad. Hay estudios que muestran un incremento de hasta el 3,54% en los últimos años, con un crecimiento anual del 0,51%22. Nuestro dato (1,50%) está en concordancia con lo publicado en España12-14,18, aunque también se han descrito cifras tan elevadas como el 17% en series con un alto porcentaje de pacientes con patología nefrourológica9,23. De los 9 aislamientos identificados en nuestro estudio, solo uno se presentó en un paciente con patología nefrourológica.
En cuanto a las resistencias en las diferentes CC. AA., se observan variaciones, pero el reducido número de muestras en algunas limita la extrapolación de resultados significativos.
Nuestro estudio presenta limitaciones: los datos obtenidos pueden no ser representativos de todas las CC. AA. por la desigual participación de las mismas. De un total de 404 colaboradores inicialmente inscritos, solo pudieron participar en el estudio 187. Esto se debió, en parte, a obstáculos burocráticos, habituales en estudios multicéntricos24, a pesar de tratarse de un estudio observacional.
El número de antibiogramas en que se testó cada antibiótico fue variable, aunque puede considerarse suficiente para los antibióticos utilizados más frecuentemente en infecciones comunitarias.
Gran parte del estudio coincidió con la pandemia por COVID-19. El estado de alarma se declaró a los 5 meses y medio de su inicio y los cambios en la asistencia pudieron influir en la recogida de datos, en el manejo de los episodios y en el número total de IU diagnosticadas adecuadamente. En los meses finales del estudio pudo haberse producido una disminución en el número de registros debido a la sobrecarga asistencial tras la reanudación de la actividad presencial, en coexistencia con las distintas olas pandémicas.
Si bien se recomienda conocer los datos actualizados de resistencia locales, es muy difícil en la práctica disponer de un número suficiente de cultivos pediátricos en un área próxima al paciente. Es más habitual que se suministren datos sin desglosar por edades ni por origen de las muestras (comunitaria u hospitalaria). Por eso creemos que los datos obtenidos en nuestro estudio, con sus limitaciones, resultan de interés para la práctica de los pediatras de AP.
CONCLUSIONES
Como conclusiones de nuestro estudio podemos decir que el uropatógeno más frecuentemente responsable de IU sigue siendo E. coli, aunque en determinados grupos puede ser necesario considerar otras bacterias. Amoxicilina, amoxicilina-clavulánico, cotrimoxazol, trimetoprima y ácido nalidíxico no deben utilizarse como tratamiento empírico. Es necesario testar la sensibilidad local a cefalosporinas de primera generación, antibióticos no considerados actualmente como de elección.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo. El presente estudio ha recibido una beca otorgada por la Asociación Española de Pediatría de Atención Primaria - Fundación para la Salud (AEPap-FPS) para Investigación en Atención Primaria en 2019.
RESPONSABILIDAD DE LOS AUTORES
Contribución de los autores: redacción del texto (MRAB, ACS), tratamiento estadístico de los datos (RJA), diseño del proyecto, coordinación con los colaboradores, búsqueda bibliográfica y revisión final del manuscrito (todos).
Los datos preliminares y parciales de este estudio se presentaron como comunicación en el 19 Congreso de Actualización en Pediatría de AEPap en 2023.
ABREVIATURAS
AP: Atención Primaria · BGN: bacilos Gram negativos · BLEE: betalactamasas de espectro ampliado · CC. AA.: comunidades autónomas · CI: consentimiento informado · DS: desviación estándar · IU: infección urinaria · GP: Gram positivos · PAP: Pediatría de Atención Primaria · UFC: unidades formadoras de colonias.
AGRADECIMIENTOS
A todos los colaboradores que han participado en la inclusión y registro de casos.
BIBLIOGRAFÍA
- González Rodríguez JD, Justa Roldán MJ. Infección de las vías urinarias en la infancia. Protoc diagn ter pediatr. 2022;1:103-29.
- Redondo Sánchez J, Domínguez Lázaro AM, Rodríguez Barrientos R, Barrio Cortes J, Seoane Sanz J, Bravo Acuña JJ, et al. Tendencias en la hospitalización por infección del tracto urinario en la población pediátrica de España en el período 2000-2015. An Pediatr (Barc). 2023;98:175-84. https://doi.org/10.1016/j.anpede.2023.01.009
- Tullus K, Shaikh N. Urinary tract infections in children. 2020;395:1659-68. https://doi.org/10.1016/s0140-6736(20)30676-0
- Mattoo TK, Shaikh N, Nelson CP. Contemporary Management of Urinary Tract Infection in Children. Pediatrics. 2021;147:e2020012138. https://doi.org/10.1542/peds.2020-012138
- Buettcher M, Trueck J, Niederer-Loher A, Heininger U, Agyeman P, Asner S, et al. Swiss consensus recommendations on urinary tract infections in children. Eur J Pediatr. 2021;180:663-74. https://doi.org/10.1007/s00431-020-03714-4
- Piñeiro Pérez R, Cilleruelo Ortega MJ, Ares Álvarez J, Baquero Artigao F, Silva Rico JC, Velasco Zúñiga R, et al. Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria. An Pediatr(Barc). 2019;90:400.e1-e9. https://doi.org/10.1016/j.anpedi.2019.02.009
- Brandström P, Lindén M. How Swedish guidelines on urinary tract infections in children compare to Canadian, American and European guidelines. Acta Paediatr. 2021;110:1759-71. https://doi.org/10.1111/apa.15727
- Chamorro Sanz N, Ferreiro-Mazón García-Plata P, García Espinosa L, Ruíz Domínguez JA, Molina Gutiérrez MA. Infección urinaria febril en el niño con patología nefrourológica. An Pediatr (Barc). 2021;95:391-2. http://doi.org/10.1016/j.anpedi.2021.03.011
- Oltra Benavent M, Ferrer Lorente B, Ródenas Moreno M, Torrejón Rodríguez L. Selección del tratamiento antibiótico empírico en pielonefritis según el perfil del paciente [Selection of empirical antibiotic treatment in pyelonephritis according to the patient's profile]. An Pediatr (Engl Ed). 2020;92:181-2. http://doi.org/10.1016/j.anpedi.2019.09.012
- Martínez Campos L, Carazo Gallego B, Berghezan Suárez A, Álvarez Ares J, Cruz Cañete M, Olmedo Díaz I. Características clínicas y microbiológicas de una muestra de 1200 urocultivos pediátricos. En: Asociación Española de Pediatría. Libro de ponencias y Comunicaciones 67 Congreso AEP (p. 551-552) [en línea] [consultado el 05/11/2024]. Disponible en www.congresoaep.org/static/upload/ow28/events/ev231/Site/files/libro/551/
- Vázquez Pérez A, Alonso Acero L, Baquero Artigao F, De Pablos Gómez M, Calvo C. Infección urinaria comunitaria: etiología, resistencias y perfil del paciente en un hospital de referencia. An Pediatr(Barc). 2022;96:77-80. https://doi.org/10.1016/j.anpedi.2021.06.015
- Rodríguez Lozano J, De Malet A, Cano ME, De la Rubia L, Wallmann R, Martínez Martínez L, et al. Antimicrobial susceptibility of microorganisms that cause urinary tract infections in pediatric patients. Enferm Infecc Microbiol Clin. 2018;36:417-22. https://doi.org/10.1016/j.eimc.2017.08.003
- Moya Dionisio V, Díaz Zabala M, Ibáñez Fernández A, Suárez Leiva P, Martínez Suárez V, Ordóñez Álvarez FA, et al. Patrón de aislamiento bacteriano y sensibilidad antimicrobiana en urocultivos positivos obtenidos de una población pediátrica. Rev Esp Quimioter. 2016;29:146-50.
- Artero López J, Gutiérrez Soto B, Expósito Ruiz M. Etiología de las infecciones urinarias en nuestra Área Sanitaria y perfil de sensibilidad de los uropatógenos más frecuentes. Arch Esp Urol. 2021;74:197-207.
- Sorlózano Puerto A, Gómez Luque JM, Luna del Castillo JD, Navarro Marí JM, Gutiérrez Fernández J. Etiological and Resistance Profile of Bacteria Involved in Urinary Tract Infections in Young Children. Biomed Res Int. 2017;2017:4909452. https://doi.org/10.1155/2017/4909452
- Lo DS, Shieh HH, Barreira ER, Ragazzi SL, Gilio AE. High Frequency of Staphylococcus Saprophyticus Urinary Tract Infections Among Female Adolescents. Pediatr Infect Dis J. 2015;34:1023-5. https://doi.org/10.1097/INF.0000000000000780
- Zboromyrska Y, De Cueto López M, Alonso Tarrés C, Sánchez Hellín V. Diagnóstico microbiológico de las infecciones del tracto urinario. Zboromyrska Y (coord.). Procedimientos en Microbiología Clínica. Cercenado Mansilla E, Cantón Moreno R (eds.). Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. (SEIMC). 2019 [en línea] [consultado el 05/11/2024]. Disponible en https://seimc.org/contenidos/documentoscientificos/procedimientosmicrobiologia/seimc-procedimiento14a.pdf
- Martínez Campos L, Carazo Gallego B, Piñeiro Pérez R, Méndez Hernández M, Conejo Fernández A. Perfil de sensibilidad a antimicrobianos de las bacterias causantes de infección urinaria de la comunidad en la población pediátrica española. En: Asociación Española de Pediatría. Libro de ponencias y Comunicaciones 67 Congreso AEP (p. 616-617) [en línea] [consultado el 05/11/2024]. Disponible en www.congresoaep.org/static/upload/ow28/events/ev231/Site/files/libro/616/
- Recomendaciones para restringir el uso de los antibióticos con fosfomicina (EMA/317719/2020). En: Agencia Europa de Medicamentos (EMA) [en línea] [consultado el 05/11/2024]. Disponible en www.ema.europa.eu/en/documents/referral/fosfomycin-article-31-referral-recommendations-restrict-use-fosfomycin-antibiotics_es.pdf
- Nitrofurantoína (FURANTOÍNA®): nuevas restricciones de uso. En: Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ministerio de Sanidad, Asuntos Sociales e Igualdad [en línea] [consultado el 05/11/2024]. Disponible en www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2016/docs/NI-MUH_FV_16-nitrofurantoina.pdf
- Grupo de trabajo de la Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Guía de Práctica Clínica. Infección del Tracto Urinario en la Población Pediátrica. Actualización 2024 [en línea] [consultado el 05/11/2024]. Disponible en https://serviciopediatria.com/wp-content/uploads/2024/05/2024_GPC-Infeccion-Tracto-Urinario-en-Pediatria.pdf
- Collingwood JD, Yarbrough AH, Boppana SB, Dangle PP. Increasing Prevalence of Pediatric Community-acquired UTI by Extended Spectrum β-Lactamase-producing E. coli: Cause for Concern. Pediatr Infect Dis J. 2023;42:106-9. https://doi.org/10.1097/INF.0000000000003777
- Pérez Heras I, Sanchez Gomez JC, Beneyto Martin P, Ruano de Pablo L, Losada Pinedo B. Community-onset extended-spectrum β-lactamase producing Escherichia coli in urinary tract infections in children from 2015 to 2016: Prevalence, risk factors, and resistances. Medicine (Baltimore). 2017;96:e8571. https://doi.org/10.1097/MD.0000000000008571
- Balaguer Martínez JV, Ciriza Barea E, Carballal Mariño M, García Vera C; Grupo de Investigación y Red de Investigación en Pediatría de Atención Primaria (PAPenRed) de la Asociación Española de Pediatría de Atención Primaria (AEPap). Research in pediatrics: A long bureaucratic obstacle course. An Pediatr (Engl Ed). 2023;99:153-4. https://doi.org/10.1016/j.anpede.2023.06.017





