Vol. 25 - Num. 100
Originales
Faringoamigdalitis y estreptococo, ¿enemigo o colonizador?
Celia Rasero Bellmunta, Germán Lloret Ferrándizb, Javier González de Diosc
aServicio de Pediatría. Hospital General Universitario Dr. Balmis. Alicante. España.
bServicio de Pediatría. Hospital General Universitario Dr. Balmis. ISABIAL-Instituto de Investigación Sanitaria y Biomédica. Alicante. España.
cServicio de Pediatría. Hospital General Universitario Dr. Balmis. Departamento de Pediatría. Universidad Miguel Hernández. ISABIAL-Instituto de Investigación Sanitaria y Biomédica. Alicante. España.
Correspondencia: C Rasero. Correo electrónico: celiarasero68@gmail.com
Cómo citar este artículo: Rasero Bellmunt C, Lloret Ferrándiz G, González de Dios J. Faringoamigdalitis y estreptococo, ¿enemigo o colonizador? . Rev Pediatr Aten Primaria. 2023;25:e105-e111. https://doi.org/10.60147/c47a3ba2
Publicado en Internet: 14-11-2023 - Número de visitas: 18836
Resumen
Introducción: la principal etiología de la faringoamigdalitis aguda (FAA) es vírica, y entre la bacteriana, Streptococcus pyogenes constituye un colonizador no despreciable de la población pediátrica sana. El objetivo del estudio es conocer el modo de utilización del test de diagnóstico rápido estreptocócico (TDR) en los servicios de urgencias pediátricas para poder optimizar su uso, reducir el sobrediagnóstico de las FAA estreptocócicas (FAAE) y la prescripción de antibióticos.
Material y métodos: se recoge la información retrospectiva del número de TDR realizados a los pacientes atendidos en el servicio de urgencias pediátricas de un hospital terciario, desde enero de 2022 a enero de 2023 (ambos inclusive). También se ha recogido información acerca de a cuántos se les había practicado más de un TDR y el tiempo transcurrido.
Resultados: durante los 13 meses estudiados se realizaron un total de 1610 TDR (43% en <5 años). Se realizó más de un TDR a 89 pacientes (53% en <5 años) y el 40% de estos se llevaron a cabo en los primeros 40 días.
Discusión: las pruebas microbiológicas para detectar Streptococcus pyogenes no son capaces de diferenciar entre infección activa y estado de portador sano. Según los resultados de nuestro estudio parece existir un uso inadecuado de los TDR; la mayoría de las pruebas se realizan en <5 años, donde la etiología estreptocócica es menos frecuente y el estado de portador sano predominante. Esto conlleva un sobrediagnóstico de la FAAE, sobretratamiento antibiótico, aparición de efectos adversos y resistencias bacterianas.
Palabras clave
● Streptococcus pyogenes ● Faringoamigdalitis aguda ● Portador sano ● Test de diagnóstico rápidoINTRODUCCIÓN
Se ha comenzado el año 2023 con algunos titulares de los periódicos donde se exaltaba la preocupación sociosanitaria por los casos de infección estreptocócica invasiva. Todo ello emana de una alerta en Reino Unido1, a 2 de diciembre de 2022, sobre un incremento de las infecciones por Streptococcus pyogenes (EBHGA, estreptococo beta-hemolítico del grupo A): de 186 casos en la semana 46 a 851 casos en dicha semana. De estas infecciones, han predominado aquellas más frecuentes en la población pediátrica, tales como amigdalitis o escarlatina. No obstante, de forma paralela, se ha apreciado un incremento en las infecciones invasivas por esta bacteria, suponiendo en niños menores de 10 años una incidencia de 2,3 casos por 100 000 niños de 1 a 4 años comparados con la media de 0,5 en los años prepandemia (2017 a 2019) y 1,1 casos por 100 000 niños de 5 a 9 años comparado con la media prepandemia de 0,3 (2017 a 2019) en el mismo periodo del año. Cabe recordar que se consideran infecciones invasivas por EBHGA a la neumonía, artritis séptica, fascitis necrotizante, sepsis y shock séptico, principalmente. Desde la Sociedad Española de Infectología Pediátrica (SEIP) se nos invita a participar en un estudio multicéntrico a nivel nacional, para el estudio de estas infecciones.
Los estreptococos son bacterias que pueden ser hemolíticas, hecho que motivó su clasificación por Schötmuller y Brown, según si eran productores de hemólisis o no (hemólisis completa, β; hemólisis incompleta, α; ausencia de hemólisis, γ). Gracias a los esfuerzos posteriores de Lancefield, se han clasificado según la composición de los hidratos de carbono de su pared celular (existen 20 grupos, de la A a la H y de la K a la V)2. EBHGA es causante de cuadros infectocontagiosos muy asiduos en población pediátrica, tales como impétigo, celulitis, fascitis necrotizante, complicaciones supurativas (abscesos periamigdalinos, linfadenitis, otitis media, sinusitis), complicaciones no supurativas (glomerulonefritis estreptocócica, fiebre reumática, síndrome PANDAS) y, por supuesto, la faringoamigdalitis estreptocócica.
La faringoamigdalitis aguda (FAA) es uno de los motivos más frecuentes de consulta en Pediatría y de uso inapropiado de antibióticos3. La FAA está causada principalmente por virus (en torno a un 75-80% de los casos) y el resto son debidos a bacterias, donde la principal protagonista es el EBHGA (responsable del 3-7% de las FAA en niños menores de 2 años, 5-10% entre 2-3 años, 30-40% entre 4-13 años y 5-10% en niños mayores de 14 años). Esta bacteria produce una FAA leve y autolimitada, de predominio estacional (finales de otoño a principios de primavera), cuyos síntomas compatibles son odinofagia de aparición brusca, cefalea, náuseas, vómitos y dolor abdominal, y cuyos signos compatibles son fiebre, exantema escarlatiniforme, amígdalas eritematosas o con exudados, petequias en paladar blando, úvula roja y edematosa, adenopatías laterocervicales unilaterales mayores de 1 cm y dolorosas. El diagnostico de FAA estreptocócica (FAAE)3,4 se debe realizar en base a un resultado positivo de una prueba microbiológica, en un paciente con síntomas y signos compatibles con infección por EBHGA y ausencia de síntomas y signos de infección vírica. Por tanto, son tres los pilares para el diagnóstico de la FAAE: los síntomas compatibles, los signos compatibles y el resultado positivo en una prueba microbiológica.
Contamos fundamentalmente con dos tipos de pruebas microbiológicas para el diagnóstico de FAAE: el cultivo y los test de diagnóstico rápido (TDR)5. El cultivo es la técnica de referencia para el diagnóstico de FAAE, ya que presenta una alta sensibilidad y especificidad, pero su uso es limitado. De mayor uso son los TDR del estreptococo, que se fundamentan en la extracción ácida enzimática del antígeno carbohidrato de la membrana plasmática (aquel que definía la clasificación de Lancefield) y presenta una sensibilidad del 85% y especificidad del 95%, por lo que ante resultado positivo se acepta que el paciente presenta una FAA por EBHGA (si síntomas y signos compatibles) o que es portador (que consiste en albergar un agente infeccioso sin presentar signos o síntomas clínicos de enfermedad). Estas dos pruebas microbiológicas no permiten diferenciar entre infección aguda y estado de portador. Además, los TDR pueden ser falsamente positivos en pacientes con FAAE poco después de completar un tratamiento antibiótico (se considera que durante el mes siguiente al tratamiento), lo que se debe a que pueden quedar restos antigénicos en la faringe de los pacientes.
Se sabe que la proporción de niños sanos portadores de EBHGA durante los brotes puede alcanzar hasta un 50% y ser de hasta un 20% en los niños escolarizados4,6. Y este estado de portador puede durar meses, aunque tanto la posibilidad de transmisión como el riesgo de fiebre reumática o glomerulonefritis postestreptocócica son muy bajas. En torno a un 15% de los individuos con FAAE se convierten en portadores asintomáticos tras recibir tratamiento6. Además, la presencia de Streptococcus milleri, una bacteria comensal que expresa antígeno A, puede originar resultados falsos positivos en los TDR5. El estado de portador sano disminuye con el incremento de la edad7, siendo en niños menores de 5 años en torno a 66%, entre 5-17 años del 45% y en mayores de 17 años del 16%. Este aspecto es fundamental a la hora de realizar los TDR, ya que, dependiendo de la edad del niño, la probabilidad de portador sano será mayor o menor, lo que influirá en la validez del resultado de la prueba.
La pregunta de interés clínico que se deriva es si con las pruebas microbiológicas (cultivo, TDR) estamos detectando una infección activa por estreptococo o colonizadores de la faringe y, por tanto, tratamos a pacientes portadores que realmente presentan una infección vírica u otra infección bacteriana diferente al EBHGA. En base a ello, el presente estudio tiene como objetivo primario conocer el uso que se está llevando a cabo de los TDR en el Servicio de Urgencias Pediátricas del Hospital General Universitario Dr. Balmis (hospital terciario de la provincia de Alicante), para así optimizar el modo de utilización de esta herramienta y reducir el sobrediagnóstico de FAAE y el sobretratamiento antibiótico (y consecuente aparición de efectos adversos, resistencias bacterianas e incremento del gasto sanitario). Como objetivo secundario se pretende realizar una adaptación del algoritmo de diagnóstico de la FAA propuesto por la Asociación Española de Pediatría (AEP) en el año 2011 en base a la experiencia y resultados obtenidos de nuestro Servicio de Urgencias Pediátricas.
MATERIAL Y MÉTODOS
Durante el periodo comprendido entre enero de 2022 y enero de 2023 (ambos inclusive) se recogió de forma retrospectiva la información acerca del número de TDR y la edad de los pacientes a quienes se realizaron. Estos datos se corresponden con todos los pacientes menores de 15 años atendidos en dicho periodo en el Servicio de Urgencias Pediátricas del Hospital General Universitario Dr. Balmis. Así mismo, se recogió la información estratificada por edades de a cuántos pacientes se les había practicado más de un TDR y el tiempo que había transcurrido entre una y otra prueba.
RESULTADOS
En el Servicio de Urgencias Pediátricas de nuestro hospital se realizaron 1610 TDR durante los 13 meses de estudio, lo que corresponde en torno a un 4% del total de pacientes atendidos en dicho periodo. Del total, 688 test (43%) se llevaron a cabo en menores de 5 años y 922 test (el 57% restante) entre 5 y 14 años. En la Tabla 1 se analiza la distribución por edades de los TDR realizados.
| Tabla 1. Distribución por edades del total de TDR realizados en el Servicio de Urgencias Pediátricas del Hospital General Universitario Dr. Balmis (enero 2022-enero 2023) | ||
|---|---|---|
| Edad | TDR estreptococo (n.º) | Porcentaje respecto al total de TDR realizados |
| <3 años | 217 | 13% |
| 3-4 años | 237 | 15% |
| 4-5 años | 234 | 15% |
| 5-6 años | 222 | 13% |
| 6-7 años | 145 | 9% |
| 7-8 años | 125 | 8% |
| 8-9 años | 82 | 5% |
| 9-10 años | 63 | 4% |
| 10-11 años | 63 | 4% |
| 11-12 años | 66 | 4% |
| 12-13 años | 53 | 3% |
| 13-14 años | 43 | 3% |
| 14-15 años | 60 | 4% |
| TOTAL | 1610 | 100% |

Por otra parte, a un total de 89 pacientes se les realizó más de un TDR, siendo el 53% de ellos menores de 5 años. Tal como se aprecia en la Tabla 2, el porcentaje de test sucesivos que se realizaron va en decremento con el aumento de la edad del niño. En torno a un 40% de estos TDR sucesivos que se realizaron se llevaron a cabo en los primeros 40 días.
| Tabla 2. Información estratificada por edades de a cuántos pacientes se les había practicado más de un TDR y tiempo transcurrido entre ellos (enero 2022 - enero 2023) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Edad | N.º pacientes con >1 TDR realizado | Días transcurridos entre los sucesivos TDR | ||||||||
| 1 día | 2 días | 3 días | 4 días | 5-14 días | 15-21 días | 21-40 días | >40 días | Total realizados en los primeros 40 días (porcentaje) | ||
| <3 años | 10 | 0 | 1 | 1 | 0 | 2 | 0 | 1 | 5 | 5 (50%) |
| 3-4 años | 22 | 0 | 1 | 0 | 0 | 2 | 1 | 3 | 15 | 7 (31%) |
| 4-5 años | 15 | 1 | 3 | 0 | 2 | 0 | 0 | 1 | 8 | 7 (41%) |
| 5-6 años | 17 | 1 | 2 | 0 | 1 | 1 | 1 | 3 | 8 | 9 (53%) |
| 6-7 años | 6 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 5 | 1 (16%) |
| 7-8 años | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 5 | 1 (16%) |
| 8-9 años | 4 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 2 | 2 (50%) |
| 9-10 años | 3 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 1 (33%) |
| 10-11 años | 2 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 (50%) |
| 11-12 años | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0< | 0 | 0 (0%) |
| 12-13 años | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 (0%) |
| 13-14 años | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 (50%) |
| 14-15 años | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 (50%) |
| Total (porcentaje) | 89 (100%) | 4 (5%) | 9 (10%) | 1 (1%) | 3 (3%) | 7 (8%) | 3 (3%) | 9 (10%) | 53 (60%) | 36 (40%) |

DISCUSIÓN
Es bien conocido que la principal causa de FAA es vírica, donde los síntomas y signos no son fáciles de diferenciar con infección bacteriana. Y sabemos que para el diagnóstico y tratamiento de la FAAE necesitamos una prueba microbiológica positiva para EBHGA. Pero ya se ha referido que las pruebas microbiológicas disponibles para detectar el EBHGA no son capaces de diferenciar infección activa de estado de portador. Por ende, el uso de los TDR, sin una correcta selección de los pacientes a los cuales realizárselos en los servicios de urgencias pediátricas y en Atención Primaria, conlleva un potencial sobrediagnóstico de FAAE.
Por una parte, la combinación de signos y síntomas clínicos se ha utilizado para el desarrollo de varias reglas de predicción clínica (Centor, McIsaac, FeverPAIN, Attia), que pretenden predecir la probabilidad de infección de etiología bacteriana en función de los mismos. Estas reglas han sido utilizadas para la prescripción empírica de antibióticos cuando los pacientes reúnen un determinado conjunto de criterios, ya que supuestamente en dichos casos la probabilidad de causa bacteriana es considerada lo “suficientemente elevada” para iniciar tratamiento antibiótico. Este criterio prescinde del tercer pilar comentado para el diagnóstico de la FAAE, que consiste en tener un resultado positivo en una prueba microbiológica. Otro aspecto para destacar respecto al uso de las reglas de predicción clínica, y tal vez más importante que el anterior, consiste en el uso de estas reglas para seleccionar a pacientes con FAAE probable, a los cuales realizar pruebas microbiológicas. Contrastando la evidencia científica desarrollada hasta el momento, se llega la conclusión de que las pruebas microbiológicas de diagnóstico del EBHGA deben realizarse a los pacientes con síntomas y signos compatibles, en ausencia de sintomatología viral.
En nuestro estudio se llevaron a cabo en menores de 5 años casi la mitad de los TDR realizados (un 43%) y ya se ha comentado que en este grupo etario la prevalencia de portadores sanos de EBHGA se estima en un 66% y la causa estreptocócica se da en un 3-10% de las FAA; mientras que entre 5-14 años la prevalencia de portadores sanos de este patógeno ocurre un 45% y la etiología estreptocócica se da en un 30-40% de las FAA. Por tanto, en nuestro Servicio de Urgencias Pediátricas, en el periodo de tiempo comentado, hemos estado realizando más TDR a los grupos de edad donde hay mayor porcentaje de portadores sanos de EBHGA y menor etiología estreptocócica de las FAA, lo que constata un uso inadecuado de las pruebas en tanto a la adecuación al contexto epidemiológico del EBHGA de cada paciente. Esto conlleva, con alta probabilidad, un sobrediagnóstico de las FAAE en niños menores de 5 años.
Por otra parte, el hecho de repetir el TDR a 89 pacientes (43% en menores de 5 años y un 50% en los primeros 40 días), sabiendo que pueden ser falsamente positivos tras completar tratamiento antibiótico o ser portadores, indica que en nuestro Servicio de Urgencias Pediátricas se podría obviar la repetición de estos test.
Sobre estas premisas, nos gustaría dejar claro que el TDR es una herramienta que apoya nuestro diagnóstico de presunción de FAAE, y este debe realizarse previamente a iniciar tratamiento antibiótico. La facilidad de uso de los TDR, la rapidez en su resultado y disponibilidad en los servicios de urgencias pediátricas y Atención Primaria estimula su uso, pero también facilita que se haga un sobreuso de los mismos. El TDR se debe realizar en base a un diagnóstico con alta sospecha de causa bacteriana, y tener en cuenta la posibilidad de falsos positivos (especialmente en menores de 5 años). Esta práctica puede suscitar inquietud de infradiagnosticar esta entidad, pero cabe recordar que la FAAE es una enfermedad leve y autolimitada donde las complicaciones supurativas y no supurativas en nuestro medio son poco habituales.
Los datos descritos en el presente artículo están supeditados a las limitaciones de los estudios descriptivos retrospectivos. Pero tienen el valor de demostrar el patrón de utilización del TDR en pacientes con síntomas de FAA en el punto de atención de urgencias pediátricas de un hospital terciario. Y, por todo lo comentado anteriormente, proponemos optimizar el uso de TDR y cultivo en nuestro Servicio de Urgencias Pediátricas para reducir el sobrediagnóstico de FAAE, los costes y la aparición de resistencias antibióticas. Defendemos que el uso de los criterios clínicos (síntomas y signos de infección bacteriana y vírica), en función del criterio del profesional y en cada caso concreto, determinen la realización o no de pruebas microbiológicas, siendo las reglas de predicción clínica un apoyo para el pediatra en esta tarea, pero no una obligatoriedad a seguir.
Todo esto se resume en el algoritmo presentado en la Figura 1, que consiste en una modificación del propuesto por la AEP4 en función de la evidencia científica actualizada y los datos analizados en el Servicio de Urgencias Pediátricas de nuestro hospital. La primera modificación consiste en que, dada la elevada prevalencia de portadores sanos en niños menores de 5 años, hemos considerado esta edad como punto de corte. De esta manera, en lugar de <3 años y 3-15 años, la población pediátrica con sintomatología de FAA quedaría dividida en <5 años y 5-15 años. Prosiguiendo con las modificaciones, en pacientes entre 5-15 años, si la sintomatología es predominantemente vírica a criterio del profesional, no sería preciso aplicar la escala de Centor modificada por Mc Isaac; si, en su defecto, presentan algún síntoma compatible con etiología bacteriana, se aplicará dicha escala, considerando necesario que al menos se cumplan tres criterios o más para la realización de TDR (ya que cumplir dos criterios, como la edad 3-14 años y la temperatura >38, es relativamente fácil que tenga que usarse para la inmensa mayoría de pacientes que acuden a urgencias, sea o no el motivo una FAA).
| Figura 1. Algoritmo de la AEP (Asociación Española de Pediatría) modificado para el manejo diagnóstico de las faringoamigdalitis agudas* |
|---|
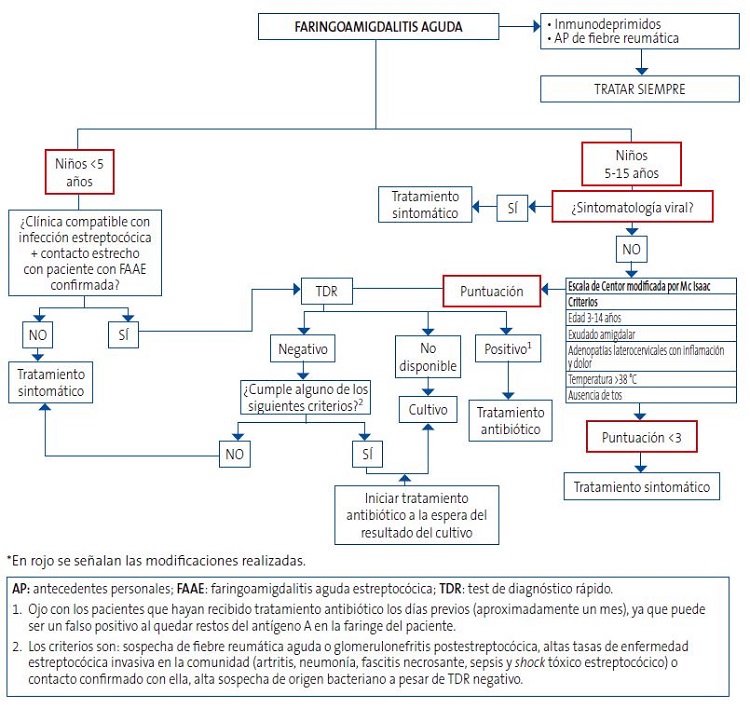 |

El objetivo es realizar un buen uso de los TDR para detectar EBHGA en el área faringoamigdalar, evitando su mal uso y sobreuso, y que para ello tengamos en cuenta que, en muchas ocasiones, el EBHGA será un germen colonizador y en menores ocasiones será el patógeno enemigo a tratar. Porque, salvando alarmas sanitarias puntuales como la comentada al inicio del artículo, no cabe perder el horizonte de este balance entre colonizador y enemigo del EBHGA a la hora de su manejo diagnóstico-terapéutico fundamentado en una medicina apropiada8.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
RESPONSABILIDAD DE LOS AUTORES
Todos los autores han contribuido de forma equivalente en la elaboración del manuscrito publicado.
ABREVIATURAS
AEP: Asociación Española de Pediatría · EBHGA: estreptococo beta-hemolítico del grupo A · FAA: faringoamigdalitis aguda · FAAE: faringoamigdalitis aguda estreptocócica · SEIP: Sociedad Española de Infectología Pediátrica · TDR: test de diagnóstico rápido estreptocócico.
BIBLIOGRAFÍA
- Sociedad Española de Infectología Pediátrica. Alerta sobre infecciones invasivas graves por Streptococcus pyogenes. 2022 [en línea] [consultado el 2/03/2023]. Disponible en aeped.es/sites/default/files/alerta_igas-seip_v1.1.pdf
- Bush LM, Vazquez-Pertejo MT. Infecciones estreptocócicas. Manual MSD. Versión para profesionales [en línea] [consultado el 2/03/2023]. Disponible en www.msdmanuals.com/es-es/professional/enfermedades-infecciosas/cocos-grampositivos/infecciones-estreptocócicas#
- García C. Utilidad del test rápido de detección de antígeno estreptocócico (TRDA) en el abordaje de la faringoamigdalitis aguda en pediatría. Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención Primaria. En: AEPap [en línea] [consultado el 2/03/2023]. Disponible en https://www.aepap.org/sites/default/files/gpi_utilidad_trda_estreptoccico.pdf
- Piñeiro R, Hijano F, Alvez F, Fernández A, Silva JC, Pérez C, et al. Documento de consenso sobre el diagnóstico y tratamiento de la faringoamigdalitis aguda. An Pediatr (Barc). 2011;75: 342.e1-13. https://doi.org/1016/j.anpedi.2011.07.015
- Hijano F, Piñeiro R, Orden B. Técnicas de detección rápida del antígeno estreptocócico. Guía-ABE. 2012 [en línea] [consultado el 2/03/2023]. Disponible en www.guia-abe.es/files/pdf/Guia-ABE_TDR_estreptococo_v.1_2012.pdf
- Hernández-Aguilera V, Sánchez l, Romao A, Panacci A, Avellaneda J, Rodríguez-Leo C, et al. Estreptococos betahemolíticos y factores asociados al estado de portador asintomático, en escolares de dos municipios del estado Aragua, Venezuela. Comunidad y Salud. 2017;16:9-21.
- Romero A, Requena M, Martínez E, Ladera M, Jeri R. Prevalencia de portadores asintomáticos de Streptococcus pyogenes y Streptococcus pneumoniae en estudiantes del primer año de la Facultad de Odontología de la USMP. Revista KIRU. 2009;6:84-7.
- González de Dios J. Evidencia científica y Medicina de la adolescencia: el camino a la Medicina apropiada. En: Medicina de la Adolescencia. Atención Integral. Madrid: Editorial Ergón; 2019. p. 63-8.





