Hematomas en un lactante de 3 meses. La importancia del diagnóstico diferencial
Ana Isabel Pastor Tudelaa, M.ª Teresa Leonardo Cabelloa, M.ª Jesús Caldeiro Díaza, Mónica López Duarteb, Teresa Torre Gonzálezc, Verónica Fernández Caboc, Diana Gutiérrez Buendíaa
aServicio de Pediatría. Hospital Universitario Marqués de Valdecilla. Santander. España.
bServicio de Hematología. Hospital Universitario Marqués de Valdecilla. Santander. España.
cMIR-Pediatría. Hospital Universitario Marqués de Valdecilla. Santander. España.
Correspondencia: AI Pastor. Correo electrónico: pastortudela91@gmail.com
Cómo citar este artículo: Pastor Tudela AI, Leonardo Cabello MT, Caldeiro Díaz MJ, López Duarte M, Torre González T, Fernández Cabo V, et al. Hematomas en un lactante de 3 meses. La importancia del diagnóstico diferencial. Rev Pediatr Aten Primaria. 2022;24:e119-e124.
Publicado en Internet: 15-03-2022 - Número de visitas: 21080
Resumen
Introducción: el motivo de consulta en Pediatría puede o no estar relacionado con patología subyacente importante, la exploración física exhaustiva en busca de signos de alarma es fundamental.
Caso clínico: presentamos el caso de un lactante de 3 meses en el que durante una visita a nuestro servicio de urgencias se detectaron hematomas. Con la sospecha inicial de un posible maltrato, se realizaron varios estudios y el diagnóstico final fue el de tromboastenia de Glanzmann.
Discusión: la tromboastenia de Glanzmann es un trastorno hereditario de la función plaquetaria. Se trata de una enfermedad muy poco frecuente de herencia autosómica recesiva. El hemograma y las pruebas de coagulación básicas son normales y el diagnóstico se realiza mediante análisis de pruebas de función plaquetaria y agregometría por transmisión de luz.
Conclusiones: la presencia de hematomas en un lactante de corta edad constituye siempre un motivo de investigación. Aunque por su incidencia el maltrato infantil constituye una de las principales causas, no debemos olvidar que se trata de un diagnóstico de exclusión, por lo que deberán descartarse otras patologías en función de los signos y síntomas que presente el paciente.
Palabras clave
● Complejo GPIIb-IIIa de Glicoproteína Plaquetaria ● Tromboastenia ● Tromboastenia de Glanzmann ● TrombopatíaINTRODUCCIÓN
El maltrato infantil en Pediatría tiene una incidencia de entre el 13 y el 18% en España1. Detectarlo es de vital importancia y en muchas ocasiones supone una tarea ardua para el pediatra. El diagnóstico de maltrato infantil es de exclusión, por lo que deberán descartarse otras patologías en función de los signos y síntomas que presente el paciente.
Uno de los grupos de enfermedades a tener en cuenta en el diagnóstico diferencial son los trastornos de la coagulación. Dentro de estos, los trastornos hereditarios de la función plaquetaria son un grupo heterogéneo de enfermedades poco frecuentes que, a menudo, son complejas y tienden a pasar desapercibidas hasta que ocurre un sangrado clínicamente relevante.
CASO CLÍNICO
Presentamos el caso de un paciente varón de 3 meses de vida que acude a urgencias por presencia de tumoración periareolar izquierda, sin otra clínica acompañante.
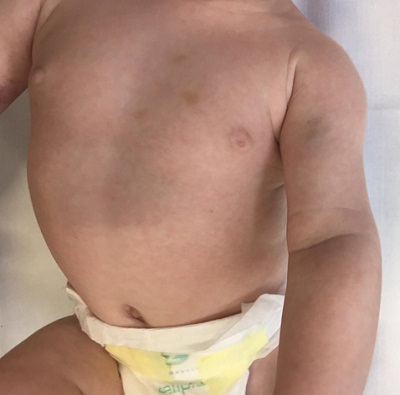
En la exploración física, llaman la atención varios hematomas digitiformes en región torácica (Fig.1).
| Figura 1. Hematomas digitiformes en diferente estadio evolutivo en región torácica y región bicipital de brazo izquierdo |
|---|
 |

La familia refiere haber percibido facilidad para la aparición de este tipo de lesiones sin traumatismo. Niegan traumatismos y sangrados a otros niveles. Como antecedentes personales, el embarazo, parto y período neonatal han cursado sin incidencias, con ganancia ponderal adecuada y desarrollo psicomotor normal. El paciente tiene dos hermanos mayores sanos y no existen antecedentes familiares de interés, salvo consanguinidad.
Ante la posibilidad de que se trate de un caso de maltrato infantil, se decide completar el estudio con un fondo de ojo por parte de Oftalmología, que no muestra alteraciones, y se realiza un hemograma con hemoglobina y recuento plaquetario normal y un estudio de coagulación (tiempo de protrombina, actividad de protrombina, tiempo de tromboplastina parcial activado y fibrinógeno) sin alteraciones.
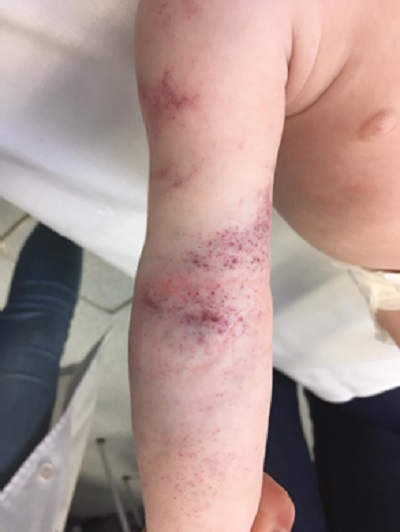
A pesar de la normalidad de las pruebas, tras las maniobras de compresión para la extracción analítica, aparece un exantema petequial muy llamativo (Fig. 2), por lo que se realiza interconsulta a Hematología, que completa el estudio con análisis del tiempo de función plaquetar (PFA) y enfermedad de von Willebrand. La cuantificación del factor de von Willebrand (FvW) resulta normal y el PFA alterado.
| Figura 2. Lesiones equimóticas que aparecieron tras realizar el procedimiento de extracción sanguínea |
|---|
 |

Ante el resultado del hemograma con recuento plaquetario normal y la alteración del PFA, se realiza estudio dirigido para descartar trombopatías en el laboratorio de referencia. Se realizó agregometría por transmisión de luz en el que solo agregaba con ristocetina, siendo este compatible con la enfermedad tromboastenia de Glanzmann, y además citometría de flujo, con la que se vio ausencia total de la integrina 2b/3a y por tanto diagnóstico tipo I. Actualmente está pendiente el resultado de la secuenciación masiva para diagnóstico molecular (técnica NGS o HTS).
DISCUSIÓN
La tromboastenia de Glanzmann es una trombopatía con recuento plaquetario normal, que se hereda de forma autosómica recesiva y que se caracteriza por sangrados prolongados y aparición de lesiones equimóticas ante pequeños traumatismos. Tiene una incidencia de 1/millón y cuando existe consanguinidad, como en nuestro caso, esta puede ser de hasta 5/millón2.
Se produce por un defecto en el gen ITGA2B o ITGB3 del cromosoma 17, que codifican las glicoproteínas IIb y IIIa de la membrana de la plaqueta, respectivamente3. Existen tres tipos distintos en función de la existencia de un defecto cuantitativo o cualitativo de las glicoproteínas. El tipo 1, como en nuestro caso, supone un déficit total; el tipo 2, un déficit parcial y el tipo 3 un defecto exclusivamente cualitativo con recuento normal de las glicoproteínas2.
Para el diagnóstico es imprescindible la realización del hemograma y frotis de sangre periférica, con recuento de plaquetas normales y normoconformadas. Esto puede ser un factor de confusión en el diagnóstico diferencial, ya que un caso de maltrato tendría las mismas pruebas básicas; es decir, hemograma, frotis de sangre periférica y pruebas de coagulación básicas normales. Es por ello que, si la sospecha clínica persiste, deben ampliarse las pruebas complementarias para descartar trombopatías.
El PFA o tiempo de sangrado tiene escasa especificidad y sensibilidad, pero nos orienta para saber si el defecto se encuentra a nivel de la hemostasia primaria2,4. Por otro lado, la técnica de laboratorio que dará el diagnóstico es la agregometría por transmisión de luz (LTA). Este test permite evaluar la agregación plaquetaria ex vivo tras el estímulo de un agonista o sustancia proagregante. Si las plaquetas se agregan ante el estímulo, aumenta la transmisión de luz y la señal producida es detectada por el espectrofotómetro. En el caso de la tromboastenia de Glanzmann la señal está abolida, ya que no existe agregación plaquetaria con los agonistas habituales; sin embargo, en el caso de utilizar la ristocetina como estímulo, sí que habrá aumento de transmisión de luz2,5. Esta característica permite realizar el diagnóstico diferencial con el síndrome de Bernard Soulier, otra trombopatía cuyo defecto es a nivel de la glicoproteína Ia-IX-V, estimulada por la unión del FvW. La ristocetina actúa a través de esta vía, por lo que, en esta enfermedad, también resultará alterada la LTA con esta sustancia2,5.
Otro método que permite contabilizar las glicoproteínas de la membrana plaquetaria es la citometría de flujo (CMF). En el caso de los tipos 1 y 2, obtendremos resultados alterados; sin embargo, el tipo 3 tendrá resultado normal, ya que el defecto es únicamente funcional6.
El motivo de consulta en Pediatría puede o no estar relacionado con patología subyacente importante, por eso queremos destacar la importancia de una exploración física exhaustiva. En nuestro caso, los padres consultaban por algo que no estaba relacionado en absoluto con el diagnóstico final del paciente. El signo de alarma guía fue la presencia de hematomas en un lactante de corta edad, algo que debe siempre investigarse. Si la familia no conoce o no da una explicación para la aparición de dichas lesiones, se debe realizar un estudio para descartar los posibles diagnósticos.
Como principal diagnóstico diferencial nos planteamos, por su frecuencia y gravedad, que se tratara de un caso de maltrato. Ante esta sospecha siempre se deben descartar alteraciones en la coagulación. A pesar de la normalidad de las pruebas básicas de coagulación, las lesiones que se produjeron por la compresión realizada durante el procedimiento fueron la clave para decidir la necesidad de una valoración especializada por parte de Hematología y lo que llevó a ampliar el estudio de trombopatías.
Los trastornos hereditarios de la función plaquetaria son un grupo heterogéneo de enfermedades que, a menudo, son complejas y tienden a pasar desapercibidas hasta que ocurre un sangrado clínicamente relevante.
De forma habitual, esta enfermedad debuta en niños menores de 5 años, presentándose menos de un 10% de los casos en edad neonatal. La clínica habitual consiste en la aparición de hematomas, epistaxis, sangrado ante traumatismos menores y sangrado intracraneal (poco frecuente de forma espontánea). El diagnóstico en niños menores de 5 años se relaciona con una clínica más severa durante el curso de su enfermedad2. En una serie de 48 casos publicados, la mediana de edad al diagnóstico fue de 2,75 años (rango intercuartil: 1,5 a 6,75) y alrededor del 25% tenía hemorragia potencialmente mortal, mientras que el 50% tenía retraso del crecimiento debido a la anemia crónica7.
En nuestro caso, el diagnóstico fue más precoz que lo descrito en la bibliografía, gracias a una exploración física exhaustiva, atendiendo a los signos de alarma, y al inicio de la investigación del caso tras la sospecha de maltrato infantil. Esto ha supuesto el diagnóstico precoz de una entidad poco frecuente y potencialmente grave, que suele conllevar múltiples consultas y extracciones analíticas que podrán ser evitadas y, lo que es más importante, se han podido iniciar medidas preventivas por parte de la familia encaminadas a evitar sangrados importantes secundarios a traumatismos.
Las revisiones publicadas en la actualidad acerca de la tromboastenia de Glanzmann abogan por la gran importancia de la educación del paciente y de sus familiares2. Es esencial que conozcan la adecuación de las actividades del niño, así como mantener una higiene oral adecuada y saber identificar los signos de alarma que les debe hacer acudir a un servicio sanitario. Esto permite adaptar desde el diagnóstico, y según el desarrollo psicomotor del paciente, las actividades que pueden ser más adecuadas para él. Es conveniente instruir a las familias sobre el manejo del sangrado leve en domicilio, las medidas farmacológicas y no farmacológicas. De las primeras, cabe destacar el uso del ácido tranexámico a nivel local y por vía oral8.
En caso de acudir para ser valorado por un especialista, es importante que el sanitario conozca la condición de esta enfermedad y que las pruebas complementarias, como el hemograma, no son imprescindibles para valorar la gravedad de la situación, ya que el recuento plaquetario será normal. En caso de un sangrado de cuantía importante, el hemograma es útil para conocer la cifra de hemoglobina.
Desde el diagnóstico de este caso hace más de seis meses, el paciente solo ha presentado sangrado mucocutáneo leve y ha requerido únicamente el uso de ácido tranexámico local. En caso de sangrados que no responden a las medidas locales o si van a realizarse procedimientos quirúrgicos, existen varias opciones de tratamiento como son las transfusiones de plaquetas, el factor VII recombinante (FVIIr) o antifibrinolíticos, todo ellos administrados solos o en combinación8.
Aunque las plaquetas son el tratamiento estándar para la tromboastenia de Glanzmann, su uso está asociado con el riesgo de transmisión de infecciones y también puede causar el desarrollo de anticuerpos plaquetarios, lo que potencialmente da como resultado la refractariedad plaquetaria3.
El FVIIr está aprobado para su uso en esta patología, principalmente para pacientes con anticuerpos plaquetarios o antecedentes de refractariedad plaquetaria. Pero existen datos publicados de registros multicéntricos que muestran que el FVIIr se usó con frecuencia en hemorragias quirúrgicas y no quirúrgicas, con altas tasas de eficacia, independientemente del estado de refractariedad o existencia de anticuerpos plaquetarios8,9.
El trasplante de células madre es el único tratamiento curativo actual y está indicado en pacientes seleccionados con un fenotipo clínico grave o que desarrollan anticuerpos anti-HLA plaquetarios2,8,10.
Como posible tratamiento curativo futuro se encuentra la terapia génica, pero hasta el momento sigue siendo experimental. La perspectiva de que esta tecnología pueda convertirse en una opción de tratamiento viable para los pacientes ha mejorado con el progreso significativo realizado en cultivos in vitro y en estudios con animales, pero se requieren más mejoras para su desarrollo clínico2,8.
CONCLUSIONES
La exploración física completa en Pediatría, independientemente del motivo de consulta, es importante para detectar signos de alarma de patologías relacionadas o no con el motivo de consulta inicial.
La presencia de hematomas en un lactante siempre debe alertarnos. Es muy importante el estudio y seguimiento adecuado de los pacientes con sospecha de maltrato infantil, sin olvidar que deben descartarse otras entidades, ya que se trata de un diagnóstico de exclusión.
La tromboastenia de Glanzmann y otros trastornos hereditarios de la función plaquetaria son enfermedades muy poco frecuentes, pero suelen presentarse en edad pediátrica, por lo que es interesante que el pediatra conozca las características de esta enfermedad con el fin de sospecharla y diagnosticarla cuanto antes para evitar, en la medida de lo posible, la morbimortalidad asociada.
CONFLICTO DE INTERESES
Las autoras declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
CMF: citometría de flujo · LTA: agregometría por transmisión de luz · PFA: tiempo de función plaquetar.
BIBLIOGRAFÍA
- Fernández JP. En: Fernández JP (coord.). El pediatra y el maltrato infantil. 2.ª edición. Barcelona: Ergon; 2017. p. 23-25.
- Grainger JD, Thachil J, Will AM. How we treat the platelet glycoprotein defects; Glanzmann thrombasthenia and Bernard Soulier syndrome in children and adults. Br J Haematol. 2018;182:621-32.
- Nurden AT, Pillois X. ITGA2B and ITGB3 gene mutations associated with Glanzmann thrombasthenia. Platelets. 2018;29:98-101.
- Harrison P. Platelet function testing. En: UpToDate [en línea] [consultado el 22/02/2022]. Disponible en www.uptodate.com/contents/platelet-function-testing
- Gómez-Gómez B, Rodríguez-Weber FP, Díaz-Greene EJ. Fisiología plaquetaria, agregometría plaquetaria y su utilidad clínica. Med Int Méx. 2018;34:244-63.
- Ignatova AA, Ponomarenko EA, Polokhov DM, Suntsova EV, Zharkov PA, Fedorova DV, et al. Flow cytometry for pediatric platelets. Platelets. 2019;30:428-37.
- Kongalappa S, Reddy JM, Durugappa T, D'Souza F, Subramanian S, Prakash A. Glanzmann Thrombasthenia in Children: Experience From a Tertiary Care Center in Southern India. J Pediatr Hematol Oncol. 2019;41:68-71.
- Poon M, Di Minno G, D’Oiron R, Zotz R. New Insights Into the Treatment of Glanzmann Thrombasthenia. Transfus Med Rev. 2016;30:92-9.
- Poon MC, D’oiron R, Von Depka M, Khair K, Karafoulidou A, Hurth-Kuehne A, et al. Prophylactic and therapeutic recombinant factor VIIa administration to patients with Glanzmann's thrombasthenia: results of an international survey. J Thromb Haemost. 2004;2:1096-103.
- Connor P, Khair K, Liesner R, Amrolia P, Veys P, Ancliff P, et al. Stem cell transplantation for children with Glanzmann thrombasthenia. Br J Haematol. 2008;140:568-71.






