Vol. 23 - Num. 89
Originales
Epidemiología de la infección SARS-CoV-2 en Navarra (España)
María Urretavizcaya Martíneza, Laura Moreno Galarragab, Jesús Castillac, Marcos García Howardd, Amaia Belza Mendikuted, Mercedes Herranz Aguirree
aServicio de Pediatría. Complejo Hospitalario de Navarra. Servicio Navarro de Salud . Pamplona. España.
bServicio de Pediatría. Complejo Hospitalario de Navarra. Servicio Navarro de Salud. Pamplona. Instituto de Investigación Sanitaria de Navarra (IdiSNA). Pamplona. España.
cInstituto de Investigación Sanitaria de Navarra (IdiSNA). Pamplona. Instituto de Salud Pública y Laboral de Navarra. Pamplona. CIBER Epidemiología y Salud Pública (CIBERESP). España.
dServicio de Pediatría. Complejo Hospitalario de Navarra. Servicio Navarro de Salud. Pamplona. España.
eSección de Enfermedades Infecciosas Pediátricas. Servicio de Pediatría. Complejo Hospitalario de Navarra. Servicio Navarro de Salud. Pamplona. Instituto de Investigación Sanitaria de Navarra (IdisNA). Pamplona. España.
Correspondencia: M Urretavizcaya . Correo electrónico: mariaurretavizcayamartinez@gmail.com
Cómo citar este artículo: Urretavizcaya Martínez M, Moreno Galarraga L, Castilla J, García Howard M, Belza Mendikute A, Herranz Aguirre M. Epidemiología de la infección SARS-CoV-2 en Navarra (España). Rev Pediatr Aten Primaria. 2021;23:53-61.
Publicado en Internet: 29-03-2021 - Número de visitas: 11732
Resumen
Introducción: desde el inicio de la epidemia de COVID-19, se han publicado numerosos estudios, pero la información sobre el impacto de la infección por SARS-CoV-2 en población pediátrica es todavía limitada. La incidencia y características en población pediátrica siguen siendo inciertas, por lo que se necesitan más estudios para entender el COVID-19 pediátrico.
Material y métodos: estudio multicéntrico retrospectivo en el que se describen la incidencia y características clínicas de los niños con COVID-19 confirmada en Navarra (España) durante la primera ola epidémica (28 de febrero-31 de mayo de 2020).
Resultados: la incidencia acumulada de COVID-19 pediátrico en Navarra en tres meses fue de tres casos por 1000 niños. De los 309 casos confirmados, el 85,7% tenían contacto domiciliario positivo; el 32,1% fueron asintomáticos; los síntomas fueron variados y solo el 15,8% tenían presentación “típica” de fiebre y síntomas respiratorios; 49% recibió atención telefónica y solo 11,6% requirió estudio complementario. Trece pacientes ingresaron en hospital (4,2%), dos fueron casos moderados (un cuadro respiratorio que requirió oxigenoterapia y un cuadro convulsivo tratado con antiepilépticos) y uno grave con el síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2 que ingresó en la unidad de cuidados intensivos (UCIP). Evolución favorable en todos los casos sin secuelas. Un 45,2% no necesitó tratamiento, el resto tratados con analgésicos, inhaladores o antibióticos en caso de sobreinfección; 2,3% recibió hidroxicloroquina.
Conclusiones: los reportes epidemiológicos son importantes para mejorar el conocimiento sobre COVID-19 en niños, ayudando a los pediatras a reconocer y tratar mejor la enfermedad.
Palabras clave
● Coronavirus pediátrico ● COVID-19 ● SARS-CoV-2INTRODUCCIÓN
En diciembre de 2019 se reportaron en Wuhan, China, una serie de casos de neumonía grave de origen desconocido. En enero de 2020 el patógeno etiológico fue identificado como un nuevo tipo de coronavirus y fue nombrado Severe Acute Respiratory Syndrome-Coronavirus-2 (SARS-CoV-2). La enfermedad causada por este coronavirus nuevo afectaba principalmente al sistema respiratorio y fue denominada COVID-191,2. Tras el brote inicial en China la enfermedad se propagó rápidamente por todo el mundo; el 30 de enero de 2020 la Organización Mundial de la Salud (OMS) la declaró la “emergencia de salud pública” y el 11 de marzo pasó a ser considerada una pandemia3.
En España, el primer paciente con COVID-19 confirmado fue registrado el 31 de enero, y tras pocas semanas se estableció la transmisión comunitaria, llevando a un aumento exponencial de los casos4. El 14 de marzo de 2020 el Gobierno de España declaró el estado de alarma e implementó medidas drásticas como el confinamiento domiciliario, la restricción de movimientos y el cierre de escuelas y establecimientos que no fueran de primera necesidad. Debido a estas restricciones de movilidad entre comunidades autónomas, la evolución en cada una de ellas fue diferente.
Las características clínicas de la COVID-19 se han ido conociendo a lo largo del tiempo, siendo esta una enfermedad nueva. Al principio se pensaba que afectaba principalmente a los adultos y con una afectación mayoritariamente pulmonar, presentándose en forma de neumonía bilateral con síndrome de dificultad respiratoria aguda o SARS1,2. En cuanto a los niños, parecía que se infectaban menos frecuentemente y con formas menos sintomáticas5,6. Con el tiempo se fue viendo que los niños se infectan en proporción parecida a los adultos y con patrones de transmisión similares, sin embargo, no suelen desarrollar las formas pulmonares típicas de los adultos y frecuentemente sus síntomas son más leves y presentan una menor mortalidad7-11.
No obstante, se han descrito afectaciones graves relacionadas con el SARS-CoV-2, especialmente en lactantes con complicaciones respiratorias. Además, desde principios de mayo, pediatras de toda Europa empezaron a comunicar series de pacientes con COVID-19 que desarrollaban un síndrome inflamatorio que compartía características clínicas y de laboratorio con la enfermedad de Kawasaki, el síndrome de shock tóxico o el síndrome de activación macrofágica; se denominó síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2 o SIM-PedS. Estos pacientes eran habitualmente adolescentes con formas graves de la enfermedad que podían evolucionar rápidamente hacia miocarditis y compromiso hemodinámico que requería cuidados intensivos12,13.
Dado que todavía hay muchas incógnitas relacionadas con la infección por SARS-CoV-2, creemos importante describir sus patrones en población pediátrica en diferentes situaciones sociodemográficas. Con este objetivo se diseña un estudio para conocer la incidencia detectada de COVID-19 pediátrica en Navarra durante la primera ola epidémica (marzo-mayo de 2020). Se describirán también las características clínicas y epidemiológicas de la infección en niños, así como su manejo clínico y evolución de los pacientes.
MATERIAL Y MÉTODOS
Estudio multicéntrico retrospectivo descriptivo en el que se describen las características clínicas y epidemiológicas, manejo y evolución de los pacientes pediátricos con infección por SARS-CoV-2 confirmada en Navarra, durante la primera ola epidémica.
Navarra es una comunidad autónoma con 660 887 habitantes, incluyendo 101 056 niños menores de 15 años (15,3%)14. El estudio incluyó un periodo de tres meses, desde el 28 de febrero de 2020, cuando se registró el primer caso confirmado de COVID-19 en Navarra (paciente adulto), hasta el 31 de mayo, cuando la circulación del virus bajó por debajo del umbral epidémico (<40 casos por 100 000 habitantes).
Durante el periodo estudiado, en Navarra se realizaban test SARS-CoV-2 a los pacientes que ingresaban en el hospital o los que acudían a urgencias o centros de salud por síntomas compatibles con COVID-19, así como a los pacientes asintomáticos con comorbilidades, discapacidad o factores de riesgo social. Además, las pruebas se realizaban en los casos de estudio de contactos. Se consideraron casos confirmados COVID-19 aquellos con una prueba reverse transcription polymerase chain reaction (RT-PCR) positiva o en los que tuvieron resultado positivo en la prueba rápida de anticuerpos. Ninguno de los pacientes fue diagnosticado por serología en sangre dado que en ese momento no se utilizaba esa técnica para el diagnóstico de infección aguda.
Los casos positivos y sus características epidemiológicas se obtuvieron gracias a la vigilancia epidemiológica de la región, que integra resultados de laboratorio, informes clínicos y encuestas epidemiológicas. Los casos pediátricos confirmados de COVID-19 se centralizaron en el hospital terciario de referencia, el Complejo Hospitalario de Navarra, la unidad de cuidados intensivos pediátricos (UCIP) se localizaba en la Clínica Universidad de Navarra y los casos ambulatorios recibieron seguimiento desde su centro de salud correspondiente.
Los criterios de inclusión fueron los pacientes de <15 años al inicio del periodo de estudio, con infección confirmada por SARS-CoV-2, con los que se pudo contactar y accedieron a participar en el estudio. El comité ético del centro aprobó el estudio y en todos los casos se solicitó consentimiento informado oral previo a la inclusión en el estudio. Los datos fueron recogidos mediante entrevistas telefónicas, revisión de historias clínicas y acceso a resultados de laboratorio y exploraciones complementarias.
Las variables incluidas fueron la edad y sexo de los pacientes, el motivo por el cual se realizó la prueba diagnóstica, la presencia de contactos domiciliarios positivos, los signos y síntomas de la enfermedad, las exploraciones complementarias que se realizaron, los tratamientos administrados y la atención médica recibida. Se realizaron análisis descriptivos de las variables continuas, expresados como mediana y rango intercuartílico (RIQ) y para las variables categóricas se expresaron las cifras con porcentajes. Los datos se analizaron utilizando el programa STATA versión 12.0 y Microsoft Excel versión 2010.
Consideraciones éticas
El comité ético de investigación clínica CEIC del Complejo Hospitalario de Navarra aprobó el estudio en mayo 2020 PI_2020/38: Estudio epidemiológico de las infecciones respiratorias causadas por el nuevo coronavirus SARS-CoV-2 en la población pediátrica.
RESULTADOS
Durante el periodo estudiado, desde el primer caso COVID-19 detectado en nuestra comunidad autónoma (28 febrero) hasta el 31 de mayo, un total de 309 pacientes menores de 15 años presentaron una infección confirmada por SARS-CoV-2 en Navarra (Fig. 1), sin casos detectados en niños en febrero. Esto supone una incidencia acumulada en tres meses de tres casos por 1000 niños. De los 309 casos totales, 259 pacientes fueron reclutados para el estudio (83,8%), el resto no pudieron ser contactados. Ninguno de los pacientes o familias a las que contactamos rechazaron la participación en el estudio. El rango de edad de nuestros pacientes fue desde un mes hasta los 15 años, la mediana de edad fue 8,74 años (RIQ 5,26-12,02). La razón por sexo fue 1 hombre por 1,14 mujeres.
| Figura 1. Incidencia semanal de SARS-CoV-2 en paciente pediátrico en Navarra, España, de marzo a mayo de 2020 |
|---|
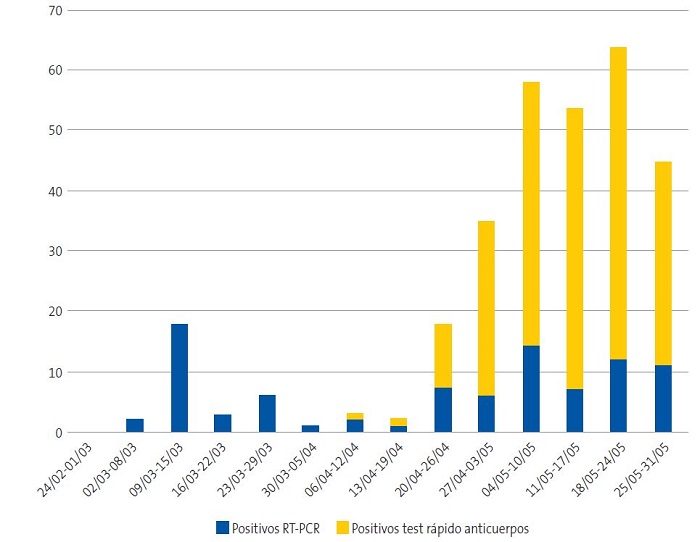 |

En cuanto a la razón por la que se realizó la prueba diagnóstica SARS-CoV-2 en los niños, encontramos que en la mayoría de los casos de COVID-19 pediátrico el test formaba parte del estudio rutinario de trazado de contactos (52,1%), mientras que el 36,7% de los pacientes fueron testados por síntomas de COVID-19. El resto fueron parte de la estrategia de cribado en niños con factores de riesgo (1,2%), en pacientes que participaron en ensayos clínicos relacionados con la infección por SARS-CoV-2 (3,1%) o como protocolo previo a ciertas consultas médicas o antes del ingreso hospitalario por otro motivo (6,6%). Independientemente del motivo inicial para realizar la prueba, la mayoría de los niños infectados reportaron un contacto domiciliario positivo para COVID-19 (85,7%).
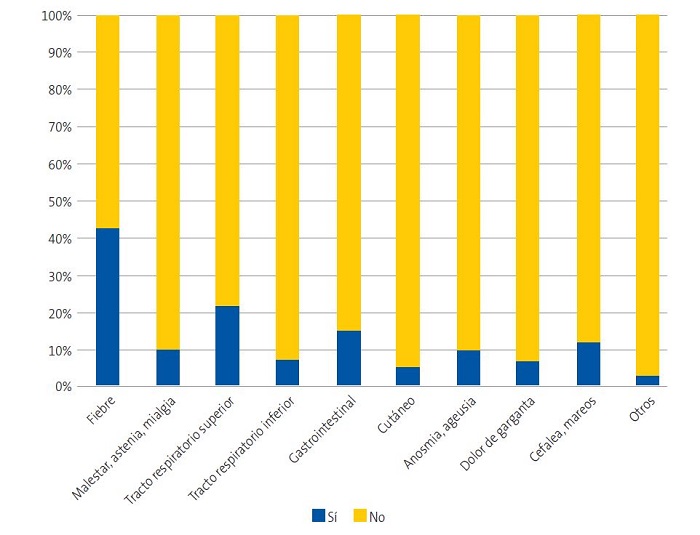
Las presentaciones clínicas de la COVID-19 en nuestra serie de pacientes fue variada, y un 32,1% de los niños fueron completamente asintomáticos. En los casos que presentaron síntomas, los más frecuentes fueron la fiebre (43,2%) y los síntomas respiratorios (27,4%); otros síntomas de COVID-19 se detallan en la Fig. 2. Solo un 15,8% de los pacientes refirió la presentación habitual en los adultos, consistente en fiebre y manifestaciones respiratorias.
| Figura 2. Proporción de pacientes presentando cada uno de los signos o síntomas, entre los pacientes pediátricos con infección por COVID-19 en Navarra, España, de marzo a mayo de 2020 |
|---|
 |

La mayoría de los niños de nuestra serie no requirieron estudios complementarios (88,4%). En los casos que hicieron falta, lo más frecuente fue la radiografía de tórax (8,5%), analítica sanguínea y otros test de laboratorio (8,5%), electrocardiografía (2,7%) y test rápido estreptocócico (1,5%), entre otros.
En un 61% de los casos se necesitó atención médica, en resto no, dado que fueron casos asintomáticos o leves. Aun así, la mayoría de las consultas médicas se hicieron telefónicamente (49%); solo un 21,1% de los pacientes necesitó atención presencial. Trece pacientes (4,2%) fueron hospitalizados, el resto fue seguido de forma ambulatoria. La evolución fue en todos los casos favorable y sin secuelas.
Entre los pacientes pediátricos hospitalizados positivos para SARS-CoV-2, la mediana de edad fue 6,67 años y un 46,2% de sexo masculino. Cinco pacientes (38,5%) presentaban comorbilidades tales como obesidad, malformación pulmonar, cardiopatía congénita o parálisis cerebral. La mediana de tiempo de hospitalización fue de cuatro días (mínimo dos y máximo 11) y la mayoría de los pacientes (76,9%) presentó una forma leve de la enfermedad. Hubo dos pacientes con compromiso moderado, uno de ellos presentó una hipoxemia que se recuperó con oxígeno suplementario y el otro tuvo crisis epilépticas que requirieron tratamiento anticomicial. Además, un paciente presentó una forma grave de COVID-19 y desarrolló un SIM-PedS con miocarditis que requirió cuidados intensivos. Otras características de los pacientes hospitalizados se presentan en la Tabla 1; además hay un artículo previamente publicado que describe detalladamente las características clínicas y datos de laboratorio de los pacientes hospitalizados con COVID-19 de Navarra, así como la evolución clínica y el manejo recibido7.
| Tabla 1. Principales características y manifestaciones clínicas de los pacientes pediátricos hospitalizados con COVID-19 en Navarra, España, de marzo a mayo de 2020 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pacientes | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| Características clínicas | |||||||||||||
| Edad (años-meses) | 1 mes | 2 años y 9 meses | 1 año | 15 años | 12 años y 11 meses | 9 años y 8 meses | 3 meses | 4 años y 5 meses | 13 años y 8 meses | 9 años y 5 meses | 7 meses | 9 años y 2 meses | 6 años y 8 meses |
| Sexo | Femenino | Masculino | Masculino | Masculino | Femenino | Femenino | Femenino | Femenino | Masculino | Femenino | Femenino | Masculino | Masculino |
| Comorbilidades | No | Sí | No | Sí | Sí | No | No | Sí | No | No | No | No | Sí |
| Contacto domiciliario | Desconocido | Desconocido | Desconocido | Desconocido | Desconocido | Confirmado | Sospecha | Confirmado | Confirmado | Sospecha | Confirmado | Sospecha | Confirmado |
| Signos y síntomas al ingreso | |||||||||||||
| Fiebre | Sí | Sí | No | Sí | Sí | Sí | No | No | Sí | No | Sí | Sí | Sí |
| Tos | Sí | Sí | No | Sí | Sí | No | No | No | No | No | Sí | No | No |
| Dificultad respiratoria | No | Sí | No | No | Sí | No | No | No | No | No | Sí | No | No |
| Vómitos | No | No | Sí | No | No | Sí | No | No | Sí | No | No | No | Sí |
| Dolor abdominal | No | No | No | No | No | Sí | No | No | Sí | Sí | No | No | Sí |
| Diarrea | No | Sí | No | Sí | No | No | Sí | No | No | No | No | Sí | Sí |
| Otros síntomas | Congestión nasal, náuseas, irritabilidad | No | Traumatismo craneal | No | No | Hematuria | Convulsión | No | No | No | Congestión nasal | No | Exantema cutáneo |
| Hospitalización | |||||||||||||
| Duración (días) | 11 | 6 | 2 | 4 | 7 | 8 | 7 | 2 | 9 | 3 | 3 | 3 | 3 |
| Gravedad | Leve | Leve | Leve | Moderadoa | Leve | Leve | Moderadob | Leve | Gravec | Leve | Leve | Leve | Leve |

Un 45,2% no necesitó ningún tratamiento. En el resto de los casos lo más frecuente fueron los antitérmicos y analgésicos (paracetamol 42,9%, ibuprofeno 10,4%), broncodilatadores inhalados (4,6%) y corticoides orales (3,5%). Del total de los pacientes, un 10,8% recibió algún tipo de antibioterapia (penicilina oral 5,8%, ceftriaxona intravenosa 3,1%, azitromicina oral 5%, otros antibióticos 1,2%) y un 2,3% de los niños fue tratado con Hidroxicloroquina. El paciente que desarrolló el SIM-PedS requirió tratamiento intravenoso con drogas vasoactivas, corticoides a alta dosis, tocilizumab e inmunoglobulinas.
DISCUSIÓN
Este estudio pediátrico de COVID-19 aporta datos similares a otras series previamente publicadas, reportando síntomas en general leves y moderados, con características más variadas y menos concretas que las presentaciones clínicas de los adultos5-11. A nuestro juicio, este puede ser uno de los primeros estudios en describir incidencia poblacional de COVID-19 en niños, y parece ser baja. Sin embargo, creemos que en parte la infección pudo ser infradiagnosticada debido a que los criterios para realizar las pruebas de SARS-CoV-2 fueron inicialmente restrictivos y cambiantes. Al principio, en nuestra comunidad autónoma, los test se realizaban solo en los casos sintomáticos con antecedente de viaje a regiones con elevada incidencia de COVID-19 como China o Italia, además del estudio de contactos. Más delante, el antecedente epidemiológico de viaje dejó de ser necesario, pero los test se realizaban solo en los casos moderados o graves que necesitaban atención médica o hospitalización. En abril se empezaron a analizar muestras de sangre o suero mediante el uso de test rápidos de anticuerpos, además de flexibilizar los criterios para la realización de RT-PCR.
En cuanto a las características clínicas, los pacientes pediátricos no se presentan habitualmente con los “síntomas respiratorios típicos” que sí son comunes entre la población adulta infectada con COVID-1911. Además, un tercio de nuestros pacientes fueron completamente asintomáticos. Creemos que nuestra proporción de asintomáticos puede ser inferior a otras series debido a las restricciones iniciales para realizar las pruebas (en asintomáticos solo se testaban aquellos niños con contacto estrecho positivo); con el tiempo y el incremento del número de pruebas realizadas, somos capaces de diagnosticar más pacientes asintomáticos y oligosintomáticos.
Ninguno de nuestros pacientes desarrolló un síndrome de dificultad respiratoria aguda (SDRA) y el máximo soporte respiratorio requerido fue el oxígeno suplementario (solo un paciente, que necesitó oxígeno de bajo flujo mediante cánulas nasales). No obstante, otras series han descrito casos de lactantes menores de 12 meses con presentaciones respiratorias graves, por lo que debemos considerarlos como grupo de riesgo para esta enfermedad8,9,11. Creemos que en nuestra serie no tenemos ningún caso de estos debido al pequeño tamaño muestral. En cualquier caso, creemos que es importante que los pediatras presten especial atención a los casos de COVID-19 en pacientes menores de 12 meses y prioricen en ellos la atención presencial.
Los casos graves de COVID-19 en niños se asocian frecuentemente al SIM-PedS. Suele tratarse de pacientes adolescentes que presentan síntomas parecidos a la enfermedad de Kawasaki y en una fase posterior empeoran desarrollando un fracaso hemodinámico que precisa cuidados intensivos12,13. En nuestra serie hubo un paciente masculino de 13 años, previamente sano, con una miocarditis y arritmia ventricular debidas a la COVID-19, necesitó inotrópicos e inmunoglobulinas15. También registramos en caso de un paciente con compromiso neurológico, fue una lactante de 3 meses con crisis convulsivas afebriles, precisó tratamiento con fármacos antiepilépticos16.
Se cree que los niños se infectan principalmente en sus hogares, ya que en la mayoría de los pacientes el caso índice de la infección SARS-CoV-2 fue uno de los padres, un miembro de la familia u otro conviviente7. A pesar de todo, pensamos que esta situación puede estar condicionada por las medidas extraordinarias de confinamiento domiciliario, y en otras condiciones los niños pueden infectarse también en sus actividades diarias. Es de vital importancia realizar un adecuado rastreo de contactos tras en diagnóstico de un caso positivo, así como un seguimiento.
Durante la primera ola de la pandemia, el modelo de atención médica cambió debido al riesgo de transmisión SARS-CoV-2. Con el objetivo de evitar aglomeraciones en los centros de Atención Primaria, algunas de las consultas médicas menos urgentes se empezaron a realizar telefónicamente. En los casos de COVID-19, los pacientes asintomáticos y aquellos con síntomas leves fueron controlados de forma telefónica ambulatoriamente, para así aislarlos del resto de la población como estrategia preventiva de contagios. Este nuevo modelo de atención telefónica se ha implementado desde entonces y parece haber sido efectivo en nuestro caso, ya que ninguno de los pacientes pediátricos con COVID-19 que fueron seguidos telefónicamente desarrolló complicaciones.
La mayoría de los pacientes pediátricos con COVID-19 no necesitaron ningún tratamiento, ya que fueron formas asintomáticas o leves de la enfermedad. El resto recibieron tratamiento sintomático con fármacos antipiréticos o tratamientos habituales de bronquitis en los casos requeridos, con broncodilatadores inhalados y corticoides orales. Entre los antitérmicos, se prefirió el Paracetamol antes que el Ibuprofeno dado que en un primer momento parecía que este último podía tener efectos adversos en los pacientes con COVID-19 relacionados con un incremento de los niveles de ACE217. En cuanto a otros tratamientos, algunos de los primeros pacientes hospitalizados recibieron hidroxicloroquina como parte del tratamiento de la enfermedad, posteriormente fue descartada de los protocolos de tratamiento del SARS-CoV-218. En los pacientes con coinfección bacteriana (sospechada o confirmada microbiológicamente) el antibiótico más frecuentemente elegido para terapia intravenosa fue la ceftriaxona, debido a que su pauta de administración cada 24 horas la hacía más conveniente para disminuir exposición de los trabajadores sanitarios. El tocilizumab se utilizó solamente en el paciente grave, así como los corticoides intravenosos a altas dosis para el síndrome inflamatorio (SIM-PedS).
Creemos que nuestro estudio es especialmente de interés dado que se ha realizado una búsqueda extensiva de todos los casos de SARS-CoV-2 en Navarra, una de las zonas más afectadas por coronavirus de España. Recogimos datos de la primera ola de infección, y debido a las medidas de confinamiento se comportó como una población cerrada. Encontramos muy pocos casos moderados-graves de COVID-19 pediátrico en niños, corroborando datos de otras series en cuanto a la baja tasa de complicaciones en los niños. Por otra parte, es verdad que la información se recabó de forma retrospectiva y fundamentalmente mediante entrevistas telefónicas, por lo que puede haber un sesgo de memoria sobre todo en cuanto a los síntomas de la enfermedad.
En conclusión, nos gustaría remarcar el hecho de que estamos ante una nueva enfermedad de la cual no teníamos ninguna información al principio y fuimos conociendo sus características con el tiempo. Creemos que los reportes epidemiológicos como el nuestro son fundamentales para profundizar en el conocimiento de los aspectos de la infección por SARS-CoV-2 en el paciente pediátrico, así como para ayudarnos a mejorar el reconocimiento, estrategias de manejo y tratamiento de la infección.
CONFLICTO DE INTERÉS
Los autores declaran no tener conflicto de interés relacionado con este estudio.
ABREVIATURAS
COVID-19: enfermedad por el SARS-CoV-2 · OMS: Organización Mundial de la Salud · RIQ: rango intercuartílico · RT-PCR: prueba de reverse transcription polymerase chain reaction · SARS-CoV-2: coronavirus del severe acute respiratory syndrome 2 · SDRA: síndrome de dificultad respiratoria aguda · SIM-PedS: síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2 · UCIP: unidad de cuidados intensivos pediátricos.
AGRADECIMIENTOS
Los autores quisieran agradecer al Servicio de Microbiología y al Instituto de Salud Pública y Laboral su enorme esfuerzo en el diagnóstico y la vigilancia epidemiológica. También quisieran remarcar el trabajo extraordinario de todos los trabajadores del sistema sanitario español en el manejo de la pandemia COVID-19.
FINANCIACIÓN
Se recibió financiación para los test SARS-CoV-2 realizados en el estudio por parte del programa Horizon 2020 program de la European Commission (I-MOVE-COVID-19, número de beca: Nº 101003673), así como del Instituto de Salud Carlos III con el European Regional Development Fund (COV20/00542 y INT19/00028). Por lo demás, los autores declaran no tener relaciones financieras a declarar relacionadas con este artículo.
BIBLIOGRAFÍA
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497-506.
- Guan W, Ni Z, Hu Y, Liang W, Ou C, He J, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382:1708-20.
- Statement on the second meeting of the International Health Regulations (2005). Emergency Committee regarding the outbreak of novel coronavirus (2019- nCoV). En: Organización Mundial de la Salud [en línea] [consultado el 23/03/2021]. Disponible en www.who.int/news/item/30-01-2020-statement-on-the-second-meeting-of-the-international-health-regulations-(2005)-emergency-committee-regarding-the-outbreak-of-novel-coronavirus-(2019-ncov)
- Enfermedad por nuevo coronavirus, COVID-19. En: Ministerio de Sanidad, Consumo y Bienestar Social [en línea] [consultado el 23/03/2021]. Disponible en www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/home.htm
- Zheng F, Liao C, Fan Q, Chen H, Zhao X, Xie Z, et al. Clinical characteristics of children with coronavirus disease 2019 in Hubei, China. Curr Med Sci. 2020;40:275-80.
- Jiehao C, Jing X, Daojiong L, Zhi Y, Lei X, Zhenghai Q, et al. A case series of children with 2019 novel coronavirus infection: clinical and epidemiological features. Clin Infect Dis. 2020;71:1547-51.
- Moreno-Galarraga L, Urretavizcaya-Martínez M, Alegría-Echauri J, García-Howard M, Ruperez-García E, et al. SARS-CoV-2 infection in children requiring hospitalization: the experience of Navarra, Spain. World J Pediatr. 2020;16:614-22.
- Swann OV, Holden KA, Turtle L, Pollock L, Fairfield CJ, Drake TM, et al. Clinical characteristics of children and young people admitted to hospital with COVID-19 in United Kingdom: prospective multicentre observational cohort study. BMJ. 2020;370:m3249. .
- Götzinger F, Santiago-García B, Noguera-Julián A, Lanaspa M, Lancella L, Calò Carducci FI, et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. Lancet Child Adolesc Health. 2020;4: 653-61.
- Zachariah P, Johnson CL, Halabi KC, Ahn D, Sen AI, Fischer A, et al. Epidemiology, Clinical Features, and Disease Severity in Patients With Coronavirus Disease 2019 (COVID-19) in a Children's Hospital in New York City, New York. JAMA Pediatr. 2020;174:e202430.
- Han Y, Feng Z, Sun L, Ren X, Wang H, Xue Y. A comparative‐ descriptive analysis of clinical characteristics in 2019-coronavirus- infected children and adults. J Med Virol. 2020;92:1596-602.
- Moraleda C, Serna-Pascual M, Soriano-Arandes A, Simó S, Epalza C, Santos M, et al. MultiInflammatory Syndrome in Children related to SARS-CoV-2 in Spain. Clin Infect Dis. 2020;ciaa1042.
- Jiang L, Tang K, Levin M, Ifran O, Morris SK, Wilson K, et al. COVID-19 and multisystem inflammatory syndrome in children and adolescents. Lancet Infect Dis. 2020;20:276-88.
- Padrón de Habitantes a 1 de enero de 2020. Datos provisionales. En: Instituto de Estadística de Navarra, Gobierno de Navarra [en línea] [consultado el 23/03/2021]. Disponible en www.navarra.es/home_es/Gobierno+de+Navarra/Organigrama/Los+departamentos/Economia+y+Hacienda/Organigrama/Estructura+Organica/Instituto+Estadistica/NotasPrensa/Padron+Continuo+de+Habitantes.htm
- Gutiérrez-Jimeno M, Ibanez Sada A, Gavira JJ, Cebrián-Nebot C, Martín López L, Macias Mojon M, et al. Severe cardiac and abdominal manifestations without lung involvement in a child with COVID-19. Int J Clin Pediatr. 2020;9:92-7.
- García-Howard M, Herranz-Aguirre M, Moreno-Galarraga L, Urretavizcaya-Martínez M, Alegría-Echauri J, Gorría-Redondo N, et al. Case Report: Benign Infantile Seizures Temporally Associated With COVID-19. Front Pediatr. 2020;8:507.
- Kutti Sridharan G, Kotagiri R, Chandiramani VH, Mohan BP, Vegunta R, Vegunta R, et al. COVID-19 and avoiding Ibuprofen. How good is the evidence? Am J Ther. 2020;27:e400-e402.
- Das S, Bhowmick S, Tiwari S, Sen S. An updated systematic review of the therapeutic role of Hydroxychloroquine in Coronavirus Disease-19 (COVID-19). Clin Drug Investig. 2020;40:591-601.





