Vol. 22 - Num. 85
Notas clínicas
Leishmaniasis cutáneo-visceral, sospecharla para diagnosticarla
M.ª José Palomares Gimenoa, Laura Segura Navasa, Sara Renau Solazb, David Bueno Clarosc
aPediatra. CS Gran Vía. Castellón. España.
bServicio de Urgencias. Hospital General de Castellón. Castellón. España.
cEnfermero. Consultorio Auxiliar Benicasim. Castellón. España.
Correspondencia: MJ Palomares. Correo electrónico: mjpalomares65@gmail.com
Cómo citar este artículo: Palomares Gimeno MJ, Segura Navas L, Renau Solaz S, Bueno Claros D. Leishmaniasis cutáneo-visceral, sospecharla para diagnosticarla. Rev Pediatr Aten Primaria. 2020;22:49-53.
Publicado en Internet: 09-03-2020 - Número de visitas: 16266
Resumen
En los últimos 25 años se ha producido un aumento global de casos de leishmaniasis. Se postula que el cambio climático, el aumento global de la temperatura, las migraciones masivas del campo a la ciudad y los proyectos agroindustriales (creación de pantanos, sistemas de riego, formación de pozos...) potencian la aparición de reservorios de mosquitos flebotomos, que son los vectores de esta enfermedad. Cabe destacar que en la Comunidad Valenciana, zona endémica, la tasa de incidencia ha sufrido un aumento considerable en los últimos años. Describimos a un paciente de dos años que presenta cuadro clínico y analítico compatible con leishmaniasis visceral (fiebre, esplenomegalia y pancitopenia) con el antecedente, varios meses antes, de leishmaniasis cutánea. Existen pocos casos en la literatura médica que describan una afectación cutánea y visceral concomitante, hecho que otorga importancia a nuestro caso. La inmadurez de la respuesta inmune celular a esa edad podría ser la causa de esta forma de presentación atípica.
Palabras clave
● Leishmaniasis cutánea ● Leishmaniasis visceralINTRODUCCIÓN
La leishmaniasis es una enfermedad parasitaria producida por un protozoo y transmitida por la picadura de mosquitos flebotomos. En España, la enfermedad es debida a Leishmania infantum. El perro doméstico es el principal reservorio de L. infantum, pero no el único, pudiendo existir ocasionalmente transmisión persona a persona1.
La enfermedad puede manifestarse de tres formas diferentes2:
- Leishmaniasis visceral (también conocida como kala-azar): en más del 95% de los casos es mortal si no se trata. El periodo de incubación es de dos a cuatro meses, aunque puede oscilar entre diez días y dos años.
- Leishmaniasis cutánea (LC): es la forma más frecuente de leishmaniasis, y produce lesiones cutáneas en las zonas expuestas del cuerpo. El periodo de incubación es de cuatro a seis semanas.
- Leishmaniasis mucocutánea: conduce a la destrucción parcial o completa de las membranas mucosas de la nariz, la boca y la garganta.
Existen entre 12-14 millones de enfermos en el mundo, con dos millones de nuevos casos anuales, de los que 1,5 millones serían cutáneos (suroeste de Asia, norte de África y Latinoamérica) y 500 000 viscerales (subcontinente indio, este de África y Brasil)3.
En Europa hay dos ciclos endémicos de transmisión, la forma zoonótica cutánea y visceral de leishmaniasis producida por L. infantum en toda la región mediterránea y la forma antroponótica cutánea causada por L. tropica, que se distribuye esporádicamente en Grecia y países vecinos3.
CASO CLÍNICO
Nuestro caso comienza en noviembre de 2017, tras la picadura de un mosquito en la frente en una lactante de 18 meses. En diciembre, ante la persistencia de una lesión de aspecto papulovesicular en la zona de la picadura, se inicia tratamiento con mupirocina tópica, con escasa mejoría, por lo que posteriormente se pauta antibiótico oral.
En enero de 2018 presenta un primer episodio de convulsión febril secundaria a un proceso vírico. Un mes después ingresa en el hospital por un segundo episodio de convulsión febril secundaria a otitis media aguda, con hemograma y electroencefalograma normales.
En mayo de 2018, más de seis meses después de la picadura, persiste la lesión papulovesicular, costrosa y eritematosa, de menos de 1 cm en el entrecejo. El dermatólogo remite una muestra a Microbiología para realizar la técnica de Giemsa, obteniendo resultado positivo para leishmaniasis en lesión cutánea. Se infiltra una dosis de Glucantime intralesional, con mejoría evidente, por lo que se administra una segunda infiltración, sin presentar hasta el momento clínica de leishmaniasis visceral.
En junio de 2018, con dos años de edad, presenta cuadro catarral febril que se trata con amoxicilina por diagnóstico de otitis media aguda. Unos días después acude a Urgencias por presentar un cuadro de lesiones urticariformes en el abdomen y la zona proximal de extremidades inferiores, asociado a picos febriles de hasta 39 °C, de seis días de evolución, que ceden parcialmente con antitérmicos. No presenta síndrome constitucional prolongado, salvo hiporexia y mayor irritabilidad, coincidente con los ascensos febriles. Se realiza una analítica de urgencia resultando pancitopenia sin blastos en sangre periférica (hemoglobina: 8,2 g/dl, 1080 neutrófilos/mm3, 85 000 plaquetas/mm3), proteína C reactiva: 42 mg/l, GPT: 77 U/l y en la ecografía abdominal una esplenomegalia homogénea (13 cm), con el resto normal, quedando pendiente hemocultivo y serología para leishmania y virus.
Ante la sospecha de leishmaniasis visceral, 48 horas después acuden a un control en el hospital de día, donde persiste clínica y en la exploración física destaca la pápula eritematosa interciliar, la esplenomegalia y el exantema urticariforme. Ante la persistencia de pancitopenia en el nuevo control analítico, hipergammaglobulinemia (3 g/dl), serología de leishmaniasis IgG e IgM positiva, la clínica sistémica y el antecedente de botón de oriente, se decide su ingreso con sospecha de leishmaniasis visceral, iniciando tratamiento con anfoterina B liposomial (3,7 mg/kg/día). Se realiza un aspirado medular, con resultado dentro de los límites de la normalidad, sin observar formas parasitarias de leishmania, por lo que se procesa la citometría y se envía muestra para reacción en cadena de la polimerasa de parvovirus B19, leishmania, citomegalovirus y virus de Epstein Barr, obteniendo resultado positivo para leishmania.
La evolución clínica es favorable, quedando afebril tras la primera dosis de amfotericina B, sin presentar reacción urticariforme. Causa alta tras completar 5 días de tratamiento, presentando buen estado general, sin exantemas ni petequias, pero con persistencia de esplenomegalia.
Dos meses después del ingreso, la paciente persiste asintomática, con normalización del hemograma (11 000 leucocitos/mm3, Hb 10,2 g/dl y 362 000 plaquetas/mm3), y negatividad de la reacción en cadena de la polimerasa para leishmania en sangre periférica.
DISCUSIÓN
Desde 1993 se han extendido de manera significativa las regiones con endemia de leishmaniasis, afectando a 88 países en el mundo3. El cambio climático, con el aumento en la temperatura global, puede facilitar la presencia de vectores (mosquito flebotomo) y ampliar su periodo de actividad fuera de los meses de verano1. Otros factores ligados al desarrollo, como las migraciones masivas del campo a la ciudad, los proyectos agroindustriales y las modificaciones medioambientales producidas por el hombre (creación de pantanos, sistemas de riego y pozos) potencian la aparición de reservorios de flebotomos involucrados en la enfermedad1. Más de un 50% de los perros infectados son portadores asintomáticos y pueden ser capaces de transmitir el parásito a los flebótomos vectores1.
Describimos un caso en el que se diagnostica una leishmaniasis visceral a partir de una lesión de leishmaniasis cutánea, entidades clásicamente causadas por subespecies distintas de leishmania. La picadura en nuestra paciente fue en el mes de noviembre en la ciudad de Castellón. Las especies de flebotomos responsables en España, P. perniciosus y P. ariasi, requieren para su desarrollo temperaturas en torno a los 20-25 °C y humedades relativas superiores al 90%3; muchas áreas de la Comunidad Valenciana cumplen estos requisitos incluso a finales de otoño.
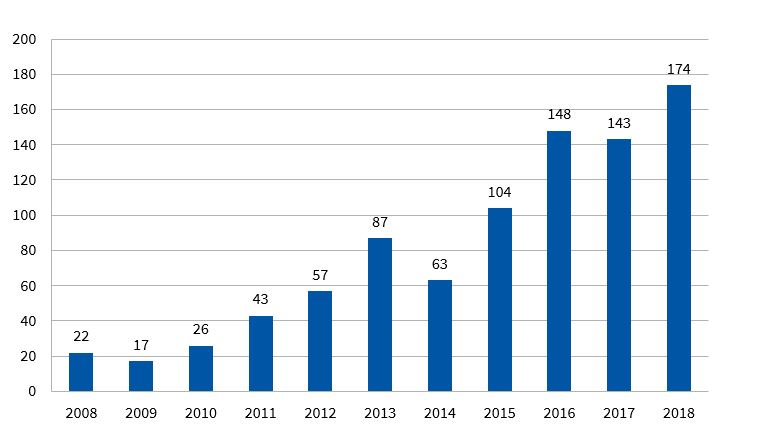
En España, la leishmaniasis no era una enfermedad de declaración obligatoria durante el periodo de 1997 a 2015. Este hecho hace sospechar una importante subdeclaración, valorada en el 25-40% para la leishmaniasis visceral y de casi el 100% para la cutánea. La mayor incidencia se da en el litoral mediterráneo y en la meseta central3. En la Comunidad Valenciana, la tasa de incidencia ha ido aumentando los últimos años. En 2018 hubo 174 casos, de ellos 27 en la provincia de Castellón, con una tasa de incidencia por 10 000 habitantes de 4,63 en dicha provincia4 (Fig. 1).
| Figura 1. Evolución temporal de casos de leishmaniasis en la Comunidad Valenciana en el último decenio |
|---|
 |

En Atención Primaria debe sospecharse leishmaniasis cutánea en lesiones localizadas en áreas expuestas que no responden al tratamiento tópico con antibióticos ni corticoides. La lesión suele comenzar como una pequeña zona de eritema en el lugar de la picadura que evoluciona a pápula y aumenta de tamaño. Posteriormente, puede ulcerarse en el centro y presentar un borde sobreelevado, bien definido e hiperpigmentado5. El diagnóstico se realiza mediante el examen microscópico y tinción Giemsa para identificar amastigotes en las muestras de piel, como fue nuestro caso.
La mayor incidencia de la leishmaniasis visceral en la edad pediátrica radica en la inmadurez del sistema inmunológico. Los mecanismos de inmunidad celular determinan la resistencia o susceptibilidad a la infección por leishmania. La activación de las células T helper (Th) desempeña un papel importante en la respuesta inmunitaria frente al parásito. Se han establecido dos tipos de respuesta según se expresen las subpoblaciones Th1 o Th2. La resistencia a la infección está mediada por la expansión de los linfocitos Th1 que producen interferón gamma e interleucina 12 (IL-12); estos mediadores activan la destrucción de los macrófagos parasitados y por tanto de las leishmania, lo que provoca la curación de la lesión. Por el contrario, la susceptibilidad a la infección se relaciona con la expansión de las células Th2 productoras de citocinas, que inhiben la respuesta celular (IL-4, IL-5, IL-10)6.
En un estudio retrospectivo realizado en el Instituto de Medicina Tropical de Asunción, en Paraguay, basado en la revisión de las historias clínicas de pacientes internados en el Servicio de Pediatría con diagnóstico al alta de leishmaniasis visceral, la edad media de presentación de la enfermedad fue de 35,4 ± 32 meses, y la distribución por sexo similar, ningún paciente positivo a virus de la inmunodeficiencia humana. La mayoría de los casos se encontraron en el grupo de edad menor de dos años. Vieron que el pronóstico de la leishmaniasis visceral en niños inmunocompetentes con tratamiento oportuno por lo general es bueno7.
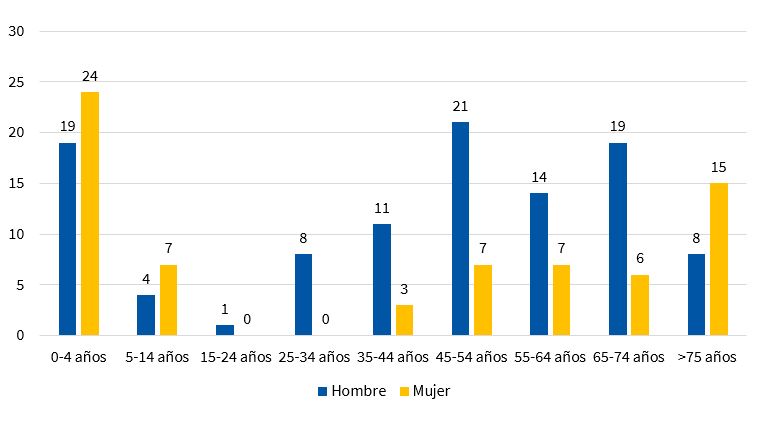
En la Comunidad Valenciana3, el grupo de edad 0 a 4 años es el que presenta mayor número de casos y en este grupo predomina la forma visceral, no así en el total de casos, en el que predomina la forma cutánea4 (Fig. 2).
| Figura 2. Casos de leishmaniasis en la Comunidad Valenciana en 2018, distribuidos por edad y sexo |
|---|
 |

Hay pocos casos descritos en la literatura médica de pacientes que presenten leishmaniasis cutánea y visceral concomitante. Hay casos en pacientes infectados por el virus de la inmunodeficiencia humana y trasplantados, en los que la inmunosupresión celular explicaría esta respuesta.
La leishmanisis cutánea-visceral en lactantes inmunocompetentes es una entidad aún menos frecuente. Los casos que se registran ocurren todos en la región mediterránea, el primero descrito en nuestro país fue el de una lactante de seis meses publicado en el año 20068, otro en un niño de dos años presentado en la Comunidad Valenciana en 20169 y otros dos casos de niños de origen marroquí publicados en 201810. La inmadurez de la respuesta inmune celular a esa edad, junto con la zona endémica podría ser la causa de esta forma de presentación atípica.
CONCLUSIÓN
La leishmaniasis es una enfermedad cuya prevalencia ha ido creciendo a nivel mundial debido al cambio climático, el aumento global de la temperatura y los proyectos agroindustriales, como sistemas de riego, que facilitan la presencia de flebotomos vectores del parásito.
La región mediterránea es una zona endémica y ya se han descrito varios casos de leishmaniasis cutánea y visceral concomitante. El antecedente de visualización de leishmania en una lesión cutánea puede ser clave en el diagnóstico de una leishmaniasis visceral en un niño con manifestaciones compatibles: fiebre, esplenomegalia y pancitopenia, es por ello por lo que, desde el Servicio de Pediatría es importante sospecharla para poder diagnosticarla.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
IL: interleucina · Th: células T helper.
BIBLIOGRAFÍA
- Ministerio de Sanidad, Servicios Sociales e Igualdad, Ministerio de Agricultura, Alimentación y Medio Ambiente. Leishmaniosis. En: Observatorio de Salud y Cambio Climático [en línea] [consultado el 03/03/2020]. Disponible en www.oscc.gob.es/es/general/salud_cambio_climatico/Leishmaniosis_es.htm
- Leishmaniasis. En: Organización Mundial de la Salud [en línea] [consultado el 03/03/2020]. Disponible en www.who.int/mediacentre/factsheets/fs375/es
- Conselleria de Sanitat, Generalitat Valenciana. Protocolo del Servicio de Vigilancia y Control Epidemiológico. Leishmaniasis. Generalitat Valenciana; 2016.
- Conselleria de Sanitat, Generalitat Valenciana. Informe de enfermedades transmitidas por vectores. Año 2018. Generalitat Valenciana; 2018.
- Del Rosal Rabes T, Baquero Artigao F, García Miguel MJ. Leishmaniasis cutánea. Rev Pediatr Aten Primaria. 2010;12:263-71.
- Liese J, Schleicher U, Bogdan C. The innate immune response against Leishmania parasites. Immunobiology. 2008;213:377-87. .
- Apodaca S, Araya S, Martínez de Cuellar C, Lovera D, Arbo A. Comportamiento clínico de la leihsmaniosis visceral en población infantil. Diez años de experiencia de un centro de referencia del Paraguay. Rev Inst Med Trop. 2015;10:12-8.
- Martínez García MS, Fernández Ibieta M, Rubio Gribble B, Salcedo E, Montes Ventura D, Auñón Martín I. Hepatoesplenomegalia febril en un lactante. Rev Pediatr Aten Primaria. 2006;8:51-63.
- García M, Pérez B, Martínez M, Meseguer P. Leishmaniasis cutánea y visceral en una lactante sana. Acta Pediatr Esp. 2016;74:e102-e105.
- Mouttaki T, Maksouri H, El Mabrouki J, Merino-Espinosa G, Fellah H, Itri M, et al. Concomitant visceral and localized cutaneous leishmaniasis in two Moroccan infants. Infect Dis Poverty. 2018;7:32.





