Tos, hipoxemia y dificultad respiratoria en el periodo neonatal. No siempre es lo que parece
Blanca Díez de los Ríos Quintaneroa, Alejandro Rasines Rodrígueza, Roberto Ortiz Movillab, Ana M.ª Malalana Martínezb, Isabel Martos Sánchezc
aMIR-Pediatría. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid. España.
bUnidad de Neonatología. Servicio de Pediatría. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid. España.
cUrgencias Pediátricas. Servicio de Pediatría. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid. España.
Correspondencia: B Díez de los Ríos . Correo electrónico: blancadiezdelosrios@gmail.com
Cómo citar este artículo: Díez de los Ríos Quintanero B, Rasines Rodríguez A, Ortiz Movilla R, Malalana Martínez AM, Martos Sánchez I. Tos, hipoxemia y dificultad respiratoria en el periodo neonatal. No siempre es lo que parece. Rev Pediatr Aten Primaria. 2019;21:e81-e85.
Publicado en Internet: 19-06-2019 - Número de visitas: 21642
Resumen
La dificultad respiratoria en el periodo neonatal tardío constituye un reto pediátrico no solo diagnóstico, sino de tratamiento, ya que a las múltiples causas del cuadro se deben sumar los factores inherentes a la propia vulnerabilidad del niño. En la práctica habitual, la principal causa de estos cuadros son las infecciones (fundamentalmente víricas), aunque se deben tener en cuenta otras etiologías como cardiológicas, digestivas, metabólicas o anatómicas. Presentamos un caso clínico de tos, dificultad respiratoria e hipoxemia en un neonato de 17 días de vida en el que los datos de la anamnesis, la exploración y el cuadro clínico condujeron a la realización de pruebas complementarias específicas que llevaron al diagnóstico de neumonía por Chlamydia. Realizaremos asimismo una revisión sobre el estado actual de la cuestión basándonos en el cuadro clínico que presentaba el recién nacido.
Palabras clave
● Chlamydia sp. ● Dificultad respiratoria ● Hipoxemia ● Neumonía ● Recién nacidoINTRODUCCIÓN
La dificultad respiratoria en la etapa neonatal tardía es un motivo de consulta relativamente frecuente en las consultas pediátricas de Atención Primaria. Aunque la mayoría de las veces se asocia a procesos infecciosos virales (sobre todo en época epidémica), el clínico se enfrenta a un amplio abanico diagnóstico a la hora de abordar estos cuadros, especialmente cuando los signos de infección respiratoria aguda viral son escasos. Las infecciones bacterianas neonatales tardías, ciertas cardiopatías congénitas u otras anomalías anatómicas congénitas intratorácicas son algunas de las patologías que pueden debutar con dificultad respiratoria en edades tempranas de la vida. Cuando se trata de enfermedades poco frecuentes se necesita un alto índice de sospecha para poder establecer el diagnóstico y el mejor tratamiento del paciente, como ocurrió en el caso que ahora describimos.
CASO CLÍNICO
Recién nacido remitido por su pediatra a la urgencia hospitalaria por dificultad respiratoria y cianosis. Como antecedentes personales destacaban un embarazo con control tardío, en una madre joven (21 años), tercípara. Las serologías de infección connatal fueron negativas (rubeola inmune) y las ecografías del segundo y tercer trimestre de gestación normales. El parto fue eutócico a las 41 semanas de edad gestacional y el recién nacido no precisó reanimación. El peso al nacimiento fue elevado para la edad gestacional (4080 g). No existieron factores de riesgo infeccioso perinatal. Fue dado de alta con 3800 g de peso a las 48 horas de vida, con exploración clínica normal. Acudió a los 17 días a su pediatra, refiriendo polipnea desde la primera semana de vida acompañada en los últimos 2-3 días de tos seca, en accesos, no emetizante, sin gallo inspiratorio. No presentaba fiebre ni rinorrea. No había tampoco ambiente epidémico catarral estacional en la comunidad ni en su hogar. Tras objetivarse dificultad respiratoria franca con tiraje subcostal y cianosis labial se decide remitir a urgencias hospitalarias.
A su llegada presentaba un peso de 3504 g (pérdida del 15% respecto al nacimiento), con temperatura 37,1 °C (axilar), polipnea franca con 92 respiraciones/minuto, tiraje subcostal y supraesternal leve, cianosis central y saturación de oxígeno en pulsioximetría del 70%. Se observó una discreta taquicardia con tensión arterial normal sin diferencial entre miembros superiores e inferiores. El niño se encontraba activo, vital, sin aspecto séptico, con relleno capilar de 2-3 segundos. La auscultación cardiaca era normal y la auscultación pulmonar objetivó un murmullo vesicular algo disminuido en bases, con algún subcrepitante aislado. Se constató también una hepatomegalia de rebordes lisos a 2 cm de reborde costal. El resto de la exploración pediátrica general fue normal. No presentaba rinorrea ni conjuntivitis.
Tras proceder a estabilizar al paciente con oxigenoterapia se inició estudio etiológico del cuadro con extracción de hemograma (20 440 leucocitos con discreta desviación izquierda, sin eosinofilia), gasometría (acidosis respiratoria moderada compensada), proteína C reactiva (46,3 mg/l), recogida de hemocultivo (informado durante el ingreso como estéril) y radiografía de tórax (Fig. 1) que mostró unos infiltrados difusos parcheados bilaterales, con condensación parenquimatosa retrocardiaca asociada. Se realizó también una ecocardiografía que fue normal. El estudio de antígenos rápidos para virus respiratorios (adenovirus, influenza, virus respiratorio sincitial) fue negativo y se extrajo aspirado nasofaríngeo para realización de una prueba de reacción en cadena de la polimerasa (PCR) para Bordetella que también fue informado como negativo en las siguientes horas.
| Figura 1. Radiografía de tórax. Infiltrados difusos bilaterales. Condensación parenquimatosa retrocardiaca |
|---|
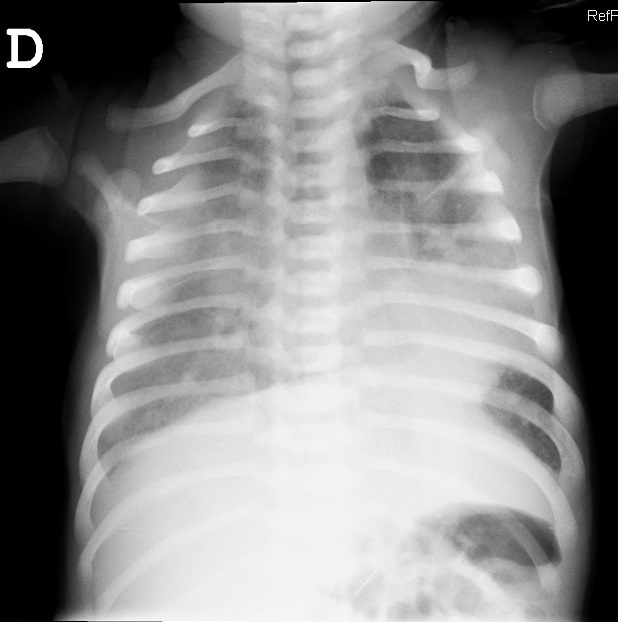 |

Dado el cuadro clínico-analítico, la edad del niño y la radiología compatible con infección neumónica se decidió ingreso, con ventilación no invasiva, tratamiento intravenoso con fluidoterapia y antibioterapia empírica con cefotaxima y vancomicina, añadiéndose eritromicina a las pocas horas para cubrir la posibilidad neumonía atípica en el periodo neonatal. Tras reevaluar el cuadro clínico y los datos de la anamnesis y las pruebas complementarias, se recogió muestra de aspirado nasofaríngeo para realización de PCR de Chlamydia, que fue positiva, confirmándose los mismos hallazgos en el exudado vaginal que se extrajo a la madre. Por ello, se decidió dejar eritromicina en monoterapia, que fue pasada a vía oral al cuarto día del ingreso. La evolución clínica fue favorable, aunque necesitó soporte respiratorio en cuidados intensivos con lento descenso del soporte ventilatorio hasta su retirada definitiva al décimo día del ingreso. Fue dado de alta a los once días del ingreso, completando de forma ambulatoria el tratamiento antibiótico hasta un total de 14 días con eritromicina. Tanto la madre como su pareja recibieron tratamiento con azitromicina oral.
DISCUSIÓN
El género Chlamydia sp. tiene tres especies que causan enfermedad en humanos: C. trachomatis, responsable de infecciones urogenitales, tracoma, conjuntivitis, neumonía y linfogranuloma venéreo; C. pneumoniae, la cual puede causar bronquitis, sinusitis, neumonía y posiblemente aterosclerosis y C. psittaci, causante de neumonía (psitacosis)1,2.
La infección por Chlamydia trachomatis es la enfermedad de transmisión sexual más frecuente en EE. UU. y aunque puede producir uretritis, cervicitis o enfermedad inflamatoria pélvica, muchas veces cursa de forma asintomática3. Los recién nacidos de madres infectadas tienen riesgo de adquirir este germen y presentar conjuntivitis o neumonía en el periodo neonatal o del lactante. La infección es principalmente transmitida a través de secreciones infectadas del canal del parto1,3. Se estima que un 2-20% de las gestantes son portadoras de C. trachomatis, y es más frecuente en adolescentes o mujeres jóvenes3,4. Un 60-70% de los recién nacidos por parto vaginal de madres con una infección activa por C. trachomatis en el momento del parto contraerán la infección, aunque no todos la desarrollarán. Aproximadamente un 20-50% presentarán conjuntivitis y un 5-30% neumonía en el periodo neonatal o en los primeros meses de vida3. Los factores de riesgo para el desarrollo de esta infección tras el nacimiento son el tipo de parto, la edad materna, y la presencia de otras enfermedades concurrentes o alteraciones anatómicas o histológicas del canal del parto1.
En la infancia, las principales manifestaciones clínicas de la infección por C. trachomatis son la neumonía, como el caso expuesto, y la conjuntivitis. La neumonía puede manifestarse durante los tres primeros meses de vida, mientras que la conjuntivitis suele presentarse, en las tres primeras semanas1,3. La neumonía por este microorganismo comienza generalmente como un cuadro insidioso de congestión nasal, taquipnea y tos productiva, de unas tres semanas o más de evolución hasta que debuta la enfermedad. En la auscultación es común encontrar crepitantes inspiratorios que en la radiografía de tórax se reflejan como infiltrados generalmente bilaterales y de características intersticiales. Es típico encontrar también a nivel analítico eosinofilia, hipoxemia y elevación de inmunoglobulinas en suero1,3. Ocasionalmente se puede palpar el hígado o el bazo debido a la hiperinsuflación pulmonar.
Aproximadamente la mitad de los pacientes que desarrollan neumonía tiene una historia previa de conjuntivitis en el periodo neonatal3. Esta conjuntivitis tiene un periodo de incubación de entre 5 y 14 días tras el parto. Las manifestaciones clínicas son variables, pero generalmente presentan una marcada secreción mucopurulenta, con hiperemia e inyección conjuntival3. En cuadros evolucionados y sin tratamiento se puede manifestar cicatrices corneales y conjuntivales con mal pronóstico. Sin embargo, con tratamiento precoz el pronóstico es muy bueno, consiguiendo resolución completa del cuadro1,3.
En el caso clínico que nos ocupa, la edad materna, la evolución subaguda con tos no pertusoide además de la ausencia de fiebre y síntomas catarrales, hicieron considerar a Chlamydia trachomatis como posible agente etiológico a pesar de no observarse eosinofilia ni tener antecedente de conjuntivitis neonatal. Las características clínicas y los hallazgos de las pruebas complementarias realizadas hacían menos probable otras etiologías responsables del cuadro.
El patrón oro para el diagnóstico de C. trachomatis en lactantes y niños es el cultivo de exudado conjuntival o nasofaríngeo3. En los últimos años las técnicas de amplificación de ácidos nucleicos se han convertido en el nuevo método de referencia para el diagnóstico de las infecciones por Chlamydia, ya que tienen una elevada sensibilidad y especificidad (incluso superior al cultivo) y mayor rapidez en la obtención de resultados. En nuestro caso se realizaron técnicas de detección de PCR de Chlamydia sp. en las secreciones respiratorias del recién nacido y, tras confirmarse su positividad, se tomó muestra de exudado vaginal materno que también fue positiva, infiriéndose que C. trachomatis era la responsable de la infección en ambas muestras.
El tratamiento de elección tanto para la conjuntivitis como para la neumonía por Chlamydia trachomatis es eritromicina a dosis de 50 mg/kg/día cada seis horas durante 14 días, por vía oral1,3,6. En el caso de las conjuntivitis por este germen, se ha demostrado que el tratamiento tópico no tiene eficacia alguna. Se debe aplicar por tanto siempre antibioterapia oral, con eritromicina (de elección) o azitromicina (a 20 mg/kg/día cada 8 horas), durante tres días, ambas con excelentes resultados clínicos6. Tanto con el uso de la eritromicina como con la azitromicina, se ha descrito como efecto adverso el desarrollo a posteriori de estenosis hipertrófica del píloro (EHP). El riesgo aumenta cuando el paciente tiene menos de dos meses de edad, por lo que en los recién nacidos o lactantes tratados con estos fármacos se les debe recomendar control clínico domiciliario estrecho con vigilancia de los signos de aparición de esta enfermedad1,3. También se ha de tratar a la madre infectada y a su pareja con azitromicina o doxiciclina.
La evolución de los recién nacidos o lactantes con neumonía tras el tratamiento antibiótico suele ser buena, no se han demostrado complicaciones a largo plazo en estos pacientes. Sin embargo, estudios actuales postulan una asociación entre la existencia de un antecedente infeccioso por Chlamydia y la manifestación de enfermedades respiratorias crónicas en la infancia, especialmente asma7,8.
A pesar de la alta prevalencia de infección por Chlamydia trachomatis en mujeres jóvenes, actualmente en nuestro medio no se realiza ningún método de cribado universal de esta infección. El cribado en la mujer embarazada se realiza en 7 de los 25 países miembros de la UE, pero discrepancias en torno a su efectividad clínica y su coste-beneficio hacen que una mayoría no incluyan esta prueba dentro de las realizadas de rutina en el seguimiento de la gestación9. En EE. UU., el Centro para el Control y Prevención de Enfermedades) también recomienda este cribado prenatal, ya que la infección por este microorganismo parece relacionarse en la mujer embarazada con corioamnionitis y riesgo aumentado de parto pretérmino, además del riesgo de transmisión al recién nacido, ya comentado6. Por otra parte, en cuanto a la conjuntivitis por C. trachomatis, el diagnóstico de la infección en la embarazada también sería la mejor forma de prevenirla, dado que el tratamiento tópico actualmente utilizado para la prevención de la oftalmia neonatales es efectivo frente a la infección gonocócica, pero no frente a la producida por Chlamydia3. Hoy en día se considera que la utilización de profilaxis antibiótica oral en recién nacidos expuestos tampoco es costoefectiva3,10.
CONCLUSIÓN
Ante un cuadro de tos, dificultad respiratoria e hipoxemia en el periodo neonatal tardío o en los primeros meses de vida, se debe tener en cuenta que las infecciones por Chlamydia trachomatis pueden ser la causa de este, lo que obligará al despistaje de la infección por este germen si el cuadro clínico y los antecedentes epidemiológicos sugieren su etiología.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
PCR: reacción en cadena de la polimerasa.
BIBLIOGRAFÍA
- Darville T. Chlamydia trachomatis infections in neonates and young children. Semin Pediatr Infect Dis. 2005;16:235-44.
- Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson JL, Loscalzo J (eds.). Harrison. Principios de medicina interna. Vol. 1. 18.ª edición. México: McGraw-Hill; 2012. p. 1421-8.
- Pammi M, Hammerschlag MR. Chlamydia trachomatis infections in the newborn. En: UpToDate [en línea] [consultado el 12/06/2019]. Disponible en www.uptodate.com/contents/chlamydia-trachomatis-infections-in-the-newborn
- American Academy of Pediatrics. Chlamydia trachomatis. En: Kimberlin DW, Brady MT, Jackson MA, Long SS (eds.). American Academy of Pediatrics. Red Book: 2018 Report of the Committee on Infectious Diseases. 31.ª edición. Itasca: American Academy of Pediatrics; 2018. p. 276.
- Rodríguez-Domínguez M, Sanbonmatsu S, Salinas J, Alonso R, Gutiérrez J, Galán JC. Diagnóstico microbiológico de las infecciones por Chlamydia spp. y especies relacionadas. Enferm Infecc Microbiol Clin. 2014;32:380-5.
- Miller KE. Diagnosis and treatment of Chlamydia trachomatis infection. Am Fam Physician. 2006;73:1411-6.
- Webley W, Tilahun Y, Lay K, Patel K, Stuart ES, Andrzejewski C, et al. Occurrence of Chlamydia trachomatis and Chlamydia pneumoniae in pediatric respiratory infections. Respir J. 2009;33:360-7.
- Jupelli M, Murthy AK, Chaganty BKR, Guentzel MN, Selby DM, Vasquez MM, et al. Neonatal chlamydial pneumonia induces altered respiratory structure and function lasting into adult life. Lab Investig. 2011;91:1530-9.
- Rours GI, Smith-Norowitz TA, Ditkowky J, Hammerschlag MR, Verkooyen RP, de Groot R, et al. Cost-effectiveness analysis of Chlamydia trachomatis screening in Dutch pregnant women. Pathog Glob Health. 2016;110:292-302.
- Rosenman MB, Mahon BE, Downs SM, Kleiman MB. Oral erythromycin prophylaxis vs watchful waiting in caring for newborns exposed to Chlamydia trachomatis. Arch Pediatr Adolesc Med. 2003;157:565-71.






