Vol. 19 - Num. 74
Notas clínicas
Linfadenitis por Mycobacterium bovis, una entidad a tener en cuenta
Diego Mauricio Peñafiel Freirea, Miguel Ángel Resano Abarzuzab, Lorea Urriza Yereguic, Ilargi Urriza Ripac, Inés Niyubahwec, Mercedes Herranz Aguirred
aServicio de Pediatría. Complejo Hospitalario de Navarra. Pamplona. España.
bMIR-Anatomía Patológica. Complejo Hospitalario de Navarra. Pamplona. España.
cMIR-Pediatría. Complejo Hospitalario de Navarra. Pamplona. España.
dSección de Enfermedades Infecciosas Pediátricas. Servicio de Pediatría. Complejo Hospitalario de Navarra. Servicio Navarro de Salud. Pamplona. Instituto de Investigación Sanitaria de Navarra (IdisNA). Pamplona. España.
Correspondencia: DM Peñafiel. Correo electrónico: dpfreire.89@gmail.com
Cómo citar este artículo: Peñafiel Freire DM, Resano Abarzuza MA, Urriza Yeregui L, Urriza Ripa I, Niyubahwe I, Herranz Aguirre M. Linfadenitis por Mycobacterium bovis, una entidad a tener en cuenta. Rev Pediatr Aten Primaria. 2017;19:147-50.
Publicado en Internet: 27-04-2017 - Número de visitas: 22569
Resumen
Las medidas de control del ganado y la pasteurización de los productos lácteos han hecho que la enfermedad tuberculosa por Mycobacterium bovis sea infrecuente en nuestro medio. El diagnóstico de esta entidad requiere un alto índice de sospecha, fundado en una historia clínica detallada y pruebas complementarias oportunas. La presentación más frecuente es extrapulmonar, principalmente como linfadenitis, por lo que ante una adenopatía de mala evolución se recomienda remitir al paciente para estudio y valorar la realización de punción aspiración con aguja fina para examen citológico y cultivo. Presentamos un caso de linfadenitis por M. bovis en una niña de siete años que respondió adecuadamente al tratamiento médico.
Palabras clave
● Diagnóstico ● Mycobacterium bovis ● Punción aspiración con aguja fina ● TuberculosisINTRODUCCIÓN
La tuberculosis es un problema importante de salud pública, con una morbimortalidad elevada. Según la Organización Mundial de la Salud, a nivel mundial y en 2014, se han producido 9,6 millones de nuevos infectados, de los que el 10,42% eran niños, y se estima una mortalidad global de un millón y medio de personas, el 9,3% niños1.
Los distintos patógenos que causan esta enfermedad se engloban dentro de lo que denominamos Mycobacterium tuberculosis complex, término que incluye a M. tuberculosis, M. bovis, bacilo de Calmette-Guérin (cepa vacunal BCG), M. africanum y M. caneti.
M. bovis infecta fundamentalmente al ganado, sobre todo bovino, siendo este su reservorio habitual. Se trata de una zoonosis que se adquiere principalmente tras la ingesta de lácteos que no han pasado un control sanitario, o bien por inhalación de aerosoles de bacilos tuberculosos provenientes de animales infectados (se puede transmitir por partículas inhaladas); por esto las medidas de vigilancia de estas infecciones en el ganado son claves en la prevención de dicha enfermedad en humanos2,3. Aunque la trasmisión persona-persona está descrita, es excepcional.
En los países industrializados, la enfermedad por M. bovis es menos del 1%. El 1,9% de los cultivos positivos para Mycobacterium tuberculosis complex detectados en el Centro Nacional de Microbiología entre 2004 y 2007 correspondieron a M. bovis4.
CASO CLÍNICO
Niña de siete años nacida en España y sin patología previa que es remitida a la Unidad de Infectología Pediátrica por adenopatías dolorosas submandibulares izquierdas de un mes de evolución, sin respuesta al tratamiento con amoxicilina-ácido clavulánico y antiinflamatorio oral.
La paciente no había presentado fiebre, sudoración nocturna ni pérdida de peso. No estaba vacunada de BCG. Durante un mes al año visita Marruecos, donde tiene contacto con animales (ovejas, corderos) y consume lácteos sin pasteurizar.
En la exploración física presenta un conglomerado submandibular izquierdo de adenopatías, doloroso a la palpación, duro, no rodadero ni adherido, la mayor de las adenopatías de 2 × 2 cm. El resto de la exploración física y anamnesis por aparatos no presentaba hallazgos patológicos.
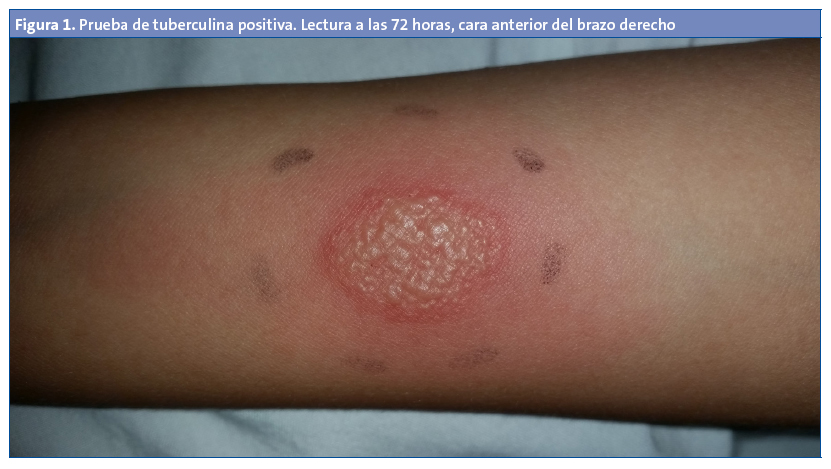
Dada la falta respuesta al tratamiento y teniendo en cuenta los datos epidemiológicos, se realizó la prueba de tuberculina, que fue positiva, con una induración de 10 mm con patrón vesicular a las 72 horas (Fig. 1). La radiografía de tórax y la ecografía abdominal fueron normales.
Las serologías de Brucella, virus de Epstein-Barr (VEB) y citomegalovirus (CMV) fueron negativas. La analítica mostró hemograma normal, velocidad de sedimentación globular (VSG) de 47 mm/hora y el interferon-gamma release assays (IGRA) (QuantiFERON®) fue positivo, con un valor de 10,15 (rango normal: 0-0,35).
Se realizó una punción aspiración con aguja fina (PAAF) de la adenopatía, que mostraba un material espeso de coloración blanquecina. El cultivo y el estudio citológico revelaron un patrón de linfadenitis granulomatosa necrotizante.
Dada la escasa afectación de la paciente y la sospecha de adenitis tuberculosa, se pautó un tratamiento domiciliario inicial con isoniacida, rifampicina y pirazinamida, a la espera del cultivo de la muestra obtenida mediante PAAF. El cultivo fue positivo para M. bovis, presentando un antibiograma con resistencia a pirazinamida y sensibilidad a estreptomicina, etambutol, isoniacida y rifampicina. Por este motivo se sustituyó la pirazinamida por etambutol durante dos meses, continuando posteriormente con isoniacida y rifampicina hasta finalizar seis meses. Los cultivos de micobacterias en jugos gástricos fueron negativos. Durante ese tiempo la paciente acudió a revisiones periódicas en el Servicio de Infectología Pediátrica, en las que se constató una buena evolución clínica y la resolución completa del proceso infeccioso.
DISCUSIÓN
La enfermedad tuberculosa por M. bovis es poco frecuente en nuestro medio, por lo que hay que tener en cuenta factores de riesgo que nos hagan sospechar dicha etiología, como el consumo de derivados lácteos sin pasteurizar o el contacto con animales o personas infectadas5.
Los hallazgos anatomopatológicos mediante PAAF de las adenopatías pueden orientar el diagnóstico si es realizado por patólogos expertos. Ante toda adenopatía de mala evolución estaría indicada su realización. El hallazgo de granulomas no es patognomónico de tuberculosis, pero es orientativo dependiendo de la sospecha del clínico y una vez se hayan descartado infección por micobacterias atípicas y enfermedades por otros gérmenes como Toxoplasma y Bartonella spp.6.
En el tratamiento de esta infección se recomienda el empleo de tuberculostáticos durante seis meses, inicialmente tres fármacos durante dos meses y posteriormente con dos fármacos7. Mycobacterium bovis presenta una mutación que le confiere resistencia a la pirazinamida8. En nuestro caso sustituimos la pirazinamida por etambutol, ajustando el tratamiento según los resultados del antibiograma.
La exéresis quirúrgica puede estar indicada en caso de mala respuesta al tratamiento médico, aunque en ocasiones el tratamiento médico es suficiente, como nuestro caso6.
Podemos sospechar esta infección en pacientes que hayan estado en países con mayor prevalencia y que presenten enfermedad extrapulmonar, sobre todo una linfadenitis de mala evolución con datos epidemiológicos que la sugieran.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: BCG: bacilo de Calmette-Guérin · CMV: citomegalovirus · IGRA: interferon-gamma release assays · PAAF: punción aspiración con aguja fina · VEB: virus de Epstein-Barr · VSG: velocidad de sedimentación globular.
BIBLIOGRAFÍA
- En: Organización Mundial de la Salud [en línea] [consultado el 25/04/2017]. Disponible en www.who.int/mediacentre/factsheets/fs104/es/
- Mycobacterium bovis (Bovine Tuberculosis) in humans. Fact sheets. En: Centers for Disease Control and Prevention [en línea] [consultado el 25/04/2017]. Disponible en www.cdc.gov/tb/publications/factsheets/general/mbovis.htm
- Jemal AM. Review on zoonotic importance of bovine tuberculosis and its control. Open Access Library J. 2016;3:e2504.
- Rodríguez E, Sánchez LP, Pérez S, Herrera L, Jiménez MS, Samper S, et al. Human tuberculosis due to Mycobacterium bovis and M. caprae in Spain, 2004-2007. Int J Tuberc Lung Dis. 2009;13(12):1536-41.
- Majoor CJ, Magis-Escurra C, van Ingen J, Boeree MJ, van Soolingen D. Epidemiology of Mycobacterium bovis Disease in Humans, the Netherlands, 1993-2007. Emer Infec Dis. 2011;17:457-63.
- Núñez Cuadros E, Baquero Artiago F, Grupo de trabajo sobre infección por micobacterias no tuberculosas de la Sociedad Española de Infectología Pediátrica (SEIP). Recomendaciones de la Sociedad Española de Infectología Pediátrica sobre el diagnóstico de las adenitis por micobacterias no tuberculosas. An Pediatr (Barc). 2012;77:208.e1-208.e12.
- Grupo de Trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica (SEIP). Documento de consenso sobre el tratamiento de la tuberculosis extrapulmonar y formas complicadas de tuberculosis pulmonar. An Pediatr (Barc). 2008;69:271-8.
- Cuevas-Córdoba B, Zenteno Cuevas R. Tuberculosis drogorresistente: mecanismos moleculares y métodos diagnósticos. Enferm Infecc Microbiol Clin. 2010;28:621-8.





