Vacunación frente a la gripe estacional en la infancia y la adolescencia. Recomendaciones del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) para la campaña antigripal 2016-2017
David Moreno Péreza, Nuria García Sánchezb, J Arístegui Fernándezc, Jesús Ruiz Contrerasd, FJ Álvarez Garcíae, Ángel Hernández Merinof, Manuel Merino Moínag, M.ª José Cilleruelo Ortegah, Josep M.ª Corretger Raueti, Teresa Hernández-Sampelayo Matosj, L Ortigosa del Castillok, Comité Asesor de Vacunas de la Asociación Española de Pediatría
aInfectología Pediátrica e Inmunodeficiencias. Unidad de Gestión Clínica de Pediatría. Hospital Materno-Infantil. Hospital Regional Universitario de Málaga. Grupo de Investigación IBIMA. Facultad de Medicina. Universidad de Málaga. Málaga. España.
bPediatra. CS Delicias Sur. Zaragoza. España.
cUnidad de Infectología Pediátrica. Hospital Universitario de Basurto. Departamento de Pediatría. Facultad de Medicina de la Universidad del País Vasco (UPV/EHU). Bilbao. España.
dServicio de Pediatría. Hospital Universitario 12 de Octubre. Universidad Complutense de Madrid. Madrid. España.
ePediatra. CS de Llanera. Departamento de Medicina. Universidad de Oviedo. Asturias. España.
fPediatra de Atención Primaria. Madrid. Vocal del Comité Asesor de Vacunas de la AEP. España.
gPediatra. CS El Greco. Getafe. Madrid. España.
hServicio de Pediatría. Hospital Universitario Puerta de Hierro-Majadahonda. Facultad de Medicina. Universidad Autónoma de Madrid. Madrid. España.
iConsell Assessor de Vacunacions. Departament de Salut. Generalitat de Catalunya. Barcelona. España.
jServicio de Pediatría. Hospital General Universitario Gregorio Marañón. Facultad de Medicina. Universidad Complutense de Madrid. Madrid. España.
kServicio de Pediatría. Hospital Universitario Ntra. Sra. de Candelaria. Facultad de Medicina. Universidad de La Laguna. Tenerife. España.
Correspondencia: D Moreno. Correo electrónico: dmp.malaga@gmail.com
Cómo citar este artículo: Moreno Pérez D, García Sánchez N, Arístegui Fernández J, Ruiz Contreras J, Álvarez García FJ, Hernández Merino A, et al. Vacunación frente a la gripe estacional en la infancia y la adolescencia. Recomendaciones del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) para la campaña antigripal 2016-2017. Rev Pediatr Aten Primaria. 2016;18:e173-e197.
Publicado en Internet: 26-10-2016 - Número de visitas: 22829
Resumen
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) emite todos los años sus recomendaciones sobre la vacunación frente a este virus en la infancia y la adolescencia.
La vacunación de la gripe es una actuación especialmente beneficiosa cuando va dirigida a personas –niños y adultos– que se incluyen en los grupos de población considerados de riesgo. Sin embargo, muchos niños y adolescentes pertenecientes a estos grupos de riesgo, y sus convivientes, continúan sin recibir, por distintas razones, dicha vacunación anual. Asimismo, se insiste en la recomendación de la vacunación de los profesionales sanitarios.
En el presente documento se presentan las recomendaciones para la vacunación antigripal en la temporada 2016-2017, y se explican los fundamentos y limitaciones de las mismas.
Es necesaria una mayor implicación de los profesionales, las autoridades sanitarias y todos los agentes sociales para transmitir cada año a la población, y de forma especial a los padres de niños y adolescentes pertenecientes a los grupos de riesgo, las recomendaciones de vacunación frente a la gripe estacional.
Palabras clave
● Adolescentes ● Enfermedades crónicas ● Gripe ● Inmunizaciones ● Niños ● VacunasRESUMEN DE LAS RECOMENDACIONES DEL CAV-AEP PARA LA CAMPAÑA ANTIGRIPAL 2016-2017
Con relación a la infancia y la adolescencia, el CAV-AEP recomienda la vacunación antigripal en:
- Grupos de riesgo: niños a partir de los seis meses de edad y adolescentes en determinadas situaciones o con enfermedades de base.
- Niños sanos a partir de los seis meses de edad, adolescentes y adultos sanos que convivan con pacientes de riesgo.
- Miembros del entorno familiar cuando existan lactantes menores de seis meses de edad con factores de riesgo, ya que estos no pueden recibir la vacuna antigripal.
- Todos los profesionales sanitarios.
Se recomienda emplear preferentemente vacunas antigripales tetravalentes, tanto inactivadas para su uso por vía intramuscular (aunque no va a ser distribuida esta temporada por decisión del fabricante) como atenuadas por vía intranasal, con las indicaciones y posología de sus fichas técnicas correspondientes.
El CAV-AEP considera que la vacunación antigripal de los niños mayores de seis meses, no incluidos en grupo de riesgo, si sus padres lo solicitan y su pediatra lo considera conveniente, es una medida recomendable dada la elevada tasa de complicaciones asociadas a la gripe en este grupo de edad.
INTRODUCCIÓN
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) emite todos los años, antes del inicio de la temporada gripal, sus recomendaciones sobre la vacunación frente a este virus en la infancia y la adolescencia1. La vacunación de la gripe es una actuación especialmente beneficiosa cuando va dirigida a personas –niños y adultos– que se incluyen en los grupos de población considerados de riesgo. Pertenecen a estos grupos de riesgo quienes, debido a la condición o enfermedad de base que padezcan o por el tratamiento que reciben, pueden padecer formas complicadas y más graves de la gripe o sufrir una desestabilización de su enfermedad de base, lo que comporta un mayor riesgo de mortalidad. Sin embargo, muchos niños y adolescentes pertenecientes a estos grupos de riesgo, y sus convivientes, continúan sin recibir, por distintas razones, dicha vacunación anual2. De hecho, las coberturas en niños con enfermedades de base no superan el 20% en algunas áreas3. Es necesaria una mayor implicación de los profesionales, las autoridades sanitarias y todos los agentes sociales para transmitir cada año a la población, y de forma especial a los padres de niños y adolescentes pertenecientes a los grupos de riesgo, las recomendaciones de vacunación frente a la gripe estacional.
Algunos países han optado por la vacunación antigripal universal de niños, con diferentes estrategias en cuanto a franjas de edad y preparados vacunales antigripales elegidos. La información procedente de estos programas, expuesta a lo largo del documento, es de suma importancia para la toma de decisiones.
VACUNA ANTIGRIPAL PARA LA TEMPORADA 2016-2017
Basándose en la experiencia acumulada en las últimas temporadas, la Organización Mundial de la Salud (OMS) ha recomendado para la temporada 2016-2017 en el hemisferio norte4:
- Mantener la cepa A/H1N1: es la misma de la temporada pasada. Procede de la cepa H1N1-2009 pandémica, que ha sido empleada desde entonces en todas las campañas.
- Cambiar la cepa A/H3N2: el año pasado se empleó la A/Switzerland/9715293/2013, mientras que este año será la A/Hong Kong/4801/2014.
- Cambio de estrategia con las cepas B: la temporada pasada, para las vacunas trivalentes se empleó una cepa de linaje Yamagata (B/Phuket/3073/2013), mientras que la cepa B adicional en las tetravalentes era de linaje Victoria (B/Brisbane/60/2008). Este año se ha decidido intercambiar las mismas cepas. En las trivalentes se empleará la cepa B linaje Victoria (B/Brisbane/60/2008), mientras que en las tetravalentes se empleará, además, la cepa de linaje Yamagata (B/Phuket/3073/2013).
En resumen, las vacunas trivalentes verán cambiadas sus cepas A/H3N2 y B, mientras que las tetravalentes solo tendrán el cambio de la A/H3N2 (Tabla 1).

RECOMENDACIONES SOBRE VACUNACIÓN ANTIGRIPAL DEL COMITÉ ASESOR DE VACUNAS DE LA AEP PARA 2016-2017
Con relación a la infancia y a la adolescencia, el CAV-AEP recomienda la vacunación antigripal en las situaciones reflejadas en la Tabla 2.

Para el CAV-AEP, la vacunación antigripal en todos estos pacientes y en sus contactos representa un beneficio claro y constituye una oferta de salud relevante.
Cualquier facultativo, ante situaciones que supongan un riesgo de gripe complicada, pero que no figuren en esta lista, deberá emplear su juicio clínico para hacer la indicación si lo considera pertinente.
Es un deber de todos los profesionales sanitarios implicados informar y recomendar la vacunación antigripal a las personas en las que está indicada, tan pronto como esté disponible la vacuna, obteniéndose el máximo beneficio si la aplicación se produce antes del inicio de la estación gripal. De todas formas, si no se ha podido administrar a tiempo, puede hacerse en cualquier momento de la temporada, mientras exista circulación del virus.
La vacunación antigripal universal de todos los niños, en el momento actual, en nuestro medio y con las vacunas disponibles, precisa de estudios de eficiencia y coste-beneficio que permitan valorar el coste y el impacto de esta medida preventiva, así como la toma justificada de decisiones como medida de salud pública. Sin embargo, el CAV-AEP considera que la vacunación antigripal de los niños mayores de seis meses, no incluidos en grupo de riesgo, si sus padres lo solicitan y su pediatra lo considera conveniente, es una medida recomendable dada la elevada tasa de complicaciones asociadas a la gripe en este grupo de edad.
Este comité, al igual que otras sociedades científicas de España, desea hacer un especial énfasis en la vacunación antigripal de todos los profesionales sanitarios en contacto con pacientes.
Nuevas indicaciones
Para esta temporada, el CAV-AEP ha añadido dos nuevas situaciones a los grupos de riesgo clásicos:
- Los niños con implante coclear tienen un riesgo aumentado de padecer meningitis por bacterias de origen nasofaríngeo y la gripe puede favorecer este fenómeno, lo que llevó a ciertos organismos como la Academia Americana de Pediatría a proponer esta recomendación5.
- Por otro lado, las enfermedades reumáticas sitúan al niño en mayor riesgo de infecciones, tanto por la propia enfermedad reumática como por el efecto de los fármacos antirreumáticos. Cada año deberían, por lo tanto, ser vacunados frente a la gripe estacional6. La vacuna antigripal inactivada es segura, no produce efectos adversos serios ni modifica la actividad de la enfermedad. Asimismo, la respuesta inmunológica es adecuada, observándose respuestas similares entre los niños con enfermedades reumáticas que reciben fármacos antirreumáticos y los controles sanos vacunados7 e incluso cuando se recibe tratamiento con corticoides a dosis no elevadas, fármacos modificadores de la enfermedad o algunos fármacos biológicos, aunque su inmunogenicidad puede disminuir cuando el paciente está siendo tratado con fármacos anti-TNF-alfa o con rituximab. En general, se debe emplear la vacuna inactivada en estos pacientes. La seguridad y eficacia de las vacunas vivas atenuadas, administradas al mismo tiempo que los inmunomoduladores recombinantes o anticuerpos monoclonales frente a linfocitos B (rituximab), no se conoce bien, recomendándose, por lo tanto, no utilizarlas en pacientes durante estos tratamientos.
ASPECTOS PRÁCTICOS: POSOLOGÍA, CONSERVACIÓN Y ADMINISTRACIÓN
Posología
En los niños menores de nueve años, para la obtención de una protección óptima frente a la gripe, son necesarias dos dosis de la vacuna, separadas por, al menos, cuatro semanas8,9. La primera dosis debe administrarse tan pronto como la vacuna esté disponible, para asegurar así que ambas dosis puedan ser recibidas antes del inicio o al comienzo de la actividad gripal, ya que la protección es mayor cuando ambas dosis se administran durante la misma temporada de gripe8. Es suficiente una sola dosis si el paciente ha recibido, al menos, dos dosis de vacuna en temporadas previas (no es necesario que estas hayan sido administradas en la misma temporada)8 (Tabla 3).

En cuanto a la cantidad de antígeno en cada acto de vacunación antigripal por vía intramuscular, está aceptada de forma general la administración de la dosis completa (0,5 ml) a partir de los 36 meses de edad. En niños de 6 a 35 meses no hay una evidencia clara sobre la idoneidad, en términos de inmunogenicidad, eficacia y seguridad, de la administración de la mitad de la dosis (0,25 ml) o bien la dosis completa. Un estudio americano reciente demostró que se producía una mayor respuesta inmunitaria frente a H1N1 con la dosis completa, sobre todo en aquellos que habían sido vacunados previamente, y que no había diferencias de seguridad entre ambas pautas10. Otros estudios han encontrado resultados similares11, incluso algunos con diferencias significativas, en cuanto a inmunogenicidad para los tres antígenos, en favor de la dosis completa12.
La vacuna atenuada intranasal, autorizada en Europa desde los 24 meses de edad hasta los 18 años, se administra con 0,1 ml en cada fosa nasal. La posología en cuanto al número de dosis es igual que para las vacunas inactivadas9 (Tabla 3).
Vía de administración y conservación
La administración de vacunas inactivadas se realiza mediante inyección intramuscular profunda. Para los niños pequeños que aún no andan, el sitio preferido para la administración de la vacuna es la zona anterolateral externa del muslo, en su tercio medio, y para el resto es el deltoides.
En pacientes con alteraciones de la coagulación o que reciben terapia anticoagulante se recomienda la administración de las vacunas antigripales no adyuvadas por vía subcutánea.
La vacuna debe conservarse entre +2 °C y +8 °C y aplicarse preferiblemente a temperatura ambiente. El periodo de validez es de un año.
La vacuna intranasal precisa la aplicación de 0,1 ml en cada fosa nasal. Su administración es sencilla y muy bien tolerada por los niños, como puede apreciarse en este vídeo (https://vimeo.com/72406459) del National Health System Education for Scotland13. No debe ser inyectada en ningún caso.
La vacuna debe conservarse entre +2 °C y +8 °C, pudiendo permanecer como máximo 12 horas a una temperatura de hasta 25 °C. A partir de este tiempo debe desecharse. El periodo de validez es de 18 semanas.
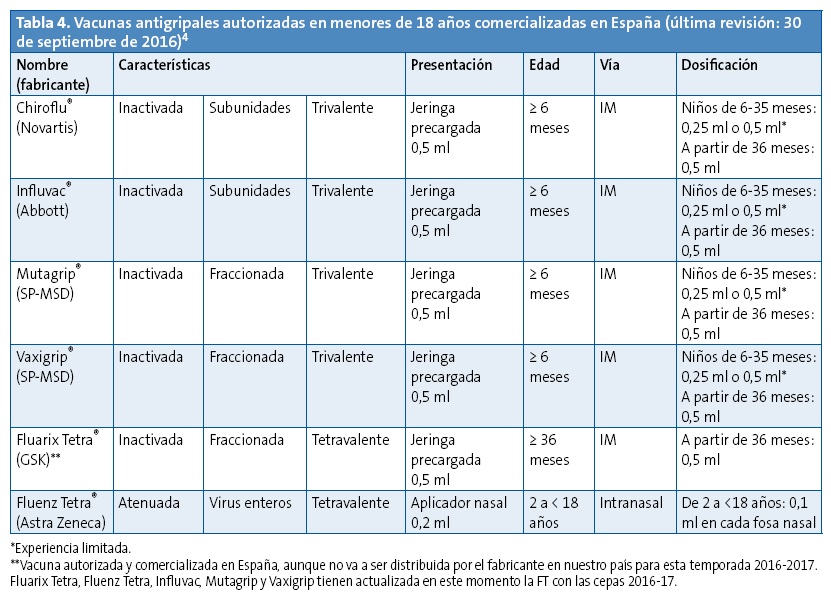
PREPARADOS DISPONIBLES DE VACUNAS ANTIGRIPALES PARA MENORES DE 18 AÑOS PARA LA TEMPORADA 2016-2017
Para esta temporada, existen aprobadas para su comercialización hasta nueve preparados de vacunas antigripales diferentes en España9, todos con la misma composición antigénica.
Se están incorporando, de forma progresiva, diversos preparados novedosos (vacunas vivas atenuadas, nuevas vacunas adyuvadas, tetravalentes, de cultivos celulares, etc.) y con vías de administración alternativas (vía intranasal, intradérmica, etc.).
Sin embargo, de entre las vacunas disponibles autorizadas para menores de 18 años en nuestro medio, en el momento actual, las más ampliamente empleadas son las trivalentes inactivadas9, procedentes de cultivos en huevos embrionados de gallina, para su administración por vía intramuscular.
Como novedad relevante para esta temporada, va a estar disponible en las farmacias comunitarias la vacuna atenuada intranasal tetravalente, en envases individuales (unidosis).
Además de la existencia del preparado tetravalente intranasal, también está comercializada (aunque no va a ser distribuida por decisión del fabricante) una vacuna inactivada con las cuatro cepas recomendadas. Este formato tetravalente, con sus dos posibles vías de administración, es el empleado en algunos países para la vacunación universal, como EE. UU. y Reino Unido. Hasta la fecha, en nuestro país, ninguna de las administraciones sanitarias de las comunidades autónomas (CC. AA.) utilizan estas vacunas tetravalentes en sus programas de prevención.
En la Tabla 4 se exponen todas las vacunas antigripales disponibles para menores de 18 años autorizadas actualmente en España para la temporada 2016-2017. Todas estas vacunas cumplen con la recomendación de la OMS4.
NUEVAS VACUNAS ANTIGRIPALES
A continuación se realiza una pequeña reseña del estado actual de las nuevas vacunas antigripales que han hecho aparición en nuestro medio o que lo harán en las próximas temporadas.
Vacuna atenuada intranasal
Esta vacuna presenta la ventaja de una administración más sencilla que la intramuscular, así como mejores datos de eficacia que las inactivadas en niños14,15. En los metaanálisis publicados, proporciona una media de protección del 80% frente a la gripe confirmada, en comparación con el placebo, más que las inactivadas. Además, cuando se comparan ambas vacunas en ensayo clínico, la atenuada proporciona un 50% de protección adicional sobre la protección que se logra con las inactivadas14. Estas dos cualidades podrían ser determinantes para mejorar la aceptabilidad de la vacunación antigripal, tanto en niños como en la población general, así como entre los profesionales sanitarios.
Actualmente ya se dispone de esta vacuna en España, en formato tetravalente, para la temporada 2016-2017, autorizada para su administración entre los 2 y los 18 años de edad. No está autorizada para su uso en menores de dos años, inmunodeprimidos, embarazadas y aquellos que estén en tratamiento con salicilatos (ver más adelante). En asmáticos debe guardarse precaución, sobre todo en niños de entre dos y cuatro años, aunque no está bien definido el grado de gravedad del asma con el que se debería restringir esta vacuna, si bien parece segura en pacientes con asma leve-moderada16. Además, en estudios poscomercialización, se ha observado incluso menos incidencia de complicaciones respiratorias en los 42 días siguientes a la administración de la vacuna en niños asmáticos menores de cinco años, en comparación con las vacunas inactivadas17.
Los datos de efectividad de esta vacuna pueden consultarse en un apartado más adelante.
Vacunas tetravalentes
Existen dos tipos de cepas B (linaje Victoria y linaje Yamagata) antigénicamente diferentes y con protección cruzada limitada. Cada vez hay más datos del impacto real que estos virus B causan en la población, tanto de forma universal4 como en nuestro medio18. En las últimas temporadas, se tiene constancia de que, en al menos la mitad de ellas, circuló la cepa B que no contenía la vacuna trivalente empleada en la campaña19. Dadas las dificultades para saber con antelación cuál de las cepas B va a circular predominantemente durante la temporada, el empleo de vacunas antigripales tetravalentes, con dos cepas A y dos cepas B, irá ganando presencia y se incorporará a las campañas de vacunación oficiales20. Esta temporada están comercializadas en España dos vacunas tetravalentes: un preparado inactivado intramuscular autorizado para niños mayores de 36 meses (aunque no va a ser distribuida por decisión del fabricante) y un preparado atenuado intranasal para mayores de 24 meses (Tabla 4).
Los datos de inmunogenicidad y seguridad de las vacunas tetravalentes, tanto las inactivadas como la atenuada intranasal, comparados con las trivalentes, son similares, según los ensayos clínicos publicados19, incluidos estudios con niños desde seis meses de edad21, así como en adultos19,21. Algunos países de nuestro entorno (por ejemplo, Reino Unido y Finlandia) ya las están empleando en niños y adultos, así como EE. UU. y Canadá. Aunque tienen un mayor coste, existen estudios de farmacoeconomía que muestran que serían coste-efectivas22.
Vacunas inactivadas desarrolladas en cultivo celular
Se podrían utilizar en los casos de antecedente de reacciones anafilácticas al huevo. Aprobadas para mayores de 18 años, actualmente solo hay una disponible en España. Se espera contar con más información una vez concluyan los ensayos clínicos en marcha, que incluyen a niños pertenecientes a los grupos de riesgo23.
Vacunas adyuvadas
Durante la temporada de la gripe pandémica de 2009 se puso de manifiesto la necesidad de tener vacunas antigripales adyuvadas, con el objetivo de disponer de vacunas inmunógenas y eficaces, con la menor cantidad de antígeno posible, para así poder fabricar un número considerable de unidades para una posible situación de emergencia. Actualmente, para la edad pediátrica no existen presentaciones en España (Tabla 4)9, aunque es posible que en años venideros sea posible el empleo de adyuvantes, con el fin de optimizar la respuesta inmunitaria, si se despejan algunas dudas abiertas sobre la seguridad de ciertos adyuvantes.
EFECTIVIDAD DE LA VACUNACIÓN ANTIGRIPAL EN LA EDAD PEDIÁTRICA
En algunos países, desde hace unos años, se están llevando a cabo diferentes estrategias de vacunación antigripal en niños, fundamentalmente en algunos países europeos (Reino Unido, Finlandia) y en Norteamérica (EE. UU., Canadá), que sin duda son de alto valor para la comunidad científica, ya que pueden influir en la toma de decisiones de otros países.
Efectividad de los programas de vacunación universal en Europa
En Europa, en la temporada 2015-2016 ha predominado la circulación de influenza A H1N1 (70% aproximadamente), seguido de una cepa B de linaje Victoria (25%), con una muy baja circulación de H3N2 y cepa B de linaje Yamagata24,25.
Experiencia en Reino Unido
En la temporada 2013-2014, el Public Health of England (PHE) comenzó un programa de inmunización universal con la vacuna atenuada intranasal en niños y adolescentes sanos de 2 a 17 años, con una dosis anual, basándose en datos de coste-efectividad propios, aunque, dada la dificultad para llevar a cabo el programa, comenzó en niños de dos a cuatro años y progresivamente, año a año, se van incorporando nuevas cohortes26.
En este tercer año del programa (temporada 2015-2016), se han vacunado con el preparado intranasal tetravalente los niños entre dos y seis años26, con coberturas en torno al 50-55% según las áreas27, y en la 2016-2017 lo harán los niños entre dos y siete años26. Además, en niños de 2 a 17 años con factores de riesgo, si no existe contraindicación, también se está administrando la vacuna atenuada intranasal26. Los únicos que están recibiendo vacuna inactivada inyectable son aquellos con alguna contraindicación para la administración de la atenuada, así como los pacientes de 18 años en adelante con factores de riesgo26.
Los datos a final de la temporada 2015-2016 han sido recientemente publicados28. La efectividad vacunal calculada para todas las edades, con ambas vacunas, para toda la temporada 2015-2016, ha sido de 52,4% (intervalo de confianza del 95% [IC 95]: 41,0-61,6) para casos de gripe confirmados atendidos en Atención Primaria. Para el grupo de edad entre 2 y 17 años, inmunizados con vacuna intranasal, la efectividad ha sido del 57,6% para cualquier tipo de gripe (IC 95: 25,1 a 76,0), del 41,5% (IC 95: -8,5 a 68,5) para los casos por gripe A/H1N1 y del 81,4% (IC 95: 39,6 a 94,3) para los casos por gripe B (Tabla 5).
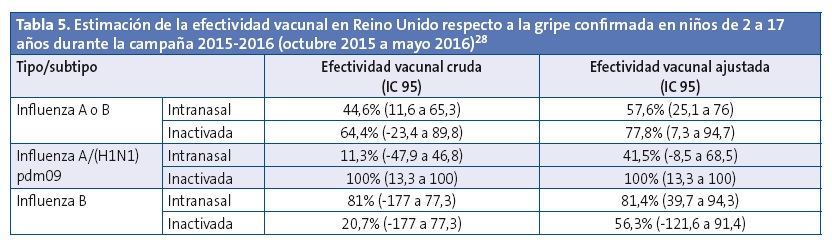
Analizando las tres temporadas conjuntas desde el inicio del programa (octubre 2013 a mayo 2016), los datos en niños entre 2 y 17 años son muy parecidos, con una efectividad vacunal ajustada del 53,1% (IC 95: 31,4 a 67,9) para cualquier tipo de gripe y resultados similares a este año para la gripe A/H1N1 y B28.
El nivel de protección alcanzado este año ha sido catalogado de moderado a bueno, y aunque mejor para la gripe B que para la gripe A/H1N1, estos resultados apoyan la continuidad y el desarrollo del programa en Reino Unido para la temporada 2016-201728, ya confirmada por el Joint Committee on Vaccination and Immunisation (JCVI) del Public Health of England (PHE)26. Probablemente, con mejores coberturas, se podrían obtener incluso datos mejores de efectividad.
Experiencia en Finlandia
Desde el año 2007, a través del Finnish National Institute for Health and Welfare (THL), se recomienda la inmunización antigripal universal de todos los niños de entre 6 y 35 meses en este país con vacuna inactivada. Además, desde esta última temporada, a los cuidadores de los niños de entre 24 y 35 meses se les ha ofrecido indistintamente una o dos dosis de vacuna inactivada o una dosis de vacuna atenuada intranasal, sin preferencia en la recomendación por ninguna de las dos29.
Los datos de efectividad durante la campaña 2015-2016 para la vacuna atenuada intranasal tetravalente han sido muy similares a los observados en Reino Unido, con una protección global frente a cualquier caso de gripe confirmada del 51% (IC 95: 28 a 66), siendo esta efectividad también superior para la cepa B (58%; IC 95: 1 a 82) que para la cepa H1N1 (48%; IC 95: 22 a 65)29. La efectividad de la vacuna inactivada trivalente ha sido algo superior: 61% (IC 95: 31 a 78).
Se ha observado una tendencia a una mayor efectividad en aquellos niños previamente vacunados.
Para esta temporada, se ha decidido continuar la vacunación con el preparado atenuado intranasal.
Experiencia en EE. UU.
En EE. UU., la vacuna antigripal atenuada trivalente se autorizó en el año 2003, recomendándose su uso indistintamente con las vacunas antigripales inactivadas. Durante las temporadas previas a la pandemia de gripe del 2009 y a la circulación del virus de la gripe A/H1N1pdm2009, diferentes estudios de eficacia comparativos con ambos tipos de vacunas realizados en niños pequeños de distintos países, mostraron consistentemente una eficacia superior (65-89%) de la vacuna atenuada trivalente frente a la vacuna inactivada14.
En el año 2012 se autorizó la vacuna atenuada antigripal tetravalente. Los estudios de efectividad vacunal durante las temporadas de gripe 2010-2011 a 2013-2014 realizados en niños de 2 a 17 años de edad, ya mostraron una menor efectividad frente a la nueva cepa de gripe A/H1N1pdm09 de la vacuna atenuada tetravalente en comparación con la inactivada, pero no frente a la cepa A/H3N2 o la cepa B30. Sin embargo, en la temporada 2014-2015, el Advisory Committee on Immunization Practices (ACIP) y los Centers for Disease Control and Prevention (EE. UU.) (CDC) emitieron una recomendación preferencial para el uso de la atenuada tetravalente para los niños sanos de edades de dos a ocho años31. Esta recomendación estaba fundamentada básicamente en los datos de los ensayos clínicos controlados y aleatorizados, realizados durante las temporadas de gripe de 2002-2009, antes de la pandemia gripal del 2009 y de la circulación del virus de la gripe A/H1Npdm2009, con las dos vacunas trivalentes: intranasal e inactivada en niños pequeños y que habían mostrado una eficacia superior de la intranasal32.
En febrero de 2015, el ACIP y los CDC no ratificaron su recomendación preferencial por la vacuna atenuada tetravalente basándose en la baja efectividad de la atenuada, observada durante la temporada 2013-2014, contra la cepa A/H1N1pdm09 y la falta de evidencia de que la atenuada proporcionaba una mejor protección que la vacuna inactivada contra la deriva antigénica del virus H3N2 que circuló predominantemente durante la temporada 2014-1533,34. Durante dicha temporada, el virus A/H1N1pdm09 predominó por primera vez desde la pandemia de 2009. La disminución de la eficacia contra la cepa A/H1N1pdm09 planteó la hipótesis de que la baja efectividad podía ser debida a una termoestabilidad reducida y a una baja infectividad de la cepa A/H1N1pdm09 de la vacuna, debido a una única mutación de aminoácidos en la región de la proteína de la hemaglutinina (HA)35, por lo que para la temporada 2015-2016, para hacer frente a los problemas de estabilidad que presentaba la HA de la cepa A/H1N1pdm09, se sustituyó dicha cepa por una diferente (cepa like) de la gripe A (H1N1), la cepa A/Bolivia/559/2013 (H1N1)36,37.
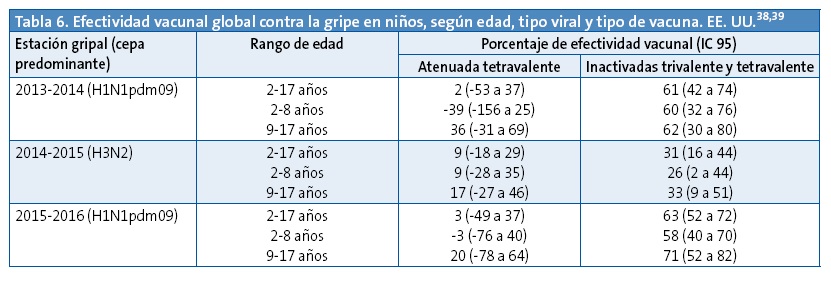
En la reunión del ACIP del 22 de junio de 2016 se presentaron nuevos datos sobre la eficacia de las vacunas contra la gripe en niños de 2 a 17 años durante la temporada 2015-2016, en la que predominó la circulación de virus A/H1N1pdm09. Los datos provenientes de los CDC mostraron que la efectividad de la vacuna atenuada tetravalente entre los niños de 2 a 17 años del estudio contra cualquier virus de la gripe era solo del 3% (IC 95: -49 a 37) y para el virus A/H1N1pdm09 del -21% (IC 95: -108 a 30). Esto significa que no se podía atribuir ningún beneficio protector a esta vacuna, especialmente contra los virus A/H1N1pdm09. Por otra parte, la vacuna inactivada ofreció una protección sustancial, con una efectividad vacunal contra cualquier virus de la gripe significativa del 63% (IC 95: 52 a 72)8,38.
En la Tabla 6 se muestran los resultados de efectividad vacunal en los EE. UU. en las tres últimas temporadas gripales, por rangos de edad y tipo de vacuna utilizada.
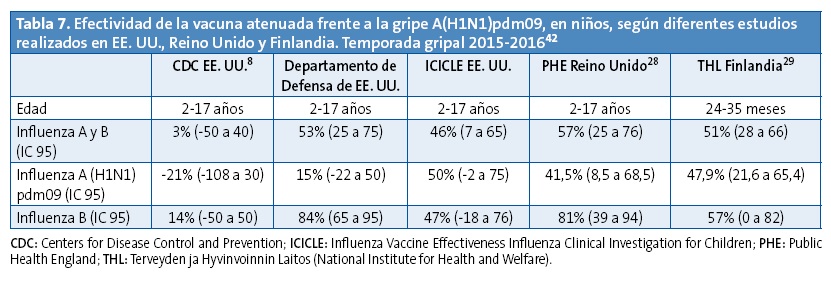
Durante la referida reunión de junio 2016, el ACIP también evaluó otros estudios adicionales comparativos de efectividad vacunal realizados en los EE. UU. Un estudio del Departamento de Defensa de aquel país, realizado en niños de 2-17 años de edad durante 2015-2016 (DoD Laboratory-based Influenza Surveillance)38, mostró para la atenuada una efectividad vacunal global del 53%. Otro estudio realizado por MedImmune, que había sido exigido por la FDA durante la fase de poscomercialización de la atenuada tetravalente, durante la temporada 2015-2016 (2015-16 US Influenza Vaccine Effectiveness Influenza Clinical Investigation for Children [ICICLE] Study)40, mostró una efectividad vacunal global del 46% (IC 95: 7 a 69).
Estos dos estudios adicionales mostraron una mayor efectividad vacunal de la atenuada tetravalente que la observada en el estudio realizado por la Red de Efectividad Vacunal contra la Influenza en los Estados Unidos (CDC), pero en los que la atenuada no funcionaba tan bien como la inactivada. La efectividad vacunal para la gripe H1N1 fue menor para la atenuada que para la inactivada en todos los estudios realizados en EE. UU. y la mayoría de las estimaciones de eficacia de la vacuna atenuada contra la gripe A/H1N1 no fueron estadísticamente significativas.
Teniendo en cuenta los datos comentados, el ACIP, en sus recomendaciones de vacunación de la gripe para 2016-2017, recomienda que durante la temporada 2016-2017 solamente se administren las vacunas inactivadas de la gripe8, a pesar de que la FDA haya autorizado el uso de la intranasal para esta temporada37.
En la Tabla 7 se exponen los datos comparativos de efectividad vacunal frente a gripe A(H1N1)pdm09 de la vacuna atenuada en niños, comentados hasta ahora.
Experiencia en Canadá
En un ensayo clínico aleatorizado controlado comparando la efectividad vacunal de la vacuna antigripal atenuada y la inactivada, llevado a cabo en comunidades de niños huteritas de Canadá, no mostró diferencias en cuanto a la protección conferida frente a la gripe. El estudio tuvo lugar entre octubre de 2012 y mayo de 2015 con 1186 vacunados y 3425 controles y las infecciones confirmadas por laboratorio, afectaron al 5,3% del grupo de vacuna atenuada y al 5,2% de los que recibieron inactivada trivalente43.
En Canadá, después de una cuidadosa revisión de los estudios realizados en las últimas temporadas gripales el National Advisory Committee on Immunization (NACI) se establecen las siguientes recomendaciones de vacunación antigripal en niños y adolescentes de 2-17 años para la temporada 2016-201744: 1) en niños sin contraindicaciones para ser vacunados, cualquiera de las siguientes vacunas antigripales puede ser utilizada: vacuna atenuada tetravalente, vacuna inactivada tetravalente o vacuna inactivada trivalente; 2) la evidencia actual no apoya la recomendación preferencial del uso de la atenuada tetravalente en niños de 2-17 años, y 3) se recomienda el uso preferencial de vacunas tetravalentes.
CONSIDERACIONES ESPECIALES DEL CAV-AEP SOBRE LA VACUNACIÓN ANTIGRIPAL UNIVERSAL
Disparidad en los datos de efectividad de la vacuna atenuada intranasal.
Existen varias posibles hipótesis que podrían explicar la baja efectividad de la vacuna atenuada tetravalente en las tres últimas temporadas de gripe en los EE. UU. Se han achacado importantes problemas metodológicos en el estudio aportado por el CDC28,29, que además contrastan con los datos de los otros dos estudios realizados en el mismo país. En la muestra de casos empleada por los CDC para su análisis, el porcentaje de casos por gripe A H1N1 es menor que en la población general, los casos por gripe B están sobrerrepresentados y la cobertura vacunal con vacuna atenuada es la mitad que en la población general, por lo que se puede concluir que la muestra es poco representativa.
De todos modos, se están revisando todas las posibles causas que pudieran provocar esa posible pérdida de efectividad. Una de ellas es que el cambio de una vacuna atenuada trivalente a una tetravalente, que ocurrió casi al mismo tiempo que la caída de la eficacia de la vacuna, podría ser la causa de una potencial interferencia entre virus en la vacuna tetravalente28, que ya se había apreciado antes45, o por el contrario podría ser simplemente una coincidencia. También se han barajado problemas de conservación de la vacuna atenuada en EE. UU., hecho ya constatado para las temporadas anteriores para ciertos lotes de la vacuna intranasal allí comercializada, dado que la cepa H1N1 incluida demostró ser especialmente termosensible y de mayor degradación de lo habitual ante temperaturas superiores a las recomendadas46.
Otra hipótesis sería que los niños que están siendo vacunados cada año generan anticuerpos que reconocen y eliminan (bloquean) la vacuna atenuada administrada antes de que esta pueda producir una buena respuesta inmunológica47. Si esta teoría fuese cierta, los futuros datos del Reino Unido, que comenzaron a usar la vacuna atenuada en fecha posterior, podrían mostrar en los próximos años los mismos resultados negativos47.
Los datos de efectividad moderada-buena procedentes de países con programa de vacunación universal de nuestro entorno europeo, como Reino Unido y Finlandia, sustentados a su vez en sistemas de control epidemiológico institucional muy potentes y fiables, aportan razones esperanzadoras para apoyar la vacunación infantil universal en nuestro medio en un futuro cercano.
Salvo EE. UU., todos los países que actualmente estaban empleando la vacuna atenuada para su programa universal (Reino Unido, Finlandia) van a seguir empleándola como hasta ahora. En Canadá, en niños de 2 a 17 años, se van a ofrecer ambas vacunas, inactivada y atenuada, sin preferencia por alguna de ellas44.
Por otro lado, para esta temporada, Francia (a partir de los dos años) y Alemania (de dos a seis años) la recomendarán de forma preferencial para los pacientes de riesgo48,49.
Vacunación antigripal de los niños como medida preventiva individual
Dado que las mayores tasas de incidencia de gripe se registran en la población menor de 15 años50, que la tasa media de hospitalización en menores de cinco años es alrededor de uno por cada 1000 niños sanos51 y que todos los años se produce un mayor número de ingresos, por complicaciones relacionadas con la gripe, de niños sanos que de niños incluidos en grupos de riesgo39, el CAV-AEP considera que la vacunación antigripal de los niños mayores de seis meses, no incluidos en grupo de riesgo, si sus padres lo solicitan y su pediatra lo considera conveniente, es una medida recomendable dada la elevada tasa de complicaciones asociadas a la gripe en este grupo de edad. Esta actitud preventiva proporciona al niño o adolescente vacunado una protección individual directa, además de favorecer una protección familiar y comunitaria indirectas.
Vacunación antigripal de los niños como medida preventiva para los adultos
Las características epidemiológicas de la gripe hacen posible que la vacunación infantil frente a la enfermedad sea, quizás, la medida más efectiva para reducir la carga global de la enfermedad en los adultos, sobre todo en los mayores de 60 años. Los niños preescolares y escolares son los principales diseminadores de la gripe en la comunidad52,53. Alrededor de la mitad de estas infecciones son asintomáticas o cursan con síntomas leves de vías respiratorias altas, que hacen difícil sospechar la enfermedad52. Esto, unido al contacto estrecho con otros miembros de la familia, contribuye a facilitar la diseminación de la enfermedad. Además, los niños excretan el virus durante un periodo más largo que los adultos (seis días frente a un día antes del inicio de los síntomas, y 14 días frente a 4,5 días después)54.
Una de las primeras evidencias de que la vacunación de los niños podía evitar un gran número de hospitalizaciones y muertes en adultos viene de Japón56. Durante los años 1962 a 1987, se introdujo en este país la práctica de vacunar a los niños de edad escolar frente a la gripe, llegando a ser obligatoria durante una década. Con la instauración de este programa, las muertes asociadas a gripe disminuyeron en los adultos. Se estimó que se evitaron entre 37 000 y 49 000 muertes anuales en adultos, lo que representó una muerte evitada por cada 420 niños vacunados55. Cuando, por diversas razones la vacunación de los niños se suspendió, se produjo de nuevo un incremento de las muertes.
Un estudio posterior de los datos de Japón ajustados según los cambios demográficos, socioeconómicos y el subtipo dominante de virus gripal, utilizando además como control los datos de EE. UU., demuestra que el programa infantil redujo la mortalidad ajustada un 36% (IC 95: 17 a 51) en personas ≥ 65 años, lo que se tradujo en 1000 (400-1800) muertes anuales evitadas en este grupo de edad56. El abandono de la vacunación de los escolares también causó un aumento de las muertes en niños57,58, sobre todo debido al aumento de encefalopatía.
La capacidad de la vacunación antigripal en los niños para inducir inmunidad de grupo en la comunidad ha sido demostrada en otros estudios. En varias comunidades de Canadá, la vacunación de niños y adolescentes tuvo una efectividad del 61% (IC 95: 8 a 83) para prevenir la gripe confirmada en personas no vacunadas59. Otro estudio demostró que existe una correlación inversa entre la cobertura de vacunación antigripal en niños y la disminución de gripe en los ancianos60. En general, todos los estudios centrados sobre este tema han demostrado que vacunando a los niños se reducen en los adultos los casos de gripe o de los síndromes clínicos asociados a esta, tanto cuando se utilizan las vacunas inactivadas61 como cuando se emplea la atenuada intranasal62.
Varios modelos matemáticos han demostrado el impacto clínico de la vacunación antigripal en los niños. En un modelo de transmisión dinámica de la gripe se estudió cuál podría ser el efecto sanitario global de la vacunación de los niños con la vacuna atenuada en Reino Unido63. El modelo establece que, con coberturas vacunales del 50-80% en los niños de 2 a 18 años, se evitan miles de casos de gripe y miles de consultas médicas anuales en todas las edades y, lo que es más importante, miles de hospitalizaciones y muertes asociadas a gripe en las personas mayores de 65 años. Si se vacuna solo a los niños de 2-4 años, el impacto, aunque significativo, es notablemente menor64. Este mismo modelo estima que asumiendo un 50% de cobertura vacunal, el mayor impacto en la salud lo tendría la práctica de vacunar a los niños de 2-18 años65.
La efectividad de la vacunación antigripal en los ancianos puede ser menor que en otras edades, aunque las adyuvadas han demostrado incrementarla. Mientras la mayoría de estudios han demostrado efectividad en los mayores de 65 años66,67, una revisión de la Cochrane no logró demostrar el efecto beneficioso68. Un estudio que se extendió a lo largo de diez temporadas gripales demostró que la vacunación antigripal en personas ≥ 65 años reducía un 27% las hospitalizaciones por neumonía o gripe y un 48% el riesgo de muerte69, aunque se ha considerado que podría contener algunos sesgos.
Además de los ancianos y otros grupos de riesgo bien establecidos, existen otros, quizás menos conocidos, como los lactantes y las embarazadas. En los lactantes, la tasa de hospitalizaciones asociadas a gripe es más alta que en ninguna otra época de la infancia51,70,71 y similar a la de otros pacientes de riesgo. Sin embargo, por debajo de los seis meses no está aprobada la vacunación frente a la gripe y en niños menores de dos años de edad la eficacia de las vacunas inactivadas se ha puesto en duda, aunque algunos estudios han encontrado que son efectivas15.
Hasta ahora, las políticas de vacunación frente a la gripe centradas en los ancianos y grupos de riesgo han fracasado parcialmente, al no obtener coberturas vacunales suficientes72-75. A la luz de todos estos hechos cobra sentido la protección de los ancianos y otros grupos de riesgo mediante la vacunación antigripal de los niños. Este fue el argumento, sustentado en los estudios matemáticos, del JCVI para la creación del programa de vacunación infantil con vacuna atenuada.
Vacunación antigripal infantil universal
La vacunación antigripal universal de todos los niños, en el momento actual en nuestro medio, con las vacunas disponibles y los datos anteriormente expuestos, plantea algunas controversias:
- Necesidad de añadir anualmente una inyección, en caso de optarse por la vacuna inactivada, al calendario de vacunaciones, con los problemas inherentes de implementación y aceptabilidad.
- En los menores de dos años, la efectividad de las vacunas antigripales trivalentes inactivadas es baja15 y la vacuna antigripal atenuada intranasal no está autorizada en ese grupo de edad.
- El coste sería elevado y no existen, en nuestro medio, suficientes datos de eficiencia en la edad pediátrica.
- La existencia en nuestro medio de una vacuna atenuada intranasal facilita la aceptabilidad y la implementación de un programa de vacunación universal.
- La existencia de preparados tetravalentes para su uso en Pediatría (tanto en vacunas atenuadas como inactivadas), que proporcionan una mayor protección en comparación con los trivalentes.
Actualmente, solo algunos países realizan vacunación universal en niños sanos, aunque en diferentes periodos etarios y con diferentes vacunas, como EE. UU., Canadá, Reino Unido, Finlandia, Israel, Austria, Estonia, Letonia, Polonia, Eslovaquia, Eslovenia y Malta.
SEGURIDAD DE LAS VACUNAS ANTIGRIPALES
Las vacunas antigripales han demostrado tener un perfil de seguridad elevado, como así lo demuestran numerosos estudios, incluido alguno reciente realizado en nuestro medio76. El balance riesgo-beneficio es netamente favorable.
Vacunas inactivadas
El efecto adverso más frecuente es la reacción local, como enrojecimiento y dolor, con una frecuencia variable según diferentes estudios, que oscila entre el 5-20% de casos; en general, son leves y no requieren atención médica77. La fiebre, definida como > 38 °C, según la Brighton Collaboration, aparece con más frecuencia en niños menores de dos años, con una frecuencia variable según edad, del 5,5-6,9%77,78.
Asimismo, se ha prestado especial atención a la eventualidad de la presentación de crisis febriles; estas aparecen con una frecuencia de 1,1 por 1000 en niños pequeños78. Inicialmente se documentó una mayor frecuencia de crisis febriles asociadas a la vacuna, con una máxima incidencia a los 16 meses79, en que aparecen en una frecuencia de 12,5 por 100 000 dosis, incrementándose a 44,9 por 100 000 dosis si la administración de la vacuna trivalente inactivada se realiza el mismo día de la vacuna neumocócica conjugada de 13 serotipos. A los 59 meses, esta reacción aparece con una frecuencia menor: 1,1 por 100 000 dosis en la administración aislada y 1,2 por 100 000 dosis en caso de administración conjunta con vacuna de neumocócica de 13 serotipos79.
Este tema ha sido objeto de seguimiento cuidadoso y tras varios recientes análisis en profundidad, se ha concluido que no existe un riesgo estadísticamente significativo de incremento de crisis febriles con la administración concomitante de vacuna antigripal inactivada trivalente de gripe y la neumocócica conjugada80. Este hecho también se ha estudiado para la administración conjunta con otras vacunas del calendario como la DTPa, encontrando un pequeño incremento del riesgo81. Es por ello que los CDC recomiendan que, para no perder oportunidades de vacunación, estas vacunas se administren el mismo día.
Se desconoce si la vacuna antigripal incrementa el riesgo de síndrome de Guillain-Barré (SGB) en los niños que lo presentaron tras vacunarse. En la actualidad, se estima que el riesgo de desarrollar SGB por una infección gripal es mayor que por la vacunación82.
Durante la campaña de vacunación masiva frente a la gripe pandémica en 2009-2010, en Suecia se observó un incremento de casos de narcolepsia en sujetos de edad inferior a 20 años que habían recibido la vacuna monovalente A (H1N1)pdm2009 adyuvada con AS03, Pandemrix®83. Esta asociación también se observó en otros países europeos. Estudios epidemiológicos identificaron una relación entre la narcolepsia y el uso de esta vacuna, en especial en sujetos portadores del alelo HLA-DQB1*06:02, presente en casos esporádicos de narcolepsia84.
Se ha cuestionado el valor de algunos de estos estudios por ser retrospectivos y presentar diversos sesgos. Tras múltiples investigaciones, todavía está pendiente de conocerse cuál es la causa subyacente de este efecto adverso y el papel que cada factor juega en el desarrollo de la narcolepsia: la nucleoproteína empleada en la elaboración de la vacuna, el adyuvante, la predisposición genética de los receptores de la vacuna, etc. Sin embargo, hasta la fecha, no está claro qué moléculas virales son las causantes de esta reacción.
La vacuna no había sido utilizada antes de la pandemia, ni se ha utilizado posteriormente.
En la actualidad, ninguna de las vacunas antigripales comercializadas se asocia a un incremento del riesgo de narcolepsia.
Vacunas atenuadas
Diversos estudios han valorado la seguridad de las vacunas atenuadas de administración nasal, prestando especial atención a los niños de 6 a 59 meses, en ensayos clínicos32, metaanálisis85 y estudios de seguridad poscomercialización86,87, y todos han demostrado la ausencia de efectos adversos serios cuando la vacuna se administra a los grupos de población en que está indicada.
Los efectos más frecuentes son congestión nasal, rinorrea y discreta elevación de temperatura, dentro de los 3-4 días que siguen a la administración de la primera dosis.
En niños mayores no se ha detectado asociación de sibilancias o asma tras la administración de la vacuna. Pero en un ensayo clínico aleatorizado32 se detectaron episodios de sibilancias con significación clínica en niños menores de 24 meses en los 42 días siguientes a la vacunación, en especial en el grupo de 6-11 meses, con mayor frecuencia que entre los que recibieron la vacuna inactivada. En este mismo grupo de edad (6-11 meses) los índices de hospitalización fueron significativamente mayores en los 180 días tras la vacunación en el grupo de la vacuna atenuada.
Para evitar la aparición de efectos indeseables se necesita el cumplimiento de las indicaciones de la vacuna, ya que algunos de ellos se han descrito en grupos de niños en los que no está indicada la vacuna atenuada87.
CONTRAINDICACIONES Y PRECAUCIONES
Contraindicaciones comunes a los dos tipos de vacuna (inactivada y atenuada)
Además de los menores de seis meses, son muy pocos los niños que no puedan recibir alguna de las vacunas de la gripe (Tabla 8).

Es una contraindicación absoluta en aquellos que han presentado una reacción alérgica grave a la vacuna antigripal previa o a alguno de sus componentes88. Esta circunstancia es muy poco frecuente, acontece en 1,35 casos (IC 95: 0,65 a 2,47) por un millón de dosis89.
La edad mínima para la vacunación son los seis meses para la vacuna inactivada y los dos años para la atenuada.
Contraindicaciones para la vacuna atenuada8,90
- Edad inferior a 24 meses.
- Historia de reacción anafiláctica a gentamicina, gelatina o arginina.
- Antecedente de síndrome de Guillain-Barré.
- Embarazo.
- Inmunodeficiencias o tratamientos que produzcan inmunodepresión; no se incluyen la infección por virus de la inmunodeficiencia humana (VIH) estable en tratamiento antirretroviral o el tratamiento con corticoides a dosis bajas.
- Tratamientos prolongados con aspirina o salicilatos por el riesgo de síndrome de Reye.
- Toma de antivirales para la gripe en las 48 horas previas.
- Recepción de vacunas parenterales de virus vivos (exceptuando la de la fiebre amarilla) en las cuatro semanas previas. Pueden, en cambio, administrarse el mismo día. No es necesario guardar ningún intervalo específico en la administración de la vacuna intranasal de la gripe y las restantes vacunas de virus vivos y las inactivadas.
Precauciones comunes a los dos tipos de vacuna
Se recomienda posponer la vacuna cuando exista alguna enfermedad febril o cualquier proceso agudo moderado o grave. No es necesario retrasarla ante procesos leves.
Los pacientes con alergia grave al huevo pueden ser vacunados en centros sanitarios con experiencia en el reconocimiento y tratamiento de reacciones alérgicas graves (ver apartado específico más adelante).
Precauciones para la vacuna inactivada
Niños que desarrollaron un síndrome de Guillain-Barré dentro de las seis semanas posteriores a una vacunación antigripal previa8. En niños sanos se recomienda no vacunar, pero se debe valorar en aquellos con enfermedades de base, ya que en estos niños los beneficios sobrepasan al riesgo8.
Precauciones para la vacuna atenuada
- Asma en niños mayores de dos años (según la ficha técnica es solo una precaución). No debe administrarse en caso de crisis agudas de asma. En caso de asma grave está contraindicada y en aquellos que hayan requerido tratamiento con esteroides orales en los 14 días previos o bien requieran dosis altas de corticoide inhalado para el control (> 800 μg/día de budesonida o > 500 μg/día de fluticasona)90. En estos casos, la seguridad de la vacuna atenuada se desconoce.
- La seguridad no está establecida en pacientes con condiciones médicas de base que supongan un riesgo de desarrollo de complicaciones en una gripe; por ejemplo, enfermedad pulmonar crónica, cardiovascular (excluyendo la hipertensión arterial), enfermedad renal, hepatopatías, enfermedades neurológicas, hematológicas, metabólicas (diabetes)8.
- Contacto con sujetos con inmunodepresión profunda, como aquellos que hayan recibido un trasplante de células hematopoyéticas; en este caso se vacunarán con la inactivada o, si reciben la atenuada, evitarán el contacto en los siete días posteriores a la recepción de la vacuna. Los contactos de pacientes con formas menos graves de inmunodepresión (diabetes, asma, VIH, en tratamiento con corticoides) pueden recibir cualquiera de las dos vacunas33.
RECOMENDACIONES SOBRE VACUNACIÓN ANTIGRIPAL EN SITUACIONES ESPECIALES
Alergia al huevo
Las vacunas antigripales actualmente disponibles proceden de cultivos en huevos de gallina, pero contienen mínimas cantidades de huevo. Aún no están disponibles en nuestro país, aunque sí autorizadas, las vacunas cultivadas en medios celulares, así como las obtenidas por tecnología recombinante y, por tanto, exentas totalmente de proteínas de huevo.
En personas con alergia al huevo es muy poco probable que se produzca una reacción alérgica a la vacunación. Esto se ha comprobado tanto en la vacuna inactivada como en la atenuada. Existen datos sobre el uso de la vacuna intranasal en alérgicos al huevo. Dos estudios prospectivos, recientemente publicados, realizados en Canadá y en Reino Unido, muestran una excelente seguridad en niños mayores de dos años con antecedentes de alergia al huevo91,92.
A pesar de que las fichas técnicas incluyen la contraindicación de uso de las vacunas antigripales en estos pacientes, se considera que los pacientes con alergia grave al huevo pueden ser vacunados en centros sanitarios con experiencia en el reconocimiento y tratamiento de reacciones alérgicas graves8. Actualmente se recomienda:
- Los sujetos con reacciones leves al huevo, como urticaria, pueden ser vacunados de la gripe. Podrían recibir cualquiera de las vacunas disponibles.
- Personas con reacciones graves tras la toma de huevo como angioedema, dificultad respiratoria o síntomas que hayan requerido adrenalina, pueden ser vacunadas con cualquiera de las vacunas disponibles, pero deberán ser vacunadas en centros, no necesariamente hospitalarios, con medios y preparación para atender eventuales reacciones graves.
- Una reacción alérgica grave a la vacuna antigripal, independientemente del componente que sea la causa de la reacción, es una contraindicación para recibir futuras dosis de la vacuna.
En el caso de lactantes con patología de base alérgica, en quienes, sin haber tomado antes huevo, se haya comprobado una sensibilización al mismo (mediante prick-test o determinación de IgE específica al huevo), se recomienda la misma actitud de prudencia.
Algunas personas que se consideran alérgicas al huevo podrían realmente no serlo y la alergia estar condicionada por otros componentes de estas vacunas, como la gelatina, por ejemplo.
Algunas medidas, tales como administrar la vacuna dividida en dos subdosis y en dos etapas, así como las pruebas cutáneas (prick test) previas, no son recomendables88,93,94.
Inmunodeprimidos
Los pacientes inmunodeprimidos que se infectan por los virus de la gripe ingresan con más frecuencia en el hospital que los no inmunodeprimidos. La mortalidad de la neumonitis en estos pacientes, dependiendo del tipo y grado de inmunosupresión, oscila entre el 3 y el 10%.
Aunque la inmunogenicidad de las vacunas antigripales es menor en los pacientes inmunodeprimidos, una proporción sustancial de estos alcanzan respuestas protectoras capaces de prevenir la enfermedad. Sin embargo, dado que muchas veces estos pacientes no consiguen respuestas protectoras, la importancia de la vacunación antigripal anual de las personas que conviven con ellos es elevada.
Se recomienda, por tanto, la vacunación antigripal anual de todos los pacientes inmunodeprimidos y de sus convivientes (así como cuidadores y sanitarios) con vacunas inactivadas por vía intramuscular, siempre que tengan más de seis meses de edad. La vacunación de contactos domiciliarios cobra especial importancia si el inmunodeprimido es menor de seis meses, al no poder ser vacunado95.
La vacuna atenuada intranasal está contraindicada en pacientes inmunodeprimidos, pero puede emplearse en los contactos de 2 a 18 años de edad, siempre que el paciente inmunocomprometido no lo sea por haber recibido un trasplante de progenitores hemopoyéticos (TPH) en los dos meses previos, padezca enfermedad injerto contra huésped o bien sufra una inmunodeficiencia combinada grave (IDCG). En estos casos si reciben la atenuada, evitarán el contacto en los siete días posteriores a la recepción de la vacuna95.
Vacunación de la embarazada
Actualmente, la vacunación antigripal está recomendada y financiada por todas las comunidades con vacuna inactivada no adyuvada en los centros de salud para todas las embarazadas. Se recomienda la vacunación durante el embarazo, en cualquier momento del mismo, por parte de todos los organismos internacionales (OMS, CDC) y nacionales (Ministerio de Sanidad y sociedades científicas), por una doble motivación96:
- Beneficio para la madre: el embarazo es una situación de mayor riesgo de complicaciones (hasta 18 veces más que las mujeres no embarazadas)97, fundamentalmente respiratorias, sobre todo a partir del segundo trimestre de la gestación, que pueden provocar problemas tanto a la madre como al feto, describiéndose un incremento de la mortalidad materna8. A nivel obstétrico, la vacunación ha demostrado disminuir la probabilidad de aborto y de cesárea8.
- Beneficio para el feto y el niño: la gripe en embarazadas aumenta el riesgo de prematuridad y de muerte perinatal8. La vacunación antigripal de la embarazada ha demostrado que disminuye significativamente la probabilidad de prematuridad y de bajo peso al nacer98.
Por otro lado, debido al efecto protector en la madre e indirectamente del niño, por el paso trasplacentario de anticuerpos de origen materno, se ha observado que vacunando a las embarazadas se consigue reducir los casos de gripe en los niños. En un ensayo clínico se apreció una reducción del 85% de casos de gripe confirmada hasta las ocho semanas de vida y del 25-30% hasta las 24 semanas99. Además, se evitan entre el 25 y el 45% de las hospitalizaciones por infecciones respiratorias graves de sus hijos durante los primeros seis meses de vida100,101, y entre un 50 y un 80% de los ingresos asociados a gripe102,103.
En cuanto a la seguridad, esta vacunación ha demostrado ser segura, aunque se precisan más datos sobre su administración durante el primer trimestre de gestación104. Aun así, no se ha observado que se acompañe de mayor riesgo de malformaciones fetales105, ni siquiera con vacunación en el primer trimestre106.
A pesar de los beneficios evidentes que proporciona y los bajos riesgos asociados, las coberturas de vacunación en embarazadas son bajas107, en gran parte por el desconocimiento, el miedo o la desinformación por parte de los propios profesionales sanitarios, por lo que debe realizarse un mayor esfuerzo global para mejorarlas.
Vacunación de los profesionales sanitarios
Este comité, al igual que otras sociedades científicas de España, desea hacer un especial énfasis en la conveniencia de la vacunación antigripal de todos los profesionales sanitarios que estén en contacto con pacientes108.
En España, generalmente las coberturas para esta vacunación son bajas (20-30%)109 si se comparan con las obtenidas en países como EE. UU.
Los pediatras han demostrado una especial sensibilidad a este respecto, siendo uno de los colectivos sanitarios más proactivos con la vacunación antigripal, como muestran los resultados de la encuesta realizada al inicio de la temporada 2012-2013, con 1585 respuestas de pediatras que ejercen su profesión en España110. Hasta el 60% se habían vacunado todos los años anteriores; por contra, solo el 12,5% reconocían no haberse vacunado nunca frente a la gripe. Para la campaña antigripal 2012-2013, el 79% admitieron haberse vacunado o tener intención franca de hacerlo. Por contra, no se habían vacunado ni tenían intención de llevarlo a cabo el 21%. Aunque este tipo de encuestas tienen muchos sesgos, los resultados sugieren que las tasas de vacunación frente a la gripe entre los pediatras son probablemente de las más altas entre los diferentes profesionales sanitarios108,111. En nuestras manos está fomentar la vacunación entre nuestros compañeros.
CONFLICTO DE INTERESES
Conflictos de intereses potenciales de los autores en los últimos cinco años:
- David Moreno Pérez ha colaborado en actividades docentes subvencionadas por Astra, Pfizer y Sanofi Pasteur MSD, y como consultor en el Advisory Board de GlaxoSmithKline.
- Francisco José Álvarez García ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD y como consultor en los Advisory Board de GlaxoSmithKline y Novartis.
- Javier Arístegui Fernández ha colaborado en actividades docentes y como investigador en ensayos clínicos subvencionados por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como consultor en el Advisory Board de Novartis, GlaxoSmithKline y Astra Zeneca.
- M.ª José Cilleruelo Ortega ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigadora en ensayos clínicos de Pfizer y como consultora en el Advisory Board de GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD.
- José M.ª Corretger Rauet ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Sanofi Pasteur MSD y Novartis.
- Nuria García Sánchez ha colaborado en actividades docentes subvencionadas por Sanofi Pasteur MSD, Novartis y Pfizer. Ha asistido a actividades docentes subvencionadas por Novartis y Pfizer.
- Ángel Hernández Merino ha recibido ayuda económica para asistir a actividades docentes nacionales y ha colaborado en una actividad docente patrocinada.
- Teresa Hernández-Sampelayo Matos ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigadora en ensayos clínicos subvencionados por GlaxoSmithKline y Pfizer.
- Manuel Merino Moína ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como consultor en el Advisory Board de Novartis.
- Luis Ortigosa del Castillo ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline.
- Jesús Ruiz Contreras ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
FINANCIACIÓN
La elaboración de estas recomendaciones (análisis de los datos publicados, debate, consenso y publicación) no ha contado con ninguna financiación externa a la logística básica facilitada por la Asociación Española de Pediatría.
ABREVIATURAS: ACIP: Advisory Committee on Immunization Practices (CDC) · AEP: Asociación Española de Pediatría · CAV-AEP: Comité Asesor de Vacunas de la Asociación Española de Pediatría · CC. AA.: comunidades autónomas · CDC: Centers for Disease Control and Prevention (EE. UU.) · HA: hemaglutinina · IC 95: intervalo de confianza del 95% · ICICLE: US Influenza Vaccine Effectiveness Influenza Clinical Investigation for Children Study · IDCG: inmunodeficiencia combinada grave · JCVI: Joint Committee on Vaccination and Immunisation (PHE, Reino Unido) · NACI: National Advisory Committee on Immunization (Canadá) · OMS: Organización Mundial de la Salud (WHO) · PHE: Public Health of England (Reino Unido) · SGB: síndrome de Guillain-Barré · THL: Terveyden ja Hyvinvoinnin Laitos (Finnish National Institute for Health and Welfare) · TPH: trasplante de progenitores hemopoyéticos · VIH: virus de la inmunodeficiencia humana.
BIBLIOGRAFÍA
- Documentos del CAV. En: Comité Asesor de Vacunas de la AEP [en línea] [consultado el 25/10/2016]. Disponible en http://vacunasaep.org/documentos
- Domínguez Cajal MM, de Arriba Muñoz A, Escosa García L, García Íñiguez JP, Biosca Pàmies M, García Sánchez N. Cobertura de vacuna antigripal en niños de riesgo durante 2007-2008 en un centro de Atención Primaria en España. Rev Pediatr Aten Primaria. 2009;11:399-411.
- Jiménez-García R, Esteban-Vasallo MD, Rodríguez-Rieiro C, Hernandez-Barrera V, Domínguez-Berjón MA, Carrasco Garrido P, et al. Coverage and predictors of vaccination against 2012/13 seasonal influenza in Madrid, Spain: analysis of population-based computerized immunization registries and clinical records. Hum Vaccin Immunother. 2014;10:449-55.
- Recommended composition of influenza virus vaccines for use in the 2016-2017 northern hemisphere influenza season. En: Organización Mundial de la Salud [en línea] [consultado el 25/10/2016]. Disponible en www.who.int/influenza/vaccines/virus/recommendations/201602_recommendation.pdf?ua=1
- Rubin LG, Papsin B; Committee on Infectious Diseases and Section on Otolaryngology-Head and Neck Surgery. Cochlear implants in children: surgical site infections and prevention and treatment of acute otitis media and meningitis. Pediatrics. 2010;126:381-91.
- Ranjan P, Chakrawarty A, Kumari A, Kumar J. Immunization in patients with rheumatic diseases: a practical guide for general practitioners. J Clin Diagn Res. 2015;9:OE01-OE14.
- Ogimi C, Tanaka R, Saitoh A, Oh-Ishi T. Immunogenicity of influenza vaccine in children with pediatric rheumatic diseases receiving immunosuppressive agents. Pediatr Infect Dis J. 2011;30:208-11.
- Grohskopf LA, Sokolow LZ, Broder KR, Olsen SJ, Karron RA, Jernigan DB, et al. Prevention and control of seasonal influenza with vaccines. MMWR Morb Mortal Wkly Rep. 2016;65:1-54.
- Fichas técnicas de vacunas antigripales. En: Comité Asesor de Vacunas de la AEP [en línea] [consultado el 25/10/2016]. Disponible en http://vacunasaep.org/profesionales/fichas-tecnicas-vacunas/resultados?diseases=148
- Halasa NB, Gerber MA, Berry AA, Anderson EL, Winokur P, Keyserling H, et al. Safety and immunogenicity of full-dose trivalent inactivated influenza vaccine (TIV) compared with half-dose TIV administered to children 6 through 35 months of age. J Pediatr Infect Dis Soc. 2015;4:214-24.
- Langley JM, Vanderkooi OG, Garfield HA, Hebert J, Chandrasekaran V, Jain VK, et al. Immunogenicity and safety of 2 dose levels of a thimerosal-free trivalent seasonal influenza vaccine in children aged 6-35 months: a randomized, controlled trial. J Pediatric Infect Dis Soc. 2012;1:55-63.
- Skowronski DM, Hottes TS, Chong M, De Serres G, Scheifele DW, Ward BJ, et al. Randomized controlled trial of dose response to influenza vaccine in children aged 6 to 23 months. Pediatrics. 2011;128:e276-89.
- National Health System Education for Scotland. Administration of Fluenz® intranasal influenza vaccine. En: Vimeo [en línea] [consultado el 25/10/2016]. Disponible en https://vimeo.com/72406459
- Ambrose CS, Wu X, Knuf M, Wutzler P. The efficacy of intranasal live attenuated influenza vaccine in children 2 through 17 years of age: a meta analysis of 8 randomized controlled studies. Vaccine. 2012;30:886-92.
- González de Dios J, Rodrigo C, Piedra JA, Corretger JM, Moreno-Pérez D. Vacunación antigripal universal en Pediatría: ¿sí o no? An Pediatr (Barc). 2013;79:261.e1-11.
- Bandell AR, Simoes EAF. Live attenuated influenza vaccine tetravalent: a clinical review. Expert Rev Vaccines. 2015;14:963-73.
- Tennis P, Toback SL, Andrews EB, McQuay LJ, Ambrose CS. A US postmarketing evaluation of the frequency and safety of live attenuated influenza vaccine use in non recommended children younger than 5 years: 2009-2010 season. Vaccine. 2012;30:6099-102.
- Matias G, Salamanca I, Camacho Conde P, Lirola M, Haguinet F, Sawchik Monegal J, et al. Burden of influenza-related hospitalisations and emergency room visits in children under 15 years of age in Spain. 4th International Conference of European Scientific Working Group on Influenza (ESWI). Malta, 2011.
- Toback SL, Levin MJ, Block SL, Belshe RB, Ambrose CS, Falloon J. Quadrivalent Ann Arbor strain live-attenuated influenza vaccine. Expert Rev Vaccines. 2012;11:1293-303.
- Heikkinen T, Tsolia M, Finn A. Vaccination of healthy children against seasonal influenza. A European perspective. Pediatr Infect Dis J. 2013;32:881-8.
- Greenberg DP, Robertson CA, Landolfi VA, Bhaumik A, Senders SD, Decker MD. Safety and immunogenicity of a inactivated quadrivalent influenza vaccine in children 6 months through 8 years of age. Pediatr Infect Dis J. 2014;33:630-6.
- Reina J. Las vacunas cuadrivalentes frente a la gripe estacional. ¿Son la solución definitiva? Med Clin (Barc). 2014;142:355-7.
- Diez-Domingo J, de Martino M, Lopez JG, Zuccotti GV, Icardi G, Villani A, et al. Safety and tolerability of cell culture-derived and egg-derived trivalent influenza vaccines in 3 to < 18 year-old children and adolescents at risk of influenza-related complications: a phase III, randomized, multicenter, observer-blind clinical trial. Int J Infect Dis. 2016;49:171-8.
- Influenza virus characterisation, summary Europe. En: European Centre for Disease Prevention and Control (ECDC) [en línea] [consultado el 25/10/2016]. Disponible en http://ecdc.europa.eu/en/healthtopics/influenza/epidemiological_data/Pages/Influenza_virus_characterisation.aspx
- Weekly National Flu Reports. En: Public Health England (PHE) [en línea] [consultado el 25/10/2016]. Disponible en www.gov.uk/government/statistics/weekly-national-flu-reports
- Annual flu programme. En: Public Health England (PHE) [en línea] [consultado el 25/10/2016]. Disponible en www.gov.uk/government/collections/annual-flu-programme#history
- Seasonal flu vaccine uptake in children of primary school age: winter season 2015 to 2016. En: Public Health England (PHE) [en línea] [consultado el 25/10/2016]. Disponible en www.gov.uk/government/statistics/seasonal-flu-vaccine-uptake-in-children-of-primary-school-age-winter-season-2015-to-2016
- Pebody R, Warburton F, Ellis J, Andrews N, Potts A, Cottrell S, et al. Effectiveness of seasonal influenza vaccine for adults and children in preventing laboratory-confirmed influenza in primary care in the United Kingdom: 2015/16 end-of-season results. Euro Surveill. 2016;21(38).
- Nohynek H, Baum U, Syrjänen R, Ikonen N, Sundman J, Jokinen J. Effectiveness of the live attenuated and the inactivated influenza vaccine in two-year-olds – a nationwide cohort study Finland, influenza season 2015/16. Euro Surveill. 2016;21(38).
- Chung JR, Flannery B, Thompson MG, Gaglani M, Jackson ML, Monto AS, et al. Seasonal effectiveness of live attenuated and inactivated Influenza vaccine. Pediatrics. 2016;137:e20153279.
- Grohskopf LA, Olsen SJ, Sokolow LZ, Bresee JS, Cox NJ, Broder KR, et al. Prevention and control of seasonal influenza with vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP) – United States, 2014-15 influenza season. MMWR Morb Mortal Wkly Rep. 2014;63:691-8.
- Belshe RB, Edwards KM, Vesikari T, Black SV, Walker RE, Hultquist M, et al. Live attenuated versus inactivated influenza vaccine in infants and young children. N Engl J Med. 2007;356:685-96.
- Grohskopf LA, Sokolow LZ, Olsen SJ, Bresee JS, Broder KR, Karron RA. Prevention and control of influenza with vaccines: Recommendations of the Advisory Committee on Immunization Practices, United States, 2015-16 Influenza Season. MMWR Morb Mortal Wkly Rep. 2015;64:818-25.
- Gaglani M, Pruszynski J, Murthy K, Clipper L, Robertson A, Reis M, et al. Influenza vaccine effectiveness against 2009 pandemic Influenza A(H1N1) virus differed by vaccine type during 2013-2014 in the United States. J Infect Dis. 2016;213:1546-56.
- Cotter CR, Jin H, Chen Z. A single amino acid in the stalk region of the H1N1pdm influenza virus HA protein affects viral fusion, stability and infectivity. PLoS Pathog. 2014;10:e1003831.
- Ficha técnica de Fluenz Tetra. En: Agencia Europea del Medicamento [en línea] [consultado el 25/10/2016]. Disponible en www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002617/WC500158412.pdf
- Ficha técnica de Flumist Quadrivalent. En: FDA [en línea] [consultado el 25/10/2016]. Disponible en www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM294307.pdf
- Flannery B, Chung J. Influenza vaccine effectiveness, including LAIV vs IIV in children and adolescents. US Flu VE Network, 2015-16 Influenza Division, CDC. June 22, 2016. En: CDC [en línea] [consultado el 25/10/2016]. Disponible en www.cdc.gov/vaccines/acip/meetings/downloads/slides-2016-06/influenza-05-flannery.pdf
- Committee on Infectious Diseases, American Academy of Pediatrics. Recommendations for prevention and control of influenza in children, 2016-2017. Pediatrics. 2016;138:e20162527.
- Caspard H, Belongia E, Bernatoniene J, Clipper L, Congeni B, Faust SN, et al. Multicenter study of the effectiveness of live attenuated Influenza vaccine and inactivated Influenza vaccine in children from 2015-2016 in the United States and the United Kingdom - Interim Results. Options IX for the Control of Influenza. ISIRV 2016 Poster P-115. Chicago, August 24-28th 2016. En: International Society for Influenza and other Respiratory Virus Diseases. Disponible en http://2016.isirv.org/sites/default/files/docs/2016/isirv-16-fp-web.pdf
- FDA information regarding FluMist Quadrivalent vaccine (06/27/2016). En: FDA [en línea] [consultado el 25/10/2016]. Disponible en www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm508761.htm
- Penttinen PM, Friede MH. Decreased effectiveness of the influenza A(H1N1)pdm09 strain in live attenuated influenza vaccines: an observational bias or a technical challenge? Euro Surveill. 2016;21(38).
- Loeb M, Russell ML, Manning V, Fonseca K, Earn D, Horsman G, et al. Live attenuated versus inactivated Influenza vaccine in Hutterite children: a cluster randomized blinded trial. Ann Intern Med. 2016 [en prensa].
- Advisory Committee Statement (ACS). National Advisory Committee on Immunization (NACI) Canadian Immunization Guide Chapter on Influenza and Statement on Seasonal Influenza Vaccine for 2016-2017. En: Public Health Agency of Canada [en línea] [consultado el 25/10/2016]. Disponible en www.phac-aspc.gc.ca/naci-ccni/assets/pdf/flu-2016-grippe-eng.pdf
- Bandell A, Woo J, Coelingh K. Protective efficacy of live-attenuated influenza vaccine (multivalent, Ann Arbor strain): a literature review addressing interference. Expert Rev Vaccines. 2011;10:1131-41.
- Caspard H, Coelingh KL, Mallory RM, Ambrose CS. Association of vaccine handling conditions with effectiveness of live attenuated influenza vaccineagainst H1N1pdm09 viruses in the United States. Vaccine. 2016;34:5066-72.
- Hawkes N. UK stands by nasal flu vaccine for children as US doctors are told to stop using it. BMJ. 2016;353:i3546.
- Bulletin Juillet-Aout 2016. En: INFOVAC [en línea] [consultado el 25/10/2016]. Disponible en www.infovac.ch/fr/infovac
- Epidemiologishes Bulletin, August 2016. En: Robert Koch Institut [en línea] [consultado el 25/10/2016]. Disponible en www.rki.de/DE/Content/Kommissionen/STIKO/stiko_node.html
- Silvennoinen H, Peltola V, Vainionpaa R, Ruuskunen O, Heikkinen T. Incidence of influenza-related hospitalizations in different age groups of children in Finland: a 16-year study. Pediatr Infect Dis J. 2011;30:e24-8.
- Poehling KA, Edwards KM, Weinberg GA, Szilagyi P, Staat MA, Iwane MK, et al. The underrecognized burden of influenza in young children. N Engl J Med. 2006;355:31-40.
- Glezen WP, Couch RB. Interpandemic influenza in the Houston area, 1974-76. N Engl J Med. 1978;298:587-92.
- Glezen WP, Taber LH, Frank AL, Gruber WC, Piedra PA. Influenza virus infections in infants. Pediatr Infect Dis J. 1997;16:1065-8.
- Frank AL, Taber LH, Wells CR, Wells JM, Glezen WP, Paredes A. Patterns of shedding of myxoviruses and paramyxoviruses in children. J Infect Dis. 1981;144:433-41.
- Reichert TA, Sugaya N, Fedson DS, Glezen WP, Simonsen L, Tashiro M. The Japanese experience with vaccinating schoolchildren against influenza. N Engl J Med. 2001;344:889-96.
- Charu V, Viboud C, Simonsen L, Sturm-Ramirez K, Shinjoh M, Chowell G, et al. Influenza-related mortality trends in Japanese and American seniors: evidence for the indirect mortality benefits of vaccinating schoolchildren. PLoS One. 2011;6:e26282.
- Sugaya N, Takeuchi Y. Mass vaccination of schoolchildren against influenza and its impact on the influenza-associated mortality rate among children in Japan. Clin Infect Dis. 2005;41:939-47.
- Sugaya N. A review of the indirect protection of younger children and the elderly through a mass influenza vaccination program in Japan. Expert Rev Vaccines. 2014;13:1563-70.
- Loeb M, Russell ML, Moss L, Fonseca K, Fox J, Earn DJ, et al. Effect of influenza vaccination of children on infection rates in Hutterite communities: a randomized trial. JAMA. 2010;303:943-50.
- Cohen SA, Chui KK, Naumova EN. Influenza vaccination in young children reduces influenza-associated hospitalizations in older adults, 2002-2006. J Am Geriatr Soc. 2011;59:327-32.
- Kim TH. Seasonal influenza and vaccine herd effect. Clin Exp Vacc Research. 2014;3:128-32.
- Glezen WP, Gaglani MJ, Kozinetz CA, Piedra PA. Direct and indirect effectiveness of influenza vaccination delivered to children at school preceding an epidemic caused by 3 new influenza virus variants. J Infect Dis. 2010;202:1626-33.
- Baguelin M, Flasche S, Camacho A, Demiris N, Miller E, Edmunds WJ. Assessing optimal target populations for influenza vaccination programmes: an evidence synthesis and modelling study. PLoS Med. 2013;10:e1001527.
- Pitman RJ, White LJ, Sculpher M. Estimating the clinical impact of introducing paediatric influenza vaccination in England and Wales. Vaccine. 2012;30:1208-24.
- Pitman RJ, Nagy LD, Sculpher MJ. Cost-effectiveness of childhood influenza vaccination in England and Wales: Results from a dynamic transmission model. Vaccine. 2013;31:927-42.
- Darvishian M, Bijlsma MJ, Hak E, van den Heuvel ER. Effectiveness of seasonal influenza vaccine in community-dwelling elderly people: a meta-analysis of test-negative design case-control studies. Lancet Infect Dis. 2014;14:1228-39.
- Puig-Barbera J, Mira-Iglesias A, Tortajada-Girbes M, Lopez-Labrador FX, Belenguer-Varea A, Carballido-Fernandez M, et al. Effectiveness of influenza vaccination programme in preventing hospital admissions, Valencia, 2014/15 early results. Euro Surveill. 2015;20:pii=21044.
- Jefferson T, Di Pietrantonj C, Al-Ansary LA, Ferroni E, Thorning S, Thomas RE. Vaccines for preventing influenza in the elderly. Cochrane Database Syst Rev. 2010;(2):CD004876.
- Nichol KL, Nordin JD, Nelson DB, Mullooly JP, Hak E. Effectiveness of influenza vaccine in the community-dwelling elderly. N Engl J Med. 2007;357:1373-81.
- Izurieta HS, Thompson WW, Kramarz P, Shay DK, Davis RL, DeStefano F, et al. Influenza and the rates of hospitalization for respiratory disease among infants and young children. N Engl J Med. 2000;342:232-9.
- Neuzil KM, Mellen BG, Wright PF, Mitchel EF, Jr., Griffin MR. The effect of influenza on hospitalizations, outpatient visits, and courses of antibiotics in children. N Engl J Med. 2000;342:225-31.
- Nunes B, Falcao I, Machado A, Rodrigues E, Falcao JM. Influenza vaccine coverage and the attack rate of influenza-like illness among the elderly in Portugal: is there a correlation? Euro Surveill. 2007;12: E070517.2.
- Aguilar I, Reyes M, Martinez-Baz I, Guevara M, Albeniz E, Belza M, et al. Use of the vaccination register to evaluate influenza vaccine coverage in seniors in the 2010/11 influenza season, Navarre, Spain. Euro Surveill. 2012;17(17):pii=20154.
- Mereckiene J, O'Donnell J, Collins C, Cotter S, Igoe D, O'Flanagan D. Risk groups and uptake of influenza and pneumococcal vaccine in Ireland. Euro Surveill. 2007;12:E13-4.
- Kroneman MW, van Essen GA. Stagnating influenza vaccine coverage rates among high-risk groups in Poland and Sweden in 2003/4 and 2004/5. Euro Surveill. 2007;12:E1-2.
- Alguacil-Ramos AM, Garrigues-Pelufo TM, Muelas-Tirado J, Portero-Alonso A, Pérez-Panadés J, Fons-Martínez J. Seguridad de las vacunas antigripales en grupos de riesgo: análisis de las sospechas de reacciones adversas notificadas en Comunidad Valenciana entre 2005 y 2011. Rev Esp Quimioter. 2015;28:193-9.
- Wood NJ, Blyth CC, Willis GA, Richmond P, Gold MS, Buttery JP, et al. The safety of seasonal influenza vaccines in Australian children in 2013. Med J Aust. 2014;201:596-600.
- Li-Kim-Moy J, Yin JK, Rashid H, Khandaker G, King C, Wood N, et al. Systematic review of fever, febrile convulsions and serious adverse events following administration of inactivated trivalent influenza vaccines in children. Euro Surveill. 2015;20(24):pii=21159.
- Tse A, Tseng HF, Greene SK, Vellozzi C, Lee GM; VSD Rapid Cycle Analysis Influenza Working Group. Signal identification and evaluation for risk of febrile seizures in children following trivalent inactivated influenza vaccine in the Vaccine Safety Datalink Project, 2010-2011. Vaccine. 2012;30:2024-31.
- Kawai AT, Martin D, Kulldorff M, Li L, Cole DV, McMahill-Walraven CN, et al. Febrile seizures after 2010-2011 trivalent inactivated influenza vaccine. Pediatrics. 2015;136:e848-55.
- Duffy J, Weintraub E, Hambidge SJ, Jackson LA, Kharbanda EO, Klein NP, et al. Febrile seizure risk after vaccination in children 6 to 23 months. Pediatrics. 2016;138(1):pii: e20160320.
- Vellozzi C, Iqbal S, Broder K. Guillain-Barre syndrome, influenza, and influenza vaccination: the epidemiologic evidence. Clin Infect Dis. 2014;58:1149-55.
- Feltelius N, Persson I, Ahlqvist-Rastad J, Andersson M, Arnheim-Dahlström L, Bergman P, et al. A coordinated cross-disciplinary research initiative to address an increased incidence of narcolepsy following the 2009-2010 Pandemrix vaccination programme in Sweden. J Intern Med. 2015;278:335-53.
- Ahmed SS, Volkmuth W, Duca J, Corti L, Pallaoro M, Pezzicoli A, et al. Antibodies to influenza nucleoprotein cross-react with human hypocretin receptor 2. Sci Transl Med. 2015;7:294ra105.
- Ambrose CS, Luke C, Coelingh K. Current status of live attenuated influenza vaccine in the United States for seasonal and pandemic influenza. Influenza Other Respir Viruses. 2008;2:193-202.
- Izurieta HS, Haber P, Wise RP, Iskander J, Pratt D, Mink C, et al. Adverse events reported following live, cold-adapted, intranasal influenza vaccine. JAMA. 2005;294:2720.
- Haber P, Moro PL, Cano M, Vellozzi C, Lewis P, Woo EJ, et al. Post-licensure surveillance of trivalent live-attenuated influenza vaccine in children aged 2-18 years, Vaccine Adverse Event Reporting System, United States, July 2005-June 2012. J Pediatric Infect Dis Soc. 2015;4:205-13.
- Echeverría Zudaire L, Ortigosa del Castillo L, Alonso Lebrero E, Álvarez García FJ, Cortés Álvarez N, García Sánchez N, et al. Documento de consenso sobre la actitud ante un niño con una reacción alérgica tras la vacunación o alergia a componentes vacunales. Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica (SEICAP) y Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). An Pediatr (Barc). 2015;83:63.e1-10.
- McNeil MM, Weintraub ES, Duffy J, Sukumaran L, Jacobsen SJ, Klein NP, et al. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol. 2016;137:868-78.
- Influenza: The Green Book, Chapter 9. 2015. En: Gov.uk [en línea] [consultado el 25/10/2016]. Disponible en www.gov.uk/government/publications/influenza-the-green-book-chapter-19
- Des Roches A, Samaan K, Graham F, Lacombe-Barrios J, Paradis J, Paradis L, et al. Safe vaccination of patients with egg allergy by using live attenuated influenza vaccine. J Allergy Clin Immunol Pract. 2015;3:138-9.
- Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M, SNIFFLE Study Investigators. Safety of live attenuated influenza vaccine in atopic children with egg allergy. J Allergy Clinical Immunol. 2015;136:376-81.
- Kelso JM, Greenhawt MJ, Li JT. Adverse reactions to vaccines practice parameter 2012 update. J Allergy Clin Immunol. 2012;130:25-43.
- Advisory Committee on Immunization Practices (ACIP). Influenza: Vaccine safety update. Presented at the Advisory Committee on Immunization Practices meeting, Atlanta, Georgia; June 19-20, 2013. En: CDC [en línea] [consultado el 25/10/2016]. Disponible en www.cdc.gov/vaccines/acip/meetings/downloads/min-archive/min-jun13.pdf
- Vacunación en niños inmunodeprimidos o con tratamiento inmunosupresor. EN. Manual de Vacunas en línea de la AEP [en línea] [consultado el 25/10/2016]. Disponible en http://vacunasaep.org/documentos/manual/cap-14
- Sakala IG, Honda-Okubo Y, Fung J, Petrovsky N. Influenza immunization during pregnancy: Benefits for mother and infant. Hum Vaccin Immunother. 2016:1-7 [en prensa].
- Martin A, Cox S, Jamieson DJ, Whiteman MK, Kulkarni A, Tepper NK. Respiratory illness hospitalizations among pregnant women during influenza season, 1998-2008. Matern Child Health J. 2013;17:1325-31.
- Nunes MC, Aqil AR, Omer SB, Madhi SA. The effects of influenza vaccination during pregnancy on birth outcomes: a systematic review and meta-analysis. Am J Perinatal. 2016;33:1104-14.
- Louik C, Kerr S, Van Bennekom CM, Chambers C, Jones KL, Schatz M, et al. Safety of the 2011-12, 2012-13, and 2013-14 seasonal influenza vaccines in pregnancy: Preterm delivery and specific malformations, a study from the case-control arm of VAMPSS. Vaccine. 016;34:4450-9.
- Nunes MC, Cutland CL, Jones S, Hugo A, Madimabe R, Simões EA, et al; Maternal Flu Trial Team. Duration of infant protection against influenza illness conferred by maternal immunization: secondary analysis of a randomized clinical trial. JAMA Pediatr. 2016;170:840-7.
- Poehling KA, Szilagyi PG, Staat MA, Snively BM, Payne DC, Bridges CB, et al. Impact of maternal immunization on influenza hospitalizations in infants. Am J Obstet Gynecol. 2011;204:S141-8.
- Regan AK, de Klerk N, Moore HC, Omer SB, Shellam G, Effler PV. Effect of maternal influenza vaccination on hospitalization for respiratory infections in newborns: a retrospective cohort study. Pediatr Infect Dis J. 2016;35:1097-103.
- Madhi SA, Cutland CL, Kuwanda L, Weinberg A, Hugo A, Jones S, et al. Influenza vaccination of pregnant women and protection of their infants. N Engl J Med. 2014;371:918-31.
- Shakib JH, Korgenski K, Presson AP, Sheng X, Varner MW, Pavia AT, et al. Influenza in infants born to women vaccinated during pregnancy. Pediatrics. 2016;137(6). pii: e20152360.
- McMillan M, Porritt K, Kralik D, Costi L, Marshall H. Influenza vaccination during pregnancy: a systematic review of fetal death, spontaneous abortion, and congenital malformation safety outcomes. Vaccine. 2015;33:2108-17.
- Polyzos KA, Konstantelias AA, Pitsa CE, Falagas ME. Maternal influenza vaccination and risk for congenital manlformations: a systematic review and meta-analysis. Obstet Gynecol. 2015;126:1075-84.
- Ding H, Black CL, Ball S, Donahue S, Fink RV, Williams WW, et al. Influenza vaccination coverage among pregnant women–United States, 2014-15 influenza season. MMWR Morb Mortal Wkly Rep. 2015;64:1000-5.
- Consenso sobre la vacunación frente a la gripe en el personal sanitario. En: Comité Asesor de Vacunas de la AEP [en línea] [consultado el 25/10/2016]. Disponible en http://vacunasaep.org/documentos/documento-de-consenso-sobre-vacunacion-del-personal-sanitario-contra-la-gripe
- Velasco Munoz C, Sequera VG, Vilajeliu A, Aldea M, Mena G, Quesada S, et al. Adverse events self-declaration system and influenza vaccination coverage of healthcare workers in a tertiary hospital. Med Clin (Barc). 2016;146:155-9.
- Encuesta 2012-2013: ¿Los pediatras nos vacunamos de la gripe? En: Comité Asesor de Vacunas de la AEP [en línea] [consultado el 25/10/2016]. Disponible en http://vacunasaep.org/resultados-de-la-encuesta-vacgripe-2012
- Arrazola P, Benavente S, De Juanes JR, García de Codes A, Gil P, Jaén F, et al. Cobertura vacunal antigripal de los trabajadores de un hospital general, 2004-2011. Vacunas. 2012;13:138-44.






