Vol. 18 - Num. 69
Grupo PrevInfad/PAPPS Infancia y Adolescencia
Cribado de la tuberculosis
José M.ª Mengual Gila, Manuel Merino Moínab, Carmen Rosa Pallás Alonsoc, Francisco Javier Sánchez Ruiz-Cabellod, Javier Soriano Faurae, Julia Colomer Revueltaf, Olga Cortés Ricog, M.ª Jesús Esparza Olcinah, Jaime García Aguadoh, Ana Martínez Rubioi, Grupo PrevInfad/PAPPS Infancia y Adolescenciaj
aPediatra. CS Delicias Sur. Zaragoza. España.
bPediatra. CS El Greco. Getafe. Madrid. España.
cServicio de Neonatología. Hospital Universitario 12 de Octubre. Madrid. España.
dPediatra. CS Zaidín Sur. Granada. España.
ePediatra. CS Fuensanta. Valencia. España.
fDepartamento de Pediatría, Obstetricia y Ginecología. Unidad de Pediatría. Universidad de Valencia. Valencia. España.
gPediatra. CS Canillejas. Madrid. España.
hPediatra. Madrid. España.
iPediatra. CS de Camas. Sevilla. España.
jJosé María Mengual Gil (coord.).
Correspondencia: JM Mengual. Correo electrónico: pepebobes@gmail.com
Cómo citar este artículo: Mengual Gil JM, Merino Moína M, Pallás Alonso CR, Sánchez Ruiz-Cabello FJ, Soriano Faura J, Colomer Revuelta J, et al. Cribado de la tuberculosis. Rev Pediatr Aten Primaria. 2016;69:65-78.
Publicado en Internet: 29-03-2016 - Número de visitas: 22799
Resumen
Hay pruebas de que el cribado universal de la infección tuberculosa latente (ITBL) en zonas de baja incidencia tiene un rendimiento pobre, un número elevado de falsos positivos y no es coste-efectivo. Hay evidencias de que el cribado de la ITBL en los grupos que tienen riesgo elevado de desarrollar una infección tuberculosa activa (ITBA) mejora el rendimiento de las pruebas diagnósticas, el balance beneficio-riesgo y debe formar parte de las estrategias para disminuir el impacto de la tuberculosis.
Sobre el dilema de cuál de las tres estrategias (prueba cutánea de la tuberculina [PCT] sola, determinación de la liberación de interferón gamma [IGRA] solo o PCT seguida de IGRA) para el diagnóstico de la ITBL es la que ofrece mejor rendimiento, existe variabilidad tanto en las recomendaciones de las guías de práctica clínica (GPC) y las instituciones como en las conclusiones de los estudios sobre el tema, aunque la mayoría de las recomendaciones van en el mismo sentido que las que proponemos en este documento.
La prueba cutánea de la tuberculina sigue siendo el test diagnóstico con mejor rendimiento para realizar el cribado de la infección tuberculosa latente en niños y adolescentes.
Recomendaciones de PrevInfad (GRADE):
- Se recomienda no realizar el cribado universal de la infección tuberculosa latente en los niños y adolescentes de nuestro país.
- Se recomienda realizar el cribado de la infección tuberculosa latente en los niños y adolescentes que pertenecen a grupos de riesgo.
- Se sugiere el uso de la prueba cutánea de la tuberculina (PCT) como primera prueba para el cribado de la infección tuberculosa latente en niños y adolescentes de nuestro país.
- Se sugiere utilizar los IGRA para los niños y adolescentes de cinco o más años con PCT positiva y antecedente de vacunación con bacilo de Calmette-Guérin (BCG) para mejorar la especificidad de la prueba de cribado.
Palabras clave
● Cribado universal ● Determinación de la liberación de interferón gamma ● Infección tuberculosa latente ● Prueba de la tuberculina ● TuberculosisINTRODUCCIÓN
El cribado de la infección tuberculosa latente (ITBL) como estrategia de prevención plantea dudas sobre si es una actividad preventiva o forma parte de un proceso diagnóstico. Los grupos de referencia en actividades preventivas a nivel internacional, como el US Preventive Services Task Force (USPSTF)1, el Canadian Task Force on Preventive Health Care (CTFPHC)2 o el UK National Screening Committee3, no incluyen entre sus recomendaciones el cribado de la ITBL en la infancia y adolescencia y derivan el tema a otras instituciones dedicadas al control de enfermedades infecciosas. A mediados de 2014, el USPSTF ha iniciado el proceso para elaborar las recomendaciones sobre el cribado de la ITBL en la edad adulta, excluyendo explícitamente a los niños y adolescentes4.
El cribado de la ITBL en los niños y adolescentes que pertenecen a grupos de riesgo forma parte de las actividades del pediatra de Atención Primaria. Un estudio epidemiológico realizado en EE. UU. considera que el 75% de los casos pediátricos de infección tuberculosa activa (ITBA) se pueden prevenir desde Atención Primaria5. Una de las principales estrategias para reducir la carga de la tuberculosis (TB) en la infancia y adolescencia es la detección de los casos de ITBL6.
En este documento se aborda el cribado de la ITBL mediante dos pruebas diagnósticas: la prueba cutánea de la tuberculina (PCT) y la determinación de la liberación de interferón gamma o IGRA por sus siglas en inglés (interferon-gamma release assays). Se ha encontrado nueva evidencia sobre el uso de los IGRA como prueba diagnóstica y su comparación con la PCT, por lo que este tema será tratado de manera más extensa. No se analizan las reglas de predicción clínica o scores clínicos ya que se usan para el cribado de la enfermedad tuberculosa activa, y tampoco se aborda la actuación ante los contactos de pacientes con TB.
De la literatura revisada destacan dos guías de práctica clínica (GPC) realizadas con metodología Grading of Recommendations Assessment, Development and Evaluation (GRADE)7, la del Sistema Nacional de Salud (SNS) de nuestro país, publicada en 20108, y la del Instituto Nacional para la Salud y la Excelencia Clínica (NICE) del Reino Unido, actualizada en 20169. Aunque su ámbito no es específico para niños y adolescentes, en las dos se recogen recomendaciones para la edad pediátrica. También destacan la revisión sistemática y metaanálisis sobre estudios en niños y adolescentes de Mandalakas, de 201110, y las de Sollai11 y Ge12 publicadas en 2014, la revisión de las recomendaciones de diversas guías internacionales de Berti (2014)13, el documento del Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención Primaria (AEPap), de 201414, y la revisión de Starke para la Academia Americana de Pediatría (AAP), publicada en 201415.
MAGNITUD DEL PROBLEMA
Los niños representan una minoría de los casos de TB, pero tienen mayor incidencia de enfermedad generalizada y de enfermedad tuberculosa extrapulmonar de difícil diagnóstico. El riesgo de progresión de la infección latente a enfermedad activa es mayor en los menores de cinco años, disminuye entre los cinco y diez años de edad y aumenta durante la adolescencia. Los lactantes menores de 12 meses tienen un riesgo de progresión del 40%, los de uno a dos años del 25% y en mayores de dos años el riesgo es de 10-15%15. Además, la identificación y el tratamiento de la ITBL puede reducir sustancialmente el riesgo de desarrollar enfermedad activa6.
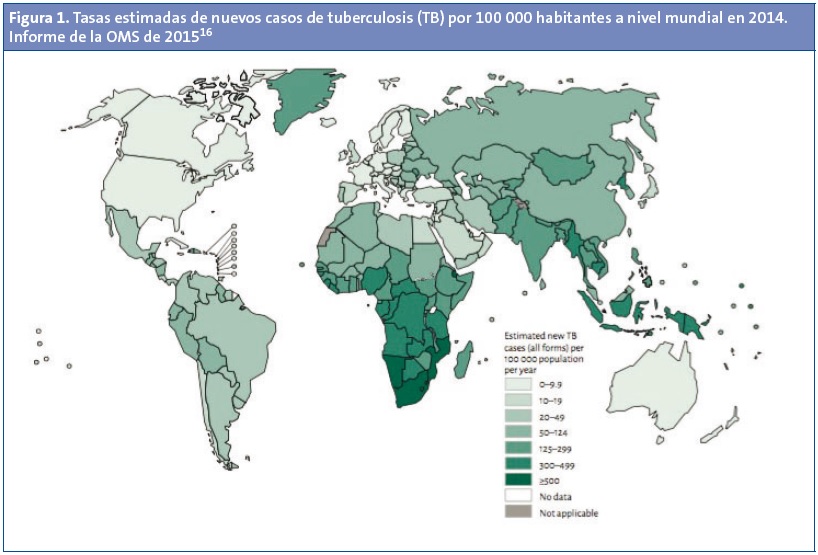
Según los datos del informe mundial sobre la tuberculosis de la Organización Mundial de la Salud (OMS) de 201516, la TB sigue siendo un problema sanitario importante a escala mundial. La cifra estimada de nuevos casos en 2014 fue de 9,6 millones de personas, y 1,5 millones murieron por esta causa. El número estimado de nuevos casos en menores de 15 años fue de 1 000 000 (el 10% del total de casos) y fallecieron 140 000 (el 9% del total de fallecimientos), de los que 81 000 eran positivos para el virus de la inmunodeficiencia humana (VIH).
En 2014, el 58% de los casos mundiales se localizaron en las regiones del Sudeste Asiático y del Pacífico Occidental (Fig. 1). El mayor número de casos tuvo lugar en India (el 28% del total), Indonesia (10%) y China. En África se dieron el 28% del total de casos mundiales, pero la carga de la enfermedad (281 casos por 100 000 habitantes) fue de más del doble que el promedio mundial, de 133 casos. Los 22 países con más alta carga de TB son: Afganistán, Bangladesh, Brasil, Camboya, China, Etiopía, Federación de Rusia, Filipinas, India, Indonesia, Kenia, Mozambique, Myanmar, Nigeria, Pakistán, República Democrática del Congo, República Unida de Tanzania, Sudáfrica, Tailandia, Uganda, Vietnam y Zimbabue.
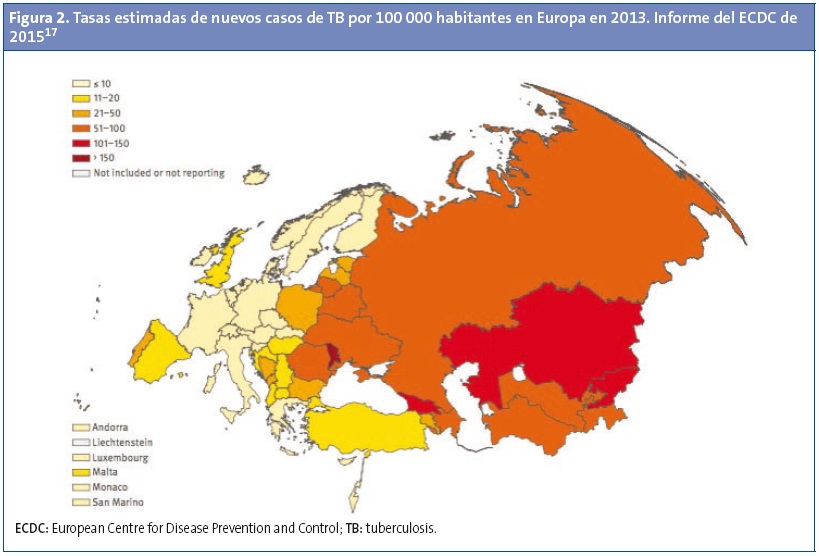
En Europa, según datos del Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC)17, la incidencia estimada en la Región Europea de la OMS en 2013 fue de 360 000 casos (39 por 100 000 habitantes) y el 85% de ellos estaban en los 18 países de alta carga de la Región Europea de la OMS (Fig. 2), que son: Armenia, Azerbaiyán, Bielorrusia, Bulgaria, Estonia, Georgia, Kazajistán, Kirguistán, Letonia, Lituania, Moldavia, Rumania, Rusia, Tayikistán, Turkmenistán, Turquía, Ucrania y Uzbekistán. En los países de la Unión Europea se notificaron 64 844 casos de TB en 2013, de los que 2655 (4,1%) eran menores de 15 años (tasa de 3,3 por 100 000 niños). De los 64 844 casos notificados, 45 279 (69,8%) se dieron en ciudadanos del país declarante (“nativos”), 18 180 (28%) eran de origen extranjero y 1385 (2,1%) de origen desconocido.
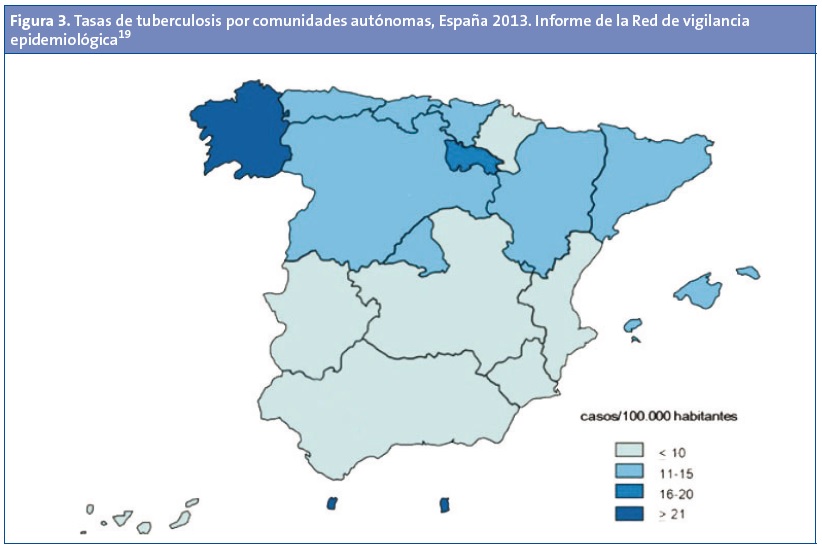
En España se notificaron 5018 casos de tuberculosis en el año 201418 (Fig. 3), lo que supone una tasa de incidencia de 10,80 casos por 100 000 habitantes. De ellos, 299 (el 6% del total) fueron menores de 15 años (tasa de 4,24 por 100 000). Del total de casos declarados, el 29% (1446) habían nacido fuera de España. Se dispone de información sobre el país de nacimiento en 895 casos (62%). Los países con mayor número de casos son Marruecos (210), Rumania (105) y Pakistán (80).
PREGUNTAS CLÍNICAS
- ¿En nuestro medio, es necesario realizar el cribado universal de la ITBL a todos los niños y adolescentes?
- ¿Se debe realizar el cribado de la ITBL a los niños y adolescentes que pertenecen a grupos de riesgo?
- ¿Cuál es la prueba de cribado más adecuada para la detección de la ITBL en la infancia y adolescencia?
¿En nuestro medio, es necesario realizar el cribado de la ITBL a todos los niños y adolescentes?
El cribado universal en poblaciones de bajo riesgo de TB tiene un pobre rendimiento20, un alto número de falsos positivos21 y no es coste-efectivo9. En el balance beneficio-riesgo hay que tener en cuenta, además del coste económico, los efectos adversos del tratamiento (hepatotoxicidad de los fármacos y aumento de resistencias) y su larga duración.
Se definen como poblaciones de alto riesgo las que alcanzan o superan los 40 casos por cada 100 000 habitantes/año y de bajo riesgo las que tienen tasas inferiores a 10 casos/100 000, aunque en Europa se consideran de bajo riesgo las tasas por debajo de 20/100 000. El riesgo medio estaría entre 20 y 39/100 000 habitantes/año. Los datos actualizados para consultar las tasas de incidencia de TB de los distintos países, con especial atención a los 22 países con más alta carga, se pueden consultar en la dirección web de la OMS (www.who.int/tb/country/data/download/en) y en la del gobierno de Reino Unido (https://goo.gl/Mutqux).
En nuestro país, las tasas de incidencia de TB en menores de 15 años y en adultos están en rangos de bajo riesgo. En 2014, el número de casos en menores de 15 años fue de 299 (el 6% del total, tasa de 4,24 casos por 100 000 habitantes), prácticamente igual a la del año 2012. Dentro de los casos pediátricos, los menores de cinco años tienen una tasa de más del doble que la del grupo de 5 a 14 años (6,57 casos/100 000 y 3,13 casos/100 000 respectivamente)18,19, todas ellas inferiores a diez casos por 100 000 habitantes/año. Con estos datos, tendríamos que cribar a 11 494 niños para evitar una ITBA y a 1724 niños para diagnosticar una ITBL (calculado con una tasa estimada de progresión del 15%). Además, habría un elevado número de falsos positivos, dada la baja incidencia y que ninguna prueba tiene una especificidad del 100%, lo que significaría tratar a un gran número de personas de forma innecesaria con un tratamiento no exento de riesgos (hepatotoxicidad, aumento de resistencias) e inconvenientes (seis meses de tratamiento oral)8,15.
La GPC del SNS8 establece una recomendación fuerte en contra de realizar el cribado poblacional de la ITBL mediante la prueba de la tuberculina, dado el bajo riesgo de tuberculosis en nuestro medio. En el mismo sentido, la guía del Instituto para la Mejora de los Sistemas Clínicos (ICSI) de EE. UU., también realizada con metodología GRADE, indica que en poblaciones de riesgo medio y bajo no está indicado el cribado, con recomendación fuerte en contra22.
Hay evidencia de buena calidad para no recomendar el cribado de la ITBL en poblaciones de riesgo bajo o medio (< 40 casos por 100 000 habitantes/año).
¿Se debe realizar el cribado de la ITBL a los niños y adolescentes que pertenecen a grupos de riesgo?
En los países de baja incidencia de TB, como el nuestro, limitar el cribado de la ITBL a los grupos que tienen riesgo elevado de padecer una ITBA mejora el rendimiento de las pruebas diagnósticas y el balance beneficio-riesgo. La guía del SNS8, la guía NICE9, el Grupo de Patología Infecciosa de la AEPap14, el Plan para la prevención y control de la TB en España21, el ICSI22, la Academia Americana de Pediatría23, los Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU.24 y la OMS25 recomiendan hacer el cribado en grupos de riesgo.
¿Cuáles son los grupos de riesgo en nuestro medio?
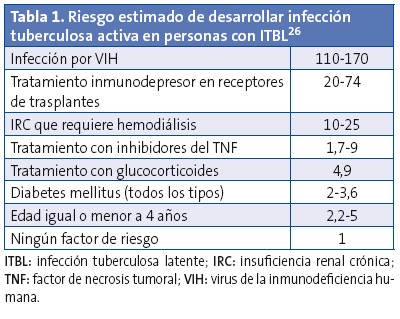
Se pueden englobar en tres apartados: los niños que proceden de zonas con tasa de incidencia alta, los que han estado en contacto con personas que tienen ITBA y los que están inmunodeprimidos9. El grado de riesgo de progresar a ITBA es distinto según el factor de riesgo (Tablas 1 y 2).
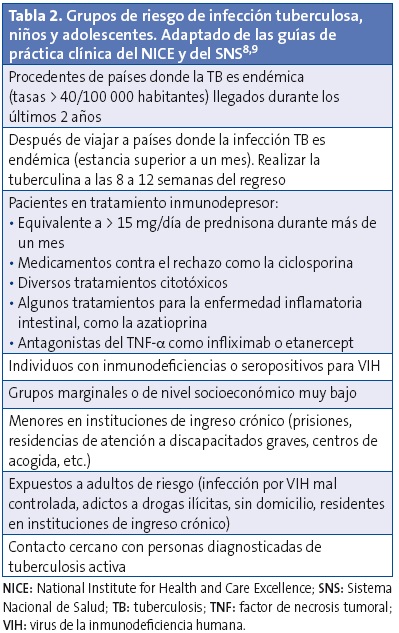
Los niños que han estado en contacto con personas con TB activa tienen un riesgo elevado de desarrollar ITBA, de presentar formas extrapulmonares y de progresar a formas invasivas, como la meningitis TB o la TB miliar, sobre todo si son menores de cinco años8,9,14,16. El contacto con un caso de TB activa es el factor de riesgo más importante para desarrollar una ITBA. Como hemos señalado en la introducción, en este documento no se aborda la actuación ante los contactos.
En Pediatría de Atención Primaria, el grupo de riesgo más frecuente es el de los niños procedentes de países con alta carga de TB. Según el Informe epidemiológico sobre la situación de la tuberculosis en España, con datos de 201418, el 29% de los casos declarados había nacido en un país distinto de España, porcentaje superior a la cifra de inmigrantes de ese mismo año, que era de alrededor del 11%. No hay datos pediátricos sobre el país de origen en este informe. Un estudio prospectivo transversal27 que incluyó 847 inmigrantes indocumentados de entre 12 y 18 años, procedentes de países con una incidencia de TB igual o superior a 50/100 000 habitantes y albergados en dos centros de acogida del País Vasco, encontró una prevalencia de ITBL, definida por una tuberculina > 10 mm, del 29%, con diferencias significativas entre la población subsahariana (67%) y la magrebí (21%). En la zona en la que se realizó este estudio la incidencia de TB es de 11/100 000 (año 2012) y los residentes extranjeros, que representan el 5% de la población, suponen el 33% de los casos de TB.
En EE. UU., un trabajo sobre la epidemiología de la TB en 364 niños menores de cinco años observó que las tasas fueron 32 veces más altas en los nacidos en el extranjero y seis veces más altas en los nacidos en EE. UU. de padres que habían nacido en el extranjero28. La mayoría (53%) de los casos de TB se dieron entre el 29% de niños nacidos en EE. UU. cuyos padres eran de origen extranjero. Dos tercios de los niños con TB sufrieron la exposición en EE. UU. Otro estudio de EE. UU. recoge 2660 niños y adolescentes menores de 18 años con TB, de los que el 31% habían nacido en otros países y el 66% tenía al menos uno de los padres nacidos en el extranjero; el 52% de los casos tenían una edad de 13 a 17 años5.
La inmunodepresión en la infancia puede ser debida a una inmunodeficiencia primaria o a una causa secundaria como el sida, la insuficiencia renal crónica, la diabetes mellitus o la administración de medicamentos tales como corticoides, inmunodepresores o inhibidores del factor de necrosis tumoral alfa (anti-TNF).
Dada la trascendencia de incluir o no a los niños con diabetes tipo 1 como grupo de riesgo, hemos revisado de manera específica el riesgo de desarrollar ITBA en pacientes diabéticos. Un estudio de baja calidad realizado en Sudáfrica, una zona de muy alta carga de TB, encontró una prevalencia 6,8 veces mayor en 258 niños de 0 a 14 años con diabetes tipo 129. Un estudio de cohortes realizado en China sobre 5195 pacientes con diabetes tipo 1, 2937 de ellos menores de 20 años, encontró un riesgo 3,59 veces mayor en este grupo en comparación con un grupo de características similares de 7726 niños y adolescentes menores de 20 años sin diabetes30. En una revisión sistemática de 13 estudios observacionales, el riesgo relativo de padecer TB en personas con diabetes, sin diferenciar por edades ni por tipo de diabetes, fue del 3,1131. Sin embargo, la OMS, en sus recientes Directrices sobre la atención de la infección tuberculosa latente25, elaboradas mediante revisiones sistemáticas de la literatura científica con metodología GRADE y dirigidas principalmente a países de medianos y altos ingresos con incidencia de TB menor de 100/100 000, no recomienda la realización de pruebas sistemáticas para diagnosticar la ITBL en pacientes diabéticos (recomendación condicional, datos científicos de muy poca calidad). El documento de la OMS señala la escasez de datos sobre los beneficios y los efectos nocivos del estudio y tratamiento sistemáticos de la ITBL en las personas con diabetes, y concluye que los beneficios no superan a los efectos nocivos a menos que estos pacientes encajen además en otros grupos de riesgo. En vista de estos datos, PrevInfad no recomienda el cribado sistemático de la ITBL en los niños y adolescentes con diabetes tipo 1.
Existen evidencias de buena calidad para recomendar el cribado de ITBL en los niños y adolescentes que pertenecen a grupos de riesgo.
¿Cuál es la prueba de cribado más adecuada para la detección de la ITBL en la infancia y adolescencia?
Actualmente disponemos de dos pruebas de cribado, la prueba de la tuberculina (PCT) y la determinación de la liberación de interferón gamma (IGRA). Esta última prueba detecta la producción de interferón gamma por linfocitos T sensibilizados frente a micobacterias. La principal diferencia entre la PCT y los IGRA es que la primera utiliza derivados proteicos purificados (PPD), una mezcla de antígenos comunes a distintas especies de micobacterias, incluyendo las de la vacuna BCG y las micobacterias no tuberculosas (MNT) más comunes, como el Mycobacterium avis, mientras que los IGRA utilizan antígenos más específicos de micobacterias tuberculosas (MT): early secretory antigenic target 6 (ESAT-6), culture filtrate protein 10 (CFP-10) y tuberculosis 7.7, que no están presentes en la BCG ni en la mayoría de las MNT, aunque sí en algunas como M. szulgai, M. marinum o M. kansasii. Actualmente hay dos pruebas IGRA disponibles para su uso: QuantiFERON®-TB Gold-IT y T-SPOT®.TB.
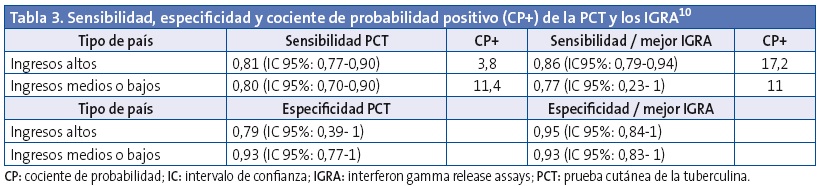
Para valorar qué prueba de cribado tiene mayor rendimiento y cuál es más precisa para el diagnóstico de la ITBL, sin discriminar entre los dos tipos de IGRA, analizamos a continuación los estudios existentes sobre la sensibilidad y la especificidad de la PCT y los IGRA, realizados en menores de 18 años de edad, y las recomendaciones de las GPC del SNS y del NICE. En las siguientes tablas se compara la tuberculina con el IGRA que tenga mejor rendimiento en el estudio (mejor IGRA).
La revisión sistemática y metaanálisis de Mandalakas10 incluyó 31 artículos y 4122 niños con una edad media de 7,6 años (rango de 1,9 a 14,6). La sensibilidad y especificidad de todas las pruebas fueron similares. El análisis estratificado sugirió una menor sensibilidad para todas las pruebas en niños menores de cinco años y en los infectados por VIH. Los autores sugieren que la PCT y los IGRA tienen una precisión similar para la detección de la infección tuberculosa (Tabla 3).
En la revisión sistemática de Pai32, aunque la población incluye adultos y niños, se recogen los subgrupos de vacunados y no vacunados con BCG. La especificidad de la prueba de la tuberculina es alta en poblaciones de no vacunados con BCG, pero baja y variable en las poblaciones vacunadas (Tabla 4). Como era de esperar, la especificidad de los IGRA no se ve afectada por la vacunación con BCG.

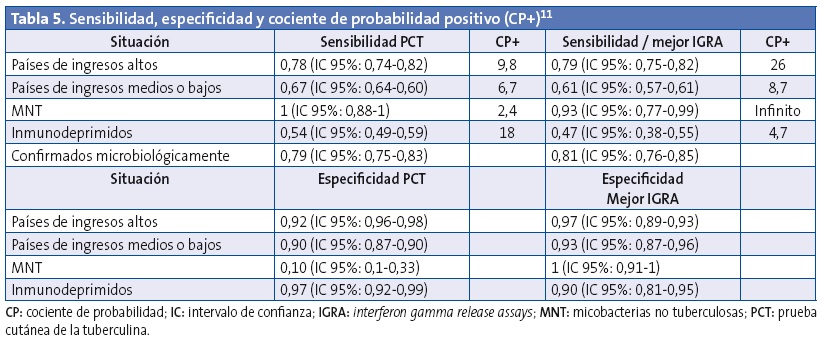
Sollai11 incluyó en su revisión sistemática y metaanálisis 31 estudios (6183 niños) para QuantiFERON®-TB Gold-IT, 14 estudios (2518 niños) para T-SPOT®.TB y 34 estudios (6439 niños) para la PCT. En la combinación de todos los resultados, ambos IGRA parecen ser una opción razonable para el diagnóstico de la tuberculosis en niños inmunocompetentes de más de cinco años en los países con ingresos altos. En los niños infectados por MNT, los IGRA tienen una especificad claramente mejor que la tuberculina. En los niños inmunodeprimidos, el rendimiento de los IGRA es peor que la prueba de la tuberculina. Desgraciadamente, los estudios en niños menores de cinco años no permitieron el metaanálisis, pero parece que los IGRA ofrecen resultados esperanzadores para mejorar la sensibilidad en combinación con la PCT (Tabla 5).
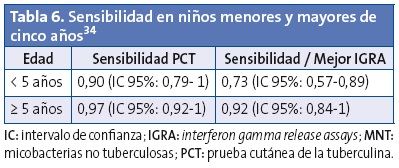
El uso de los IGRA en niños menores de cinco años es controvertido, pues se considera que tienen un menor rendimiento debido a la inmadurez del sistema inmunitario. Un estudio con 338 niños en riesgo de TB encontró un mejor rendimiento de la PCT en menores de cinco años (Tabla 6)33. Parece claro que por debajo de los dos años no deben de utilizarse, pero entre los dos y los cinco años hay estudios en los que se considera su uso cuando los niños están vacunados con BCG34,35.
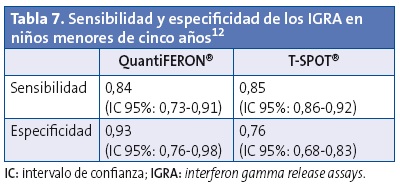
En el reciente metaanálisis de Ge12 se incluyeron 627 niños, con edades de entre 1 y 60 meses, con el objetivo de evaluar el rendimiento diagnóstico de los IGRA para la ITBL. La sensibilidad y especificidad de los IGRA fue ligeramente superior a la de la PCT. Los autores indican que los IGRA se pueden utilizar como herramienta de apoyo para detectar la infección latente en niños menores de cinco años, aunque, debido a las limitaciones de los estudios incluidos y al pequeño número de participantes, se necesitan estudios adicionales para definir mejor su utilidad en el diagnóstico de la ITBL en este rango etario (Tabla 7).
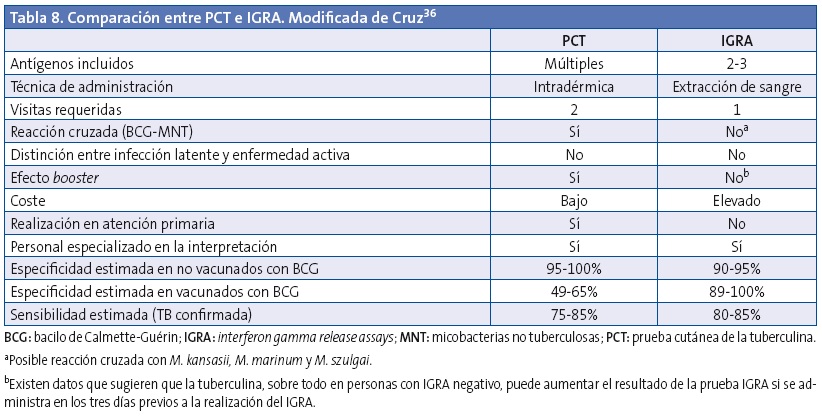
En la Tabla 8, basada en la revisión de Cruz36 y ampliada con datos de otros trabajos6,11,15,32, vemos reflejadas las características de estas dos herramientas.
Existen evidencias de moderada y de baja calidad para recomendar la realización del cribado de la ITBL con la prueba cutánea de la tuberculina en nuestro medio.
Existen evidencias de moderada y de baja calidad de que los IGRA tienen una mejor especificidad que la tuberculina para el cribado de la ITBL en niños con edad igual o mayor de cinco años y vacunados con BCG.
Evaluación del coste-efectividad
En la actualización de la guía NICE sobre TB de 20169 se sugiere que hay una considerable incertidumbre respecto al coste-efectividad de las diferentes pruebas diagnósticas para la detección de la infección latente en los niños, ya que la evidencia clínica en la que se basa el análisis tiene altos niveles de heterogeneidad y un infrarregistro de variables potencialmente influyentes, como el estado de vacunación con BCG. No obstante, realizan simulaciones según la sensibilidad y especificidad de las distintas pruebas en niños y los resultados muestran que la PCT ≥ 5 mm es marginalmente más efectiva que el QuantiFERON®-TB Gold-IT. La estrategia más efectiva es la PCT negativa (< 5 mm) seguida de QuantiFERON®-TB Gold-IT, con una probabilidad del 32% de ser coste-efectiva para un valor de 20 000 libras esterlinas por año de vida ajustado por calidad (AVAC). Si solo se tiene en cuenta el coste por AVAC, la PCT (≥ 5 mm) es la que tiene un menor coste.
En inmigrantes recién llegados de países de alta prevalencia, sin discriminar entre niños y adultos, las simulaciones que realizan en la guía NICE muestran que la PCT ≥ 5 mm es mejor que la PCT ≥ 5 mm seguida de IGRA, y tiene una probabilidad del 47% de ser la opción óptima para un valor de 20 000 libras esterlinas por AVAC.
En un estudio realizado en adultos en Brasil, la PCT fue la estrategia más coste-efectiva para evitar nuevos casos de tuberculosis a corto plazo37.
Los modelos de evaluación económica que se pueden aplicar no son precisos para pruebas diagnósticas y no tienen un patrón oro para el diagnóstico de ITBL, por lo que no es posible obtener conclusiones firmes.
RESUMEN DE LA EVIDENCIA
Hay pruebas de que el cribado universal de la ITBL en zonas de baja incidencia tiene un rendimiento pobre, un número elevado de falsos positivos y no es coste-efectivo.
Hay evidencias de que el cribado de la ITBL en los grupos que tienen riesgo elevado de desarrollar una ITBA mejora el rendimiento de las pruebas diagnósticas, el balance beneficio-riesgo y debe de formar parte de las estrategias para disminuir el impacto de la tuberculosis.
Sobre el dilema de cuál de las tres estrategias (tuberculina sola, IGRA solo o tuberculina seguida de IGRA) para el diagnóstico de la ITBL es la que ofrece mejor rendimiento, existe variabilidad tanto en las recomendaciones de las GPC e instituciones como en las conclusiones de los estudios sobre el tema, aunque la mayoría de las recomendaciones van en el mismo sentido que las que proponemos en este documento.
Los estudios primarios, revisiones sistemáticas y metaanálisis analizados tienen importantes limitaciones metodológicas. La mayoría de estudios son heterogéneos, con diversidad de situaciones epidemiológicas, tasas de incidencia, vacunación, edad, estado nutricional, número de pacientes estudiado…, lo que limita la comparabilidad de los estudios y la interpretación de los resultados. No hay un patrón oro para el diagnóstico de la ITBL y se usan criterios variables: carga de la enfermedad en la zona, porcentajes de riesgo por edad y tipo de contacto, distintos puntos de corte del diámetro de la tuberculina. En muchas ocasiones, para calcular la sensibilidad y la especificidad de las pruebas se usa la enfermedad activa como patrón oro, pero como en los niños la confirmación microbiológica es difícil, el diagnóstico se tiene que hacer también en base a criterios clínicos, con lo que tampoco es un buen patrón. En los metaanálisis se hacen análisis por subgrupos que ayudan a aclarar el panorama, pero disminuyen la calidad al bajar el número de niños incluidos. Todas estas limitaciones hacen que los estudios disponibles sean de calidad baja o moderada.
Los IGRA se desarrollaron para mejorar la sensibilidad y, sobre todo, la especificidad de la prueba de la tuberculina, pero las evidencias en niños no son claras al respecto. Los criterios de aplicación de una u otra estrategia se basan, además de en las pruebas científicas, en criterios clínicos y epidemiológicos.
Hay pruebas de que los IGRA se comportan mejor en las personas vacunadas con BCG y en individuos infectados con MNT, pero no hay evidencias de que tengan mejores resultados que la PCT en los niños con mayor riesgo de infección tuberculosa, los menores de cinco años o los inmunodeprimidos. En un estudio sobre el diagnóstico de la ITBL en inmigrantes, los IGRA mostraron un buen rendimiento, bien como prueba de entrada o como segunda prueba tras la tuberculina, mejoraron la especificidad y disminuyeron el número de falsos positivos posiblemente debidos a la vacunación con BCG, siendo coste-efectivos al disminuir el número de tratamientos y pruebas innecesarias35. No obstante, son necesarios nuevos estudios que amplíen el seguimiento de los niños durante más tiempo para comprobar la sensibilidad de la prueba.
La estrategia secuencial de hacer primero la PCT y, teniendo en cuenta las condiciones epidemiológicas, después realizar un IGRA, es la opción más razonable en algunas circunstancias, como en los niños procedentes de países con alta carga de TB, en los niños inmunodeprimidos o en los menores de cinco años de edad. En niños procedentes de países con alta carga de TB, que presumiblemente estarán vacunados con BCG, interesa evitar falsos positivos, por lo que la estrategia secuencial de hacer primero la PCT y, si es positiva, realizar un IGRA, es la más adecuada. En los niños inmunodeprimidos y en los menores de cinco años existe mayor riesgo de desarrollar enfermedad tuberculosa activa, por lo que interesa mejorar la sensibilidad y evitar falsos negativos; en estos casos, la estrategia secuencial de hacer primero la tuberculina y, si es negativa, realizar un IGRA, parece la más razonable.
RECOMENDACIONES DE OTROS GRUPOS
Como hemos dicho en la introducción, los grupos referentes en actividades preventivas a nivel internacional como el USPSTF1, el CTFPHC2 o el UK National Screening Committee3, no incluyen entre sus recomendaciones el cribado de la TB en la infancia y adolescencia y derivan el tema a otras instituciones dedicadas al control de enfermedades infecciosas.
En la Tabla 9 se reflejan los datos de una revisión sistemática13 de las guías publicadas a nivel internacional sobre tuberculosis en la infancia, desde el año 2000 hasta agosto de 2013, que incluye 27 guías que cumplían criterios de calidad, cuatro de ellas españolas, completados con las recomendaciones de la GPC del SNS y actualizados en lo que se refiere a la guía NICE.
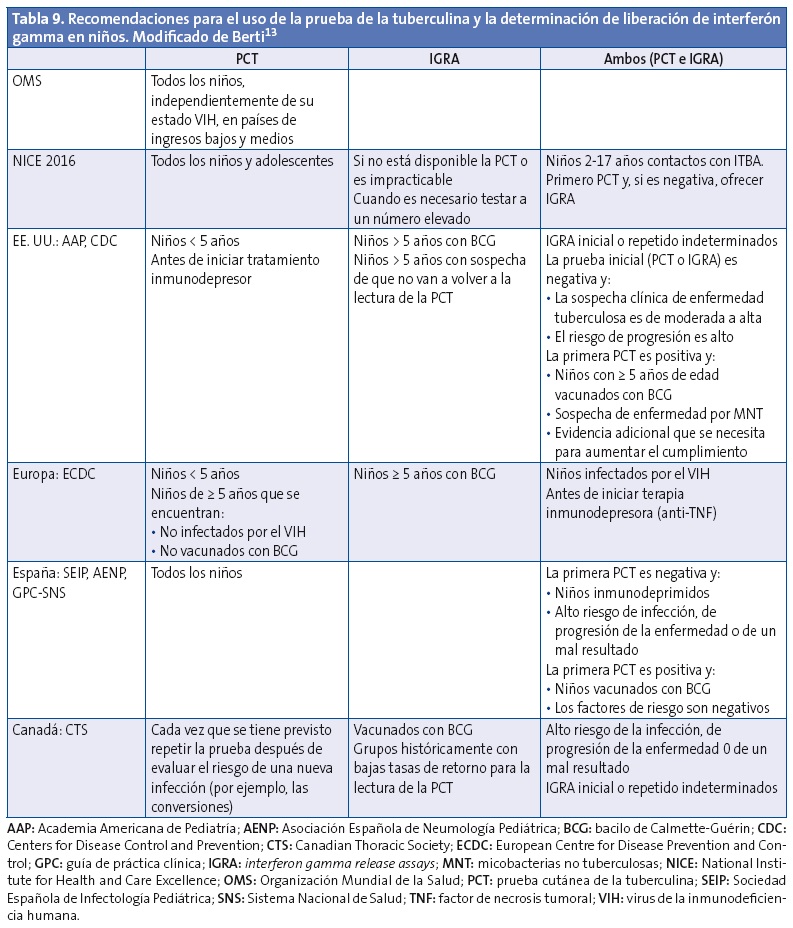
Los principales puntos de desacuerdo son la interpretación del resultado de la PCT y las recomendaciones sobre el uso de tuberculina y/o los IGRA para el diagnóstico de la infección tuberculosa.
RECOMENDACIONES DE PREVINFAD (GRADE)
- Se recomienda no realizar el cribado universal de la infección tuberculosa latente en los niños y adolescentes de nuestro país.
- Se recomienda realizar el cribado de la infección tuberculosa latente en los niños y adolescentes que pertenecen a grupos de riesgo.
- Se sugiere el uso de la tuberculina como primera prueba para el cribado de la infección tuberculosa latente en niños y adolescentes de nuestro país (Tabla 10)38.
- Se sugiere utilizar los IGRA para los niños y adolescentes de cinco o más años con PCT positiva y antecedente de vacunación con BCG, para mejorar la especificidad de la prueba de cribado.

CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: AAP: Academia Americana de Pediatría · AEPap: Asociación Española de Pediatría de Atención Primaria • AENP: Asociación Española de Neumología Pediátrica • BCG: bacilo de Calmette-Guérin • CDC: Centers for Disease Control and Prevention • CTFPHC: Canadian Task Force on Preventive Health Care • CTS: Canadian Thoracic Society • ECDC: European Centre for Disease Prevention and Control • GRADE: Grading of Recommendations Assessment, Development and Evaluation • GPC: guía de práctica clínica • IGRA: interferon gamma release assays • ISCI: Institute for Clinical Systems Improvement • ITBA: infección tuberculosa activa • ITBL: infección tuberculosa latente • MNT: micobacterias no tuberculosas • NICE: National Institute for Health and Care Excellence • OMS: Organización Mundial de la Salud • PCT: prueba cutánea de la tuberculina • PPD: derivados proteicos purificados • SEIP: Sociedad Española de Infectología Pediátrica • SNS: Sistema Nacional de Salud • TB: tuberculosis • TNF: factor de necrosis tumoral • USPSTF: US Preventive Services Task Force • VIH: virus de la inmunodeficiencia humana.
BIBLIOGRAFÍA
- US Preventive Services Task Force [en línea] [consultado el 16/03/2016]. Disponible en uspreventiveservicestaskforce.org
- Canadian Task Force on Preventive Health Care [en línea] [consultado el 16/03/2016]. Disponible en http://canadiantaskforce.ca
- UK National Screening Committee [en línea] [consultado el 16/03/2016]. Disponible en gov.uk/government/groups/uk-national-screening-committee-uk-nsc
- Draft Update Summary. Tuberculosis infection: screening. US Preventive Services Task Force [en línea] [consultado el 16/03/2016]. Disponible en uspreventiveservicestaskforce.org
- Winston CA, Menzies HJ. Pediatric and adolescent tuberculosis in the United States, 2008-2010. 2012;130:e1425-32.
- Perez-Velez CM, Marais BJ. Tuberculosis in children. N Engl J Med. 2012;367:348-61.
- GRADE working group [en línea] [consultado el 16/03/2016]. Disponible en gradeworkinggroup.org/_es/index.htm
- Grupo de trabajo de la Guía de Práctica Clínica sobre el Diagnóstico, el Tratamiento y la Prevención de la Tuberculosis, Centro Cochrane Iberoamericano (coords.). Guía de práctica clínica sobre el diagnóstico, el tratamiento y la prevención de la tuberculosis. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Agència d ́Informació, Avaluació i Qualitat en Salut (AIAQS) de Cataluña; 2009. Guías de Práctica Clínica en el SNS: AATRM No 2007/26.
- NICE guidelines [NG33]. Tuberculosis [en línea] [consultado el 16/03/2016]. Disponible en nice.org.uk/guidance/ng33
- Mandalakas AM, Detjen AK, Hesseling AC, Benedetti A, Menzies D. Interferon-gamma release assays and childhood tuberculosis: systematic review and meta-analysis. Int J Tuberc Lung Dis. 2011;15:1018-32.
- Sollai S, Galli L, de Martino M, Chiappini E. Systematic review and meta-analysis on the utility of Interferon-gamma release assays for the diagnosis of Mycobacterium tuberculosis infection in children: a 2013 update. BMC Infect Dis. 2014;14:S6.
- Ge L, Ma JC, Han M, Li JL, Tian JH. Interferon-γ release assay for the diagnosis of latent Mycobacterium tuberculosis infection in children younger than 5 years: a meta-analysis. Clin Pediatr (Phila). 2014;53:1255-63.
- Berti E, Galli L, Venturini E, de Martini M, Chiappini E. Tuberculosis in childhood: a systematic review of national and international guidelines. BMC Infect Dis. 2014;14:S3.
- Rodríguez Vega HD, Alfayate Miguélez S, Grupo de Patología Infecciosa de la AEPap. Diagnóstico de la tuberculosis en Pediatría. En: Asociación Española de Pediatría de Atención Primaria [en línea] [consultado el 16/03/2016]. Disponible en http://goo.gl/QSEY5R
- Starke JR, Committee On Infectious Diseases. Interferon-γ release assays for diagnosis of tuberculosis infection and disease in children. 2014;134:e1763-73.
- Global tuberculosis report 2015. En: Organización Mundial de la Salud [en línea] [consultado el 16/03/2016]. Disponible en who.int/tb/publications/global_report/en/
- European Centre for Disease Prevention and Control, WHO Regional Office for Europe. Tuberculosis surveillance and monitoring in Europe 2015. En: ean Centre for Disease Prevention and Control [consultado el 16/03/2016]. Disponible en http://goo.gl/Yn3ngq
- Centro Nacional de Epidemiología, Instituto de Salud Carlos III. Informe epidemiológico sobre la situación de la tuberculosis en España. Año 2014. En: Instituto de Salud Carlos III [en línea] [consultado el 16/03/2016]. Disponible en http://goo.gl/4aB2wv
- Rodríguez E, Villarrubia S, Díaz O. Tuberculosis en España en el año 2013. Situación epidemiológica. Bol Epidemiol Semanal. 2014;22:201-9.
- Moreno-Pérez D, Andrés Martín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez-Pastrana Durán D, et al. Diagnóstico de la tuberculosis en la edad pediátrica. Documento de consenso de la Sociedad Española de Infectología Pediátrica (SEIP) y la Sociedad Española de Neumología Pediátrica (SENP). An Pediatr (Barc). 2010;73:143.e1-143.14.
- Grupo de Trabajo de expertos en tuberculosis y Grupo de trabajo de Salud Pública para la prevención y control de la tuberculosis. Plan para la prevención y control de la tuberculosis en España. En: Ministerio de Sanidad y Consumo [en línea] [consultado el 16/03/2016]. Disponible en http://goo.gl/XVbNUh
- Wilkinson J, Bass C, Diem S, Gravley A, Harvey L, Maciosek M, et al. Preventive services for children and adolescents. En: Institute for Clinical Systems Improvement [en línea] [consultado el 16/03/2016]. Disponible en icsi.org/_asset/x1mnv1/PrevServKids.pdf
- Bright futures guidelines for health supervision of infants, children, and adolescents, Rationale and Evidence. En: Bright Futures [en línea] [consultado el 16/03/2016]. Disponible en https://goo.gl/IofIv7
- Infección de tuberculosis latente. En: CDC [en línea] [consultado el 16/03/2016]. Disponible en cdc.gov/tb/esp/publications/faqs/ltbi.htm
- Guidelines on the management of latent tuberculosis infection. En: Organización Mundial de la Salud [en línea] [consultado el 16/03/2016]. Disponible en who.int/tb/publications/ltbi_document_page/en/
- Pai M, Menzies D. Interferon-gamma release assays for diagnosis of latent tuberculosis infection. En: UpToDate [en línea] [consultado el 16/03/2016]. Disponible en uptodate.com/contents/interferon-gamma-release-assays-for-diagnosis-of-latent-tuberculosis-infection
- Salinas C, Ballaz A, Díez R, Aguirre U, Antón A, Altube L. Cribado de la tuberculosis en inmigrantes adolescentes indocumentados usando el QuantiFERON®-TB Gold In-Tube. Med Clin (Barc). 2015;145:7-13.
- Pang J, Teeter LD, Katz DJ, Davidow AL, Miranda W, Wall K, et al. Epidemiology of tuberculosis in young children in the United States. 2014;133:e494-504.
- Webb EA, Hesseling AC, Schaaf HS, Gie RP, Lombard CJ, Spitaels A, et al. High prevalence of Mycobacterium tuberculosis infection and disease in children and adolescents with type 1 diabetes mellitus. Int J Tuberc Lung Dis. 2009;13:868-74.
- Shen TC, Lin CL, Wei CC, Liao WC, Chen WC, Chen CH, et al. Increased risk of tuberculosis in patients with type 1 diabetes mellitus: results from a population-based cohort study in Taiwan. Medicine (Baltimore). 2014;93(16):e96.
- Jeon CY, Murray MB. Diabetes mellitus increases the risk of active tuberculosis: a systematic review of 13 observational studies. PLoS Med. 2008;5:e152.
- Pai M, Zwerling A, Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med. 2008;149:177-84.
- Chiappini E, Bonsignori F, Mazzantini R, Sollai S, Venturini E, Mangone G, et al. Interferon-gamma release assay sensitivity in children younger than 5 years is insufficient to replace the use of tuberculin skin test in western countries. Pediatr Infect Dis J. 2014;33:1291-3.
- Critselis E, Amanatidou V, Syridou G, Spyridis NP, Mavrikou M, Papadopoulos NG, et al. The effect of age on whole blood interferon-gamma release assay response among children investigated for latent tuberculosis infection. J Pediatr. 2012;161:632-8.
- Howley MM, Painter JA, Katz DJ, Graviss EA, Reves R, Beavers SF, et al. Evaluation of QuantiFERON-TB gold in-tube and tuberculin skin tests among immigrant children being screened for latent tuberculosis infection. Pediatr Infect Dis J. 2015;34:35-9.
- Cruz AT, Starke JR, Lobato MN. Old and new approaches to diagnosing and treating latent tuberculosis in children in low-incidence countries. Curr Opin Pediatr. 2014;26:106-3.
- Steffen RE, Caetano R, Pinto M, Chaves D, Ferrari R, Bastos M, et al. Cost-effectiveness of Quantiferon®-TB Gold-in-Tube versus tuberculin skin testing for contact screening and treatment of latent tuberculosis infection in Brazil. PloS One. 2013;8:e59546.
- Moreno-Pérez D, Andrés Marín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez-Pastrana Durán A, et al. Diagnóstico de la tuberculosis en la edad pediátrica. An Pediatr (Barc). 2010;72:283.e1-283.e14.





