Vol. 17 - Num. 65
Colaboraciones especiales
Prevención de la muerte súbita cardiaca en Pediatría: el papel esencial del pediatra de Atención Primaria
Francisco Javier Pérez-Lescure Picarzoa
aUnidad de Cardiología Infantil. Servicio de Pediatría. Hospital Universitario Fundación Alcorcón. Alcorcón. Madrid. España.
Correspondencia: J Pérez-Lescure. Correo electrónico: jplescure@fhalcorcon.es
Cómo citar este artículo: Pérez-Lescure Picarzo J. Prevención de la muerte súbita cardiaca en Pediatría: el papel esencial del pediatra de Atención Primaria. Rev Pediatr Aten Primaria. 2015;17:77-86.
Publicado en Internet: 17-03-2015 - Número de visitas: 53179
Resumen
La muerte súbita se define como la muerte abrupta e inesperada en ausencia de anomalías cardiovasculares conocidas. La probabilidad de un paciente joven de sobrevivir tras una parada cardiaca fuera del hospital es < 20%, por lo que la identificación de pacientes en riesgo es esencial. El 90% de las muertes súbitas son de origen cardiovascular, por lo que teóricamente sería posible identificar los pacientes en riesgo antes del evento y prevenirlo. Aunque la muerte súbita puede ser la primera manifestación de la enfermedad, los pacientes con enfermedad cardiaca estructural-funcional o eléctrica primaria tienen con frecuencia síntomas previos como mareo, dolor de pecho, síncope, palpitaciones, disnea o antecedentes familiares de muerte súbita. A veces, estas señales de advertencia pueden ser malinterpretadas o ignoradas tanto por los pacientes y los padres como por el personal médico. Las estrategias para la prevención pasan por reconocer las enfermedades que pueden acabar en una muerte súbita mediante los procedimientos de cribado y mantener un índice de sospecha adecuado cuando se atienden los niños en la consulta.
Palabras clave
● Arritmias ● Canalopatías ● Miocardiopatía ● Muerte súbita ● Pediatra de Atención Primaria ● PrevenciónINTRODUCCIÓN
La muerte súbita se define como la muerte abrupta e inesperada en ausencia de anomalías cardiovasculares conocidas.
La probabilidad de un paciente joven de sobrevivir tras una parada cardiaca fuera del hospital es menor del 20%1. Aunque la disponibilidad de desfibriladores externos automáticos combinado con maniobras de reanimación cardiopulmonar de forma inmediata puede mejorar la supervivencia sustancialmente, la identificación de pacientes en riesgo es, nunca mejor dicho, de importancia vital.
INCIDENCIA Y ETIOLOGÍA
Excluyendo el síndrome de muerte súbita del lactante (SMSL), que tiene una incidencia aproximada del 1-1,5/1000 lactantes, la muerte súbita (MS) es un evento poco frecuente en la edad pediátrica. La incidencia de MS en niños y adolescentes oscila entre 0,8 y 6,2/100 000 personas/año2. El 90% de las muertes súbitas son de origen cardiovascular3.
Como la mayoría de las muertes súbitas tienen una causa cardiovascular, es teóricamente posible identificar los pacientes en riesgo antes del evento y prevenirlo.
Aunque la muerte súbita cardiaca (MSC) puede acaecer a cualquier edad y estando en reposo, el 25% acaecen durante la práctica deportiva4. Las causas que predisponen a MSC en la edad pediátrica y adolescencia se muestran en la Tabla 15.
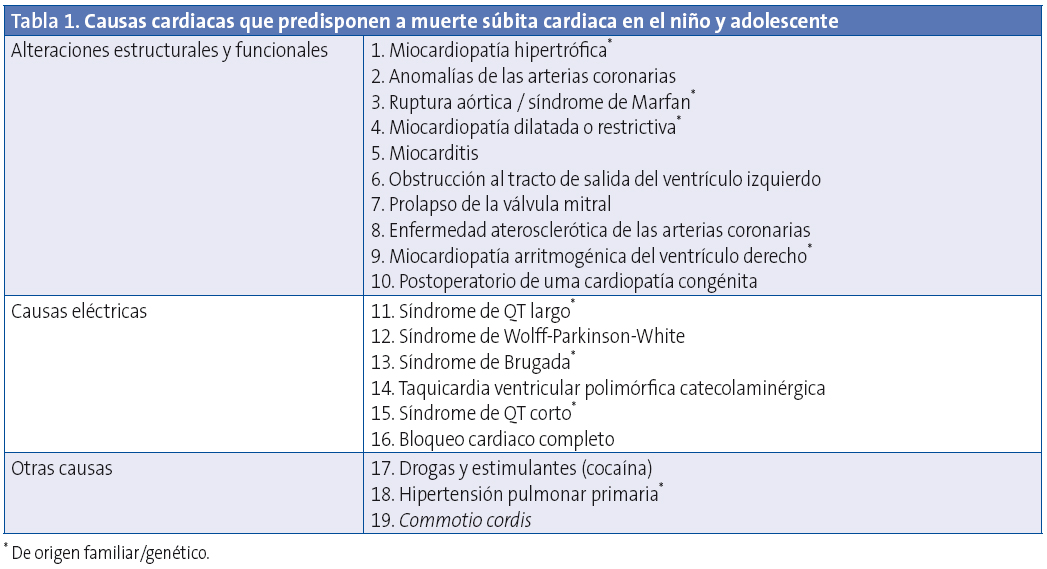
Aunque la frecuencia de las distintas causas de MSC en la edad pediátrica y adolescencia varía según los distintos autores, entre las más frecuentes se encuentran la miocardiopatía hipertrófica (25%), la miocardiopatía arritmogénica del ventrículo derecho (20%), anomalías coronarias (12%), síndrome de QT largo (20%) y miocarditis 12%6.
CAUSAS CARDIACAS QUE PREDISPONEN A MUERTE SÚBITA EN EL NIÑO Y ADOLESCENTE
Alteraciones estructurales y funcionales
Miocardiopatía hipertrófica. La miocardiopatía hipertrófica (MCH) es la causa más frecuente de MSC en menores de 30 años7, estimándose la prevalencia hasta el 1 por 500 en los adultos jóvenes. La MCH es a menudo clínicamente silente, pero el electrocardiograma (ECG) puede mostrar hipertrofia ventricular izquierda o anomalías de la onda T. La MSC suele estar desencadenada por el esfuerzo y habitualmente secundaria a arritmias ventriculares malignas. La MCH es un trastorno congénito autosómico dominante caracterizado por hipertrofia septal asimétrica y una alteración de las fibras musculares ventriculares, que contribuyen al riesgo de arritmias incluso en pacientes con hipertrofia mínima y sin obstrucción evidente al tracto de salida del ventrículo izquierdo.
Anomalías de las arterias coronarias. En los EE. UU. las anomalías de las arterias coronarias son la segunda causa más frecuente de MSC en los jóvenes. La anomalía más común asociado con la MSC es el origen de la coronaria izquierda en el seno de Valsalva derecho, pasando su trayecto entre la aorta y la arteria pulmonar8. Se ha propuesto que, durante el esfuerzo, el aumento de tamaño de los grandes vasos comprimiría la arteria coronaria izquierda ocasionando la isquemia.
Ruptura aórtica y síndrome de Marfan. El 25% de pacientes presentan afectación cardiovascular durante la edad pediátrica, incluyendo dilatación de la raíz aórtica con riesgo de disección aórtica, poco frecuente en la infancia pero de importancia en la adolescencia. Otras alteraciones son el prolapso valvular mitral y las arritmias.
Miocardiopatía dilatada o restrictiva. La miocardiopatía dilatada se caracteriza por dilatación ventricular y disminución de la función sistólica. Hay formas adquiridas secundarias a isquemia, miocarditis o tóxicos y formas hereditarias, por lo general como un rasgo autosómico dominante con penetrancia variable. Los síntomas de presentación más frecuentes son disnea e intolerancia al ejercicio secundarios a disminución del gasto cardiaco y/o hipertensión venosa pulmonar con edema pulmonar. Los pacientes pueden presentar un soplo de insuficiencia mitral y/o ritmo de galope a la exploración.
Miocarditis. La miocarditis se ha encontrado con frecuencia en la necropsia de los pacientes con muerte súbita de causa desconocida. Puede no haber síntomas previos o aparecer síntomas de insuficiencia cardiaca o hallazgos sutiles, como una frecuencia cardiaca elevada. También puede aparecer bloqueo auriculoventricular (AV) o arritmias ventriculares.
Obstrucción del tracto de salida del ventrículo izquierdo. La estenosis aórtica valvular está relacionada clásicamente con la MSC en los niños. Una historia previa de síncope, dolor torácico o hipertrofia ventricular izquierda con signos de obstrucción severa son factores de riesgo para la misma.
Prolapso de la válvula mitral. El prolapso severo de la válvula mitral se asocia con arritmias y fibrilación auricular que pueden evolucionar hasta producir paro cardiaco y MSC. No está claramente definida la relación causa-efecto entre el prolapso mitral y las arritmias, por lo que también se postula que la MSC sea secundaria a la insuficiencia mitral grave o a la insuficiencia cardiaca congestiva que estos pacientes pueden terminar desarrollando.
Enfermedad aterosclerótica de las arterias coronarias. En raras ocasiones puede aparecer enfermedad arterial coronaria adquirida precoz en menores de 30 años. La predisposición familiar, junto con otros factores de riesgo, puede conducir a episodios coronarios por aterosclerosis.
Miocardiopatía arritmogénica del ventrículo derecho. La displasia o miocardiopatía arritmogénica del ventrículo derecho (DAVD/MAVD) es la causa más frecuente de MSC en deportistas jóvenes en Italia9. La presentación clínica se produce normalmente en la adolescencia temprana y la edad adulta. Es una miocardiopatía hereditaria y progresiva que se caracteriza por el reemplazo graso y fibroso del miocardio, causando adelgazamiento de la pared libre del ventrículo derecho e inestabilidad eléctrica. Pueden aparecer arritmias ventriculares que a menudo son provocados por el ejercicio. El ECG en reposo puede mostrar extrasistolia ventricular con morfología de bloqueo de rama izquierda y eje superior, inversión de la onda T en las derivaciones derechas (V1, V2 y V3), onda épsilon siguiendo los QRS en la derivación V1 y QRS ancho en las derivaciones V1-V3. Las pruebas genéticas pueden ayudar en el diagnóstico, en casos con antecedentes familiares.
Postoperatorio cardiopatía congénita. La incidencia de muerte súbita en pacientes con cardiopatía congénita es de 100/100 000 pacientes/año10. Es más alta en cardiopatías cianógenas y lesiones obstructivas del corazón izquierdo y puede ser debida a arritmias, embolias o alteraciones circulatorias. El riesgo de MSC parece aumentar con la edad y el tiempo desde la cirugía. Algunos defectos congénitos tienen un riesgo más alto de arritmias adquiridas después de la reparación. En concreto, la tetralogía de Fallot se asocia con mayor incidencia de taquicardia ventricular.
Causas eléctricas
Síndrome de QT largo. La forma congénita del síndrome de QT largo (SQTL) es una enfermedad genética familiar que se produce en 1 de cada 2500-3500 personas. Se manifiesta por alteraciones de la repolarización ventricular secundarias a mutaciones de los canales iónicos cardiacos. En los pacientes sintomáticos, el síntoma de presentación suele ser el síncope secundario a taquicardia ventricular tipo torsades de pointes. El síncope puede ocurrir con desencadenantes específicos, como el estrés, la natación y los estímulos auditivos fuertes, o puede ocurrir cuando el niño esta bradicárdico durante el reposo o el sueño. En la mayoría de los casos, el intervalo QT corregido en el ECG está prolongado, pero hay una considerable superposición con la distribución normal de los intervalos QT en la población sana. En general se considera normal el intervalo QTc ≤ 0,45 s.
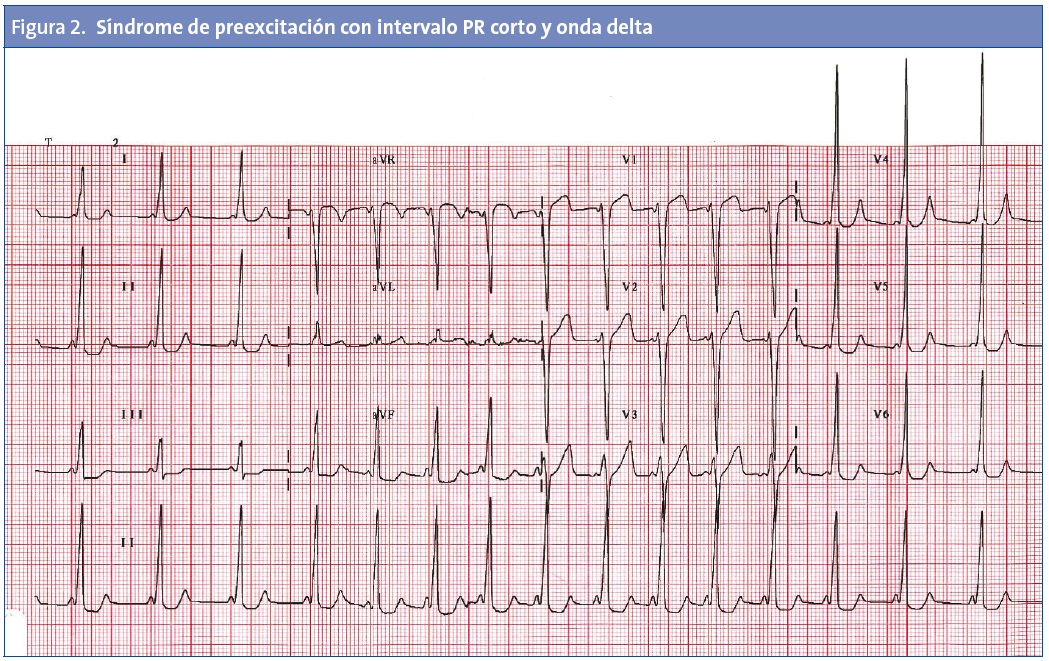
Síndrome de Wolff-Parkinson-White (WPW). Además de causar taquicardia supraventricular paroxística (TSVP), el síndrome de WPW puede dar lugar a fibrilación auricular con conducción rápida a través de la vía accesoria, que conduce a la fibrilación ventricular y muerte súbita. Este cuadro es inusual en pacientes pediátricos, pero su incidencia aumenta en la adolescencia. En los adultos, existe una incidencia de muerte súbita en pacientes asintomáticos de 1 por 1000 pacientes/año, pero esta tasa también puede ser mayor en los niños, que, por definición, no habrían sobrevivido hasta la edad adulta.
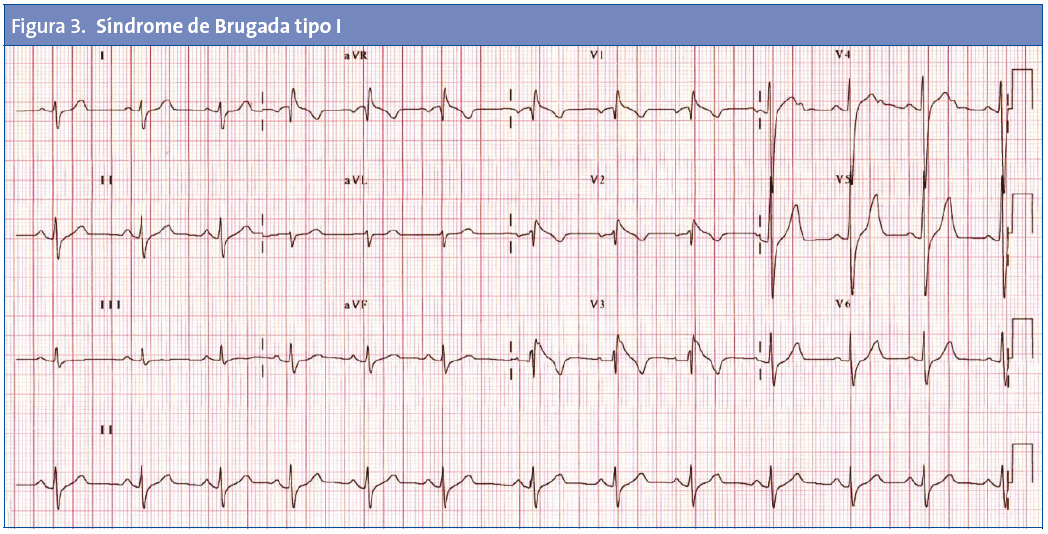
Síndrome de Brugada. Es un síndrome arritmogénico hereditario caracterizado por alteraciones del ECG y arritmias ventriculares potencialmente mortales. Los hallazgos electrocardiográficos son característicos. Se han descubierto varias mutaciones genéticas, siendo el defecto SCN5A el más frecuente.
Taquicardia ventricular polimórfica catecolaminérgica (TVPC). Se caracteriza por extrasistolia ventricular inducida por el ejercicio o el estrés emocional. Se trata de un canalopatía de base genética. El inicio de los síntomas ocurre típicamente en la niñez y la adolescencia. La ergometría es importante para el diagnóstico, ya que la TVPC no se puede diagnosticar en el ECG basal. Durante la prueba de esfuerzo, la extrasistolia aumenta con mayores niveles de actividad y puede aparecer taquicardia ventricular “bidireccional”.
Síndrome de QT corto. El conocimiento de este síndrome es reciente11 y se ha relacionado con MSC a edades tempranas.
Bloqueo auriculoventricular completo. El bloqueo AV completo congénito suele ser el resultado de un proceso autoinmune con destrucción del sistema de conducción en el nódulo AV. Ningún impulso auricular se conduce a los ventrículos, siendo la actividad auricular y ventricular independientes. En el ECG, las ondas P están disociadas de los complejos QRS. A pesar de que los ritmos auricular y ventricular están disociados, ambos son regulares, manteniendo intervalos PP y RR regulares. La duración del complejo QRS es normal si el bloqueo es proximal al haz de His, mientras que la existencia de un complejo QRS ancho indica que el bloqueo es más distal. Si existe un ritmo de escape de la unión o ventricular con frecuencia adecuada, los pacientes pueden permanecer asintomáticos, aunque con bradicardia en reposo y con frecuencia cardiaca limitada al ejercicio. Los pacientes pueden presentarse con fatiga, intolerancia al ejercicio, síncope, presíncope o convulsiones. El hallazgo clínico de bradicardia en un deportista joven puede traducir una disfunción sinusal, un bloqueo AV completo o una bradicardia sinusal fisiológica en un paciente entrenado, siendo necesario realizar un ECG para su distinción.
Otras causas
Drogas y estimulantes (cocaína), hipertensión pulmonar primaria y Commotio cordis.
Commotio cordis. Este término define la MSC debido a un impacto leve en la pared anterior del tórax en personas con un corazón normal. Requiere un golpe directo sobre el corazón, justo antes del pico de la onda T en la fase vulnerable de repolarización, que desencadenaría una arritmia y por lo general fibrilación ventricular. Es una causa muy poco frecuente de MSC en los jóvenes, aunque su frecuencia puede ser subestimada12. Las víctimas suelen ser varones menos de 18 años de edad.
SIGNOS Y SÍNTOMAS DE ALARMA
Aunque la MSC puede ser la primera manifestación de la enfermedad, los pacientes con enfermedad cardiaca estructural-funcional o eléctrica primaria tienen con frecuencia síntomas previos como mareo, dolor de pecho, síncope, palpitaciones, disnea o antecedentes familiares de muerte súbita13. A veces, estas señales de advertencia pueden ser malinterpretadas o ignoradas tanto por los pacientes y los padres como por el personal médico.
En la mayoría de los casos, la causa inmediata de la MSC es una taquiarritmia ventricular letal (fibrilación ventricular o taquicardia ventricular sin pulso) con parada cardiaca. Algunas de estas arritmias pueden ser autolimitadas, causando episodios de síncope/presíncope o convulsiones14. Estos pacientes son remitidos con frecuencia a Neurología, lo que condiciona un retraso en el diagnóstico y tratamiento correctos.
El dolor torácico rara vez está presente en pacientes con trastornos eléctricos primarios, pero es más probable en pacientes con miocardiopatías, anomalías congénitas de las arterias coronarias o enfermedad de la aorta (por ejemplo, la disección o ruptura asociada con el síndrome de Marfan).
En ocasiones la disminución de la distensibilidad ventricular izquierda o la hipertensión venosa pulmonar secundaria a las miocardiopatías puede provocar síntomas sugestivos de broncoespasmo inducido por ejercicio que se malinterpretan como asma de esfuerzo. La normalidad de las pruebas de función pulmonar en un niño con sospecha de asma de esfuerzo debe condicionar la evaluación cardiovascular del paciente para descartar patología cardiaca.
Las convulsiones febriles pueden ser un signo de presentación del síndrome de Brugada15.
Aproximadamante el 5-10% de los casos de muerte súbita del lactante pueden estar relacionados con mutaciones genéticas productoras de canalopatías como el síndrome de QT largo, el síndrome de Brugada o la taquicardia ventricular polimorfa catecolaminérgica16.
Las estrategias para la prevención pasan por reconocer las enfermedades que pueden acabar en una muerte súbita mediante los procedimientos de cribado y mantener un índice de sospecha adecuado cuando se atienden los niños en la consulta.
PROCEDIMIENTOS DE CRIBADO
No hay ningún método de cribado validado con alta efectividad en la detección de niños con riesgo de MSC. Pueden realizarse como parte del reconocimiento predeportivo y durante los controles del niño sano en Atención Primaria.
Revisión predeportiva
Como la MSC es más frecuente durante la práctica deportiva, se han desarrollados distintos protocolos de evaluación predeportiva. Recientemente la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC) ha desarrollado una guía clínica de revisión predeportiva con objeto de detectar patología cardiovascular de riesgo. En esta guía se recomienda una evaluación sistemática de los antecedentes personales y familiares, la realización de historia clínica dirigida a la presencia de dolor precordial, síncope o presíncope, palpitaciones o disnea, la exploración física general y específica con tensión arterial, presencia de deformidades torácicas, auscultación cardiaca, palpación de pulsos y presencia de estigmas del síndrome de Marfan. Además, la guía recomienda la realización sistemática de un ECG en la evaluación predeportiva de los niños por su utilidad en el diagnóstico de miocardiopatías (hipertrófica, arritmogénica, dilatada), enfermedades del sistema de conducción (bloqueos AV, síndromes de preexcitación como el Wolff-Parkinson-White o algunas canalopatías (SQTL, SQTC, síndrome de Brugada).
Controles del programa de salud infantil
Se debe considerar la evaluación de riesgo cardiovascular en la infancia y la adolescencia en todos los pacientes, a todas las edades y por cualquier pediatra durante los controles del niño sano. Los pediatras de Atención Primaria deben conocer los signos de alarma de la MSC y actuar de forma adecuada con una evaluación cardiovascular, realización de ECG, remisión del paciente a unidad de Cardiología y restricción de la actividad física cuando sea necesario. Existen diferentes cuestionarios que evalúan el riesgo de MSC, la mayoría de los cuales recogen al menos las cuatro preguntas básicas señaladas en la Tabla 2.

El reconocimiento del origen genético de varias entidades relacionadas con la MSC y el estudio de la familia tienen gran relevancia clínica pues pueden identificar de forma prospectiva miembros de la familia incluso asintomáticos afectos genotípicamente por una enfermedad que predispone a MSC.
ATENDIENDO NIÑOS EN LA CONSULTA
Muchas de las causas más frecuentes de muerte súbita en niños y adolescentes pueden ser identificadas a partir de la historia clínica, los antecedentes personales y familiares y la exploración física.
Síncope
El síncope es un motivo de consulta relativamente frecuente en Pediatría. La evaluación cuidadosa de un niño que experimenta por ejemplo un síncope asociado con el ejercicio es de suma importancia, ya que puede ser la última oportunidad para diagnosticar una afección potencialmente mortal.
En la Tabla 3 se muestra el diagnóstico diferencial entre el síncope cardiogénico y el síncope vasovagal17.
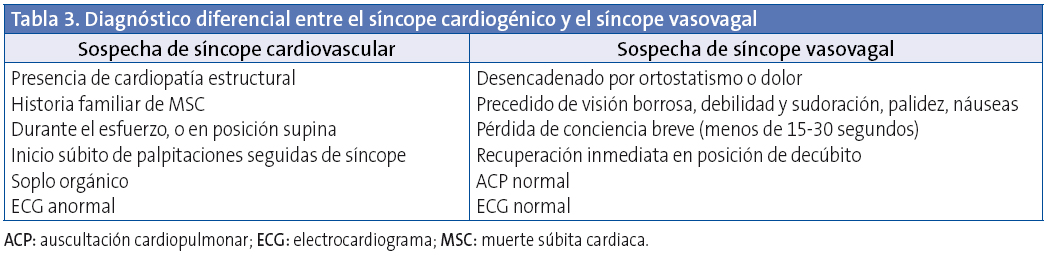
Los datos que han mostrado mayor sensibilidad para detectar el síncope de origen cardiológico18 son el síncope de esfuerzo, sin pródromos, precedido por dolor torácico o palpitaciones, que requiere reanimación cardiopulmonar; el examen físico anormal; un ECG anormal; historia cardiaca previa y antecedentes familiares de riesgo.
La literatura médica sugiere que a todos los niños con síncope se les debe realizar un ECG. Un ECG normal puede ser tranquilizador, ya que las causas graves a menudo tienen cambios en el ECG; sin embargo, un ECG normal no siempre excluye patología cardiaca subyacente. En adultos el ECG ha mostrado una sensibilidad del 86% y una especificidad del 70% para excluir patología cardiovascular19. Algunas entidades muy poco frecuentes, como la taquicardia ventricular polimórfica catecolaminérgica tienen ECG de reposo normal, pero dado que la prevalencia de esta entidad es desconocida (aparte de que sea poco frecuente), es difícil saber cuántos niños con esta patología se pueden perder si se lleva a cabo solo un ECG de reposo (y no de ejercicio). Una vez más, la historia es lo más importante.
En la Tabla 4 se muestran causas cardiacas que pueden producir síncope en la edad pediátrica y los cambios en el ECG correspondientes.
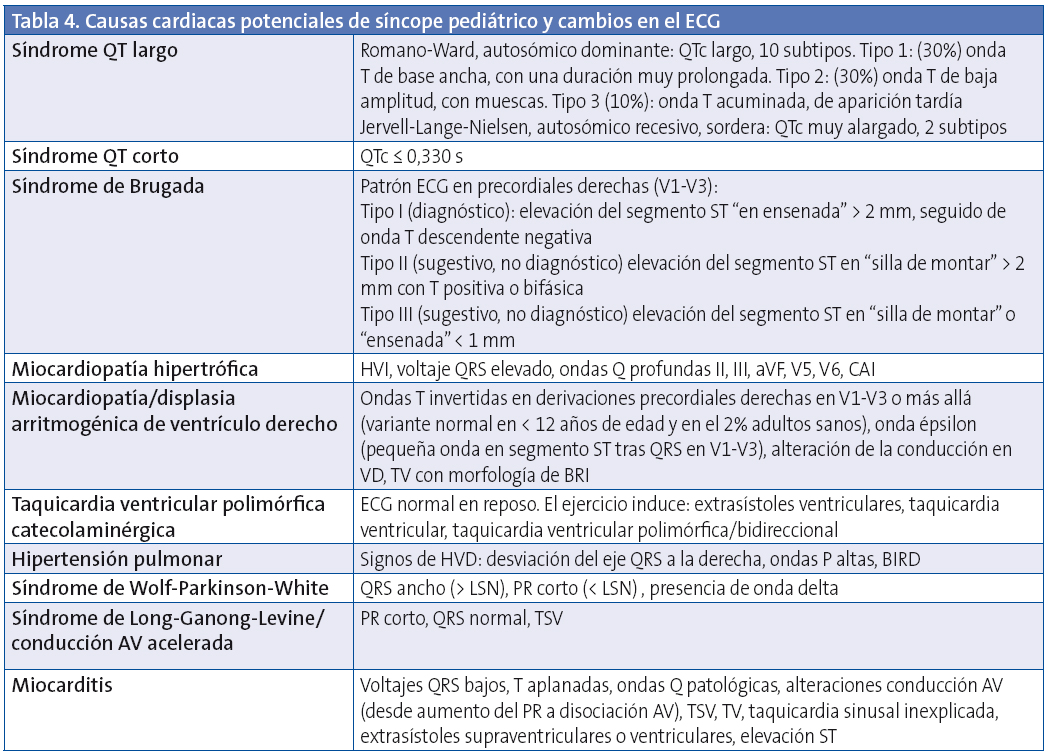
ACI: arteria coronaria izquierda; AP: arteria pulmonar; AV: auriculoventricular; BAV: bloqueo auriculoventricular; BIRD: bloqueo de rama izquierda; BRI: bloqueo de rama izquierda; CAI: crecimiento aurícula izquierda; CBA: crecimiento biauricular; DAVD: displasia arritmogénica de ventrículo derecho; HVI: hipertrofia ventricular izquierda; HVD: hipertrofia ventricular derecha; LSN: límite superior normalidad; QT: intervalo QT; QTc: intervalo QT corregido; s: segundos; TSV: taquicardia supraventricular; TV: taquicardia ventricular; VD: ventrículo derecho; VI: ventrículo izquierdo.
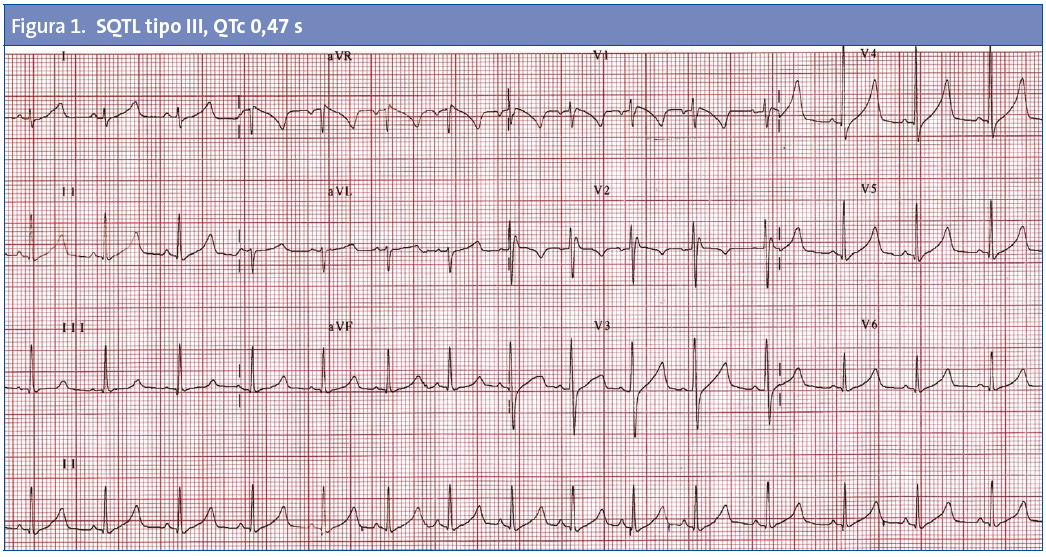
No todos los trastornos que causan MSC en los niños tienen alteraciones fácilmente identificables en el ECG. Entre las enfermedades detectables habitualmente por ECG se encuentran la MCH, el SQTL (Fig. 1), el síndrome de Wolff-Parkinson-White (Fig. 2) o el síndrome de Brugada (Fig. 3).
Dolor torácico
Entre las enfermedades cardiacas que pueden debutar con dolor torácico en niños sin antecedentes de cardiopatía se encuentran la miocarditis, la pericarditis, anomalías coronarias, la hipertensión pulmonar, el tromboembolismo pulmonar, la disección aortica, la arteritis de Takayasu, la MCH y la miocardiopatía dilatada.
El ECG es una prueba no invasiva, barata y de fácil realización, aunque su especificidad para identificar condiciones cardiacas subyacentes en adolescentes con dolor torácico no es elevada20. En la inmensa mayoría de los casos, con la historia y la exploración, y en ocasiones con un ECG, llegaremos al diagnóstico. El uso juicioso de otras pruebas, como la radiografía de tórax, la analítica sanguínea (troponina, dímero D), la ecocardiografía, ergometría, etc., nos ayudarán en casos seleccionados.
Aunque cada una de las condiciones mencionadas anteriormente tiene tratamiento específico, el tratamiento inmediato más eficaz para cambiar la MSC en MS abortada es aumentar la prevalencia de la capacitación en reanimación cardiopulmonar en la población general y la disponibilidad de desfibriladores externos automáticos (DEA). Los DEA deben estar ubicados en lugares donde grandes grupos de personas se reúnen, incluso cuando los jóvenes atletas pueden competir.
CONFLICTO DE INTERESES
El autor declara no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
Parte de este texto ha sido presentado en el 62.º Congreso de la AEP de junio de 2014 en Madrid, y en el 12.º Curso de Actualización en Pediatría de la AEPap de febrero de 2015 en Madrid.
ABREVIATURAS: AV: auriculoventricular; DAVD/MAVD: displasia o miocardiopatía arritmogénica del ventrículo derecho; ECG: electrocardiografía/electrocardiograma; MCH: miocardiopatía hipertrófica; MS: muerte súbita; MSC: muerte súbita cardiaca; SECPCC: Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas; SMSL: síndrome de muerte súbita del lactante; SQTL: síndrome de QT largo; TSVP: taquicardia supraventricular paroxística; TVPC: taquicardia ventricular polimórfica catecolaminérgica; WPW: síndrome de Wolff-Parkinson-White.
BIBLIOGRAFÍA
- Van Hare FG. Sudden Death. Nelson Textbook of Pediatrics. 19.ª edición. Filadelfia: Saunders; 2011. p. 1619-21.
- Wren C. Sudden death in children and adolescents. Heart. 2002;88:426-31.
- Firoozi S, Sharma S, McKenna WJ. Risk of competitive sport in young athletes with heart disease. Heart (BCS). 2003;89:710-4.
- O’Connor FG, Kugler JP, Oriscello RG. Sudden death in young athletes: screening for the needle in a haystack. Am Fam Physician. 1998;57:2763-70.
- Morrow W, Berger S, Jenkins K, Minich L. Pediatric sudden cardiac arrest. Pediatrics. 2012;129:e1094-102.
- Wren C. Screening for potentially fatal heart disease in children and teenagers. Heart. 2009;95:2040-6.
- Maron BJ, Shirani J, Poliac LC, Mathenge R, Roberts WC, Mueller FO. Sudden death in young competitive athletes. Clinical, demographic, and pathological profiles. JAMA. 1996;276:199-204.
- Lipsett J, Cohle SD, Berry PJ, Russell G, Byard RW. Anomalous coronary arteries: A multicenter pediatric autopsy study. Pediatr Pathol. 1994;14:287-300.
- Corrado D, Basso C, Thiene G. Arrhythmogenic right ventricular cardiomyopathy: An update. Heart. 2009;95:766-73.
- Maron BJ, Doerer JJ, Haas TS, Tierney DM, Mueller FO. Sudden deaths in young competitive athletes: Analysis of 1866 deaths in the United States, 1980-2006. Circulation. 2009;119:1085-92.
- Giustetto C, Di Monte F, Wolpert C. Short QT syndrome: clinical findings and diagnostic–therapeutic implications. Eur Heart J. 2006;27:2440-7.
- Maron BJ, Gohman TE, Kyle SB, Estes NA, Link MS. Clinical profile and spectrum of commotio cordis. JAMA. 2002;287:1142-6.
- Liberthson RR. Sudden death from cardiac causes in children and young adults. N Engl J Med. 1996;334:1039-44.
- Wisten A, Messner T. Symptoms preceding sudden cardiac death in the young are common but often misinterpreted. Scand Cardiovasc J. 2005;39:143-9.
- Probst V, Denjoy I, Meregalli PG. Clinical aspects and prognosis of Brugada syndrome in children. Circulation. 2007;115:2042-8.
- Arnestad M, Crotti L, Rognum TO. Prevalence of long-QT syndrome gene variants in sudden infant death syndrome. Circulation. 2007;115:361-7.
- Moya A. Guía de práctica clínica para el diagnóstico y manejo del síncope (versión 2009). Rev Esp Cardiol. 2009;62:1466.e1-e52.
- Tretter JT, Kavey RE. Distinguishing cardiac syncope from vasovagal syncope in a referral population. J Pediatr. 2013;163:1618-23.
- Quinn J, McDermott D. Electrocardiogram findings in emergency department patients with syncope. Acad Emerg Med. 2011;18:714-8.
- Hanson CL, Hokanson JS. Etiology of chest pain in children and adolescents referred to cardiology clinic. WMJ. 2011;110:58.





