Vol. 13 - Num. 52
Notas clínicas
Tos ferina: revisión clínica a propósito de un caso
Jorge Olivares Ortiza, M.ª Mercedes Bueno Campañab
aPediatra. CS Barcelona. Móstoles. Madrid. España.
bUnidad de Pediatría. Hospital Universitario Fundación Alcorcón. Alcorcón. Madrid. España.
Correspondencia: J Olivares. Correo electrónico: jorge.olivares@salud.madrid.org
Cómo citar este artículo: Olivares Ortiz J, Bueno Campaña MM. Tos ferina: revisión clínica a propósito de un caso. Rev Pediatr Aten Primaria. 2011;13:575-84.
Publicado en Internet: 30-01-2012 - Número de visitas: 107441
Resumen
La tos ferina es una enfermedad contagiosa que afecta en la actualidad a lactantes menores de seis meses y a adolescentes o adultos jóvenes, debido a una inmunidad vacunal limitada. Cursa clínicamente en varias fases, siendo el periodo de contagio la fase catarral inicial y las dos primeras semanas de la fase paroxística. En los lactantes pequeños puede presentarse de forma atípica, con pausas de apnea sin tos llegando a ser un cuadro potencialmente grave, por lo que pueden requerir ingreso. El diagnóstico es clínico, dadas las dificultades técnicas para la confirmación microbiológica. El germen responsable es Bordetella pertussis, aunque existen cuadros clínicos similares producidos por otros microorganismos, tanto virus como bacterias. El tratamiento antibiótico recomendado es con azitromicina tanto para el caso como para los contactos. No se ha demostrado que los tratamientos adyuvantes sean útiles.
Palabras clave
● Profilaxis ● Síndrome pertusoide ● Tosferina ● TratamientoIntroducción
La tos ferina es una enfermedad contagiosa que ha experimentado un aumento de prevalencia en los últimos años, debido a un cambio epidemiológico por el cual se afectan más adultos jóvenes y adolescentes, que son fuente de infección para lactantes, en los cuales la enfermedad puede ser grave.
Caso clínico
Lactante de 47 días sin antecedentes de interés que acude a la consulta de su pediatra por un cuadro de tos y mucosidad nasal de cuatro días de evolución, habiéndose hecho la tos más persistente en forma de accesos repetidos en los que le han observado cianosis perioral y que ocasionalmente terminan con un vómito; se encuentra afebril y con una reducción en la ingesta de leche materna.
En la exploración física se objetiva un buen estado general, con buena coloración y perfusión periférica, sin signos de dificultad respiratoria y auscultación cardiopulmonar normal; se decide dejar en observación, durante la cual se objetiva uno de estos episodios en los que presenta un acceso con varios golpes de tos durante la espiración y con una inspiración ruidosa en forma de gallo al finalizar el acceso, acompañado de cianosis facial.
Se decide ingresarlo bajo la sospecha de síndrome pertusoide, con monitorización continua de saturación de oxígeno, frecuencia cardiaca y respiratoria. Durante su ingreso aumenta la frecuencia de los accesos de tos de tipo pertusoide, se objetiva repercusión en la frecuencia cardiaca y la saturación de oxígeno durante dichos accesos e, incluso, en los periodos intercríticos presenta pausas de apnea que se recuperan con estimulación, por lo que se le administra oxigenoterapia con gafas nasales y también sueroterapia intravenosa hasta que recupera una alimentación enteral suficiente; se trata con azitromicina al paciente y a los contactos cercanos.
Durante su ingreso hospitalario, se realiza un estudio serológico para Bordetella pertussis que resulta negativo tanto en la determinación inicial como en la siguiente, un mes después.
Discusión
La tos ferina es una enfermedad muy contagiosa, con una tasa de infección subclínica del 80% para aquellos individuos que han tenido una exposición intensa y que estaban previamente inmunizados1,2. El periodo de contagio es la fase catarral inicial y las dos primeras semanas de la fase paroxística (hasta seis semanas en el caso de niños no imunizados)2. Ni la vacunación ni la infección natural consiguen una inmunidad completa. Del total de los casos, el 67% aparece en adolescentes y adultos2, que son la principal fuente de infección para los niños3; en la actualidad existen dos picos de incidencia de la tos ferina: en los niños menores de cinco meses y en los mayores de diez años.
La duración de la inmunidad es limitada, de unos 15 años con la infección natural1 y de 5-6 años con la vacunación4; la eficacia de la vacuna también se va perdiendo con el paso del tiempo; así, a los cuatro años es de un 84%, y a los siete años es del 46%5. La vacunación requiere un mínimo de dos dosis para ser eficaz6; por tanto, son los lactantes de menos de cuatro meses los de mayor riesgo. El principal origen de la infección en niños son los adultos que conviven con ellos, sobre todo los padres7.
Bordetella pertussis es el germen responsable de todos los casos de tos ferina epidémica y de la mayoría de las esporádicas. B. parapertussis es responsable de algunos casos de tos ferina esporádica, y B. bronchiseptica produce infecciones en inmunodeprimidos.
El síndrome pertusoide es un cuadro similar a la tos ferina, pero generalmente más leve y producido por otros gérmenes (Mycoplasma pneumoniae, Chlamydophila pneumoniae, Chlamydia trachomatis, Ureaplasma urealyticum, virus respiratorio sincitial, adenovirus, Haemophilus parainfluenzae, citomegalovirus [CMV] y enterovirus).
El cuadro clínico clásico de la tos ferina cursa en varias fases: periodo de incubación de 7-10 días; fase catarral (1-2 semanas) indistinguible de cualquier infección respiratoria de vías altas, sin fiebre y con una tos progresivamente más intensa; fase paroxística (2-4 semanas), con accesos de tos con 5-10 golpes en cada espiración seguidos de un estridor inspiratorio característico conocido como gallo. Tras el acceso es frecuente expulsar una mucosidad espesa, filante o un vómito alimentario. Durante el paroxismo, la cara se muestra abotargada, cianótica, con hemorragias conjuntivales y protusión de la lengua, esto es lo que se conoce como facies pertusa. Entre paroxismos, el niño está asintomático. Posteriormente se sigue de una fase de convalecencia (1-3 semanas) en durante la cual las crisis de tos se van haciendo menos frecuentes y más leves, hasta que desaparecen.
En los menores de tres meses, el cuadro puede ser más grave y prolongado, la fase catarral puede pasar desapercibida, los accesos de tos son menos llamativos y sin gallo y es posible ver episodios de apnea o cianosis sin tos1.
Las complicaciones más graves son la neumonía por Bordetella o por sobreinfección bacteriana (S. aureus, S. pneumoniae)2, esta última aparece en un 5% de los casos y es la causa del 90% de las muertes por tos ferina; y por otro lado la encefalopatía tosferinosa (1/100 000 casos), con convulsiones y alteración del nivel de conciencia.
La necesidad de ingreso en Unidades de Cuidados Intensivos y de ventilación mecánica es más frecuente en menores de tres meses y se debe a insuficiencia respiratoria secundaria a apnea y a la neumonía bacteriana secundaria2.
Se ha descrito el síndrome de la tos ferina maligna, que se da en menores de tres meses y se caracteriza por una reacción leucemoide (> 100 000 leucocitos) con linfocitosis y bronconeumonía con hipoxemia e hipertensión pulmonar, que tiene una mortalidad del 75%.
Dadas las dificultades técnicas y el retraso en los resultados del diagnóstico microbiológico, en la práctica el diagnóstico es fundamentalmente clínico.
Desde el punto de vista microbiológico, se puede realizar un cultivo que demuestre la presencia del germen en el aspirado nasofaríngeo profundo, mediante una torunda flexible de dacrón o de alginato cálcico, manteniéndola durante 15-30 segundos. Para la conservación de la muestra durante un periodo de cuatro días se puede emplear el caldo de cultivo de Stainer-Scholte o el medio semisólido de Regan-Lowe2. Dada la complejidad técnica del cultivo y puesto que finalmente la sensibilidad de la prueba es de menos del 50%, se desaconseja su uso rutinario. Otra opción de diagnóstico microbiológico es la inmunofluorescencia directa (IFD), que puede hacerse sobre el cultivo o bien directamente en la muestra nasofaríngea, si bien es muy dependiente de la experiencia del laboratorio, alcanzando una sensibilidad del 60% y una especificidad del 90% en las condiciones óptimas1. El diagnóstico serológico se realiza mediante la detección en suero de IgG frente a toxina pertusoide (TP) y hemaglutinina filamentosa (HAF), que son detectables aproximadamente hasta cinco años después de la infección. Los anticuerpos dirigidos frente a TP son especificos para B. pertussis y se consideran marcadores serológicos de la infección de elección en niños. La detección de IgA se ha utilizado en algunos países para la definición de caso, pero no mejora el rendimiento del diagnóstico serológico frente a IgG y es más útil en niños mayores y adultos porque en niños pequeños, debido a su inmadurez inmunológica, los niveles de IgA en suero pueden ser indetectables. Para la confirmación diagnóstica sería necesario demostrar una seroconversión con un aumento en dos o cuatro veces del nivel de anticuerpos en una muestra convaleciente frente a una muestra inicial previa, lo cual no es posible en la práctica habitual. Se intenta utilizar determinaciones únicas de IgG TP para el diagnóstico serológico de la infección, para lo cual es necesario disponer de puntos de corte respecto a la población general, que de momento no están disponibles. En lactantes, se considera diagnóstica la existencia de títulos altos de IgG TP en una sola muestra en fase aguda y en ausencia de anticuerpos maternos3. Por último, la técnica de la reacción en cadena de la polimerasa (PCR) es la idónea, con una sensibilidad del 65-99% y una especificidad del 90-100%, mejores que las del resto de las técnicas.
La tos ferina es una enfermedad de declaración obligatoria (EDO), por lo que una vez diagnosticada se debe dar parte a los servicios de salud pública locales.
Se plantea el diagnóstico diferencial con síndrome pertusoide, recidivas clínicas de una tos ferina previa o bronquiolitis en los lactantes.
Ante la sospecha clínica de un caso de tos ferina, tanto en las consultas de Atención Primaria como en los Servicios de Urgencias Pediátricas, se debe valorar la necesidad de ingreso hospitalario (tabla 1).

Todo paciente ingresado por tos ferina debe ser monitorizado, se debe asegurar la adecuada nutrición e hidratación del niño, pudiendo ser necesaria la sueroterapia intravenosa, la alimentación a través de sonda nasogástrica o incluso la alimentación parenteral en los niños que no ganan peso, siendo esta la última opción2,8.
Es necesario el aislamiento respiratorio9 hasta que se hayan cumplido cinco días de tratamiento antibiótico efectivo o hayan pasado tres semanas desde el inicio de los síntomas.
El tratamiento antibiótico tiene dos objetivos: disminuir la gravedad de los síntomas10 si el tratamiento se inicia dentro de los primeros siete días de clínica, y reducir el riesgo de transmisión11 eliminando el germen de la nasofaringe.
Se recomienda el tratamiento antibiótico según se indica en las tablas 2 y 3.

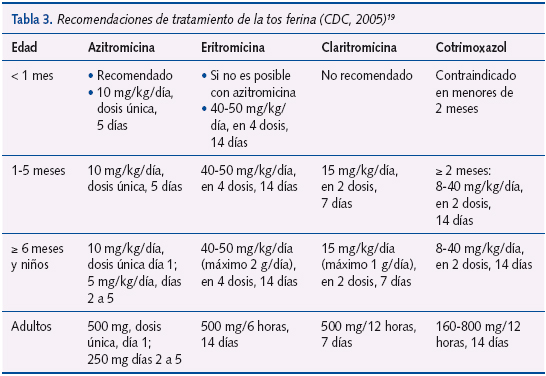
Las pautas de tratamiento se describen en la tabla 3 (recomendaciones de los Centers for Disease Control and Prevention [CDC] 200519). Si no se pueden administrar macrólidos, se puede utilizar el cotrimoxazol (TMP-SMZ) en los mayores de dos meses de edad. Los betalactámicos no son útiles en el tratamiento de la infección por Bordetella13. En los menores de un mes se excluye la claritromicina porque se han registrado casos de estenosis hipertrófica del píloro, y también el TMP-SMZ, por el riesgo de kernicterus en los menores de dos meses.
Los tratamientos coadyuvantes, incluidos broncodilatadores, corticoides y antitusígenos, no han demostrado beneficio en pacientes con tos ferina14. Por tanto, no hay evidencia suficiente para recomendar ninguno de ellos, y en algún caso se recomienda no usarlos por sus efectos adversos. El salbutamol, ya sea inhalado o por vía oral, se ha probado en dos estudios con un total de 34 pacientes en los que no se ha demostrado diferencia significativa con el grupo control15,16, aunque algunos autores recomiendan hacer un ensayo terapéutico con betaagonistas inhalados en caso de compromiso respiratorio. Con respecto a los corticoides, existe un estudio con 11 pacientes en tratamiento con dexametasona oral en el que no se demuestra diferencia significativa17; existen datos individuales que sugieren un posible beneficio clínico con el uso de corticoides, aunque no se recomiendan de forma rutinaria. Los antitusígenos como la codeína no solo no son eficaces, sino que están contraindicados por su efecto sedante8.
En cuanto al uso de inmunoglobulinas específicas para antígenos de Bordetella pertussis, un estudio demostró una disminución en la frecuencia de accesos de tos18, pero no hay datos suficientes para recomendar su uso habitual.
El uso de tratamiento antibiótico profiláctico postexposición a los contactos en los primeros 21 días de clínica del caso inicial puede prevenir el desarrollo de los síntomas; pasado este tiempo la indicación no está clara la indicación y habrá que valorar el beneficio-riesgo individual8.
Las indicaciones de tratamiento antibiótico profiláctico alcanzan a todos los contactos cercanos (exposición cara a cara a menos de 1 metro del paciente, contacto directo con las secreciones respiratorias, se comparte un espacio cerrado próximo al paciente durante al menos una hora19) incluidos los cuidadores de la guardería y miembros de la familia, independientemente de su estado vacunal9. Siguiendo la misma pauta de tratamiento antibiótico que para los pacientes y dentro de los primeros 21 días de clínica del paciente caso.
Para los convivientes y contactos íntimos menores de siete años se administrará una dosis adicional de DTPa si han recibido cuatro dosis. A los que han recibido menos de cuatro dosis de DTPa se les revacunará a intervalos de cuatro semanas, con las dosis que les falten hasta completar el calendario vacunal. En los de siete o más años, adolescentes y adultos puede administrarse Tdpa (con carga antigénica reducida de difteria y tos ferina)19.
Dado que la principal fuente de infección son los adolescentes y adultos, el Comité Asesor de Vacunas de la Asociación Española de Pediatría recomienda la vacunación a los 14 años con Tdpa en lugar de la Td actual20.
Algunos autores se plantean la vacunación de mujeres embarazadas en el último trimestre, ya que podría dar protección al lactante hasta que reciba la primera dosis de la vacuna. Pero se ha visto que los anticuerpos transferidos por la madre son indetectables a los 2-6 meses21 y además podrían interferir con la respuesta inmunógica tras la vacunación22. La vacunación en la embarazada solo se hará en situaciones de alto riesgo1.
Se han realizado algunos estudios con vacunación en recién nacidos con resultados heterogéneos y no concluyentes, en los que se encuentran un nivel elevado de anticuerpos de forma precoz a los 2-3 meses, pero niveles más bajos a los 7-8 meses, con respecto a la pauta vacunal habitual23-25. En la actualidad no se recomienda la vacunación neonatal. Los niños que han pasado la tos ferina deben continuar con su calendario vacunal habitual.
En resumen, la tos ferina es una enfermedad de prevalencia global descendiente pero con un cambio en su patrón epidemiológico que ha hecho aumentar su presencia en adultos jóvenes vacunados en su infancia y en lactantes pequeños antes de que su vacunación sea efectiva, y es en estos últimos en los que se dan con cierta frecuencia cuadros que pueden llegar a ser graves. Por tanto, es conveniente tener en cuenta esta patología en el conjunto de las infecciones respiratorias que se ven habitualmente en las consultas. Las dificultades en el diagnóstico microbiológico hacen que el diagnóstico diferencial entre las distintas causas del síndrome pertusoide deba basarse principalmente en la clínica. En cualquier caso, la actitud terapéutica habrá de ser la misma y, por tanto, la confirmación microbiológica, en general, no es necesaria.
Bibliografía
- Moraga FA, Campins M. Tos ferina. En: Delgado Rubio A. Enfermedades infecciosas en Pediatría, 1.ª ed. Madrid: McGraw-Hill/Interamericana de España, SAU; 2009. p. 73-80.
- Long SS. Tos ferina (Bordetella pertussis y Bordetella parapertussis). En: Kliegman RM, Behrman RE, Jenson HB, Stanton BF. Nelson Tratado de Pediatría, 18.ª ed. Barcelona: Elsevier; 2009. p. 1178-82.
- Sanz JC, de Ory F. Diagnóstico de laboratorio de tos ferina. Papel de la serología. Enferm Infecc Microbiol Clin. 2002;20(5):212-8.
- Wendelboe A, Van Rie A, Salmaso S, Englund JA. Duration of inmunity against pertussis after natural infection or vaccination. Pediatr Infect Dis J. 2005;25:S58-S61.
- Jenkinson D. Duration of effectiveness of pertussis vaccine. Br Med J. 1988;286:612-4.
- Olin P, Gustafsson L, Barreto L, Hessel L, Rie AV, Bogaerts H et al. Declining pertussis incidence in Sweden following the introduction of acellular pertussis vaccine. Vaccine. 2003;21:2015-21.
- Forsyth K, Tan T, König CH, Caro JJ, Plotkin S. Potential strategies to reduce the burden of pertussis. Pediatr Infect Dis J. 2005;24:S69-S74.
- Yeh S. Treatment and prevention of Bordetella pertussis infection in infants and children. Uptodate 18.3 [en línea] [actualizado el 27/09/2010; consultado el 07/03/2011]. Disponible en www.uptodate.com
- American Academy of Pediatrics. Pertussis (whooping cough). En: Pickering LK (ed.). Red Book: 2009 report of the committee on infectious diseases, 28th ed. Elk Grove Village, IL: American Academy of Pediatrics; 2009. p. 504.
- Bass JW. Pertussis: current status of prevention and treatment. Pediatr Infect Dis J. 1985;4:614.
- Bortolussi R, Miller B, Ledwith M, Halperin S. Clinical course of pertussis in immunized children. Pediatr Infet Dis J. 1995;14:870-4.
- Center for Disease Control and Prevention guidelines for the control of pertussis outbreaks. Atlanta, GA: Center for Disease Control and Prevention; 2000.
- Trollfors B. Effect of erythromycin and amoxicillin on Bordetella pertussis in the nasopharynx. Infection. 1978;6:228-30.
- Pillay V, Swingler G. Symptomatic treatment of the cough in whooping cough. Cochrane database Syst rev. 2003;CD00 3257.
- Metsola J, Viljamen MK, Ruskanen O. Salbutamol in the treatment of whooping cough. Scand J Infect Dis Rev. 1986;18:593.
- Krantz I, Norrby SR, Trollfors B. Salbutamol vs placebo for treatment of pertussis. Pediatr Infect Dis. 1985;4:638-40.
- Roberts I, Gavin R, Lennon D. Randomizaed controlled trial of steroids in pertussis. Pediatr Infect Dis J. 1992;11:982-3.
- Hewlett EL, Edwuards KM. Clinical practice. Pertussis not just for kids. N Engl J Med. 2005;352:1215-22.
- Martínez Antón A, Ordóñez Sáez O, Ruiz Contreras J. Síndrome pertusoide (v.1/2007). En: Hernández Merino A (coord.). Guía-ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico [en línea][actualizado el 17/10/2007; consultado el 07/03/2011]. Disponible en www.guia-abe.es
- Marès Bermúdez J, van Esso Arbolave D, Moreno-Pérez D, Merino Moína M, Álvarez García FJ, Cilleruelo Ortega MJ, y cols. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2011. An Pediatr (Barc). 2011;74:132.e1-132.e19.
- Tiwani T, Murphy TV, Moran J. Recommended antimicrobial agents for the treatment and postexposure prophylaxis of pertussis: 2005 CDC guidelines. MMWR Recomm Rep. 2005; 54 (RR14);16.01.
- Edwuard KM. Pertussis and important target for maternal immunization. Vaccine. 2003;21:3483-6.
- Englund JA, Anderson EL, Reed GF. The effect of maternal antibody on serologic response and the incidence of adverse reactions after primary immunization with acellular and whole-cell pertussis vaccines combined with diphtheria and tetanus toxoids. Pediatrics. 1995;96:580-4.
- Belloni C, De Silvestri A, Tinelli C, Avanzini MA, Marconi M, Strano F et al. Immunogenicity of a three-component acellular pertussis vaccine administered at birth. Pediatrics. 2003;111:1042-15.
- Halasa NB, O’Shea A, Shi JR, LaFleur BJ, Edwards KM. Poor inmune responses to a birth dose of diphteria, tetanus and acellular pertussis vaccine. J Pediartr. 2008;153:327-32.
- Knuf M, Schmidt HJ, Wolter J, Schuerman L, Jacquet JM, Kieninger D et al. Neonatal vaccination with acellular pertussis vaccine accelerates the acquisition of pertussis antibodies in infants. J Pediatr. 2008;152:655-60.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.





