Vol. 12 - Num. 47
Grupo PrevInfad/PAPPS Infancia y Adolescencia
Vitamina D profiláctica
C Alonso Lópeza, N Ureta Velascoa, Carmen Rosa Pallás Alonsoa, Grupo PrevInfadb
aServicio de Neonatología. Hospital Universitario 12 de Octubre. Madrid. España.
bF. J. Soriano Faura (coord.), J. Colomer Revuelta, O. Cortés Rico, M. J. Esparza Olcina, J. Galbe Sánchez-Ventura, J. García Aguado, A. Martínez Rubio, J. M. Mengual Gil, M. Merino Moína, C. R. Pallás Alonso, F. J. Sánchez Ruiz-Cabello.
Cómo citar este artículo: Alonso López C, Ureta Velasco N, Pallás Alonso CR, Grupo PrevInfad. Vitamina D profiláctica. Rev Pediatr Aten Primaria. 2010;12:495-510.
Publicado en Internet: 30-09-2010 - Número de visitas: 31090
Resumen
La vitamina D es una hormona compleja que interviene en la homeostasis del calcio y en otras múltiples funciones en diversos órganos.
El déficit de vitamina D se asocia con raquitismo y osteomalacia. En las últimas décadas, numerosos estudios muestran el resurgir del raquitismo nutricional y sugieren que la vitamina D está implicada en el mantenimiento de la inmunidad natural, en la prevención de infecciones, enfermedades autoinmunes, 15 tipos de cáncer, osteoporosis, enfermedades cardiovasculares, diabetes mellitus tipos 1 y 2 y enfermedades psiquiátricas.
La fuente principal de vitamina D es el sol, y la dieta solo provee el 10%. La menor exposición solar de la población debida a los cambios en el estilo de vida, a los movimientos migratorios y a las campañas de salud pública, que aconsejan evitar el sol en los niños por el riesgo de cáncer de piel, ha condicionado la reaparición del déficit de vitamina D.
Dada la escasez de efectos adversos de los suplementos de vitamina D en las dosis recomendadas, y hasta que no existan unas recomendaciones bien equilibradas de protección solar, parece adecuada la suplementación con vitamina D. Por ello, la Sociedad Pediátrica de Canadá, la Academia Americana de Pediatría, las recomendaciones de Australia y Nueva Zelanda y el grupo PrevInfad recomiendan una dosis de vitamina D de 400 UI/día para todos los niños durante su primer año de vida.
Palabras clave
● Raquitismo ● Vitamina DNota:
Grupo PrevInfad: FJ. Soriano Faura (Coordinador del grupo, Valencia), J. Galbe Sánchez-Ventura (Zaragoza), J. Pericas Bosch (Barcelona), M. Merino Moína (Madrid), FJ. Sánchez-Ruiz Cabello (Granada), CR. Pallás Alonso (Madrid), J. Colomer Revuelta (Valencia), O. Cortés Rico (Madrid), A. Martínez Rubio (Sevilla) y MJ. Esparza Olcina (Madrid).
Introducción
La vitamina D es más que una vitamina liposoluble. Su forma más activa, el calcitriol, se considera una hormona compleja que no solo interviene en la homeostasis del calcio, sino que además tiene otras múltiples funciones en diversos órganos, que incluyen la regulación del crecimiento celular1,2.
Existen dos tipos de vitamina D: la vitamina D3, o colecalciferol, y la vitamina D2, o ergocalciferol. La vitamina D3 es la principal fuente de vitamina D en el ser humano. Se sintetiza en la piel por la acción de la luz ultravioleta B (UVB) sobre el 7-dehidrocolesterol. También la podemos obtener por la ingesta de algunos alimentos, pero es una vitamina muy escasa en la mayoría de los que se consumen habitualmente. Solo está presente en cantidades significativas en el pescado azul y algunos aceites de pecado, el hígado y la grasa de mamíferos marinos, la yema de huevo3 y productos fortificados (algunas marcas de leche, zumo, pan y cereales)4. La vitamina D2 se sintetiza a partir del ergosterol de los hongos por acción de la luz UVB1,4,5, y la podemos consumir al tomar este alimento.
La 25(OH)D, o calcidiol, es la forma circulante de vitamina D más abundante. Además, es el mejor indicador de la suficiencia o insuficiencia de vitamina D. La 1,25(OH)2D, o calcitriol, es la forma más activa de vitamina D. El calcitriol es fundamental en la homeostasis del calcio. Sin embargo, actualmente se sabe que sus funciones no se limitan a regular el metabolismo fosfocálcico y la mineralización ósea, sino que es una de las sustancias más potentes inductoras de la maduración celular e inhibidoras de la proliferación celular6-8. De hecho, el receptor de la 1,25(OH)2D no solo se encuentra en el hueso, sino también en múltiples órganos y tejidos, como el estómago, el intestino delgado, el colon, el páncreas (células b), los osteoblastos, los linfocitos B y T activados, el cerebro, el corazón, el aparato yuxtaglomerular, las células de músculo liso vascular, las gónadas, la próstata y la mama6. Al calcitriol se le atribuyen funciones diversas tales como la estimulación de la producción de insulina, la modulación de la función de linfocitos B y T activados, efectos en la contractilidad miocárdica, prevención de la enfermedad inflamatoria intestinal y promoción de la secreción de TSH, entre otras4. Por ello, últimamente el déficit de vitamina D se ha relacionado con múltiples enfermedades.
Magnitud del problema de déficit de vitamina D
La vitamina D es esencial para la absorción normal de calcio en el intestino (solo el 10% de la absorción de calcio es independiente de la vitamina D), y su déficit se asocia con raquitismo en niños y con osteomalacia tanto en niños como en adultos5,9,10. Las primeras descripciones del raquitismo fueron realizadas por Daniel Whistler y Francis Glisson en Inglaterra en el siglo xvii11. A finales del siglo xix, con la industrialización, la enfermedad se hizo endémica hasta el descubrimiento de que la exposición al sol y el aceite de hígado de bacalao prevenían y curaban el raquitismo12.
Cuando se identificó la vitamina D y se encontraron métodos para suplementar los alimentos, el raquitismo nutricional casi desapareció en los países industrializados. Sin embargo, en las últimas décadas, en los países occidentales se han publicado numerosas series de casos que ponen de manifiesto el resurgir del raquitismo nutricional (fundamentalmente debido a una exposición insuficiente a la luz solar unida a una ingesta de vitamina D escasa):
- Series de casos de lactantes donde el raquitismo se asocia a la lactancia materna y a piel oscura casi de forma exclusiva13-15; otras en las que el raquitismo se asocia a la actancia materna, pero se describen casos en niños de piel tanto clara como oscura16-18.
- Niveles bajos de 25(OH)D en niños lactantes de piel preferentemente clara en relación con la exposición solar19-23.
- Series de casos de raquitismo en niños y adolescentes13-17,24.
- Niveles bajos de 25(OH)D en niños y adolescentes27-28.
Por tanto, el raquitismo por déficit de vitamina D ha adquirido relevancia nuevamente. Además, como ya se ha mencionado, en las dos últimas décadas hay estudios que sugieren que la vitamina D desempeña un papel esencial en el mantenimiento de la inmunidad natural29,30, y se ha implicado en la prevención de infecciones30,31, enfermedades autoinmunitarias (esclerosis múltiple32-34, artritis reumatoide35), al menos 15 tipos de cáncer36-39, osteoporosis40-44, enfermedades cardiovasculares45-52, diabetes mellitus tipo 1 y 253-58 y enfermedades psiquiátricas59,60, entre otras. Pero la mayoría de estas asociaciones proviene de estudios epidemiológicos ecológicos que relacionan estas patologías con poblaciones que habitan en altas latitudes (donde hay menor síntesis de vitamina D por radiación solar), o de estudios que encuentran una menor incidencia de estas enfermedades en poblaciones que reciben suplementos de vitamina D o que tienen una mayor concentración sérica de 25(OH)D. Por este motivo no se ha establecido una clara asociación causal, y se precisan más estudios para analizar ciertas variables de confusión y ajustar el riesgo atribuible a cada factor como, por ejemplo, qué parte del efecto se debe a la propia radiación solar y no a la vitamina D61.
Justificación de la suplementación con vitamina D
En 1917, Hess12 demostró en un barrio de población de raza negra la eficacia de la vitamina D para la prevención del raquitismo. Seleccionó 65 niños cuyos hermanos habían desarrollado raquitismo. Algunos de ellos ya tenían signos de raquitismo en el momento de entrar en el estudio. Se trató a todos menos a 16 (grupo control) con aceite de hígado de bacalao (unas 400 UI de vitamina D/día). De los que cumplieron el tratamiento, el raquitismo se previno o se curó en el 94% de los casos. De los que lo cumplieron parcialmente, obtuvieron una tasa de prevención entre el 80% y el 58%, en relación con la cantidad total ingerida de aceite de hígado de bacalao. De los 16 del grupo control, que no tomaron aceite de hígado de bacalao, desarrollaron raquitismo clínico el 85%. Con este trabajo quedó establecida la posibilidad de profilaxis del raquitismo, aun en poblaciones de muy alto riesgo, con un suplemento de vitamina D de aproximadamente 400 UI/día.
Más recientemente, en una revisión Cochrane se revisan las intervenciones para la prevención del raquitismo nutricional en niños nacidos a término62. Se identifican cuatro ensayos clínicos: dos en China, uno en Francia y otro en Turquía, que tienen como objetivo mostrar la eficacia de una intervención (suplemento de vitamina D, suplemento de vitamina D y calcio o mayor exposición solar) para la prevención del raquitismo. Dos estudios se realizaron en niños menores de tres años. El estudio de Turquía63 mostró cómo ninguno de los 300 niños del grupo de intervención (suplemento con 400 UI/día de vitamina D) presentó raquitismo, frente a 14 de los 372 del grupo control (riesgo relativo [RR]: 0,04; intervalo de confianza del 95% [IC 95%]: 0-0,71). En el estudio de China64 se suplementó con vitamina D (300 UI/día) y con calcio. El grado de incumplimiento de la suplementación en el grupo de intervención fue muy alto; 100 de los 183 niños del grupo suplementado y 33 de los 46 no suplementados presentaron signos de raquitismo nutricional (RR: 0,76; IC 95%: 0,61-0,95). La conclusión de los autores de la revisión es que, considerando la favorable relación riesgo-beneficio, es razonable ofrecer medidas preventivas para el raquitismo nutricional a todos los niños hasta los dos años de edad.
Comentarios respecto a la exposición a la luz solar
La principal fuente de vitamina D es el sol. Mientras que las dietas occidentales únicamente proveen el 10% del total de la concentración de vitamina D en el organismo, la síntesis cutánea inducida por la luz UVB provee el 90% restante1. Solo unos pocos alimentos tienen de forma natural cantidades sustanciales de vitamina D (fundamentalmente D3)3, y son muy pocos los alimentos que están reforzados con esta vitamina4. A lo largo de la historia, la luz solar ha suplido la mayoría de los requerimientos de vitamina D del ser humano8. Sin embargo, la menor exposición solar de la población en general, y de los niños en particular, ha condicionado la reaparición del déficit de vitamina D y el raquitismo nutricional como un problema de salud mundial13-28,65. Esto se ha debido a los cambios actuales en el estilo de vida1, a los movimientos migratorios y a las campañas de salud pública, respaldadas por la Asociación Americana de Pediatría, que aconsejan la evitación del sol en los niños, por el riesgo de cáncer de piel asociado a la exposición a la luz ultravioleta (UV)3,66. Sin embargo, no debemos olvidar que la radiación solar tiene algunos efectos beneficiosos para la salud que parecen independientes de la síntesis de vitamina D2,67-69 (y que, por lo tanto, no se obtienen con la suplementación), y varios autores consideran que los beneficios de la exposición responsable a la luz UV superan a los riesgos2,4,67. Sin embargo, es difícil estimar cuál es la exposición solar adecuada. Por ello, dada la escasez de efectos adversos de los suplementos de vitamina D en las dosis recomendadas, y hasta que no existan unas recomendaciones bien equilibradas de protección solar que aseguren un estado de suficiencia de vitamina D sin incrementar significativamente el riesgo de desarrollar cáncer inducido por la luz UV2,67, parece adecuada la suplementación con vitamina D en niños que se exponen escasamente al sol (o que lo hacen siempre con protección solar o con el cuerpo cubierto de ropa por tradiciones culturales), y en aquellos de piel oscura3.
Comentarios respecto a los niños de piel oscura
La pigmentación de la piel afecta al tiempo necesario para producir un cierto nivel de vitamina D, pero no altera el nivel alcanzable. Una persona de etnia india o asiática requiere tres veces más tiempo de exposición solar para alcanzar el mismo nivel de vitamina D que otra de piel clara, y las personas de etnia afroamericana de piel muy pigmentada, diez veces más70. Por otro lado, hay un nivel umbral de luz UVB requerido para inducir la producción de vitamina D71, que no se alcanza generalmente durante el invierno en áreas con latitudes por encima de los 40º. Debe almacenarse suficiente vitamina D durante la primavera, el verano y el otoño. Para los niños de piel oscura que hayan inmigrado a países de 42º latitud o más (Madrid: 40º latitud Norte) será mucho más difícil alcanzar los tiempos de exposición a la luz solar adecuados para sintetizar suficiente vitamina D.
Comentario respecto a los lactantes amamantados
Los cambios en los hábitos de vida han hecho también que las mujeres gestantes y las que están amamantando tengan una exposición muy limitada al sol y, por tanto, su leche tiene bajo contenido de vitamina D. En 1977 se describió que la leche humana, aunque tenía poca vitamina D como tal, contenía otros metabolitos en cantidades bastante altas, que podían tener efecto similar al de la vitamina D72. A partir de ese momento, las recomendaciones de suplementación para los niños lactados al pecho fueron más ambiguas y, aunque se ofrecía la posibilidad de suplementación, esta no era obligada73,74. Estudios posteriores mostraron que estos metabolitos que se habían encontrado en la leche de madre no tenían prácticamente actividad (< 5% de actividad de vitamina D)75 y que en la mayoría de las leches de madre analizadas las cantidades de vitamina D eran muy bajas (en torno a 40 UI/L). Por otro lado, tal como se ha referido anteriormente, siguiendo las recomendaciones actuales en relación con la exposición solar, los lactantes, sobre todo los más pequeños, prácticamente no se exponen al sol, de tal forma que los que están amamantados no consiguen niveles adecuados de vitamina D ni a través de la leche ni por la exposición solar13,23.
Comentarios sobre niños y adolescentes
Los niños mayores de dos años y los adolescentes, si realizaran actividades al aire libre, tendrían niveles adecuados de vitamina D. En general, la exposición solar sin protección, en época cálida, de unos 15 minutos al día, entre las 10 y las 15 horas, teniendo el rostro y parte de los brazos al descubierto, sería suficiente para garantizar la síntesis de vitamina D. Actualmente, muchos niños y adolescentes hacen “vida de interior” y pasan muy poco tiempo al aire libre. Si, además, cuando salen lo hacen cubiertos con mucha ropa o con protección solar, los niveles de vitamina D pueden ser insuficientes13-17,24-28. Ya se ha comentado que los aportes de vitamina D a través de la dieta son muy escasos, y en España está muy poco extendido el uso de alimentos suplementados con vitamina D.
Por todo lo anteriormente expuesto, parte de la población infantil presenta una serie de condiciones que la exponen a un riesgo elevado de déficit de vitamina D. En la tabla 1 se exponen todas estas situaciones de riesgo.

Rango óptimo de vitamina D
La 25(OH)D sérica es la principal forma de vitamina D circulante y es el mejor indicador nutricional de vitamina D. Su vida media es de 2-3 semanas1,9. Por el contrario, el metabolito 1,25(OH)2D no es un buen indicador, porque tiene una vida media mucho menor (de 4 h13 a 24 h1), se encuentra en menores cantidades circulantes y su concentración puede ser normal o incluso alta en situación de déficit de vitamina D como consecuencia del hiperparatiroidismo secundario9.
Debido a los diferentes métodos de laboratorio utilizados para medir la concentración de 25(OH)D, y a las dificultades para establecer los límites de referencia de normalidad para todos los grupos de edad de la población, actualmente no existe consenso con respecto a la concentración sérica que define la insuficiencia de vitamina D para lactantes y niños3.
La mayoría de los autores consideran déficit de vitamina D cuando la concentración de 25(HO)D es menor de 50 nmol/L (< 20 ng/mL) y consideran que puede existir cierta insuficiencia de vitamina D cuando la concentración de 25(HO)D está en 50-80 nmol/L (20-30 ng/mL)1,3,76. Estos datos están basados en los niveles circulantes de 25(OH)D a partir de los cuales la concentración de hormona paratiroidea sérica en adultos se estabiliza en forma de meseta77-80, y en los niveles de 25(OH)D que parece que optimizan la absorción del calcio intestinal en mujeres postmenopáusicas81 y la densidad mineral ósea40,42.
La deficiencia grave y crónica de vitamina D provoca en los niños anomalías óseas típicas del raquitismo, pero probablemente los casos de raquitismo clínico sean la punta del iceberg de una población mayor con deficiencia subclínica de vitamina D. El raquitismo solo se produce si la deficiencia persiste durante muchos meses. De todas formas, en el informe publicado en 2007 “Effectiveness and safety of vitamin D in relation to bone health”82 se concluye que las pruebas en relación con la enfermedad ósea y la vitamina D son mucho más consistentes en los adultos y ancianos que en los lactantes, niños y adolescentes. Además, insisten en que, como ya se ha referido, se desconoce con exactitud la concentración de 25(OH)D asociada con raquitismo, en parte por la escasez de estudios y en parte por la poca precisión de las pruebas utilizadas para su determinación. Sin embargo, una cifra para definir la deficiencia grave, según el consenso Australiano y de Nueva Zelanda de 20065, podría ser < 12,5 nmol/L (< 5 ng/mL), ya que con esas cifras el 90% de los niños presentan hipocalcemia y el 70% raquitismo.
Diversos estudios de distintas partes del mundo (incluida España) muestran que un gran número de niños y adolescentes presenta una concentración sérica de 25(HO)D supuestamente insuficiente, sin objetivarse en muchos casos alteraciones esqueléticas ni alteraciones en el metabolismo del calcio19,23. Todavía queda por determinar con pruebas consistentes qué efectos tiene este déficit subclínico, el cual, como se ha comentado previamente, se ha asociado a múltiples patologías crónicas.
Suplementación con vitamina D
Las referencias históricas12,83 mostraban cómo la dosis de 400 UI/día era eficaz para prevenir el raquitismo en niños lactados al pecho y en población de piel oscura, y con esta dosis se mantenían niveles de 25(OH)D mayores de 50 nmol/L. También se demostró cómo con niveles de 25(OH)D menores de 50 nmol/L se producían aumentos de fosfatasa alcalina84,85 (que se eleva cuando existe déficit de vitamina D). En la revisión Cochrane también se muestra cómo la dosis de 400 UI/día parece eficaz para la prevención del raquitismo62.
En el año 200386, la Academia Americana de Pediatría recomendaba una dosis diaria de 200 UI/día de vitamina D para todos los lactantes, niños y adolescentes (suficiente para mantener niveles de 25(OH)D > 27,5 nmol/L); pero en el año 200887 la nueva dosis recomendada se ha elevado a 400 UI/día, que es la que ha demostrado mantener los niveles de 25 (OH)D por encima de 50 nmol/L (concentración recomendada actualmente)3,9.
Desde el año 2007, la Sociedad Pediátrica de Canadá88 recomienda una dosis de vitamina D de 400 UI/día para todos los niños durante su primer año de vida, elevando la dosis a 800 UI/día en invierno en aquellos niños que vivan en latitudes por encima de 55º Norte y entre la latitud 40º y 55º si presentan algún otro factor de riesgo de déficit de vitamina D. Además, insisten en la necesidad de nuevos estudios que analicen la dosis de vitamina D en relación con el peso, dado que los lactantes triplican su peso en el primer año de vida. Las recomendaciones de Australia y nueva Zelanda5, en el año 2006, también indican la profilaxis con vitamina D con 400 UI/día.
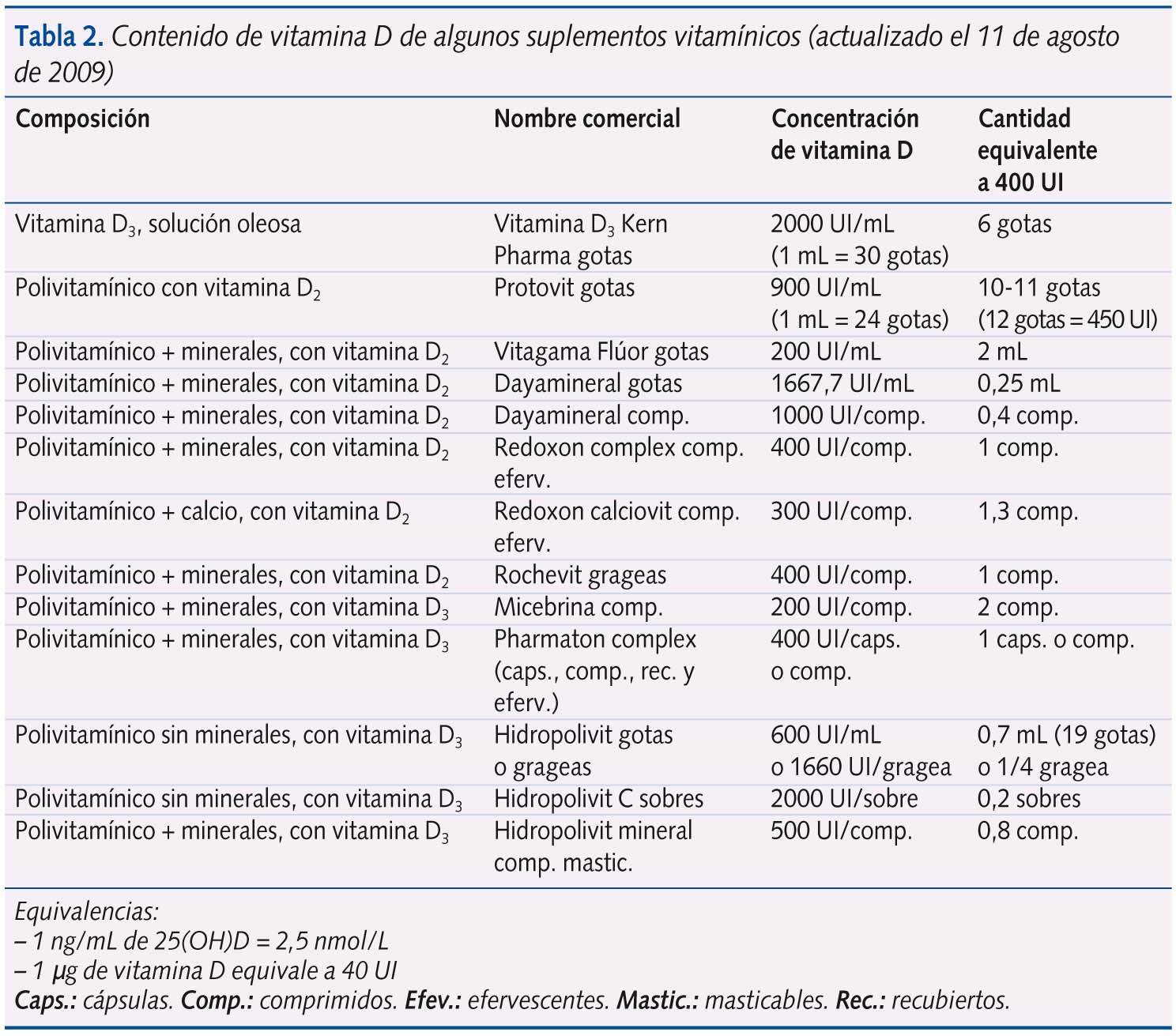
Por todo lo referido anteriormente, parece que la dosis adecuada de profilaxis es 400 UI/día. Los suplementos de vitamina D comercializados pueden estar preparados a partir de vitamina D2 o D3. Hay estudios que demuestran que la vitamina D3 puede ser de 1,789 hasta 3 veces90 más potente que la vitamina D2 en la capacidad de elevar los niveles de 25(OH)D, por lo que son principalmente recomendados los suplementos con vitamina D3 (tabla 2). Un microgramo de vitamina D equivale a 40 UI.
Situaciones especiales
- Los niños alimentados con fórmulas artificiales y que ingieran 1 L de leche al día, recibirán aproximadamente 400 UI/día de vitamina D, ya que esta es la cantidad aproximada de vitamina D por litro que contienen la mayoría de las fórmulas comercializadas en España (aunque puede variar entre 330 y 960 UI de vitamina D/L). Hay casos descritos de raquitismo en niños de piel oscura alimentados con fórmula artificial pero, aunque no se proporciona información sobre la cantidad de leche artificial que tomaban13-17, probablemente no llegara al litro.
- En niños prematuros se ha realizado un ensayo clínico en relación con la profilaxis con vitamina D. Se ha demostrado que precisan una cantidad de vitamina D desde 200 UI/kg/día hasta un máximo de 400 UI/día91.
- En ciertas circunstancias, en adolescentes de especial riesgo, puede aconsejarse la ingesta de alimentos suplementados con vitamina D (algunos zumos, galletas, margarina y leche).
Recomendaciones de PrevInfad
Aunque hay aspectos todavía sin esclarecer, hasta que haya nuevos datos disponibles parece razonable establecer las siguientes recomendaciones:
- Los lactantes menores de un año lactados al pecho deben recibir un suplemento de 400 UI/día de vitamina D, cuya administración se iniciará durante los primeros días de vida. Estos suplementos se administrarán hasta que el niño ingiera 1 L diario de fórmula artificial, ya que todas las fórmulas están enriquecidas con vitamina D (Recomendación grado B).
- Todos los lactantes menores de un año alimentados con fórmula artificial que ingieren menos de 1 L diario de fórmula, han de recibir un suplemento de vitamina D de 400 UI/día (Recomendación grado B).
- A los niños mayores de un año o adolescentes, de forma general, se les recomienda para la adecuada producción de vitamina D la exposición diaria al sol de medio día sin protección durante 10-15 minutos durante la primavera, el verano y el otoño. En invierno, por encima de 42º de latitud no se producirá vitamina D (Recomendación grado I).
- Los niños prematuros menores de un año de edad corregida precisan una ingesta de vitamina D de 200 UI/kg/día hasta un máximo de 400 UI/día (Recomendación grado A).
Bibliografía
- Wagner CL, Taylor SN, Hollis BW. Does vitamin D make the world go ‘round’? Breastfeed Med. 2008;3:239-50.
- Reichrath J. The challenge resulting from positive and negative effects of sunlight: how much solar UV exposure is appropriate to balance between risks of vitamin D deficiency and skin cancer? Prog Biophys Mol Biol. 2006;92:9-16.
- Wagner CL, Greer FR. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents. Pediatrics. 2008;122:1142-52.
- Holick MF. Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease. Am J Clin Nutr. 2004;80:1678S-88S.
- Munns C, Zacharin MR, Rodda CP, Batch JA, Morley R, Cranswick NE et al. Prevention and treatment of infant and childhood vitamin D deficiency in Australia and New Zealand: a consensus statement. Med J Aust. 2006;185:268-72.
- Holick MF. Vitamin D: A millenium perspective. J Cell Biochem. 2003;88:296-307.
- Young MV, Schwartz GG, Wang L, Jamieson DP, Whitlatch LW, Flanagan JN et al. The prostate 25-hydroxyvitamin D-1 alpha-hydroxylase is not influenced by parathyroid hormone and calcium: implications for prostate cancer chemoprevention by vitamin D. Carcinogenesis. 2004;25:967-71.
- Holick MF. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis. Am J Clin Nutr. 2004;79:362-71.
- Misra M, Pacaud D, Petryk A, Collett-Solberg PF, Kappy M; Drug and Therapeutics Committee of the Lawson Wilkins Pediatric Endocrine Society. Vitamin D deficiency in children and its management: review of current knowledge and recommendations. Pediatrics. 2008;122:398-417.
- Wharton B, Bishop N. Rickets. Lancet. 2003;362:1389-400.
- Dunn PM. Francis Glisson (1597-1677) and the “discovery” of rickets. Arch Dis Child Fetal Neonatal Ed. 1998;78:F154-5.
- Hess AF, Unger LJ. Prophylactic therapy for Rickets in a negro community. JAMA. 1017;69:1583.
- Nozza JN, Rodda C. Vitamin D deficiency in mothers of infants with rickets. MJA. 2001;175:253-5.
- Callaghan AL, Moy RJD, Booth IW, Debelle G, Shaw NJ. Incidence of symptomatic vitamin D deficiency. Arch Dis Child. 2006;91:606-7.
- Robinson PD, Högler W, Craig ME, Verge CF, Walker JL, Piper AC, et al. The re-emerging burden of rickets: a decade of experience from Sydney. Arch Dis Child. 2006;91:564-8.
- Lazol JP, Cakan N, Kamat D. 10 year case review of nutritional rickets in Children´s Hospital of Michigan. Clinical Ped. 2008;47:379-84.
- Yeste D, Carrascosa A. Raquitismo carencial en la infancia: análisis de 62 casos. Med Clin (Barc). 2003;121:23-7.
- Cabezuelo G, Abeledo A, Frontera P. Deficiencia de vitamina D en una madre lactante y raquitismo grave en su hijo. An Pediatr (Barc). 2005;63:561-8.
- Gessner BD, Plotnik K, Muth P. 25-Hydroxyvitamin D levels among healthy children in Alaska. J Pediatr. 2003;143:434-7.
- Challa A, Ntourntoufi A, Cholevas V, Bitsori M, Galanakis E, Andronikou S. Breastfeeding and vitamin D status in Greece during the first 6 months of life. Eur J Pediatr. 2005;164:724-9.
- Ziegler EE, Hollis BW, Nelson SE, Jeter JM. Vitamin D deficiency in breastfed infants in Iowa. Pediatrics. 2006;118:603-10.
- Gordon C, Feldman HA, Sinclair L. Prevalence of vitamin D deficiency among healthy infants and toddlers. Arch Pediatr Adoles Med. 2008;162:505-12.
- Cabezuelo G, Vidal S, Abedelo A, Frontera P. Niveles de 25 hidroxivitamina en lactantes. Relación con la lactancia materna. An Pediatr (Barc). 2007;66:491-5.
- Bonet M, López N, Besora R, Herrero S, Esteban E, Seidel V. Raquitismo en inmigrantes asiáticos en período puberal. An Esp Pediatr. 2002;57:264-7.
- Rovner AJ, Kimberly O. Hypovitaminosis D among healthy children in the United States. A review of the current evidence. Arch Pediatr Adolesc Med. 2008;162:513-9.
- Docio S, Riancho JA, Pérez A, Olmos JM, Amado JA, González-Macías J. Seasonal deficiency of vitamin D in children: a potential target for osteoporosis-preventing strategies? J Bone Miner Res. 1998;13:544-8.
- Tangpricha V, Pearce EN, Chen TC, Holick MF. Vitamin D insufficiency among free living healthy young adults. Am J Med. 2002;112:659-62.
- Del Arco C, Riancho JA, Luzuriaga C, González-Macías J, Florez J. Vitamin D status in children with Down Syndrome. J Intellect Disabil Res. 1992;36:251-7.
- Liu PT, Stenger S, Li H, Wenzel L, Tan BH, Krutzik SR et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science. 2006;311:1770-3.
- Martineau AR, Wilkinson RJ, Wilkinson KA, Newton SM, Kampmann B, Hall BM et al. A single dose of vitamin D enhances immunity to mycobacteria. Am J Respir Crit Care Med. 2007;176:208-13.
- Rehman PK. Sub-clinical rickets and recurrent infection. J Trop Pediatr. 1994;40:58.
- Hayes CE. Vitamin D: a natural inhibitor of multiple sclerosis. Proc Nutr Soc. 2000;59:531-5.
- Munger KL, Zhang SM, O’Reilly E, Hernán MA, Olek MJ, Willett WC et al. Vitamin D intake and incidence of multiple sclerosis. Neurology. 2004;62:60-5.
- Kimball SM, Ursell MR, O’Connor P, Vieth R. Safety of vitamin D3 in adults with multiple sclerosis. Am J Clin Nutr. 2007;86:645-51.
- Merlino LA, Curtis J, Mikuls TR, Cerhan JR, Criswell LA, Saag KG; Iowa Women’s Health Study. Vitamin D intake is inversely associated with rheumatoid arthritis: results from the Iowa Women’s Health Study. Arthritis Rheum. 2004;50:72-7.
- Grant WB. An estimate of premature cancer mortality in the U.S. due to inadequate doses of solar ultraviolet-B radiation. Cancer. 2002;94:1867-75.
- Garland FC, Garland CF, Gorham ED, Young JF. Geographic variation in breast cancer mortality in the United States: a hypothesis involving exposure to solar radiation. Prev Med. 1990;19:614-22.
- Lefkowitz ES, Garland CF. Sunlight, vitamin D, and ovarian cancer mortality rates in US women. Int J Epidemiol. 1994;23:1133-6.
- Giovannucci E, Liu Y, Rimm EB, Hollis BW, Fuchs CS, Stampfer MJ et al. Prospective study of predictors of vitamin D status and cancer incidence and mortality in men. J Natl Cancer Inst. 2006;98:451-9.
- Bischoff-Ferrari HA, Dietrich T, Orav EJ, Dawson-Hughes B. Positive association between 25-hydroxy vitamin D levels and bone mineral density: a population-based study of younger and older adults. Am J Med. 2004;116:634-9.
- Outila TA, Karkkainen MU, Lamberg-Allardt CJ. Vitamin D status affects serum parathyroid hormone concentrations during winter in female adolescents: associations with forearm bone mineral density. Am J Clin Nutr. 2001;74:206-10.
- Meier C, Woitge HW, Witte K, Lemmer B, Seibel MJ. Supplementation with oral vitamin D3 and calcium during winter prevents seasonal bone loss: a randomized controlled open-label prospective trial. J Bone Miner Res. 2004;19:1221-30.
- Dawson-Hughes B, Harris SS, Krall EA, Dallal GE. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N Engl J Med. 1997;337:670-6.
- Chapuy MC, Arlot ME, Duboeuf F, Brun J, Crouzet B, Arnaud S et al. Vitamin D3 and calcium to prevent hip fractures in the elderly women. N Engl J Med. 1992;327:1637-42.
- Krause R, Bühring M, Hopfenmüller W, Holick MF, Sharma AM. Ultraviolet B and blood pressure. Lancet. 1998;352:709-10.
- Forman JP, Giovannucci E, Holmes MD, Bischoff-Ferrari HA, Tworoger SS, Willett WC et al. Plasma 25-hydroxyvitamin D levels and risk of incident hypertension. Hypertension. 2007;49:1063-9.
- Zittermann A, Schleithoff SS, Koerfer R. Putting cardiovascular disease and vitamin D insufficiency into perspective. Br J Nutr. 2005;94:483-92.
- Zittermann A, Schleithoff SS, Koerfer R. Vitamin D insufficiency in congestive heart failure: why and what to do about it? Heart Fail Rev. 2006;11:25-33.
- Giovannucci E, Liu Y, Hollis BW, Rimm EB. 25-hydroxyvitamin D and risk of myocardial infarction in men: a prospective study. Arch Intern Med. 2008;168:1174-80.
- Qiao G, Kong J, Uskokovic M, Li YC. Analogs of 1alpha,25-dihydroxyvitamin D(3) as novel inhibitors of renin biosynthesis. J Steroid Biochem Mol Biol. 2005;96:59-66.
- Carthy EP, Yamashita W, Hsu A, Ooi BS. 1,25-Dihydroxyvitamin D3 and rat vascular smooth muscle cell growth. Hypertension. 1989;13:954-9.
- Lee JH, O’Keefe JH, Bell D, Hensrud DD, Holick MF. Vitamin D deficiency an important, common, and easily treatable cardiovascular risk factor? J Am Coll Cardiol. 2008;52:1949-56.
- The EURODIAB Substudy 2 Study Group. Vitamin D supplement in early childhood and risk for Type I (insulin-dependent) diabetes mellitus. Diabetologia. 1999;42:51-4.
- Hypponen E, Läärä E, Reunanen A, Järvelin MR, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet. 2001;358:1500-3.
- Harris SS. Vitamin D in type 1 diabetes prevention. J Nutr. 2005;135:323-5.
- Fronczak CM, Barón AE, Chase HP, Ross C, Brady HL, Hoffman M et al. In utero dietary exposures and risk of islet autoimmunity in children. Diabetes Care. 2003;26:3237-42.
- Chiu KC, Chu A, Go VL, Saad MF. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction. Am J Clin Nutr. 2004;79:820-5.
- Pittas AG, Dawson-Hughes B, Li T, Van Dam RM, Willett WC, Manson JE et al. Vitamin D and calcium intake in relation to type 2 diabetes in women. Diabetes Care. 2006;29:650-6.
- McGrath J, Selten JP, Chant D. Long-term trends in sunshine duration and its association with schizophrenia birth rates and age at first registration—data from Australia and the Netherlands. Schizophr Res. 2002;54:199-212.
- Murphy PK, Wagner CL. Vitamin D and mood disorders among women: an integrative review. J Midwifery Womens Health. 2008;53:440-6.
- McKinlay A. Workshop round-up session rapporteur’s report. Prog Biophys Mol Biol. 2006;92:179-84.
- Lerch C, Meissner T. Intervenciones para la prevención del raquitismo nutricional en niños nacidos a término (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. (Traducida de The Cochrane Library, 2008 Issue 3. Chichester, UK: John Wiley & Sons, Ltd.) Disponible en: http://www.update-software.com.
- Beser E, Cackmakci T. Factors affecting the morbidity of vitamin D deficiency and primary protection. East African Med J. 1994;71:358-62.
- Strand MA, Peng Z, Zhang P, Lee G. Preventing rickets in locally appropriate ways: a case report from North China. International Quarterly of Community Health Education. 2003;21:297-322.
- Pettifor JM. Rickets and vitamin D deficiency in children and adolescents. Endocrinol Metab Clin North Am. 2005;34:537-53.
- American Academy of Pediatrics. Committee on Environmental Health. Ultraviolet light: a hazard to children. Pediatrics. 1999;104:328-33.
- Lucas RM, Ponsonby AL. Considering the potential benefits as well as adverse effects of sun exposure: can all the potential benefits be provided by oral vitamin D supplementation? Prog Biophys Mol Biol. 2006;92:140-9.
- Grant WB, Garland CF, Holick MF. Comparisons of estimated economic burdens due to insufficient solar ultraviolet irradiance and vitamin D and excess solar UV irradiance for the United States. Photochem Photobiol. 2005;81:1276-86.
- Wolpowitz D, Gilchrest BA. The vitamin D questions: how much do you need and how should you get it? J Am Acad Dermatol. 2006;54:301-17.
- Hollis BW. Circulating 25-hydroxyvitamin D levels indicative of vitamin D sufficiency: implications for establishing a new effective dietary intake recommendation for vitamin D. J Nutr. 2005;135:317-22.
- Matsuoka LY, Wortsman J, Haddad JG, Hollis BW. In vivo threshold for cutaneous synthesis of vitamin D3. J Lab Clin Med. 1989;114:301-5.
- Lakdawala DR, Widdowson EM. Vitamin D in human milk. Lancet. 1977;1:167-8.
- American Academy of Pediatrics. Committee on Nutrition, Nutrition Committee of the Canadian Pediatric Society Breastfeeding. Pediatrics. 1978;62:591-601.
- American Academy of Pediatrics. Committee on Nutrition. Nutrition and Lactation. Pediatrics. 1981;68:435-43.
- Reeve LE, De Luca HF, Schnoes HK. Synthesis and biological activity of vitamin D3-sulfate. J Biol Chem. 1982;256:823-36.
- Holick MF, Chen TC. Vitamin D deficiency: a worldwide problem with health consequences. Am J Clin Nutr. 2008;87:1080S-6S.
- Chapuy MC, Preziosi P, Maamer M, Arnaud S, Galan P, Hercberg S et al. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int. 1997;7:439-43.
- Peacock M. Effects of calcium and vitamin D insufficiency on the skeleton. Osteoporos Int. 1998;8:S45-51.
- Dawson-Hughes B, Harris SS, Dallal GE. Plasma calcidiol, season, and serum parathyroid hormone concentrations in healthy elderly men and women. Am J Clin Nutr. 1997;65:67-71.
- Lamberg-Allardt CJ, Outila TA, Kärkkainen MU, Rita HJ, Valsta LM. Vitamin D deficiency and bone health in healthy adults in Finland: could this be a concern in other parts of Europe? J Bone Miner Res. 2001;16:2066-73.
- Heaney RP, Dowell MS, Hale CA, Bendich A. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr. 2003;22:142-6.
- Agency for Healthcare Research and Quality U.S. Department of Health and Human Services. University of Ottawa. Evidence-based Practice Center. Effectiveness and safety of vitamin D in relation to bone health. Evidence report/Technology Assessment nº 158. August 2007. [En línea.] [Consultado el 11/05 2010.] Disponible en www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=hstat1b.chapter.73328.
- Park E. The therapy of rickets. JAMA. 1940;115:370-9.
- Jones G, Blizzard C, Riley MD, Parameswaran V, Greenaway TM, Dwyer T. Vitamin D levels in prepubertal children in Southern Tasmania: prevalence and determinants. Eur J Clin Nutr. 1999;53:824-9.
- Jones G, Dwyer T, Hynes KL, Parameswaran V, Greenaway TM. Vitamin D insufficiency in adolescent males in Southern Tasmania: Prevalence, determinants, and relationship to born turnover markers. Osteoporos Int. 2005;16:636-41.
- American Academy of Pediatrics. Committee on Nutrition, Section of Breastfeeding Medicine. Prevention of rickets and vitamin D deficiency: New guidelines for vitamin D intake. Pediatrics. 2003;111:908-10.
- American Academy of Pediatrics. Committee on Nutrition, Section of Breastfeeding. Wagner CL, Greer FR. Prevention of rickets and vitamin D deficiency in infants, children and adolscents. Pediatrics. 2008;122:1142-52.
- Vitamin D supplementation: Recommendations for Canadian mothers and infants. Paediatr Child Health, 2007;12:583-98.
- Trang HM, Cole DE, Rubin LA, Pierratos A, Siu S, Vieth R. Evidence that vitamin D3 increases serum 25-hydroxyvitamin D more efficiently than does vitamin D2. Am J Clin Nutr. 1998;68:854-8.
- Armas LA, Hollis BW, Heaney RP. Vitamin D2 is much less effective than vitamin D3 in humans. J Clin Endocrinol Metab. 2004;89:5387-91.
- Backstrom MC, Mäki R, Kuusela AR, Sievänen H, Koivisto AM, Ikonen RS et al. Randomised controlled trial of vitamin D supplementation on bone density and biochemical indices in preterm infants. Arch Dis Child Fetal Neonatal Ed. 1999;80:F161-6.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.





