Vol. 12 - Num. 47
Originales
La Prueba de Tuberculina en población pediátrica inmigrada
Rosa María Masvidal Alibercha, Arantxa Aliaga Ugarteb, Beatriz Miguel Gilc, A Estabanell Buxód, E de Frutos Gallegoe, C Cruz Rodríguezf, M.ª Dolors Riera Vidalg
aPediatra. CAP Lluís Sayé. Raval Nord. ICS. Barcelona. España.
bPediatra. CAP Castelldefels. ABS Castelldefels. ICS. Castelldefels. Barcelona. España.
cEnfermera pediátrica. CAP Lluís Sayé. Raval Nord. ICS. Barcelona. España.
dPediatra. CAP Gòtic (Anexo Rull). ICS. Barcelona. España.
ePediatra. ABS Raval Nord. Barcelona. España.
fEnfermera pediátrica. CAP Gòtic (Anexo Rull). ICS. Barcelona. España.
gPediatra. CAP Drassanes. Raval Sur. ICS. Barcelona. España.
Correspondencia: RM Masvidal . Correo electrónico: rmmasvidal.bcn.ics@gencat.cat
Cómo citar este artículo: Masvidal Aliberch RM, Aliaga Ugarte A, Miguel Gil B, Estabanell Buxó A, de Frutos Gallego E, Cruz Rodríguez C, et al. La Prueba de Tuberculina en población pediátrica inmigrada. Rev Pediatr Aten Primaria. 2010;12:399-411.
Publicado en Internet: 30-09-2010 - Número de visitas: 25953
Resumen
Introducción: la inmigración ha hecho aumentar la prevalencia de la infección tuberculosa latente, por tanto es interesante conocer los resultados de la Prueba de Tuberculina (PT) en la población infantil inmigrada.
Pacientes y método: Estudio multicéntrico, transversal y descriptivo. Se realizó la PT a niños de 6 meses a 15 años de Países de Baja Renta (PBR) que hacia menos de 12 meses que habían inmigrado. Se estudió algunos factores relacionados con el resultado de la PT y el cumplimiento de su lectura.
Resultados: De 1009 niños, presentaron una PT positiva el 6,1% (Intervalo de confianza 95%: 4,7-7,7). El 83% con cicatriz de BCG tenían 0mm de induración. Hubo mayor prevalencia de PT positiva entre los vacunados BCG hacía más de 3 años. La PT positiva aumentaba con la edad. No hubo asociación significativa entre la PT positiva y el sexo, nivel cultural de los padres ni hacinamiento en nuestro país. Todos los niños con contacto con bacilífero tuvieron la PT positiva. No se leyó la PT en el 3,7%, lo que se asoció con el índice de hacinamiento >2 y con que el padre no trabajase. No se observó diferencia estadísticamente significativa entre la negatividad de la PT y la presencia o no de parasitación intestinal.
Conclusiones: Consideramos indicada la realización de la PT a niños inmigrados de PBR.
Palabras clave
● Emigrantes e inmigrantes ● Infección tuberculosa latente ● Tuberculina ● TuberculosisNota:
Este estudio ha recibido el soporte institucional y económico del Pla Director d'Immigració en l'Àmbit de la Salut, del Departament de Salut de la Generalitat de Catalunya a través de l’Institut d’Investigació i Recerca en Atenció Primària (IDIAP Jordi Gol).
Introducción
La tuberculosis (TBC) es una enfermedad, predominantemente respiratoria, producida por el Mycobacterium tuberculosis. Causa cerca de 1,6 millones de fallecimientos anuales y su control y erradicación es una prioridad desde el punto de vista sanitario 1.
El grado de endemia de TBC está en relación con la situación socio-sanitaria de cada país. La mayoría de los países de baja renta (PBR) tienen altos índices de infección TBC 1, adquiriéndose con frecuencia en la infancia. El niño infectado puede sufrir la enfermedad, en ocasiones la padece en sus formas más graves (meníngea o miliar), pero en gran parte de los casos los bacilos mantienen un largo periodo de latencia y evolucionan o no a enfermedad durante la vida adulta. En caso de enfermedad, el niño difícilmente contagia, es el enfermo adulto quien transmite la infección manteniendo la endemia2.
Se han seguido dos estrategias para el control de la TBC: la vacunación BCG, y el diagnóstico y tratamiento precoces, tanto de la infección tuberculosa latente (ITL) como de la enfermedad. Esta última estrategia ha sido la más seguida en el Estado Español, basándose en una endemia media / baja, un sistema público de salud potente y en el hecho de que la vacuna BCG, aunque evita las formas graves de la enfermedad en la infancia, no es eficaz para eliminar la endemia2. Siguiendo esta política de control de la TBC, es importante la detección precoz de los individuos infectados3, 4, 5.
Para el diagnóstico de la ITL se realiza la Prueba de Tuberculina (PT) que se basa en la reacción que se produce después de la inyección intradérmica de un extracto proteico purificado (PPD) de Mycobacterium tuberculosis. Para valorar el resultado de la PT se mide el diámetro transversal al eje del brazo de la induración producida en el lugar de la inyección, en mm., trascurridas entre 48 y 96 horas2. Es sabido que la administración de la BCG puede interferir en el resultado de la PT, también se han relacionado otros factores como la parasitación intestinal6. Los valores de la induración que indican una ITL se marcan por consenso entre expertos.
La inmigración procedente de PBR ha hecho aumentar la incidencia de la enfermedad tuberculosa y la prevalencia de la ITL en algunas zonas7. Por este motivo nos planteamos este estudio con el objetivo de conocer la prevalencia de la PT positiva en la población infantil recientemente inmigrada de PBR, estudiar los factores asociados a las PT positivas8-16 y al incumplimiento de su lectura, así como la repercusión de la parasitación intestinal en el resultado.
Material y métodos
Estudio descriptivo clínico-epidemiológico observacional transversal que incluía población inmigrante de entre 6 meses y 15 años, que hacía menos de un año que habían llegado a Cataluña procedentes de un PBR y que fueron visitados por primera vez entre el 1 de Diciembre de 2005 y el 1 de Diciembre de 2006 por alguno de lospediatras participantes en el estudio. Participaron 69 pediatras y enfermeras voluntarios de Cataluña.
Se han considerado PBR todos excepto Estados Unidos de América, Canadá, Japón, Australia, Nueva Zelanda y Europa Occidental.
Criterios de exclusión: Procedencia de PBR pero de zonas con características similares a los países de renta alta. Negativa de los padres o tutores a la realización de la PT.
La muestra se calculó para valorar el resultado de la PT y de otras determinaciones que también formaban parte del Programa de Atención al Niño Inmigrante (PANI)17, considerando un riesgo alfa del 5% y una precisión de 20, obteniéndose la n de 854.
Variables principales: Resultado de la PT en mm. Antecedente de vacunación BCG; tiempo transcurrido entre la vacunación BCG y la PT (más/ menos de 3 años); antecedente de PT previa; lectura de la PT (si/ no, tiempo trascurrido desde la realización de la PT); antecedentes de contacto con enfermo tuberculoso; sintomatología o no de tuberculosis; posible inmunodeficiencia.
Variables asociadas: Sexo, edad, país de procedencia, índice de hacinamiento (nº de personas que conviven en un domicilio/ nº de habitaciones del domicilio, excluyendo cocina, baño y recibidor: alto: >2); estudios de los padres y su situación laboral; si entienden o no nuestro idioma. Presencia o no de eosinofilia sanguínea y resultado del análisis coproparasitológico.
El estudio coproparasitológico se realizó, en la mayoría de los casos, con una única muestra y bien con técnicas de concentración (Formol-éter o variantes: Formol-Acetato de etilo, SAF-éter, SAF-Acetato de etilo) o sin concentración (MIF, fresco, SAF).
Las procedencias fueron agrupadas en: Magreb, África Subsahariana, antigua URSS, otros de Europa del Este, Indo-Pakistán (incluye India, Pakistán y Bangla Desh), otros de Asia, América del Sur, Centro América y Caribe.
Se facilitó un Libro del Investigador con instrucciones para la valoración y registro de las variables.
La PT fue realizada por enfermeras de pediatría, siguiendo la técnica de Mantoux, con 2 unidades de tuberculina PPD (RT-23), midiéndose el diámetro trasversal al eje del brazo de la induración producida, en mm, preferentemente entre las 48 y 72 horas.
Definimos PT positiva aquella cuyo resultado es sugestivo de ITL, basándonos en lo propuesto por el Grupo de Trabajo de Tuberculosis de la Sociedad de Infectología Pediátrica de la Asociación Española de Pediatría (AEP) en el 20036 (Tabla 1).

Se realizaron radiografías de tórax de frente y de perfil a los niños con una PT >4 mm, independientemente de si estaban o no vacunados con BCG.
La vacunación BCG se valoró como “segura” por la visualización de la cicatriz, “probable” en caso de constar en un documento fiable, “dudosa” en caso de que así fuera, y “no realizada”.
Se recogieron las variables del estudio mediante un cuestionario y se introdujeron en una base de datos (Easytrials®) comunicada a través de Internet.
Se realizó un estudio descriptivo, etiquetado y control de la calidad de los datos.
Se incluyó media, mediana, rango, desviación típica, percentil P25 y P75, proporciones e intervalos de confianza del 95%; pruebas de normalidad y gráficos de dispersión. Les prevalencias se describieron de manera global y estratificadas por edad, sexo y país de origen. Se aplicó la prueba xi cuadrado y /o prueba exacta de Fisher, según cumplimiento de las condiciones de aplicación de cada una de ellas. Las variables cuantitativas se compararon mediante la prueba de T de Student o U de Mann-Whitney si no cumplían el supuesto de normalidad. Para comparar variables en más de dos grupos se aplicó el análisis de la variancia o la prueba H de Kruskal-Wallis.
Se utilizó el paquete estadístico SPSS® para Windows® versión 13 y el programa de cálculo de intervalos de confianza CIA®.
El diseño del estudio fue revisado y recibió la autorización del Comité de Ética del Institut d’Investigació en Atenció Primària Jordi Gol.
Resultados
Durante el periodo de la recogida de datos se visitaron 1226 niños/niñas que cumplían con los requisitos del estudio.
Presentan cicatriz de BCG 758 niños/niñas, en 101 la vacunación es probable y en 34 dudosa, 111 se consideraran no vacunados, en el resto no consta o no se sabe.
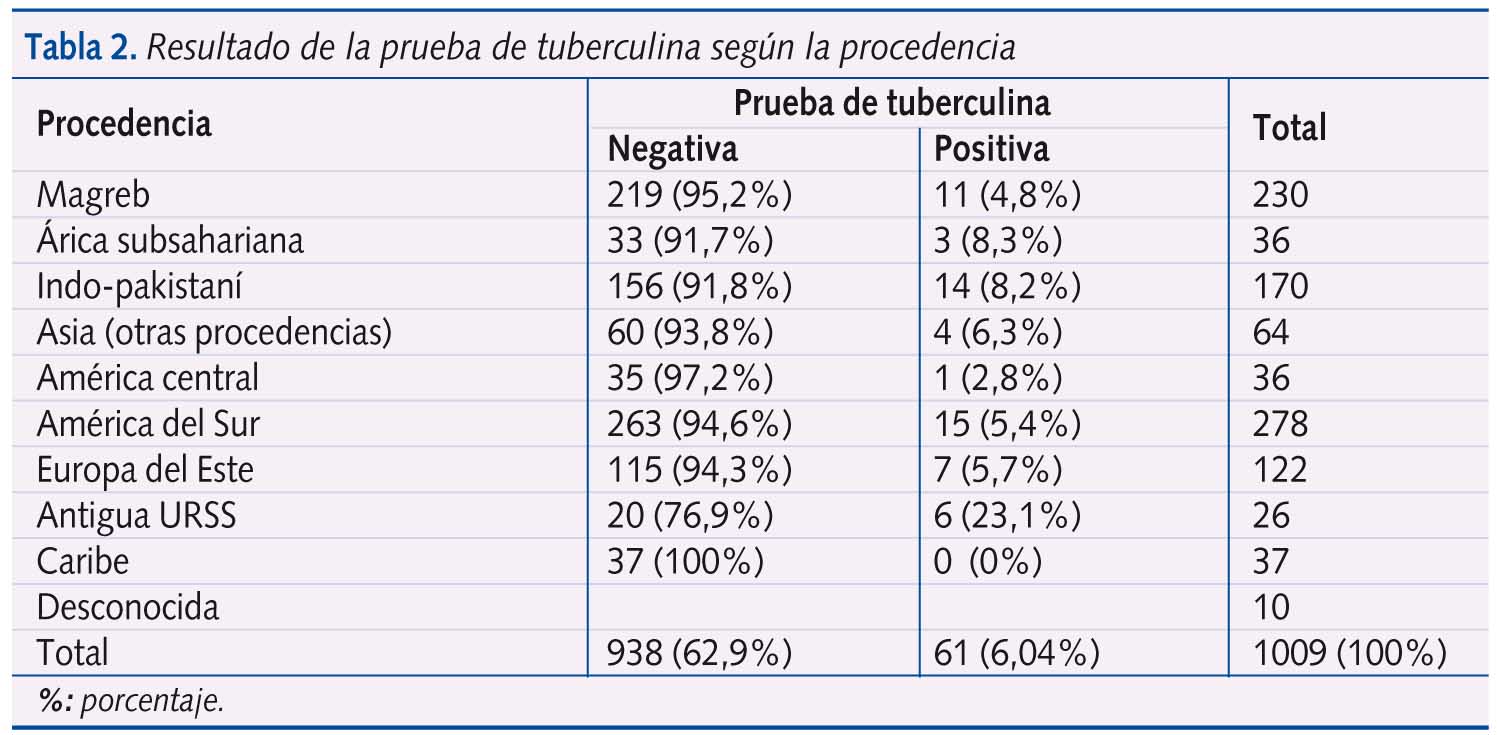
De los 1226 niños, al 14,6% no se les ha practicado PT y un 3,2% no ha acudido a su lectura. Así se han considerado válidos 1009 niños, la distribución de los cuales, según países de origen, se plasma en la Tabla 2.
Presentan una PT positiva el 6,1% con un Intervalo de Confianza del 95% (IC95%): 4,7%-7,7%. Considerando positiva la induración de 10 o más mm. independientemente del tiempo transcurrido desde la vacunación BCG, hay 64 casos positivos (6,3%), no siendo la diferencia significativa en relación al resultado siguiendo los criterios del estudio.
En la tabla II se muestran los resultados de las prevalencias de la PT positiva según la procedencia. Excluyendo los casos de la Antigua URSS y los del Caribe, no hay diferencias significativas.
La edad media de los niños con PT positiva es significativamente mayor (p<0.0001). La prevalencia de PT positiva aumenta con la edad: test de tendencia lineal con p<0,0001 (tabla 3).
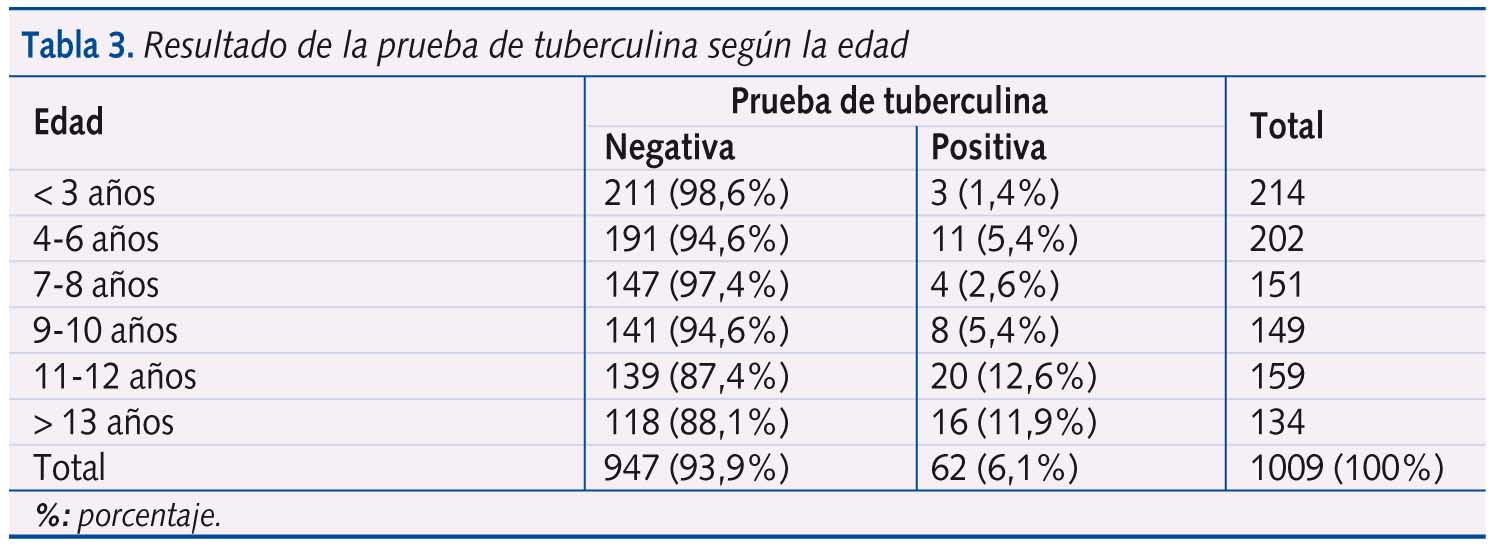
De todas las variables estudiadas, observamos diferencias estadísticamente significativas en la prevalencia de positividad de la PT respecto la edad y el tiempo transcurrido desde la vacunación por BCG. La estimación de la prevalencia ajustada por estas dos variables es 5,1 (IC 95%: 3,3-7,6).
La prevalencia de PT positiva no se asocia estadísticamente al sexo, nivel cultural de los padres ni hacinamiento en nuestro país.
En 6 niños se conoce contacto con un adulto bacilífero, presentando todos ellos una PT positiva.
No se ha encontrado ningún caso de enfermedad tuberculosa.
Considerando positiva la induración de 15 o más mm entre los vacunados de BCG “ciertos” y “probables” la prevalencia es de 3,11% (IC 95%: 2,06-4,48).
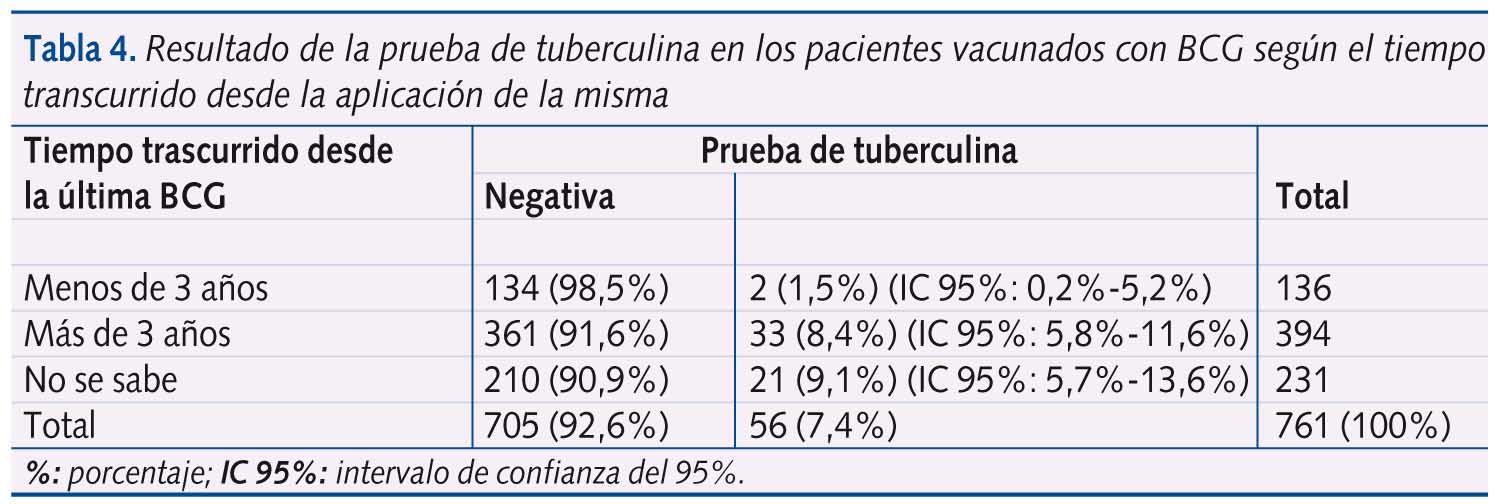
En 761 niños “vacunados” o “probablemente vacunados” consta el tiempo trascurrido desde la vacunación BCG y la PT, el resultado de ésta se visualiza en la tabla IV. Encontramos significación estadística en cuanto a positividad de la PT entre los que hacía más de 3 años de la vacunación respecto a los que hacía menos de tres años (p<0,0052). Entre 99 considerados como no vacunados la prevalencia de PT positiva es del 1% (IC95% 0-3).
Entre 656 con cicatriz de BCG, el 83% tienen 0 mm de induración en la PT, siendo este porcentaje del 88 % en los que hace menos de 3 años de la vacunación.
Entre los 612 pacientes en que se constata sólo una cicatriz de BCG, el 86,6% tienen una PT de 0 mm. En 42 casos se visualizó dos cicatrices y en dos pacientes más de dos, entre estos 44 casos un 59,1% tienen 0 mm de induración. La prevalencia de resultado de 0 mm en la PT entre los que tienen sólo una cicatriz fue estadísticamente superior a la de los que tienen dos o más cicatrices (p<0.00001). Un 11,4% de los niños con dos o más cicatrices presentan un resultado igual o superior a 10 mm (tabla 4).
La respuesta sobre si se les habían practicado PT previas al estudio consta en 828 casos. Se había aplicado a 18 niños en una ocasión, a 9 en más de una ocasión y a 17 niños esta aplicación previa era dudosa. Entre los que no se les había practicado una PT previa 50 (6,4%) son positivos; entre los 27 que tenían registrada una PT previa 3 se consideraron positivos (11,1%), con cifras de 12, 20 y 20mm.
Se ha realizado una segunda PT en 45 casos, esta repetición se realizó por criterio personal del pediatra responsable, siendo negativa en 39. Entre los 6 restantes solo dos se han considerado nuevamente como infectados (6mm-20mm y 0mm-12mm). La diferencia de induración entre la primera PT y la segunda es de 0 mm en 35 casos.
En cuanto a la lectura de la PT, consta no leída en 39 (3,7%), observándose significación estadística con respecto al índice de hacinamiento > 2 (p<0,05) y al hecho de que el padre no trabaje (p < 0,02). No se ha obtenido significación en cuanto a la procedencia, comprensión del lenguaje, estudios de los padres o al hecho de que la madre trabaje.
Un 82,9% de PT fueron leídas entre las 48 y 72 horas,4 poco antes de las 48 horas (3 negativas y una positiva) y 20 después de las 96 horas (3 positivas y 17 negativas, 14 de ellas con un valor de 0mm).
Se han analizado las heces de 883 niños. El tanto por ciento de positivos a la PT es mayor entre los que se detectó parasitación, pero no se observa diferencia estadísticamente significativa.
Entre 885 casos con PT negativa el 25,8% presentan eosinofília, entre 59 con PT positiva la presentaba el 42,4% (p=0,005).
Discusión
La diferencia de criterios para considerar la PT como positiva y el tipo de población estudiada hace que nuestro estudio no puede ser del todo comparable a otros. En Barcelona, durante el curso 2004-2005, se realizó cribado tuberculínico en el primer curso de primaria en todas las escuelas de la ciudad, considerándose positiva la PT, en niños no vacunados de BCG, a partir de 5 o más mm de induración, e igual o superior a 15 mm si habían sido vacunados; encontrando una prevalencia de positivos del 0,6%18. En otro estudio realizado en Galicia19 con criterios diagnósticos idénticos al anterior, se encontró una prevalencia general del 0,36%. En nuestro estudio, considerando el mismo criterio entre los vacunados, la prevalencia de la PT entre éstos fue del 3,11%, algo inferior que en un estudio realizado en Barcelona en el área del Raval20 que fue del 4,7%.
La interpretación de la PT en niños vacunados de BCG es difícil y controvertida ya que la BCG puede ser causa de reacción a la PT. Numerosos trabajos han sido realizados al respecto8-14. Un metanálisis publicado por Wang y colaboradores10 concluye que, en pacientes vacunados de BCG, la cifra de induración en la PT que determina una mayor especificidad para el diagnóstico de la ITL es la de 15 mm o más pero algunos autores no han encontrado diferencias estadísticamente significativas en el resultado de la PT entre los vacunados y no vacunados de BCG14. Ante esta controversia se optó seguir las recomendaciones del Grupo de Trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica de l’AEP del 20036 para la valoración de la PT.
En cuanto al efecto booster debido a PT previas, parece evidenciarse más en la lectura de la PT a las 48 horas y ser menor o insignificante en la lectura a las 72-96 horas11,13
No disponíamos en el momento de realizar nuestro estudio, y todavía no disponemos en el ámbito de la Atención Primaria, de otras pruebas diagnósticas más específicas que la PT para el diagnóstico de la ITL. Actualmente los test de detección de liberación de interferón gamma específico para el Mycobacterium tuberculosis (TIGRAs) ya están disponibles en algunos hospitales y Centros de Referencia en Tuberculosis. Se consideran técnicas caras y que precisan aún de estudios, pero su existencia es muy esperanzadora ya que nos permitiría diferenciar una PT positiva debida a la BCG de una PT positiva debida a ITL21-23. A pesar de ello creemos que la PT, por su facilidad de realización y bajo coste, será aún de elección, durante mucho tiempo, como prueba de cribado inicial de la ITL y que, con este fin, está indicada su aplicación en la población infantil inmigrante19,24,25.
Llama la atención el porcentaje de PT positivas entre los niños procedentes de la antigua URSS, lo cual no coincide con los datos de la OMS, y el no hallar ningún caso entre los procedentes del Caribe. El hecho de que ambas muestras sean pequeñas hace que se tengan que valorar estos resultados con prudencia.
El sexo, nivel cultural de los padres y el hacinamiento en nuestro país no se asociaron a mayor prevalencia de PT positiva, coincidiendo con otros autores15,16.
El contacto con un enfermo TBC es la variable más significativa relacionada con la positividad de la PT, hecho confirmado por todos los estudios.
No se ha encontrado ningún enfermo de tuberculosis, al contrario de otros estudios de cribado16,20 . Es posible que esto sea debido al poco tiempo transcurrido desde la llegada del niño y la realización del cribado.
Vistos los resultados, creemos que sería mejor considerar positiva en todos los niños sin factores de alto riesgo (contacto con bacilífero, clínica y radiología compatible, inmunodeprimidos) la PT igual o superior a 10 mm independientemente del tiempo trascurrido desde la vacunación BCG. Nos basamos en el alto porcentaje de resultados de 0mm en los niños en que se les había administrado la BCG hacia menos de tres años (89%). Esto coincide con el documento del Grupo de Trabajo de Tuberculosis de la Sociedad de Infectología Pediátrica de la AEP5 y otros autores3, 24.
Con las nuevas pruebas diagnósticas (TIGRAs) quizás ya ha llegado el momento en que no tengamos que aceptar el riesgo de diagnósticos erróneos de ITL basándonos únicamente en la PT. A pesar de ello, mientras no podamos disponer de estas nuevas pruebas diagnósticas, habremos de asumir el realizar tratamientos de ITL basándonos en una PT considerada positiva según los Criterios de lo Expertos y valorando individualmente el riesgo / beneficio. Esta individualización del caso es imprescindible en los pacientes vacunados más de una vez de BCG y a los que previamente se les haya practicado otra PT.
El porcentaje de individuos que no acudieron a la lectura fue del 3,7%, inferior a otros estudios27,28. Creemos que el trabajo de recaptación de las enfermeras de pediatría favoreció este resultado. Es de destacar que ni la procedencia de los niños ni el desconocimiento de nuestro idioma influyeron en el resultado.
No encontramos relación entre tener parásitos y el resultado de la PT. La presencia de parasitación intestinal se ha considerado como inhibidora de la reacción producida por la PT6. Revisando la bibliografía, sólo encontramos un artículo al respecto y, aunque hallaron una proliferación celular T específica a la PT, tras la vacunación BCG, en niños a los que se había tratado su parasitosis intestinal, no observaron diferencias estadísticamente significativas en cuanto a la reactividad cutánea de la PT29. Aunque nuestro estudio se limita a observar si existe o no una asociación entre los porcentajes de PT positivas y parasitación intestinal, a la vista de los resultados es improbable que la parasitación intestinal influya en el resultado de la PT.
Hemos observado una asociación estadísticamente significativa entre la presencia de eosinofilia y la positividad de la PT. Este resultado no es concluyente, dado que la muestra es escasa, pueden haber falsos negativos en los estudios coproparasitológicos que no se realizaron con técnica de concentración, y porque no se investigó otras parasitaciones que también pueden cursar con eosinofília y que precisan de otros métodos diagnósticos. Encontramos dos artículos que se referían a la eosinofília en niños con tuberculosis pulmonar30, 31 relacionándolo a la parasitación concomitante con helmintos y a hipereosinofília tropical pulmonar respectivamente.
Otras limitaciones del estudio: el pequeño tamaño de algunas sub-muestras hace que algunos resultados deban ser considerados con cautela; no podemos descartar cierta variabilidad en la medición de la PT pero no creemos que haya influenciado en el resultado; las diferencias culturales e idiomáticas pueden haber dificultado la recogida de algunas variables en la entrevista-cuestionario.
Conclusiones:
- La prevalencia de la PT positiva en nuestra muestra es del 6,1% por lo que creemos que aún esta indicada la aplicación de la PT a todos los niños recién inmigrados de PBR como método inicial de cribado de la ITL.
- Circunstancias sociales, como que el padre no trabaje y vivir con un índice de hacinamiento superior a 2, influye en el incumplimiento de la lectura de la PT.
- Es dudoso que la parasitación intestinal influya en el resultado de la PT.
- Se ha de conseguir que las pruebas más específicas de diagnostico de la ITL (TIGRAs) estén al alcance de la Asistencia Primaria, especialmente para los niños vacunados de BCG.
Agradecimientos:
A los 69 pediatras y 64 enfermeras de atención primaria que han colaborado en la recogida de datos.
A las técnicas de salud: Mª Isabel Fernandez Sanmartín y Noemí Olona por el asesoramiento.
A Yolanda Benavente que ha realizado el análisis estadístico.
Bibliografía
- World Health Organitation. WHO report 2009: Global Tuberculosis control-epidemiology, strategy, financing. [Consultado el 11/04/2010.] Disponible en : www.who.int/tb/publications/2009/.
- Departament de Sanitat i Seguretat Social. Generalitat de Catalunya. Guia per la Prevenció i control de la tuberculosis infantil. Quaderns de Salut Pública 1997.
- Pediatric Tuberculosis Collaborative Group. Targeted Tuberculin Skin Testing and Treatment of Latent Tuberculosis Infection in Children and Adolescents. Pediatrics 2004;114:1175-1201.
- Altet Gómez MN, Alcaide Mejías J. Control y eliminación de la tuberculosis en España: las estrategias para el siglo XXI. An Pediatr (Barc) 2006;64:66-73.
- Martín F, García de Miguel M, Corretger Rauet J, Hernández-Sampelayo Matos T, González Montero R, Martínez Campos L, Martínez-Roig A et al. Documento de consenso sobre el tratamiento de la exposición a tuberculosis y de la infección tuberculosa latente en niños. An Pediatr (Barc) 2006;64:59-65.
- Grupo de trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica. Interpretación de la prueba de tuberculina en niños. An Pediatr (Barc) 2003;59:582-5.
- Shigandia D, Novelli V. Diagnosis and treatment of TBC in children. Lancet Infect Dis 2003;3:624-32.
- García-Sancho C, García-García L, Jiménez-Corona ME, et al. Is Tuberculin skin testing useful to diagnose latent TBC in BCG-vaccinated children?. Int J Epidemiol 2006;35:1447-1454.
- Lockman S, Tappero JW, Kenyon TA, Rumisha D, Huebner RE, Binkin NJ. Tuberculin reactivity in pediatric population with high BCG vaccination coverage. Int J Tuberc.Lung Dis 1999;3(1):23-30.
- Wang L, Turner MO, Elwood RK, Schulzer M, Fitzegerald JM. A meta-analysis of the effect of Bacille Calmette Guerin vaccination on tuberculin skin test measurements. Thorax 2002;57:804-809.
- Tissot F, Zanetti G, Francioli P, Zallweger JP, Zysset F. Influence of bacille Calmette-Guérin vaccination on size of tuberculin skin test reaction: to what size?.Clin Infect Dis 2005;40:211-7.
- Singh D, Sutton C, Woodcock A. Repeat Tuberculin Testing in BCG-vaccinated Subjects in the United Kingdom. Am J Respir Crit Care Med 2001;164:962-964.
- Trunz BB, Fine P, Dye C. Effect of BCG vaccination on childhood tuberculous meningitis and miliary tuberculosis worldwide: a meta-analysis and assessment of cost-effectiveness. Lancet 2006;367:1173-80.
- Sleiman R, Al-Tannir M, Dakdoudi G, Ziade F, et al. Interpretation of the Tuberculin Akin Test in Bacille Calmette-Guerin Vaccinated and Nonvaccinated School Children. Pediatr Infect Dis J. 2007;26:134-13.
- Collet E, Krahenbuhl JD, Gehri M, Bissery A, Zellweger JP. Risk factors for positive tuberculin skin tests among migrant and resident children in Lausanne, Switzerland. Swiss Med Wkly 2005;135:703-9.
- Martínez Roig A, Diz Ardid A, Guevara Carrasco P, Pou Briera I, Galdeano Ruiz de Larramendi A, Mombiela Vidal R, Bonet Alcaina M, Seidel Padilla V. Estudio de tuberculosis entre niños inmigrantes ingresados en un hospital general de Barcelona durante el periodo de 1 enero de 2000 a diciembre de 2005. Acta Pediatr Esp 2006;64:545-550.
- Generalitat de Catalunya. Departament de Salut. Protocol d’atenció a infants immigrants: programa de seguiment del nen sa. Direcció General de Salud Pública. 2005
- Agència de Salut Pública de Barcelona. Tuberculosi a Barcelona. Informe 2004. Documents. [Consultado 18 de Marzo 2009.] Disponible en : www.aspb.es/quefem/docs/Tuberculosi2004pdf.
- Espinosa Arévalo M, Vázquez Gallardo R, Gayoso Diz P. La prueba de tuberculina en los controles del niño sano. ¿Debemos cambiar nuestra práctica?. An Pediatr (Barc) 2006;65(3):225-225.
- Masvidal RM, Miguel B, Vall M, Zabaleta E, Carnero E, Rodriguez de la Rubia C. Tuberculosis en zona de gran incidencia y con elevado porcentaje de inmigrantes. An Pediatr (Barc) 2004;60:22-7.
- Al-Orainey IO. Diagnosis of latent tuberculosis: Can we do better?. Ann Thorac Med 2009;4:5-9.
- Menzies D, Pai M, Comstock G. Meta-analysis: new test for the diagnosis of latent tuberculosis infection: areas of uncertainty and recommendations for research. Ann Intern Med 2007; 148:340-354.
- Higuchi K, Kawabe Y, Mitarai S, Yoshiyama T, Harada N, Mori T. Comparison of performance in two diagnostic methods for tuberculosis infection. Med Microbiol Immunol 2009; 198:33-37.
- Altet Gómez MN, Alcaide Megías J. La tuberculosis en niños inmigrantes: dificultades y recomendaciones. An Pediatr (Barc) 2005; 62 (Supl.1):1-5,32.
- Balboa de Paz F, Pérez Rodríguez O, Barbosa Gomes E. Estado actual de la tuberculosis. Acta Pediatr Esp 2005;63 (10): 406-412.
- Cabral M, Guasch E, Rifá MA, Coromina E, Bellvehi M, Rufas AM. El reto de la inmigración: estudio en Atención Primaria. Rev Pediatr Aten Primaria 2007;9:17-30.
- Bran C, Gómez i Prat J, Cayla JA, García de Olalla P. Estudio de los factores asociados a la infección tuberculosa latente en inmigrantes en menores de 35 años. Enferm Infecc Microbiol Clín 2006; 24:322-325.
- Yung J, O’Connor ME. Risk factors associated with latent tuberculosis infection in Mexican American children. Pediatrics 2005;115:647-53.
- Elias D, Wolday D, Akuffo H, Bronner U, Britton S. Effect of deworming on human T cell responses to mycobacterial antigens in helminth-exposed individuals before and after bacille Calmette-Guérin (BCG) vaccination. Clin Exp Inmunol 2001;123:219-225 .
- Tristao-Sá R, Ribeiro-Rodrigues R, Jonson LT, Pereira FE, Dietze R. Intestinal nematodes and pulmonary tuberculosis. Rev Soc Bras Med Trop 2002;35:533-5.
- Ray D, Abel R. Hypereosinophilia in association with pulmonary tuberculosis in a rural population in south India. Indian J Med Res 1994;100:219-22 .
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.





