Vol. 11 - Num. 16
Endocrinología pediátrica
Desarrollo puberal normal. Pubertad precoz
aPediatra. Jefe de Servicio. Servicio de Pediatría. Hospital del Sureste. Arganda del Rey. Madrid. España.
Cómo citar este artículo: Temboury Molina MC. Desarrollo puberal normal. Pubertad precoz. Rev Pediatr Aten Primaria. 2009;11 Sup l16;s127-s142.
Publicado en Internet: 31-10-2009 - Número de visitas: 1209528
Resumen
La pubertad es el período final del crecimiento y maduración del niño en el que se alcanza la talla final y la madurez psicosocial y reproductiva. Se inicia en el sistema nervioso central por factores neuroendocrinos que activan el eje hipotálamo-hipofisario-gonadal y sus mecanismos reguladores. Estos factores actúan bajo control genético e influencia ambiental.
La pubertad precoz se define como la aparición progresiva de signos puberales a una edad por debajo de 2,5 DS de la media para una población determinada. Puede ser dependiente de gonadotropinas (central) o independiente de gonadotropinas (periférica). La mayoría de los casos son de origen idiopático, aunque también puede estar causada por enfermedades orgánicas de severidad variable. Por la repercusión desfavorable que tiene en la maduración del niño se recomienda tratar adecuadamente.
Palabras clave
● Pubertad ● Pubertad precoz central ● Talla finalPubertad
La pubertad es el período final del crecimiento y maduración del niño en el que se alcanza la capacidad reproductiva, es una etapa de transición entre la infancia y la edad adulta. Comienza cuando aparecen los caracteres sexuales secundarios y aumenta la velocidad de crecimiento, más adelante el niño va experimentando cambios somáticos y psicológicos que progresan ordenadamente, hasta que al final alcanza la talla adulta, la madurez psicosocial y la fertilidad.
Desarrollo puberal normal
La pubertad se inicia por una secuencia de cambios madurativos regulados por factores neuroendocrinos y hormonales, que actúan bajo control genético (herencia poligénica) e influjo ambiental (luz, nutrición, altura, nivel socioeconómico, disruptores endocrinos...)1. La aparición del botón mamario es el primer signo puberal de las niñas, mientras que los niños comienzan con aumento del tamaño testicular, ambos consecuencia de la secreción de gonadotropinas y esteroides sexuales. La aceleración del crecimiento se produce al principio de la pubertad de las niñas y en el período intermedio en los niños. Por el contrario, la menstruación y la espermatogénesis son fenómenos tardíos, que se observan hacia el final del desarrollo puberal.
En el hipotálamo las neuronas de GnRH liberan hormona estimulante de las gonadotropinas (GnRH) a la circulación portal hipofisaria, donde estimula la secreción pulsátil de gonadotropinas adenohipofisarias a la circulación periférica. Ambas gonadotropinas (LH: hormona luteinizante y FSH: hormona folículo estimulante) inducen la síntesis de estradiol por el ovario, que a su vez favorece el crecimiento del pecho y la maduración del sistema reproductivo femenino. En el varón la LH provoca la síntesis de testosterona por las células testiculares de Leydig, mientras que la FSH induce la maduración de los túbulos seminíferos. En ambos sexos los andrógenos estimulan el crecimiento de vello púbico y axilar, la maduración de las glándulas sudoríparas apocrinas (responsables del sudor adulto) y los cambios cutáneos relacionados con el acné. Los esteroides sexuales impulsan el gran crecimiento somático, característico de este período, en parte directamente y en parte indirectamente, aumentando la secreción de hormona de crecimiento. El estradiol es la principal hormona responsable de la maduración ósea en ambos sexos1,2.
Los mecanismos de feedback del eje hipotalámo-hipofisario-gonadal comienzan a actuar desde la vida fetal (en la que ya está presente la secreción pulsátil de gonadotropinas por estímulo de la GnRH), se mantienen en el período neonatal, declinan y permanecen ralentizados durante la niñez, hasta rebrotar en la pubertad (figura 1).
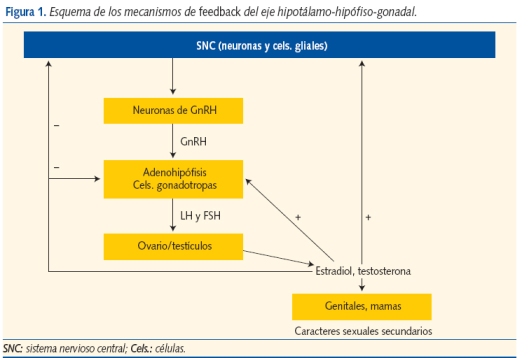
Estos mecanismos adquiridos en la vida fetal se mantienen activos por tanto muchos años después. A lo largo de la vida hay variaciones en la sensibilidad de este feedback negativo, que está principalmente bajo el control del sistema nervioso central. Las inhibinas A y B, relacionadas con la FSH, la masa folicular y de células de Sertoli, son detectables durante la niñez, aumentan en la pubertad y colaboran en este feedback.
Durante la infancia el eje hipotálamo-hipofisario-gonadal se regula a baja intensidad, aunque si se activa, es capaz de alcanzar pleno funcionamiento.
El patrón prepuberal del eje se caracteriza por la secreción mínima de GnRH y de gonadotropinas (más FSH proporcionalmente). Al comienzo de la pubertad aumentan los niveles de FSH y LH basales y en respuesta a la GnRH (LH sobre todo). El patrón puberal se caracteriza por niveles más elevados de gonadotropinas y en diferente proporción que en la niñez (más LH). El ratio LH/FSH (basal o tras GnRH), es útil para identificar el comienzo de la pubertad, ya que es diferente en el período prepuberal (en el que predomina la FSH y es < 1), que en el período puberal (predomina la LH y es > 1)1.
El comienzo de la pubertad es consecuencia del aumento de secreción episódica de GnRH, que produce a su vez secreción pulsátil de LH y FSH; al principio solo durante el sueño, pero más tarde aumentan en frecuencia y amplitud los pulsos y se extienden a lo largo de todo el día. Los mecanismos que inician y controlan la secreción hipotalámica de GnRH no se conocen completamente, pero parecen reflejar un balance entre neurotransmisores estimuladores e inhibidores (acetilcolina, catecolaminas, GABA, péptidos, prostaglandinas, serotonina, etc.).
Hacia el final de la primera década de la vida disminuye la secreción de GABA, principal neurotransmisor del sistema nervioso central (SNC) encargado de inhibir los pulsos de GnRH, y aumenta simultáneamente el glutamato (aminoácido que aumenta los pulsos de GnRH), ayudados por otros factores como la noradrenalina y el neuropéptido Y. La kisspeptina parece ser necesaria para la secreción pulsátil de GnRH. La astroglía, los péptidos anorexígenos y orexígenos y otros factores autocrinos y paracrinos parecen jugar también un papel en este proceso. La pubertad se inicia por la reactivación de la secreción pulsátil de GnRH, producida por el estímulo de las redes neuronales y gliales sobre las neuronas productoras de GnRH. Estas redes están bajo el control de una cascada de genes, a su vez influidos por factores periféricos y ambientales1-3.
Cronología de la pubertad normal
Hay una variación muy amplia entre personas sanas de todo el mundo en el rango de inicio de la pubertad, que sigue un patrón familiar, étnico y de género.
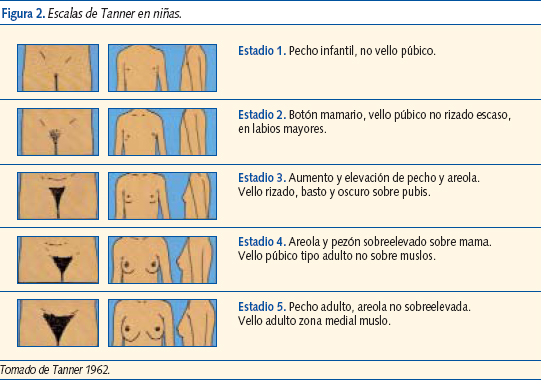
La escala de Tanner describe los cambios físicos que se observan en genitales, pecho y vello púbico, a lo largo de la pubertad en ambos sexos. Esta escala, que está aceptada internacionalmente, clasifica y divide el continuo de cambios puberales en 5 etapas sucesivas que van de niño (I) a adulto (V) (figuras 2 y 3).

El aumento en la actividad del eje hipotálamo-hipofisario-gonadal de la época puberal se conoce como gonarquia. Telarquia es el comienzo del desarrollo del pecho, menarquia la primera regla y pubarquia el desarrollo de vello sexual (consecuencia de los andrógenos adrenales, ováricos o testiculares).
Pubertad normal en la mujer
Los niveles de FSH, LH y estradiol se elevan antes de que se manifiesten los cambios físicos. Estas hormonas siguen aumentando a lo largo de la pubertad, acompañadas de niveles crecientes de inhibinas A y B. Los niveles de LH (basales o tras GnRH) y de estradiol por encima del rango prepuberal confirman la gonarquia en las chicas. Los estrógenos estimulan el desarrollo y maduración mamaria, el crecimiento genital (sobre todo de labios menores), la maduración de la mucosa vaginal uterina, el crecimiento endometrial y cambios en la composición corporal compatibles con la distribución femenina de grasa (en caderas).
La adrenarquia es el resultado del aumento de la producción adrenal de andrógenos, que habitualmente comienza antes que la gonarquia. Está representada por niveles puberales del andrógeno débil DHEAS.
La aceleración del crecimiento lineal es una de las primeras manifestaciones de la pubertad en niñas. Hay además, aumento de peso y de proporción de grasa corporal.
El crecimiento durante la pubertad no es uniforme. Sufre una aceleración importante en el primer año y medio, y posteriormente se desacelera progresivamente, dando lugar en ambos sexos al pico o brote puberal. La velocidad de crecimiento en el pico máximo es de 8,5 cm/año en las niñas.
El intervalo entre el inicio puberal y la menarquia es variable, porque es consecuencia de la exposición a estrógenos y no siempre indica el comienzo de la ovulación. Por término medio trascurren 2 años desde el botón mamario hasta la menarquia. La edad de la menarquia se correlaciona positivamente con la edad ósea, el índice de masa corporal (IMC) y negativamente con el remanente de crecimiento. Cuanto más prolongada ha sido la exposición previa a estrógenos más cerca está de la talla adulta. Como media las chicas crecen de 4-6 cm tras la menarquia. Sin embargo, las chicas que tienen la menarquia más jóvenes les pueden quedar hasta 10 cm de crecimiento. A pesar de este ajuste, cuanto más joven se tiene la menarquia, menor tiempo total de crecimiento y en general menor talla adulta.
La pubertad habitualmente dura 3-4 años, manteniendo cada estadio de Tanner unos 12-15 meses. Los límites normales de inicio de pubertad (T2) se mantienen entre los 9 y 11 años en niñas blancas europeas (media 10,7 años) y el final de ella a los 15,2 años. Aunque se ha observado una tendencia secular al adelanto puberal, parece haberse estabilizado desde los años ochenta. La edad media de menarquia es los 12,5 años en niñas blancas (rango 10-15 años)1,4,5.
Pubertad normal en el varón
Se observan a lo largo de la pubertad valores crecientes de LH, FSH y testosterona, como consecuencia del patrón puberal de regulación del eje hipotálamo-hipofisario-gonadal. También aumentan otros metabolitos de origen adrenal y testicular como estrona, estradiol, 17 OH progesterona, DHEAS, inhibina B.
El primer signo puberal en varones es el aumento del tamaño testicular. El testículo prepuberal tiene 2 cc o menos de volumen y menos de 1,5 cm de longitud. Cuando el testículo es mayor de 3 cc de volumen o una longitud máxima mayor de 2,2 cm, es claramente puberal y está estimulado por las gonadotropinas. Las escalas de Tanner no describen el tamaño de los testículos que son un hallazgo físico clave (se correlacionan). La pubarquia es uno de los primeros signos puberales. El vello axilar aparece en la mitad. El vello de otras áreas corporales dependientes de andrógenos como pecho, cara, espalda y abdomen aparecen a mitad de la pubertad y sigue progresando durante años. La distribución del vello estimulado por andrógenos es muy variable entre individuos y depende más de factores raciales, familiares y genéticos que del nivel de andrógenos.
Normalmente los niños comienzan el desarrollo puberal entre los 12 y 14 años (un par de años después que las niñas). En las últimas décadas el estadio 2 de pubarquia se encuentra por término medio a los 12,3 años en varones, aunque los datos están peor recogidos que en las niñas.
El pico de máxima velocidad de crecimiento en los chicos ocurre hacia la mitad de la pubertad, tras una exposición significativa a andrógenos (volumen testicular medio de 10 ml), como sucede también con el cambio de voz, el acné y el vello axilar. La velocidad de crecimiento durante el pico máximo es por termino medio de 9,5 cm/año, en varones.
A lo largo de la pubertad hay un aumento de la densidad mineral ósea y de la masa magra, con una disminución del contenido de tejido adiposo. Los cambios corporales empiezan al principio de la pubertad pero son más evidentes hacia la mitad. En ambos sexos el estradiol es la principal hormona que estimula la maduración ósea. Los niveles de estradiol que tienen los varones a mitad de la pubertad, son como los del comienzo de la pubertad de las niñas y coinciden en ambos casos con el pico de máxima velocidad de crecimiento1-3.
La espermarquia ocurre hacia los 14 años, coincidiendo con el estadio III de Tanner. La ginecomastia puberal es el crecimiento palpable de las mamas que se observa en un tercio de los chicos hacia la mitad de la pubertad, es un proceso autolimitado y una variante del desarrollo normal.
Pubertad precoz
Se define como la aparición progresiva de signos puberales a una edad cronológica inferior a 2,5 DS por debajo de la media para una determinada población. Incluye no solo cambios en las mamas y genitales, sino también aceleración del crecimiento y de la edad ósea. Es importante no confundirla con “pubertad precoz no progresiva”, que es una variante frecuente del desarrollo normal de las niñas. Por tanto, para que el diagnóstico de pubertad precoz sea preciso, es importante asegurarse de que es progresiva y basarse no solo en hallazgos clínicos, sino también hormonales y radiológicos6.
Aunque en Estados Unidos en los últimos años se han adelantado los límites de la definición para las niñas, en Europa seguimos definiendo la pubertad precoz como la aparición de caracteres sexuales por debajo de los 8 años en niñas y de los 9 años en varones. Tradicionalmente se describe como pubertad adelantada la que se inicia en el período comprendido entre los 8 y 9 años en las niñas y entre los 9 y 10 años en los niños. Esta última es un extremo del rango inferior del desarrollo normal, pero en ocasiones puede acortar el potencial de talla o producir problemas adaptativos, motivo por el que conviene consultar con un endocrinólogo infantil1,2,4.
La pubertad precoz no solo produce adelanto de la aparición de caracteres sexuales, sino también aumento de la velocidad de crecimiento y aceleración de la maduración ósea, con cierre precoz de las placas de crecimiento y talla final baja.
El crecimiento puberal supone un 15-20% de la talla adulta y puede compensar parcialmente la reducción de años de crecimiento prepuberal (a menor edad mayor pico de crecimiento puberal). Sin embargo, cuando la pubertad se produce precozmente, el aumento fisiológico de la amplitud del pico de crecimiento no es capaz de compensar la reducción de años de crecimiento prepuberal, reduciendo la talla final7,8.
Las consecuencias psicológicas (estrés, ansiedad, depresión…) y psicosociales (alteración de la conducta social y sexual, agresividad y mal rendimiento escolar) de la pubertad precoz pueden ser muy importantes para el paciente y su familia, y siempre deben tenerse en consideración a la hora de decidir el tratamiento9.
Pubertad precoz dependiente de gonadotropinas
También llamada central o verdadera (tabla I), es consecuencia de la activación del eje hipotálamo-hipofisario-gonadal. Aunque precoz es fisiológicamente normal y se produce por secreción hipotalámica de GnRH. Lleva a madurez sexual y reproductiva prematura. La talla es alta durante la niñez, pero se produce una disminución variable de la talla final.

En la mayoría de los casos no se encuentra causa que la justifique (90% idiopáticas), aunque puede producirse como consecuencia de anomalías del SNC que alteran el balance estimulatorio-inhibitorio que coordina el comienzo de la pubertad (igual frecuencia en niños que en niñas)10. Los hamartomas hipotalámicos, los quistes subaracnoideos y los tumores de células germinales, se asocian habitualmente a pubertad precoz. Sin embargo, es menos frecuente entre los tumores gliales y craneofaringiomas. En la hidrocefalia, abscesos cerebrales o granulomas puede ser consecuencia de la hipertensión intracraneal y desaparecer con su tratamiento. La exposición prolongada a andrógenos causada por hiperplasia suprarrenal congénita no diagnosticada, favorece la maduración del eje hipotálamo-hipofisario-gonadal, produciendo una pubertad precoz central sobreañadida1.
Recientemente se ha demostrado que un porcentaje de los casos clasificados como idiopáticos son familiares y consecuencia de alteraciones en los genes que regulan el comienzo de la pubertad. La pubertad precoz idiopática es mucho más frecuente en niñas que en niños (10:1). Se ha observado además mayor incidencia entre las niñas adoptadas procedentes de países subdesarrollados1,10.
Pubertad precoz independiente de gonadotropinas o periférica
Aparición precoz de caracteres sexuales secundarios por causas diferentes de la activación del eje hipotálamo-hipofisario-gonadal (tabla I). Ocurre por secreción de esteroides gonadales independiente de las gonadotropinas. La fuente puede ser hiperplasia suprarrenal congénita, tumores adrenales, gonadales o esteroides sexuales exógenos (alimentos, cremas, insecticidas u otros disruptores endocrinos). Del total de niñas con pubertad precoz menos del 10% es periférica. Es igual de frecuente en ambos sexos (puede ser iso- o heterosexual).
La hiperplasia suprarrenal congénita es la causa más frecuente de pubertad precoz de origen adrenal11.
El síndrome de McCune-Albright se produce por una mutación activadora en el gen que codifica la subunidad alfa de la proteína G, que estimula el AMP cíclico en líneas celulares de diferentes órganos. Es una mutación somática que se distribuye en mosaico, de expresión variable y que cursa con exacerbaciones y remisiones. Las lesiones clásicas son: displasia fibrosa poliostótica localizada en diferentes huesos, máculas cutáneas melanóticas (manchas café con leche) y endocrinopatías por hiperfunción glandular, consecuencia de la estimulación por la proteína G, como pubertad precoz (frecuentes quistes ováricos), hiperadrenocortisolismo, hipertiroidismo, exceso de GH e hipofosfatemia. Esta pubertad precoz se trata con inhibidores de la aromatasa y antiestrógenos como tamoxifeno11.
Las mutaciones activadoras del receptor de la LH o pubertad precoz periférica familiar limitada al varón, también llamada testotoxicosis, son mutaciones del receptor de la LH que a través de la estimulación de la proteína G aumentan el AMPc, y, como consecuencia, las células de Leydig secretan testosterona de manera autónoma a niveles superiores al rango adulto, con niveles bajos de LH y FSH. La herencia es autosómica dominante. Clínicamente se caracteriza por pubertad precoz en niños entre los 2-4 años, con aumento bilateral de los testículos y aceleración del crecimiento y de la edad ósea. Se trata con ketoconazol, espirolactona e inhibidores de la aromatasa como la testolactona. Puede producirse posteriormente pubertad precoz central secundaria.
Otras causas más raras incluyen tumores de células de Leydig que secretan grandes cantidades de testosterona, tumores ováricos secretores de estrógenos, tumores secretores de gonadotropina coriónica humana, que actúan sobre las células de Leydig estimulando la producción de testosterona. Considerar también los quistes funcionales del ovario, o la exposición a esteroides sexuales exógenos11.
El hipotiroidismo primario no tratado cursa con niveles elevados de TSH y puede producir desarrollo mamario en niñas (a veces con galactorrea) o aumento testicular en varones, por activación del receptor de la FSH y estimulación de la prolactina por la TRH. Cursa con retraso de crecimiento y de maduración ósea, y mejora con tratamiento sustitutivo adecuado1,11.
Otras variantes del desarrollo puberal
Telarquia precoz: desarrollo mamario precoz sin otros cambios puberales significativos. Puede estar alta la FSH, pero los estrógenos están a nivel prepuberal. La maduración ósea y la velocidad de crecimiento corresponden con la edad cronológica, en la ecografía pélvica el útero y los ovarios son pequeños, aunque pueden tener algún quiste folicular. Habitualmente es un proceso autolimitado, que tiende a involucionar espontáneamente, pero precisa vigilancia porque en ocasiones puede progresar a pubertad precoz12.
Adrenarquia o pubarquia precoz: presencia de vello púbico antes de los 8 años en niñas o de los 9 años en niños, que se puede acompañar de acné, axilarquia y sudor apocrino. Se produce por una maduración precoz de la zona reticular de las suprarrenales, que ocasiona producción de andrógenos a niveles puberales: DHEA y androstendiona. En la mayoría de los casos es una situación benigna y autolimitada. Solo en algunos casos precisa mayor evaluación por tratarse de otros procesos.
Menarquia precoz: entidad poco frecuente, de etiología mal aclarada, benigna y autolimitada, que no suele pasar de 1-3 episodios de hemorragia, sin otros signos de desarrollo puberal. Es un diagnóstico de exclusión, tras haber descartado enfermedades hemorrágicas, traumatismos, abusos, infecciones, tumores, cuerpos extraños…
Diagnóstico de pubertad precoz
Se basa en verificar la precocidad puberal e identificar las causas subyacentes.
- Historia clínica completa recogiendo datos como exposición a tóxicos, fármacos, curva de crecimiento, edad de comienzo y progresión de los cambios puberales, síntomas neurológicos, antecedentes personales de traumatismo craneoencefálico, infecciones, convulsiones y antecedentes familiares (incluyendo tallas y edad de pubertad).
- Exploración física cuidadosa del estadio puberal de Tanner y del aspecto de los genitales (maduración vulvar y tamaño del clítoris en niñas y tamaño testicular en varones), o asimetrías. Los testículos prepuberales tienen menos de 2 cc de volumen (usar orquidómetro) o de 1,5 cm de longitud, y su hallazgo orienta a que la pubertad precoz no es de origen central. Si la longitud es mayor a 2,2 cm o tienen un volumen mayor de 3 cc, sugieren estímulo por las gonadotropinas (central). Es imprescindible valorar el peso, talla, envergadura, proporciones corporales, piel (manchas, acné, vello corporal), palpación tiroidea y exploración neurológica, además de la exploración general habitual.
- Determinaciones hormonales basales: inicialmente determinar LH, FSH, DHEAS, 17-OH progesterona, estradiol en niñas y testosterona en varones, hormonas tiroideas, hCG. Si LH y FSH en conjunto están en rango puberal, orientan a pubertad precoz central. Si solo está elevado la FSH y la LH está baja, sugiere que todavía la situación es prepuberal. En general, el ratio LH/FSH menor de uno se considera prepuberal y mayor de uno puberal. Los niveles de testosterona elevados en varones verifican pubertad, pero no identifican el origen. El estradiol elevado sugiere situación puberal, aunque hay bastante solapamiento con los valores prepuberales.
- El test de LH-RH o el test con análogos de GnRH (Procrin), tienen mucha utilidad diagnóstica, ya que en la pubertad precoz central encontraremos una respuesta elevada de LH (> 3 UI/ml), mientras que en la periférica las gonadotropinas estarán suprimidas por los niveles de esteroides sexuales elevados. En la respuesta prepuberal, la LH estará baja, así como los esteroides sexuales. Los niveles de FSH muestran solapamiento prepuberal-puberal y aunque orientan, tienen menos utilidad diagnóstica.
- Pruebas de imagen: es imprescindible hacer una radiografía de muñeca para ver la edad ósea, que en la pubertad precoz estará adelantada e informará del pronóstico de talla adulta.
La ecografía pélvica en las niñas tiene mucha utilidad, ya que nos informa del tamaño ovárico y de la existencia de folículos (volumen puberal > 2 cc y > 5-6 folículos), así como el tamaño y maduración uterino (puberal > de 3,6 cm de longitud, forma de pera, igual tamaño cuerpo/cuello). También informa de la presencia de quistes o masas tumorales.
La ecografía testicular puede ser necesaria en varones si se sospecha un tumor testicular. Ocasionalmente es necesaria la ecografía abdominal.
La RNM del SNC: es una prueba obligada en todos los varones con pubertad precoz central y en las niñas menores de 7 años o con niveles elevados de estradiol. En las niñas con pubertad precoz central de 7-8 años, es muy poco frecuente encontrar patología del SNC y se puede individualizar la necesidad de realizar, aunque hay autores que la recomiendan siempre1,13.
Tratamiento de pubertad precoz
Si se identifica una causa subyacente de pubertad precoz hay que tratarla en primer lugar. Cualquier tipo de tumor, sea del SNC, ovárico, adrenal, testicular, etc. se tratará con la cirugía, quimioterapia o radioterapia correspondiente. Una excepción la constituyen los hamartomas hipotalámicos cuyo abordaje quirúrgico produce elevada morbilidad. En estos casos se prefiere el tratamiento médico con análogos. En otros casos habrá que tratar la hiperplasia suprarrenal congénita subyacente, el hipotiroidismo o suspender la exposición a esteroides gonadales.
Los pacientes con producción autónoma de esteroides gonadales (síndrome de McCune-Albrigth y testotoxicosis) se tratan con inhibidores de la síntesis de esteroides como el ketoconazol, inhibidores de la aromatasa como la testolactona o el anastrazol y antagonistas del receptor de estrógenos, como el tamoxifeno14.
Tratamiento con análogos de la GnRH de la pubertad precoz dependiente de gonadotropinas
El tratamiento con análogos de la GnRH es el de elección y prácticamente el único disponible actualmente. Su base farmacológica es la supresión de la secreción episódica de gonadotropinas, por saturación y bloqueo de los receptores hipofisarios de GnRH. Los análogos producen la ocupación continua de estos receptores por sus niveles altos mantenidos, su mayor afinidad por el receptor y la duración de acción más prolongada14.
Se utilizan principalmente las inyecciones intramusculares o subcutáneas del preparado depot, aunque también existen implantes subcutáneos y preparados nasales de acción corta (poco utilizados). Los análogos producen inicialmente una suelta de LH y FSH, seguida de una supresión prolongada en las semanas posteriores si se usa la dosis adecuada15. Se utiliza sobre todo la tryptorelina a dosis de 75-100 mcg/kg, administrada cada 3-4 semanas intramuscular o subcutánea. Aunque hay poca experiencia en niños existen preparados trimestrales de 11,5 mg de tryptorelina que parecen eficaces. También se utiliza la leuprorelina a dosis de 100-150 mcg/kg intramuscular cada 28 días16. Algunos autores para minimizar el efecto estimulante de la primera inyección, utilizan acetato de ciproterona durante 1-2 meses a 50 mg cada 12 horas (15-30 días antes y 15-30 días después de la 1.ª inyección)14,16.
Conviene informar a los padres de que a veces se produce un pequeño sangrado menstrual tras las dos primeras inyecciones, sin importancia clínica.
El tratamiento produce una regresión parcial de los caracteres sexuales secundarios, tanto de las mamas, como de los genitales y testículos, que es visible también en la ecografía pélvica por disminución del tamaño de ovarios y útero. Todos estos cambios son reversibles cuando se suspende. También disminuye la velocidad de crecimiento, que pasa a ser prepuberal y se frena la maduración ósea. La predicción de talla adulta mejora en general entre 5-10 cm. Sin embargo, hay un pequeño subgrupo en el que se ralentiza excesivamente la velocidad de crecimiento, lo que puede comprometer la talla adulta (se cree que por envejecimiento excesivo de la placa de crecimiento por exposición prolongada a estrógenos). En ellos podría estar indicada la asociación simultánea de hormona de crecimiento. En general, tienen peor ganancia de talla los pacientes con edad ósea muy avanzada o clínica prolongada de signos puberales al inicio del tratamiento.
Se recomienda suspender el tratamiento cuando las niñas alcanzan una edad ósea de 11-12 años y los varones de 13-14 años, para preservar el brote de crecimiento puberal que se produce habitualmente al interrumpirlo.
Tras la supresión del tratamiento se produce la recuperación completa del eje hipotálamo-hipofisario-gonadal. Como consecuencia, en unos meses se recupera la respuesta puberal al estímulo con GnRH y la pubertad progresa normalmente. La menarquia en general se produce entre 6-18 meses después y no se altera la fertilidad ni la espermatogénesis16.
La decisión de tratar o no tratar se debe tomar en conjunto con los padres, tomando en consideración los aspectos psicosociales, la velocidad de progresión de la pubertad y el acortamiento del pronóstico de talla (< de 155 cm en niñas o de 165 cm en niños). Como no todos los pacientes se benefician del tratamiento, ni existen criterios claramente establecidos, la decisión de tratar o no tratar en las edades límites de la normalidad, debe tomarse de manera individualizada1,16.
Monitorización del tratamiento: es necesario hacer un seguimiento clínico trimestral para asegurarse de que la pubertad está adecuadamente frenada y la velocidad de crecimiento es correcta. Es necesario además hacer controles periódicos hormonales (LH, test de LHRH, test de Procrin), ecográficos y de edad ósea.
Los efectos secundarios son escasos: reacciones locales, aumento de la grasa corporal, disminución transitoria de la densidad mineral ósea (se recupera al finalizar el desarrollo puberal) y ocasionalmente migrañas. En general, son bien tolerados y los efectos secundarios de poca gravedad16.
En resumen, la pubertad precoz se define con criterios estadísticos. Está causada por un conjunto de enfermedades de gravedad variable, aunque en la mayoría no se encuentra una causa desencadenante. Tiene importantes repercusiones sobre la maduración del niño, tanto clínicas como psicosociales y en el crecimiento. El tratamiento es diferente si es dependiente o independiente del eje hipotálamo-hipofisario-gonadal. En la dependiente del eje o central, el tratamiento con análogos de la GnRH ha supuesto una considerable mejora del pronóstico del paciente.
Bibliografía
- Lee PA, Houk CP. Puberty and its disorders. In: Lifshitz F (ed.). Pediatric Endocrinology. New York: Informa Healthcare USA; 2007.p.273-303.
- Castro Feijoo L, Cabanas Rodríguez P, Barreiro Conde J, Pombo Arias M. Pubertad precoz y talla final. En: Sociedad Española de Endocrinología Pediátrica. Avances en Endocrinología Pediátrica. Barcelona: J&C Ediciones Médicas SL; 2007.p.31-49.
- Chueca Guindulain M, Oyarzabal Irigoyen M. Pubertad Precoz. Diagnóstico y tratamiento. En: Sociedad Española de Endocrinología Pediátrica. Avances en Endocrinología pediátrica. Barcelona; J&C Ediciones Médicas SL; 2006.p.73-81.
- Sun SS, Schubert CM, Chumlea WC, et al. National estimates of the timing of sexual maturation and racial differences among US children. Pediatrics. 2002;110:911-9.
- Marco Hernández M, Benítez R, Medranda I, Pizarro C, Méndez MJ. Variaciones fisiológicas normales del desarrollo puberal: edad de inicio, edad de la menarquia y talla. An Pediatr (Barc). 2008;69(2):147-53.
- Prété G, Couto-Silva AC, Trivin C, Brauner R. Idiopathic central precocious puberty in girls: presentation factors. BMC Pediatr. 2008;4;8-27.
- Carel JC, Lahlou N, Roger M, Chaussain JL. Precocious puberty and statural growth. Hum Reproduction Update. 2004;10(2):135-47.
- Brown JJ, Warne GL. Growth in precocious puberty. Indian J Pediatr. 2006;73(1):81-8.
- Mrug S, Elliot M, Gilliland MJ, Grunbaum JA, Tortolero SR, Cuccaro P, Schuster M. Positive parenting and early puberty in girls: protective effects against aggressive behavior. Arch Pediatr Adolesc Med. 2008;162(8):781-6.
- Kaplowitz P. Clinical characteristics of 104 children referred for evaluation of precocious puberty. J Clin Endocrinol Metab. 2004;89:3644-50.
- Zou CC, Liang L, Dong GP, Zhao ZY. Peripheral precocious puberty: a retrospective study for six years in Hangzhou, China. J Paediatr Child Health. 2008;44(7-8):415-8.
- Zhu SY, Du Ml, Huang TT. An analysis of predictive factors for the conversion from premature thelarche into complete central precocious puberty. J Pediatr Endocrinol Metab. 2008;21(6):533-8.
- Chemaitilly W, Trivin C, Adan L, Gall V, Sainte-Rose C, Brauner R. Central precoucious puberty: clinical and laboratory features. Clin Endocrinol (Oxf). 2001;54:289-94.
- Antoniazzi F, Zamboni G. Central precocious puberty: current treatment options. Paediatr Drugs. 2004;6:211-3.
- Couto-Silva AC, Adan L, Trivin C, Brauner R. Adult height in avanced puberty with or without gonadotropin hormone releasing hormone analog treatment. J Pediatr Endocrinol Metab. 2002;15:297-305.
- Pozo Román J. Indicaciones y monitorización del tratamiento con análogos de GnRH. En: Sociedad Española de Endocrinología Pediátrica. Actualizaciones en Endocrinología pediátrica. Barcelona: J&C Ediciones Médicas SL; 2005.p.101-33.
CONFLICTO DE INTERESES
La autora declara no presentar conflicto de interés en relación con la preparación y publicación de este artículo.





