Vol. 11 - Num. 15
Dermatitis atópica
Tratamiento de la dermatitis atópica
E Sendagorta Cudósa, Raúl de Lucas Lagunab
aDermatología. Madrid. España.
bDermatología. Responsable de la Unidad de Dermatología Pediátrica. Servicio de Dermatología. Hospital Universitario La Paz. Madrid. España.
Cómo citar este artículo: Sendagorta Cudós E, de Lucas Laguna R. Tratamiento de la dermatitis atópica. Rev Pediatr Aten Primaria. 2009;11 Supl 15;s49-s67.
Publicado en Internet: 30-06-2009 - Número de visitas: 34287
Resumen
En este artículo se revisan las recomendaciones sobre los hábitos de vida en los pacientes atópicos, así como el tratamiento más apropiado según la gravedad de la enfermedad. Su elaboración está basada en guías clínicas y revisiones sistemáticas. Además se resume la experiencia existente en la bibliografía en el uso de nuevos tratamientos para la dermatitis atópica.
Palabras clave
● Corticoides ● Dermatitis atópica ● Inmunomoduladores ● TratamientoIntroducción
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica que cursa en brotes. Su alta prevalencia en la edad pediátrica hace que en ocasiones se subestime el impacto de la enfermedad en la calidad de vida de los pacientes1,2. Por una parte, el intenso prurito que acompaña a la enfermedad conduce a un mal rendimiento escolar y a alteraciones del sueño. Por otra parte el deterioro físico y psicológico que conlleva, puede dificultar las relaciones con los demás y conducir al aislamiento social1,2.
Para el manejo óptimo de la DA no basta con conocer el tratamiento farmacológico de los brotes, sino que es necesario también evitar los desencadenantes de la enfermedad, mantener una higiene cuidadosa e hidratar correctamente la piel.
No existe ningún tratamiento curativo para la DA, y hasta el momento no es posible modificar el curso de la enfermedad. Así, el objetivo del tratamiento de la DA es la reducción de los síntomas, disminuir el número de recurrencias y controlar a largo plazo la enfermedad. Se trata de un tratamiento que debe individualizarse según la gravedad de la dermatitis; sin embargo con fines didácticos revisaremos los distintos recursos terapéuticos de los que se dispone en la actualidad, para después realizar recomendaciones según la gravedad de la dermatitis.
El cuidado de la piel atópica
La piel atópica se caracteriza por una alteración en la función barrera de la piel con una elevada tasa de pérdida de agua transepidérmica, disminución en la capacidad de retención de la misma en la epidermis y una menor cantidad de lípidos y ceramidas intraepidérmicas3,4. Esto da lugar a una piel seca y pruriginosa que precisa una higiene cuidadosa, evitando la irritación, y la aplicación diaria de emolientes que constituyen un pilar fundamental en el tratamiento de la DA independientemente de su gravedad.
Aseo e higiene
La necesidad de baño en niños atópicos es evidente pero el agua excesivamente caliente, la fricción y los detergentes pueden irritar la piel. En la actualidad se recomienda baño breve o ducha a diario, seguido de la aplicación inmediata de emolientes, para evitar la evaporación del agua de la piel5. Conviene emplear jabones de pH ácido (45). Se recomienda evitar las fuentes de calor y recurrir a toallas suaves, sin frotar la piel. Es aconsejable mantener las uñas cortas y limpias5.
Emolientes e hidratantes
Denominamos sustancias hidratantes a aquellas que aumentan el contenido en agua de la capa córnea, y emolientes a aquellas que la hacen menos áspera y más flexible. Puesto que muchos emolientes basan su acción en el aumento del contenido de agua de la epidermis, a menudo se emplean ambos términos indistintamente6. La aplicación de emolientes forma parte del tratamiento de mantenimiento de la DA5. No ha podido demostrarse que la aplicación regular de emolientes mejore de forma directa la DA, sin embargo ayudan a mejorar el aspecto de la piel atópica, y proporcionan sensación de bienestar al reducir el prurito y facilitar la reepitelización de la piel6-8. Poseen cierta actividad antiinflamatoria y disminuyen el riesgo de infección7. La mayoría de los autores coinciden en que el uso continuado de estas sustancias reduce la necesidad de corticoides tópicos, por lo que forman parte de la mayoría de guías de tratamiento5,9. Debe evitarse su uso durante los brotes, puesto que son ineficaces una vez que se instaura la enfermedad. Además, su aplicación producirá aumento del prurito y sensación de escozor. Se recomienda su aplicación 3 minutos después del baño, con la piel todavía húmeda, y aplicárselo tantas veces como sea necesario, recomendándose un mínimo de 2 veces al día5. Ningún estudio ha demostrado la superioridad de un emoliente frente al resto, por lo que se recomienda utilizar aquel con el que el paciente encuentra la máxima hidratación con una cosmética aceptable (tabla I). Entre los productos más utilizados se encuentran:
- Vaselina: es una mezcla de hidrocarbonos que se obtiene mediante el refinado y eliminación de las ceras de aceites minerales pesados. Se comercializa en forma sólida y líquida siendo su principal inconveniente su tacto graso, que hace que muchos pacientes no toleren su uso10.
- Lanolina: es una mezcla de alcoholes y ácidos grasos esterificados de alto peso molecular que provienen de la destilación de la lana. Actúan mezclándose con los lípidos del estrato córneo dañado. Como inconveniente destaca su capacidad sensibilizante11.
- El colesterol, los ácidos grasos libres y las ceramidas forman parte de la barrera lipídica, por lo que se utilizan en numerosos productos como principio activo.
- Glicerina: de gran capacidad higroscópica, actúa formando un reservorio a nivel del estrato córneo que dificulta la solidificación de las grasas manteniendo la estructura de la bicapa lipídica en estado fluido.
- Urea: actúa como humectante a bajas concentraciones y como queratolítico a altas concentraciones. Está por tanto especialmente indicada ante lesiones como la queratosis pilar, donde su acción queratolítica resulta especialmente beneficiosa12. Sin embargo, su uso en zonas de eccema producirá picor y escozor.
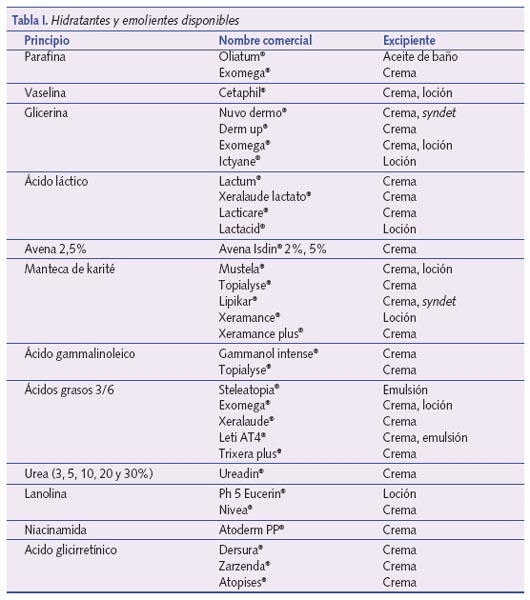
Recientemente se han comercializado nuevas líneas de emolientes que añaden compuestos antipruriginosos y antiinflamatorios, como glicerofosfoinositol colina (Derm up®) o seletiose (Trixera plus®). Los productos formulados con proantocianidinas y ácido glicirretínico (Dersura®, Zarzenda®) se han denominado protectores de barrera activos. Poseen capacidad regeneradora de la barrera cutánea, con actividad antiinflamatoria y antipruriginosa13. Existe un estudio controlado aleatorizado con escaso tamaño muestral, que apunta a una mayor eficacia que los emolientes convencionales, así como estudios preliminares respecto al ahorro de corticoides derivados de su uso14. Destaca por otra parte su elevado coste en comparación con los emolientes convencionales.
Evitar desencadenantes
Evitar infecciones
La colonización por microorganismos y el riesgo de infección es mayor en pacientes atópicos debido a la alteración en la barrera cutánea y a la relativa carencia de péptidos antimicrobianos protectores frente a bacterias, hongos y virus.
- Infecciones bacterianas. Existe un aumento de la colonización por Staphylococcus aureus, que está presente en más del 90% de los niños con DA, tanto en piel afecta como en piel sana, frente al 5% en niños sin dermatitis. Es posible que el Staphylococcus aureus desempeñe algún papel como desencadenante de los brotes, mediado por una reacción de superantígenos que estimularían la activación de los linfocitos T y los macrófagos. Sin embargo no existe evidencia que apoye el tratamiento profiláctico de la DA con antibióticos, estando indicado tratar cuando clínicamente exista sobreinfección de las lesiones eccematosas. En la mayoría de los casos el tratamiento tópico con antibióticos como gentamicina, ácido fusídico, mupirocina o retapamulina, resulta suficiente para controlar infecciones leves localizadas. En ocasiones es necesario añadir antibióticos orales, siendo de elección las penicilinas orales resistentes a las beta-lactamasas, debiendo por el contrario evitarse los macrólidos por el alto índice de resistencias del Staphylococcus aureus. Debe tenerse en cuenta que en cualquiera de las modalidades puede inducirse la aparición de resistencias. Algunos pacientes, incluso sus familiares o cuidadores, son portadores nasales del estafilococo, si esto se confirma precisan tratamiento con mupirocina intranasal 2 veces al día durante 10 días para evitar infecciones recurrentes.
- Infecciones víricas. Las infecciones causadas por virus herpes, papilomavirus humano (responsables de las verrugas vulgares) o poxvirus como el Molluscum contagiosum, son también más prevalentes en los pacientes atópicos siendo con frecuencia desencadenantes de brotes de eccema. Además en el paciente atópico acontecen con más frecuencia infecciones diseminadas por virus herpes, el denominado eccema herpeticum o erupción varioliforme de Kaposi, que deberán tratarse con aciclovir oral o intravenoso según la gravedad del proceso.
- Infecciones fúngicas. Se ha descrito también una mayor incidencia de infecciones fúngicas como las causadas por Trichophyton rubrum. Es posible además, que Malassezia furfur interfiera en los mecanismos inmunológicos que determinan la patogenia de la enfermedad, sobre todo en las formas localizadas en cabeza, cuello y porción alta de tronco. Aunque no se ha documentado un aumento de colonias, si existe un aumento de la IgE específica contra Malasezzia. La respuesta Th2 en los pacientes atópicos predispondría al incremento en la síntesis de IgE y al desarrollo y respuestas de hipersensibilidad frente a Malasezzia. Un estudio reciente revela una flora de Malasezzia diferente en niños y adultos con DA y afectación de cabeza y cuello. En ocasiones puede ser necesario completar el tratamiento en algunas zonas como cuero cabelludo o pliegues con antifúngicos tópicos.
Dieta
Existe controversia respecto al papel de la dieta en la patogenia de la DA. La influencia de la dieta en la DA es relevante solo en un porcentaje muy pequeño de los casos, y casi siempre en niños pequeños. Si existe una sospecha clara de alergia alimentaria, el diagnóstico debe confirmarse mediante determinación de anticuerpos IgE específicos, prick test cutáneo o pruebas de provocación oral. Solo basándose en la positividad de estas pruebas puede recomendarse una dieta especial. Los alimentos más frecuentemente incriminados son la leche de vaca, el huevo, el plátano y el pescado. Por tanto, no existen pruebas suficientes para recomendar dietas de eliminación de rutina si no se han producido reacciones alérgicas de tipo I. La evitación sistemática de alimentos, incluso en los casos en que se haya demostrado sensibilización alérgica a alguno de ellos no suele conducir a la desaparición de la DA, y solo en algunos casos conduce a cierta mejoría.
Factores medioambientales
El clima templado y húmedo favorece la humidificación del estrato córneo, por lo que es mejor tolerado que el clima frío y seco. El calor excesivo y el sudor pueden desencadenar brotes de dermatitis. La exposición solar suele tener un efecto beneficioso. Sin embargo, si el paciente presenta lesiones activas, puede producir aumento de la sensación de escozor.
No está claro si las medidas encaminadas a erradicar los ácaros pueden tener algún papel en el tratamiento de la DA. Así, en algunos estudios parece que la intensidad de los brotes disminuye tras reducir su número en los hogares, pero en otros no se confirma esta hipótesis. Un estudio reciente sugiere que la colonización de los hogares por Staphilococcus aereus podría tener un papel agravante de la DA.
En cuanto a la ropa se recomienda el uso de prendas de algodón y evitar la lana, fibras sintéticas, plástico o gomas, así como cualquier prenda oclusiva que favorezca la sudoración, ya que el sudor es un factor importante como desencadenante de brotes en la DA. Recientemente se están realizando estudios con nuevos tejidos (Dermasilk®) con materiales antimicrobianos capaces de reducir la colonización por Staphilococcus aureus, cuya utilidad práctica parece escasa.
Factores psicológicos
Aunque resulta difícil demostrarlo mediante estudios de calidad, se observa en la práctica clínica una relación entre el estrés y los brotes de DA. Además el estrés emocional puede desencadenar respuestas de picor y rascado en pacientes atópicos, interfiriendo en la función barrera cutánea.
Prevención
Medidas durante el embarazo
El efecto de la lactancia materna sobre la DA es objeto de controversia. Aunque algunos autores han encontrado un efecto protector cuando hay antecedentes familiares de atopia, otros encuentran un aumento del riesgo asociado con la prolongación de la lactancia materna. En el momento actual no existe evidencia de que la dieta o la presencia de aeroalergenos durante el embarazo tenga influencia en el desarrollo de la DA.
Probióticos
Sin embargo algunos estudios apoyan el posible efecto beneficioso de la administración de cepas probióticas durante el embarazo y lactancia. La teoría de la higiene postula que el aumento en la incidencia de la DA se debe a un descenso de la exposición a microorganismos durante los primeros años de vida. Así, se produciría una alteración en la regulación de la respuesta inmune y en el balance Th1/Th2, que daría lugar a una respuesta excesiva en estos pacientes a las infecciones por diferentes microorganismos. La manipulación de la respuesta inmune innata mediante la administración de bacterias probióticas (Lactobacillus) en los primeros años de vida podría así mejorar los síntomas ató-picos. Parece que esta mejoría podría deberse a un incremento en la producción de IFNγ. El potencial inmunomodulador de las diferentes cepas probióticas comporta considerables diferencias. Una revisión sistemática reciente de 13 estudios controlados aleatorizados sintetiza la evidencia actual respecto al uso de probióticos como prevención durante el embarazo en madres de alto riesgo, y como tratamiento en los primeros meses de vida. Parece que especialmente L. rhamnosus podría ser efectivo en la prevención de la DA, sin embargo son necesarios más estudios al respecto. Además redujeron la gravedad de la DA en la mitad de los estudios evaluados, aunque no se demostró una disminución significativa de los niveles de la mayoría de los marcadores inflamatorios (INFγ, Il-4). En otros estudios los probióticos solo fueron eficaces en niños con sensibilización alimentaria. Son necesarios más estudios para aclarar la verdadera eficacia de los probióticos en la prevención y tratamiento de la DA.
Suplementos de ácidos grasos
Los ácidos grasos poliinsaturados son componentes de las membranas celulares y pueden tener una función inmunomoduladora en la DA. Los resultados de los estudios con suplementos de ácido gammalinolénico en la dieta de lactantes y niños pequeños realizados hasta ahora son controvertidos. En el momento actual no existe evidencia suficiente para apoyar la suplementación de aceite de pescado, borraja, linoleico y linolénico.
Tratamiento farmacológico de los brotes
El tratamiento del paciente atópico persigue dos objetivos fundamentales. En primer lugar, aliviar los síntomas de la enfermedad y controlar los brotes y, en segundo lugar, disminuir la frecuencia de los mismos, modificando el curso de la enfermedad.
Corticoides tópicos
Los corticoides tópicos han sido durante varias décadas el tratamiento fundamental de la DA. Aún hoy constituyen el tratamiento de primera línea para inducir la remisión y controlar los brotes moderados y graves. Actúan reduciendo la inflamación, disminuyendo el prurito, el rascado y la irritación cutánea. Los corticoides pueden clasificarse según su potencia (determinada por su efecto vasoconstrictor o de blanqueamiento de la piel) en cuatro grandes grupos (tabla II). La potencia del corticoide que debemos emplear varía según el estadio de la DA, así como el excipiente a utilizar. Así, en las lesiones muy exudativas, elegiremos una crema como vehículo. Sin embargo, en las lesiones más liquenificadas elegiremos una pomada o ungüento, en el cuero cabelludo una loción y en los pliegues una crema o emulsión. Siendo el excipiente más graso en las pomadas o ungüentos, el efecto es similar a una cura oclusiva, aumentando la absorción. Deben emplearse una o dos veces al día según la gravedad del eccema. Debe tenerse en cuenta igualmente la zona a tratar, de manera que en zonas de piel fina como pliegues o cara se aplicará preferentemente un corticoide suave, mientras que en zonas de piel más gruesa como palmas y plantas usaremos un corticoide más potente. Los brotes de la enfermedad pueden tratarse con un corticoide de potencia media o alta aplicado 1 ó 2 veces al día durante 5-7 días, hasta inducir la remisión, pasando entonces al tratamiento de mantenimiento con inhibidores de la calcineurina o emolientes. Puede reducirse el riesgo de efectos adversos con la aplicación de corticoides de mayor potencia durante periodos más cortos, frente al empleo de los de menor potencia que requerirán de tratamientos más prolongados. El riesgo de taquifilaxia se reduce si se aplican durante periodos cortos de tiempo y de forma discontinua.
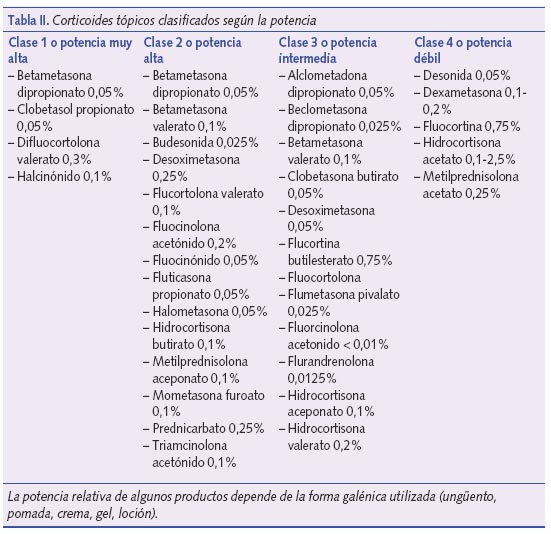
Es frecuente que los padres se muestren preocupados respecto al uso de corticoides. Deben explicarse los beneficios del tratamiento, puesto que, bien empleados, los corticoides son un arma eficaz y segura en la gran mayoría de casos.
Los efectos adversos dependen de:
- La potencia del corticoide: a mayor potencia mayor riesgo de atrofia cutánea. Los nuevos corticoides no fluorados, con similar actividad antiinflamatoria, pero desprovistos de una buena parte de la actividad antimitótica, inducen menos efectos secundarios.
- La edad del paciente: la piel del anciano es más susceptible a la aparición de telangiectasias, púrpura y atrofia. La piel de niños y adolescentes presenta con más frecuencia estrías de distensión.
- La zona de aplicación: la piel fina de los pliegues, cara o genitales presenta con más frecuencia secuelas por el uso de corticoides.
- El empleo de cura oclusiva aumenta el potencial atrofogénico de los corticoides.
Los efectos secundarios descritos son poco frecuentes, con un buen perfil beneficio-riesgo cuando se utilizan adecuadamente. Localmente pueden inducir atrofia, hipopigmentación, aparición de estrías de distensión, dermatitis perioral, foliculitis, eritema facial persistente, telangiectasias, erupciones acneiformes, hipertricosis local o dermatitis de contacto.
La atrofia cutánea es parcialmente reversible al principio. Cuando se prolonga en el tiempo se hace muy evidente y deja de ser reversible. Se trata de un fenómeno frecuente en los tratamientos realizados durante más de 3-4 semanas con corticoides de elevada potencia, sobre todo en zonas de piel fina o pliegues. En ancianos, la atrofia y la púrpura son particularmente evidentes en las zonas de elastosis solar previa. La aparición de brotes de pústulas inflamatorias, que cursan de forma monomorfa y sin lesiones comedonianas, se denomina acné corticoideo. Aparece habitualmente en la espalda, los hombros y la cara. Tanto los excipientes como los propios corticoides pueden producir eccema alérgico de contacto, debiendo sospecharse cuando el eccema no mejora o incluso empeora con el tratamiento.
A nivel sistémico los efectos secundarios de los corticoides tópicos son excepcionales, puesto que en su correcta aplicación, su absorción es mínima. En tratamientos prolongados, con corticoides potentes y especialmente en cura oclusiva, es posible la supresión del eje hipotálamo-suprarrenal. Se han descrito casos de síndrome de Cushing iatrogénico, retraso en el crecimiento infantil o hiperaldosteronismo, aunque se trata de hallazgos extraordinariamente raros. Igualmente infrecuentes son las complicaciones oftalmológicas como glaucoma y cataratas.
Inmunomoduladores tópicos
Los inhibidores tópicos de la calcineurina surgen como alternativa a los corticoides tópicos, en respuesta a la demanda de agentes antiinflamatorios no esteroideos, sin la capacidad atrofogénica de los corticoides.
- Tacrolimus (FK506) es un macrólido inmunomodulador que inhibe la fosfatasa calcineurina, impidiendo la activación de linfocitos T, la transcripción de citocinas proinflamatorias y la liberación de mediadores de mastocitos y basófilos en la piel. En el 2000, la Food and Drugs Administration estadounidense (FDA) aprobó su uso en DA moderada o grave en niños mayores de 2 años. La pomada de tacrolimus se ha mostrado eficaz en la reducción de los síntomas de la DA moderada y grave en niños mayores de 2 años y adultos. Se encuentra disponible en concentraciones de 0,03% y 0,1%. Es más eficaz a la concentración más elevada, a igualdad de efectos secundarios. La potencia del tacrolimus al 0,1% es equivalente a la de un corticoide de mediana potencia. Los efectos secundarios más frecuentes son el picor y quemazón o eritema en la zona tratada. Manteniendo el tratamiento, la sensación de escozor irá disminuyendo en sucesivas aplicaciones. Se ha descrito una mayor incidencia de infecciones locales víricas en niños tratados frente a la aplicación del vehículo aislado. A nivel sistémico la absorción es mínima, estando en muchos pacientes por debajo del límite detectable en suero.
- Pimecrolimus es un derivado de la ascomicina con mecanismo de acción similar a tacrolimus, pero con aún menor absorción sistémica. Se encuentra comercializado en crema al 1%. Al igual que el tacrolimus, se ha demostrado eficaz en el control de los síntomas de la DA leve a moderada, en niños y adultos, con mejoría habitualmente en la primera semana. Sus efectos adversos son comparables a los de tacrolimus pero se producen con menos frecuencia. Al igual que el tacrolimus, se considera de primera elección en zonas como cara, cuello o genitales, donde el empleo continuado de corticoides está contraindicado.
Recientemente la EMEA15 ha aprobado la aplicación de la pomada de tacrolimus en un régimen de 2 veces por semana para la prevención de los brotes y la prolongación de periodos sin brotes. Este régimen de aplicación está indicado para adultos y niños a partir de 2 años, con DA moderada o grave. La decisión se basó en los resultados de los dos estudios CONTROL16,17 de fase III llevados a cabo en 524 adultos y niños en 13 países europeos, en los que se observó que una vez que los pacientes habían respondido al tratamiento de dos veces al día con la pomada de tacrolimus, la continuación del tratamiento con un régimen de aplicación de 2 veces por semana reducía significativamente el número de brotes en comparación con el régimen de tratamiento limitado a los brotes. Casi el 50% de los pacientes del grupo que usó tacrolimus 2 veces por semana no experimentaron ningún brote durante los 12 meses del periodo de estudio.
En el 2005 la FDA levantó la alarma en torno al riesgo teórico de que los inmunomoduladores tópicos fueran capaces de inducir carcinogénesis a largo plazo, basándose en la experiencia con inmunomoduladores orales, estudios con animales, y en algunos casos aislados de linfoma comunicados en pacientes en tratamiento con pimecrolimus y tacrolimus, en los que no pudo encontrarse una relación causal. Numerosos colectivos dermatológicos respondieron apoyando la seguridad de los inhibidores de la calcineurina, y comités de expertos en Oncología concluyeron que los linfomas comunicados no tenían relación con el uso tópico de estas sustancias. Desde entonces ningún estudio epidemiológico ha podido encontrar una asociación entre estos medicamentos y el aumento de la incidencia de neoplasias. Los múltiples estudios sobre la seguridad del tacrolimus y pimecrolimus, con pacientes en seguimento hasta 5 años con el primero y al menos uno con el segundo, se reafirman en el excelente perfil de seguridad de ambos. Se han realizado más de 5,4 millones de prescripciones de tacrolimus en todo el mundo sin poderse evidenciar ninguna relación con la aparición de neoplasias. Sin embargo, a menudo los padres nos preguntan angustiados al respecto. Debemos tranquilizarles explicando que se ha demostrado que la absorción percutánea de ambas es mínima, el perfil de seguridad favorable y que no se ha encontrado hasta la fecha asociación alguna con la aparición de neoplasias en estos pacientes en ninguno de los estudios realizados.
En EE. UU. y Europa el tacrolimus (0,03%) y el pimecrolimus (1%) están aprobados para su uso en DA en mayores de 2 años, mientras que el tacrolimus al 0,1% está aprobado solo en adultos. Sin embargo en la práctica clínica, se utilizan en ocasiones en lactantes de más de 6 meses con DA que requieren corticoides de manera continuada o bien en zonas conflictivas como en la cara con muy buena experiencia en cuanto a eficacia y seguridad. Se administran en capa fina 2 veces al día. Debe evitarse su empleo en pacientes inmunodeprimidos y en otras situaciones de riesgo, como dermatosis que puedan predisponer al desarrollo de neoplasias, alergia a macrólidos o infección viral activa.
El hallazgo de la eficacia de los inhibidores tópicos de la calcineurina, sin el inconveniente de producir atrofia cutánea, hace que los utilicemos como ahorradores de corticoides en pacientes que requieren un uso prolongado de los mismos, o como tratamiento de mantenimiento para prevenir los brotes.
Tratamiento sistémico: corticoides orales
Se utilizan en ciclos cortos para el control agudo de brotes graves. Resultan muy eficaces en dosis de 0,5-1 mg/kg/día con reducción progresiva en pauta descendente, pero debe evitarse su empleo a largo plazo por el riesgo de efectos secundarios sistémicos, posible efecto rebote tras suspender el tratamiento y riesgo de desarrollar taquifilaxia.
Fototerapia
Todas las modalidades de fototerapia (UVA-1, PUVA, UVB, UVB banda estrecha), han demostrado eficacia en la disminución del prurito y la inflamación que caracterizan a la DA. Actúa inhibiendo la presentación de antígenos por las células de Langerhans, la activación de linfocitos T y modificando la producción de citoquinas por parte de los queratinocitos. La recidiva es habitual al suspender el tratamiento, por lo que es necesario valorar el riesgo-beneficio o instaurarlo como parte de una medida rotativa. Son efectos secundarios a largo plazo el fotoenvejecimiento y la fotocarcinogénesis. Debe considerarse una alternativa, como adyuvante al tratamiento tópico, en el tratamiento de mantenimiento (una vez resuelto el brote agudo) de pacientes córtico-dependientes. En la población pediátrica existe la contraindicación relativa de no administrarlo en menores de 12 años, siendo además un tratamiento que obliga al absentismo escolar y laboral de los padres, deteriorando en ocasiones aún más la calidad de vida de los pacientes.
Tratamiento alternativo: inmunosupresores
Ciclosporina. Existen numerosos estudios controlados aleatorizados avalando la eficacia de la ciclosporina en la DA. Se trata de un macrólido capaz de inhibir la activación de las células T y modular la respuesta inmune mediada por células. Se trata de un tratamiento rápido y eficaz, debiendo plantearse en pacientes con DA grave, recalcitrante y refractaria a otros tratamientos. Parece tan eficaz en adultos como en niños, a dosis de 2,5 a 5 mg/kg/día. Puede utilizarse de forma discontinua en tratamiento de 3-4 meses con suspensión posterior, o de forma más prolongada a dosis más bajas para prevenir recurrencias. Los efectos adversos son dosis-dependiente, debiéndose monitorizar la tensión arterial y los niveles de creatinina por el riesgo de toxicidad renal. Debe tenerse en cuenta el riesgo de interacciones con drogas que se metabolicen por el sistema citocromo P450. Se han descrito casos aislados de trastornos linfoproliferativos en niños con DA tratados con ciclosporina, sin embargo no se ha establecido una relación causal con el tratamiento.
Azatioprina. Existen escasos ensayos clínicos aleatorizados controlados valorando la eficacia de la azatioprina. Sin embargo en la práctica clínica se utiliza con buenos resultados en casos graves y refractarios a los tratamientos previos. Se metaboliza en hígado a 6-mercaptopurina y después a nucleótidos de 6-tioguanina, que parecen los responsables de su acción inmunosupresora. Se utiliza en dosis de 50 a 200 mg/día, recomendándose ajustar la dosis según los niveles de tiopurina metiltransferasa en sangre. Un estudio retrospectivo reciente realizado en niños demuestra la disminución en el riesgo de mielotoxicidad cuando se ajusta la dosis según los niveles enzimáticos, de manera que se evita su uso cuando existen niveles bajos de la enzima.
Sus principales efectos secundarios son la depresión medular, intolerancia gastrointestinal y hepatotoxicidad, presentando además el inconveniente de una mayor latencia de acción (2-3 meses) que otros tratamientos como la ciclosporina.
Metotrexate. Es un antagonista del ácido fólico con actividad antiinflamatoria e inmunosupresora. Existe un estudio abierto de ajuste de dosis con mejoría tras administrarlo en dosis de 7,5 a 25 mg semanales durante 3 meses en pacientes adultos con formas graves y resistentes. Sin embargo, son necesarios más estudios controlados para poder evaluar su eficacia en el tratamiento de la DA.
Interferon γ. Se trata de una citoquina que inhibe la producción de IgE y la proliferación de células Th2 productoras de IL-4 y 5. Existen 2 ensayos aleatorizados controlados durante 12 semanas, valorando la eficacia de la administración subcutánea. En ambos la respuesta fue superior a placebo. Sin embargo ambos estudios han sido criticados por la mala calidad del diseño. Como efectos secundarios puede producir síntomas pseudogripales, así como leucopenia y trombopenia.
Micofenolato mofetilo. Es un inhibidor de la síntesis de purinas que parece también eficaz en la atopia grave. Existen 2 estudios no controlados sobre su uso en DA, con un total de 20 pacientes, en los que se produjo una mejoría del 55 y 68% a las 10 semanas de tratamiento.
Inmunoglobulinas intravenosas. Existen escasos estudios, con resultados contradictorios. Parece que puede ser eficaz en monoterapia en algunos pacientes, especialmente niños, siendo aparentemente necesario en adultos inmunosupresión concomitante. Se podría plantear en pacientes en los que hubieran fracasado todas las anteriores medidas terapéuticas.
Inhibidores de los leucotrienos. Zafirlukast y montelukast se utilizan en la rinitis alérgica y el asma, siendo su papel en la DA actualmente controvertido. Existe un estudio doble-ciego con montelukast a dosis de 10 mg/día en el que resultó superior a placebo. Sin embargo otros autores no han encontrado eficacia, por lo que no es posible actualmente extraer conclusiones. Se trata por otra parte de fármacos con un excelente perfil de seguridad, por lo que podrían resultar útiles especialmente en pacientes con asma concomitante.
Tratamientos biológicos. Los anticuerpos monoclonales se han utilizado ampliamente en psoriasis, comunicándose su uso en DA en casos aislados con infliximab, etanercept y efalizumab. También existe un estudio de 9 pacientes con alefacept. De entre ellos el que parece haber dado mejor resultado es el efalizumab, un anticuerpo monoclonal humanizado contra el CD 11a, que se ha utilizado a dosis de 1 mg/kg en un estudio prospectivo con 10 pacientes con buen resultado. El omalizumab es un anticuerpo monoclonal humanizado que se une a 2 moléculas de IgE, impidiendo la unión a sus correspondientes receptores en los mastocitos, basófilos y células presentadoras de antígenos. Actualmente está aprobado para el tratamiento del asma refractaria en niños mayores de 12 años. La dosis se ajusta en función del peso y los niveles de IgE. Se ha utilizado en la DA con resultados variables, atribuyéndose los malos resultados iniciales de algunos autores a una dosis insuficiente para los niveles de IgE. Otros autores han comunicado buenos resultados en pacientes con IgE moderadamente elevada, con muy buen perfil de seguridad. Debe tenerse en cuenta esta posibilidad terapéutica en pacientes que no han respondido a otros tratamientos, especialmente si presentan asma concomitante.
Wet wraps. Se ha encontrado beneficio clínico tras la aplicación de tratamiento con ropas húmedas y emolientes o corticoides tópicos en casos de brote grave de DA. Para algunos autores constituiría una segunda o tercera línea de tratamiento, aunque hacen falta estudios controlados aleatorizados. Debe tenerse en cuenta el aumento de la absorción percutánea al aplicarse cualquier tratamiento en oclusión.
Hierbas chinas. Es un tratamiento controvertido, existiendo estudios que encuentran eficacia en la DA. Se han descrito efectos adversos hepáticos, e incluso inducción de cataratas, por lo que actualmente se desaconseja su uso.
Tratamiento adyuvante
La educación de los padres y pacientes. La educación y apoyo a padres y cuidadores es fundamental. Debe dedicarse el tiempo suficiente a explicar la naturaleza, evolución y tratamiento de la enfermedad. Esta medida es considerada por algunos autores como la más importante en el correcto manejo de la DA.
Tratamiento del prurito. El prurito de la DA no está mediado por histamina. Los antihistamínicos de primera generación como la hidroxicina o la dexclorfeniramina, son útiles por su efecto sedante en el tratamiento del prurito que aparece en los brotes graves de DA. Por el contrario, los antihistamínicos no sedantes tienen un papel modesto en el tratamiento de la DA, siendo sin embargo útiles si se asocian a rinitis alérgica o asma. La levocetirizina es segura y de cómoda posología, por lo que en ocasiones, aun conociendo su limitada eficacia, lo asociamos en el tratamiento de los brotes. Existen estudios evaluando el papel de la aplicación tópica de doxepina, cromoglicato y naltrexona en el prurito de la DA, pero no existe evidencia suficiente para extraer conclusiones.
Psicoterapia. Algunos autores han hecho hincapié en la importancia del apoyo psicológico y de la reducción del estrés en el manejo del paciente atópico. Técnicas de psicoterapia, como la hipnosis o técnicas de modificación del comportamiento y reducción del estrés, pueden en ocasiones resultar útiles como tratamiento adyuvante de los pacientes atópicos.
Dermatitis atópica. Tratamiento según la gravedad
Formas leves:
- Puede ser suficiente con las medidas generales de aseo e hidratación.
- En fases de reagudización emplearemos un corticoide tópico de potencia baja o media entre 5-10 días.
Formas moderadas:
- Seguir de forma constante las medidas generales.
- Cuando se presenten reagudizaciones las trataremos con un corticoide tópico de potencia baja, media o alta según la gravedad durante periodos breves. Puesto que los pacientes requerirán el empleo repetido de estos fármacos, debe prestarse atención a su perfil de seguridad y absorción.
- Utilizaremos un inhibidor de la calcineurina tópico de mantenimiento, haciendo hincapié en su uso en brotes leves o moderados, o al principio del brote como ahorrador de corticoides.
- Administrar antihistamínicos antiH1 por vía oral mientras exista prurito intenso. Los antihistamínicos de primera generación son más eficaces con este propósito. No deben emplearse nunca antihistamínicos por vía tópica.
Formas graves:
- El brote grave aislado de DA debe tratarse inicialmente con corticoides orales, disminuyendo progresivamente la dosis para disminuir el riesgo de taquifilaxia. Se administrarán por vía oral en ciclos cortos, con dosis iniciales de 0,5-1 mg/kg de peso/día de prednisona, disminuyendo esta de forma paulatina. Se seguirán las medidas de precaución y, en su caso, tratamientos complementarios para el uso de esteroides sistémicos.
- Si la enfermedad no se controla con el tratamiento tópico y el paciente requiere tratamiento con corticoides orales de manera continuada, se valorará iniciar tratamiento con inmunomoduladores, entre los cuales la ciclosporina resulta el más rápido y eficaz. Si la respuesta es escasa o está contraindicada, se valorará iniciar tratamiento con otros inmunosupresores.
En definitiva, el tratamiento del paciente atópico requiere un manejo individual complejo, en el que es necesario tanto el control de factores predisponentes, como el cuidado óptimo de la piel mediante buenos hábitos de higiene y emolientes. Los tratamientos tópicos y/o sistémicos deben adecuar-se a la gravedad y extensión de la enfermedad.
Hasta el momento no existe un tratamiento capaz de modificar el curso de la enfermedad, por lo que resulta necesario investigar nuevos fármacos y medidas que puedan prevenir la enfermedad y controlar los brotes más graves. Se necesitan más estudios para conocer la eficacia real de muchos de estos procedimientos.
Bibliografía
- McKenna SP, Doward LC. Quality of life of children with atopic dermatitis and their families. Curr Opin Allergy Clin Immunol. 2008;8:228-31.
- Misery L, Thomas L, Jullien D, Cambazard F, Humbert P, Dubertret L, et al. Comparative study of stress and quality of life in outpatients consulting for different dermatoses in 5 academic departments of dermatology. Eur J Dermatol. 2008;18:412-5.
- Loden M. The clinical benefit of moisturizers. J Eur Acad Dermatol Venereol. 2005;19:672-88; quiz 686-7.
- Matsumoto T, Yuasa H, Kai R, Ueda H, Ogura S, Honda Y. Skin capacitance in normal and atopic infants, and effects of moisturizers on atopic skin. J Dermatol. 2007;34:447-50.
- Hanifin JM, Cooper KD, Ho VC, Kang S, Krafchik BR, Margolis DJ, et al. Guidelines of care for atopic dermatitis. J Am Acad Dermatol. 2004;50:391-404.
- Loden M. Role of topical emollients and moisturizers in the treatment of dry skin barrier disorders. Am J Clin Dermatol. 2003;4:771-88.
- Lucky AW, Leach AD, Laskarzewski P, Wenck H. Use of an emollient as a steroid-sparing agent in the treatment of mild to moderate atopic dermatitis in children. Pediatr Dermatol. 1997;14:321-4.
- Hagströmer L, Kuzmina N, Lapins J, Talme T, Emtestam L. Biophysical assessment of atopic dermatitis skin and effects of a moisturizer. Clin Exp Dermatol. 2006;31:272-7.
- Lipozencic J, Wolf R. Atopic dermatitis: an update and review of the literature. Dermatol Clin. 2007:25;605-12.
- Ghadially R, Halkier-Sorensen L, Elias PM. Effects of petrolatum on stratum corneum structure and function. J Am Acad Dermatol. 1992;26:387-96.
- Clark EW, Steel I. Investigations into biomechanisms of moisturizing funtion of lanolin. J Soc Cosmet Chem. 1993;44:181-7.
- Andersson AC, Lindberg M, Loden M. The effect of two urea-containing creams on dry, eczematous skin in atopic patients. I. Expert, patient and instrumental evaluation. J Dermatol Treat. 1999;10:165-9.
- Abramovits W, Perlmutter A. Atopiclair™: its position within a topical paradigm for the treatment of atopic dermatitis. Exp Rev Drmatol. 2007;2:115-9.
- Abramovits W, Hebert AA, Boguniewicz M, Kempers SE, Tschen E, Jarratt MT, et al. Patient-reported outcomes from a multicenter, randomized, vehicle-controlled clinical study of MAS063DP (AtopiclairTM) in the management of mild-to-moderate atopic dermatitis in adults. J Dermatolog Treat. 2008;22:1-6.
- European Medicines Agency. Evaluation of Medicines for Human Use. Protopic. Nota informative del 22 de enero de 2009 [en línea] [consultado el 25/4/2009]. Disponible en www.emea.europa.eu/pdfs/human/opinion/Protopic_4034009en.pdf.
- Thaçi D, Reitamo S, Gonzalez Ensenat MA, Moss A, Boccaletti V, Cainelli T, et al. Proactive disease management with 0.03% tacrolimus ointment for children with atopic dermatitis: results of a randomized, multicentre, comparative study. Br J Dermatology. 2008;159:1348-56.
- Wollenburg A, Reitamo S, Girolomoni G, Lahfa M, Ruzicka T, Healy E, et al. Proactive treatment of atopic dermatitis in adults with 0.1% tacrolimus ointment. Allergy. 2008;63:742-50.





