Vol. 27 - Num. 108
Originales
Adherencia a las recomendaciones en el diagnóstico de la infección urinaria: estudio multicéntrico
Josefa Ares Álvareza, M.ª Eulalia Muñoz Hiraldob, M.ª Rosa Albañil Ballesterosc, M.ª José Martínez Chamorrod, Ana Cubero Santose, Beatriz Morillo Gutiérrezf, Rafael Jiménez Alésg
aPediatra. CS Virgen Peregrina. Pontevedra. España .
bCS Doctor Castroviejo. Madrid. España.
cPediatra. CS Cuzco . Fuenlabrada. Madrid. España.
dPediatra. CS Polanco. Polanco. Cantabria. España.
ePediatra. CS San Roque. Badajoz. España.
fServicio de Pediatría. Hospital de Riotinto. Minas de Riotinto. Huelva. España.
gPediatra. CS José Gallego Arroba. Puente Genil. Córdoba. España.
Correspondencia: J Ares. Correo electrónico: finaares@gmail.com
Cómo citar este artículo: Ares Álvarez J, Muñoz Hiraldo ME, Albañil Ballesteros MR, Martínez Chamorro MJ, Cubero Santos A, Morillo Gutiérrez B, et al. Adherencia a las recomendaciones en el diagnóstico de la infección urinaria: estudio multicéntrico . Rev Pediatr Aten Primaria. 2025;27:371-83. https://doi.org/10.60147/8cb9014a
Publicado en Internet: 25-11-2025 - Número de visitas: 1771
Resumen
Introducción: la infección del tracto urinario (ITU) pediátrica debe diagnosticarse cuando existen síntomas compatibles y un urocultivo positivo obtenido mediante una técnica adecuada, aunque los errores diagnósticos son frecuentes.
Objetivo: analizar la inadecuación diagnóstica en ITU, según las recomendaciones del documento español del 2019.
Material y métodos: estudio observacional, prospectivo y multicéntrico, realizado en España entre octubre de 2019 y diciembre de 2020, en el que 206 pediatras de Atención Primaria registraron episodios de sospecha de ITU en sus pacientes.
Resultados: de 1506 registros, 1402 fueron válidos: 1212 (86,4%) diagnósticos adecuados y 190 (13,6%) inadecuados (p <0,001). Causas de inadecuación: urocultivo de muestra inadecuada (37,4%), diagnóstico sin urocultivo (31,6%), interpretación inadecuada del recuento de UFC/mL (26,8%) e infradiagnóstico (4,2%).
El uso de bolsa colectora para urocultivo en <2 años, especialmente en AP frente a urgencias hospitalarias (66,7% vs. 21,7%; p = 0,005), y ausencia de urocultivo en ≥6 años frente a ≥2-5 años (33,9% vs. 66,1%; p = 0,015), se asociaron a mayor inadecuación.
Hematuria (4,7% vs. 11,1%; p = 0,001), pérdida de peso (2,4% vs. 5,8%; p = 0,016) y esterasa leucocitaria positiva (42,8% vs. 53,6%; p = 0,009) se asociaron con mayor probabilidad de errores diagnósticos.
En los inadecuadamente diagnosticados, los urocultivos de control fueron significativamente más frecuentes (39,0% vs. 26,5%; p = 0,002) y concentraron el 23,6% de las prescripciones antibióticas.
Conclusiones: el 13,6% de las sospechas de ITU no cumplieron las recomendaciones, generando un 23,6% de tratamientos antibióticos innecesarios. Hallazgos que subrayan la importancia de reforzar prácticas basadas en la evidencia, particularmente en la obtención de muestras, confirmación microbiológica e interpretación de aislamientos.
Palabras clave
● Adherencia a guías clínicas ● Agentes antibacterianos ● Errores diagnósticos ● Infección del tracto urinario ● Obtención de muestras de orina ● Sobretratamiento ● UrocultivoINTRODUCCIÓN
La infección del tracto urinario (ITU) en Pediatría representa un desafío clínico, diagnóstico y terapéutico, especialmente en el ámbito de la Atención Primaria (AP)1.
Su definición requiere la combinación de dos elementos clave: la presencia de síntomas compatibles y la confirmación mediante un urocultivo positivo. Este debe realizarse de una muestra de orina recogida mediante una técnica adecuada para minimizar el riesgo de contaminación y garantizar la fiabilidad del resultado1-3.
Desde una perspectiva epidemiológica, la prevalencia de la ITU varía considerablemente según la edad y el sexo. En menores de un año, es mayor en niños (3,7%) que en niñas (2%). Esta tendencia se invierte en la edad escolar, afectando al 3% de niñas y al 1% de niños4. Existen, además, factores de riesgo (FR) que aumentan la susceptibilidad a padecer una ITU, entre los que destacan la disfunción vésico-intestinal, anomalías congénitas del sistema urinario como el reflujo vesicoureteral, y la fimosis en los niños5,6.
El diagnóstico en menores de dos años es particularmente complejo por la inespecificidad clínica (fiebre sin foco, irritabilidad, vómitos) y la dificultad para obtener muestras de orina adecuadas, lo que requiere, a menudo, métodos invasivos1,5,6. Aunque la tira reactiva de orina (TRO) es útil como cribado, el diagnóstico definitivo requiere de un urocultivo1,6-9.
El manejo diagnóstico adecuado es fundamental. Por un lado, es crucial un alto nivel de sospecha y un tratamiento antibiótico precoz para reducir el riesgo de cicatrización renal, especialmente en lactantes febriles1,10. El sobrediagnóstico conduce a la prescripción de antibióticos innecesarios, fomentando el desarrollo de resistencias bacterianas, y a pruebas complementarias que suponen una carga adicional para el paciente y para el sistema de salud11,12. Además, la heterogeneidad entre guías clínicas favorece una notable variabilidad en su abordaje diagnóstico1,13-15.
Este estudio tiene como objetivo principal analizar la inadecuación diagnóstica en los episodios de sospecha de ITU en Pediatría en España, según el documento español Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria de 20193 y la Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica de 20112, vigentes en el momento de su inicio.
Como objetivo secundario, se planteó la identificación de los errores diagnósticos más frecuentes, la cuantificación del impacto que esta inadecuación tuvo en el uso de antibióticos y la realización de urocultivo de control (UCc).
MATERIAL Y MÉTODOS
Estudio observacional, prospectivo, multicéntrico y de ámbito nacional, desde octubre de 2019 hasta diciembre de 2020.
La población de estudio fueron niños de 0-15 años, con clínica sugerente de ITU (Tabla 1), atendidos en distintos niveles asistenciales y seguidos en consultas de Pediatría de AP. Colaboraron 206 pediatras de AP de forma voluntaria y aleatoria, distribuidos por todo el territorio nacional (16 comunidades autónomas), que documentaron los episodios de sospecha correspondientes a sus pacientes asignados.
| Tabla 1. Criterios de bacteriuria significativa según el documento Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria de 20193 y clínica asociada a infecciones urinarias en Pediatría6 | ||||
|---|---|---|---|---|
| Método de recogida | Recuento de colonias (UFC/mL) | |||
| Punción suprapúbica | Cualquiera | |||
| Sondaje vesical | ≥10 000 | |||
| Micción espontánea | ≥100 000. Considerar 10 000-50 000 si hay una alta probabilidad clínica de infección urinaria (fiebre + piuria-bacteriuria o en casos de nefropatía) | |||
| Clínica | ||||
| Grupos de edad | Más frecuente ↔-------------↔ Menos frecuente | |||
| Lactantes <3 meses |
|
|
|
|
| >3 meses | Preverbal (<2 años) |
|
|
|
| Verbal(>2 años) |
|
|
|
|
| UFC: unidades formadoras de colonias. | ||||

Los criterios de exclusión fueron: episodios de ITU sin posibilidad de seguimiento, ajenos al cupo del colaborador o sin consentimiento informado.
Los datos anonimizados de profesionales, pacientes y episodios se recopilaron mediante formulario en línea. Cada colaborador registró los datos clínicos y de manejo de los episodios. Además, se les solicitaba que confirmaran o descartaran el diagnóstico inicial de sospecha de ITU, en función de su valoración clínica, a la vista de los resultados de las pruebas disponibles.
Posteriormente, el equipo investigador clasificó cada episodio como “adecuadamente diagnosticado” (EAD) si cumplía los criterios microbiológicos del documento de recomendaciones (Tabla 1) junto con clínica compatible3 (Tabla 1) e “inadecuadamente diagnosticados” (EID) si no lo hacía. Los EID se categorizaron en cuatro subgrupos para un análisis más detallado (Figura 1):
| Figura 1. Diagrama de flujo |
|---|
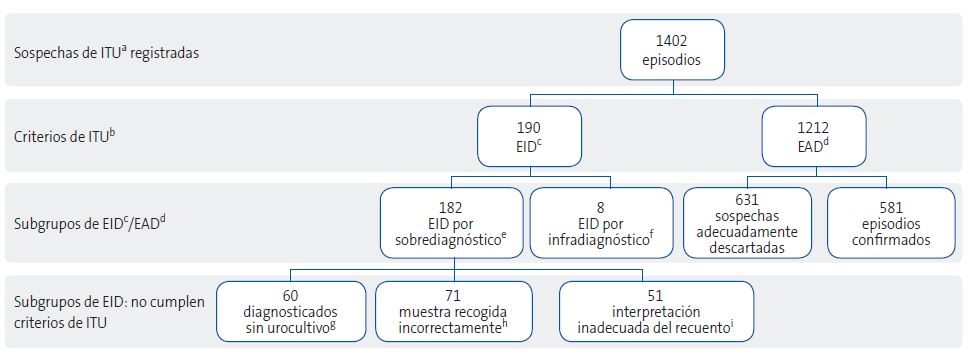 |
|
aITU: infección de orina. bLos investigadores aplicaron los criterios del documento de recomendaciones de 20193 para considerar la adecuación diagnóstica: clínica, factores de riesgo, datos del uroanálisis y urocultivo. cEID: episodios inadecuadamente diagnosticados, por incumplimiento de alguno de los criterios. dEAD: episodios adecuadamente diagnosticados cumpliendo los criterios tanto para confirmar como para descartar la ITU. eEID por sobrediagnóstico: episodios diagnosticados de ITU por los colaboradores que no cumplen los criterios del documento de recomendaciones de 20193. fEID por infradiagnóstico: episodios que cumplen criterios de ITU pero el colaborador no considera ITU. gEpisodios diagnosticados sin urocultivo: solo en base a criterios clínicos y/o de laboratorio (tira reactiva de orina y/o sistemático). hEpisodios con muestra recogida incorrectamente: con diagnóstico microbiológico de muestras recogidas con bolsa colectora en niños incontinentes. iEpisodios con interpretación inadecuada del recuento: diagnóstico microbiológico pero la valoración del recuento de UFC/ml no sigue los criterios del documento de recomendaciones de 20193. |

- Episodios con muestra recogida incorrectamente: el urocultivo se obtuvo mediante una bolsa colectora en un niño incontinente.
- Episodios diagnosticados sin urocultivo: el diagnóstico se hizo con datos clínicos con/sin uroanálisis (sistemático o TRO), sin confirmación microbiológica.
- Episodios con interpretación inadecuada del recuento: la interpretación del recuento de unidades formadoras de colonias (UFC/mL) no cumplía los criterios de bacteriuria significativa según el método de recogida.
- Episodios infradiagnosticados: casos que cumplían criterios de ITU, pero no fueron confirmados como tales por el colaborador.
Se analizaron diferentes variables: características demográficas y profesionales de los pediatras, datos clínicos y demográficos de los pacientes, y de los episodios de ITU y su distribución temporal para evaluar la posible influencia de la pandemia de COVID-19 en la inadecuación diagnóstica. Además, se analizó la petición de UCc, y el uso de antibióticos en los EID. Se realizaron comparaciones entre EID y subgrupos con los EAD de aquellas variables con relevancia estadística e impacto en el estudio.
El estudio obtuvo la aprobación del Comité de Ética del Hospital Universitario de Fuenlabrada, Madrid, (APR 19/03). Los pacientes se incluyeron tras obtener el consentimiento informado de padres/tutores y del paciente mayor de 12 años.
Análisis estadístico: con JASP 0.19.3 se analizaron las variables continuas mediante medias/medianas con sus correspondientes medidas de dispersión (desviación estándar y rango intercuartílico). Las categóricas, como frecuencias y porcentajes. Para comparaciones, se aplicaron χ2 y prueba exacta de Fisher (dicotómicas). Se aplicó la odds ratio (OR) con intervalo de confianza del 95% (IC 95) y p exacta de Fisher para analizar asociaciones entre variables.
RESULTADOS
Se obtuvieron 1506 registros, y 1402 se consideraron válidos para el análisis (Figura 1). De estos, 190 (13,6%) se clasificaron como EID y 1212 (86,4%) como EAD (p <0,001).
Desglose de la inadecuación diagnóstica (Tabla 2.1): el error más frecuente en el grupo de EID fue el uso de una muestra inadecuada (37,4%) por el uso de bolsa colectora. Le siguieron el diagnóstico sin urocultivo (31,6%), la interpretación incorrecta del recuento de colonias (26,8%) y, en menor medida, el infradiagnóstico (4,2%).
| Tabla 2.1. Características demográficas de los colaboradores y ámbitos de trabajo | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| EAD | EID | p | EID muestra inadecuadaa | p | EID sin urocultivo | p | EID recuento inadecuadob | p | |
| N.º episodios (%) | 1212 (86,4) | 190 (13,6) | <0,001 | 71 (37,4) | 60 (31,6) | 51 (26,8) | |||
| SEXOc | |||||||||
| Mujer | 1139 (94,1) | 170 (89,5) | 0,026 | 53 (88,3) | 0,092 | 40 (78,4) | <0,001 | ||
| Hombre | 72 (5,9) | 20 (10,5) | 7 (11,7) | 11 (21,6) | |||||
| Mujeresd | 251 (57,8) | 40 (56,3) | <0,001 | ||||||
| Hombresd | 183 (42,2) | 31 (46,7) | |||||||
| ÁMBITO CENTRO | |||||||||
| Centro rural | 324 (26,7) | 52 (27,37) | 0,860 | 20 (28,2) | 0,235 | 21 (35,0) | 0,160 | 8 (15,7) | 0,079 |
| Centro urbano | 888 (73,3) | 138 (72,63) | 51 (71,8) | 39 (65,0) | 43 (84,3) | ||||
| EXPERIENCIA LABORAL | |||||||||
| >20 años | 758 (62,6) | 125 (65,8) | 0,314* | 43 (84,3) | 0,904* | 47 (78,3) | 0,043* | 30 (58,8) | 0,076* |
| 11-20 años | 312 (25,8) | 49 (25,8) | 20 (28,2) | 8 (13,3) | 19 (37,2) | ||||
| <11 años | 141 (11,7) | 16 (8,4) | 8 (11,3) | 5 (8,3) | 2 (4,0) | ||||
| >20 años en hombres | 44 (71,0) | 18 (94,7) | 0,034 | ||||||
| <11 años en hombres | 18 (29,0) | 1 (5,3) | |||||||
| LUGAR DE SOSPECHA | |||||||||
| Episodios en ConAP | 827 (91,0) | 119 (76,3) | <0,001 | 32 (54,2) | <0,001 | 30 (66,2) | <0,001 | ||
| Episodios en SUAP | 82 (9,0) | 37 (23,7) | 27 (45,8) | 14 (31,8) | |||||
| Episodios en incontinentes ConAP | 254 (94,1) | 54 (96,4) | 0,748 | ||||||
| Episodios en incontinentes SUAP | 16 (5,9) | 2 (3,69) | |||||||
| Episodios en ConAP | 827 (73,2) | 119 (77,8) | 0,241 | 32 (97,0) | <0,001 | 30 (61,1) | 0,347 | ||
| Episodios en SUH | 303 (26,8) | 34 (22,2) | 1 (3,0) | 7 (18,9) | |||||
| Episodios en incontinentes ConAP | 254 (60,6) | 54 (66,7) | 0,005 | ||||||
| Episodios en incontinentes SUH | 165 (39,4) | 15 (21,7) | |||||||
| ConAP: consultas de Atención Primaria; EAD: episodios con diagnóstico adecuado; EID: episodios con diagnóstico inadecuado; SUAP: servicios de urgencia de Atención Primaria; SUH: servicios de urgencia hospitalarios. *P prueba χ2. aEID por muestra recogida incorrectamente. bEID por interpretación inadecuada del recuento de UFC/mL. cEn un episodio no consta el sexo. dSolo el grupo de colaboradores (mujeres y hombres) que han registrado episodios de pacientes incontinentes. | |||||||||

Factores asociados a la inadecuación diagnóstica
Análisis por profesional y nivel asistencial (Tabla 2.1)
Se observó que los profesionales varones, y específicamente los varones con más de 20 años de experiencia, reportaron una proporción significativamente mayor de EID (95% vs. 71%; p 0,034; OR: 6,44; IC 95: 1,18 a 4,18; p = 0,034) y en los diagnosticados sin urocultivo de forma general (OR: 2,14; IC 95: 1,18 a 4,18; p = 0,013) (Tabla 2.2).
| Tabla 2.2. Odds ratio de las características relacionadas con el colaborador entre EID/EAD | ||||
|---|---|---|---|---|
| Variable | OR | IC 95 inferior | IC 95 superior | p |
| Sexo colaborador | 0,54 | 0,32 | 0,92 | 0,026 |
| Centro de salud rural-urbano | 0,91 | 0,30 | 2,53 | 1,000 |
| Cupo <1000 pacientes – ≥1000 pacientes | 1,11 | 0,81 | 1,51 | 0,523 |
| Experiencia laboral >20 años/<11 años | 1,22 | 0,71 | 2,25 | 0,581 |
| Experiencia laboral hombres >20 años/<11 años | 6,44 | 1,17 | 163,03 | 0,034 |
| EID sin urocultivo – Experiencia laboral >20 años/<20 años | 2,14 | 1,18 | 4,18 | 0,013 |
| EID/EAD: episodios inadecuadamente diagnosticados/episodios adecuadamente diagnosticados; IC 95: intervalo de confianza 95%. | ||||

En cuanto al nivel asistencial (Tabla 2.1), la inadecuación fue significativamente más baja en las consultas de AP (ConAP) frente a los servicios de urgencias de AP (SUAP) (OR: 0,32; IC 95: 0,21 a 0,50; p <0,001) (Tabla 2.3).
| Tabla 2.3. Odds ratio de los diferentes grupos de inadecuación según el nivel asistencial | |||||
|---|---|---|---|---|---|
| Variable | OR | IC 95 inferior | IC 95 superior | p | |
| EID/EAD | ConAP/SUAP | 0,32 | 0,21 | 0,50 | 0,0001 |
| SUH/ConAP | 1,28 | 0,86 | 1,94 | 0,241 | |
| Incontinentes muestra inadecuada/EAD | ConAP/SUAP | 1,60 | 0,43 | 11,20 | 0,748 |
| ConAP/SUH | 2,32 | 1,29 | 4,40 | 0,005 | |
| Sin urocultivo/EAD | SUAP/ConAP | 8,51 | 4,86 | 14,90 | 0,0001 |
| ConAP/SUH | 10,28 | 2,22 | 243,39 | 0,0001 | |
| Recuento inadecuado/EAD | ConAP/SUAP | 0,21 | 0,11 | 0,43 | 0,0001 |
| ConAP/SUH | 1,54 | 0,71 | 3,90 | 0,347 | |
| ConAP: consultas de Atención Primaria; EID/EAD: episodios inadecuadamente diagnosticados/episodios adecuadamente diagnosticados; IC 95: intervalo de confianza 95%; SUAP: Servicios de urgencia de Atención Primaria; SUH: Servicios de urgencias hospitalarias. | |||||

Cuando se consideraron solo episodios en incontinentes, la inadecuación fue mayor en las ConAP vs. servicios de urgencias hospitalarias (SUH) por los episodios con muestra inadecuada (OR: 2,32; IC 95: 1,29 a 4,40; p = 0,005) (Tabla 2.3).
La inadecuación por diagnósticos sin urocultivo fue significativamente mayor en los episodios sospechados en los SUAP vs. ConAP (OR: 8,51; IC 95: 4,86 a 14,90; p = 0,0001) (Tabla 2.3).
En los episodios con interpretación inadecuada del recuento, la inadecuación disminuyó cuando las sospechas diagnósticas se realizaban en las ConAP vs. SUAP (OR: 0,21; IC 95: 0,11 a 0,43; p = 0,0001) (Tabla 2.3).
Análisis por características del paciente y episodios (Tabla 3)
| Tabla 3. Características de los pacientes en relación con todos los episodios registrados por los colaboradores | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| EAD | EID | p | EID muestra inadecuadaa | p | EID sin urocultivo | p | EID recuento inadecuadob | p | |
| N.º EPISODIOS (%) | 1212 (86,4) | 190 (13,6) | <0,001 | 71 (37,4) | 60 (31,6) | 51 (26,8) | |||
| EDAD PACIENTES | |||||||||
| Media (DE) (años) | 4,7 (3,9) | 5,7 (3,0) | 0,8 (0,6) | 7,5(3,3) | 6,1 (4,4) | ||||
| Mediana (RIC) (años) | 3,9 (6,3) | 6,9 (4,4) | 0,7 (0,6) | 7,8 (3,5) | 4,7 (6,1) | ||||
| <24 meses | 400 (33,0) | 78 (41,0) | 0,032 | 68 (95,8) | 0,337 | 1 (1,7) | <0,001 | 9 (17,6) | 0,022 |
| ≥24 meses | 812 (67,0) | 112 (59,0) | 3 (4,2) | 59 (98,3) | 42 (82,4) | ||||
| 2-5 años | 414 (50,9) | 45 (40,2) | 0,034 | 20 (33,9) | 0,015 | 19 (45,2) | 0,528 | ||
| ≥6 años | 398 (49,0) | 67 (59,8) | 39 (66,1) | 23 (54,8) | |||||
| 2-5 años mujeres | 334 (50,2) | 18 (34,0) | 0,031 | ||||||
| ≥6 años mujeres | 331 (49,8) | 35 (66,0) | |||||||
| SEXO PACIENTESc | |||||||||
| Mujeres | 886 (73,2) | 140 (73,7) | 0,930 | 53 (88,3) | 0,010 | 40 (78,4) | 0,518 | ||
| Hombres | 324 (26,8) | 50 (26,3) | 7 (11,7) | 11 (21,6) | |||||
| Mujeres incontinentes | 251 (57,8) | 40 (56,3) | 0,897 | ||||||
| Hombres incontinentes | 183 (42,2) | 31 (43,7) | |||||||
| INCONTINENCIA | |||||||||
| Síd | 435 (36,6) | 83 (43,7) | 0,052 | 71 (100) | 4 (6,7) | <0,001 | 8 (15,7) | 0,002 | |
| No | 768 (63, 4) | 107 (56,3) | - | 56 (93,3) | 43 (84,3) | ||||
| N.º DEL EPISODIO | |||||||||
| 1er episodio | 1059 (87,3 | 153 (80,5) | 0,016 | 51 (85,0) | 0,553 | 43 (84,3) | 0,519 | ||
| ≥2º episodio | 153 (12,6) | 37 (19,5) | 9 (15,0) | 8 (15,7) | |||||
| 1er episodio en incontinentes | 388 (89,2) | 54 (76,1) | 0,004 | ||||||
| ≥2º episodio en incontinentes | 47 (10,8) | 17 (23,9) | |||||||
| EAD: episodios con diagnóstico adecuado; EID: episodios con diagnóstico inadecuado; DE: desviación estándar; RIC: rango intercuartílico. aEID por muestra recogida incorrectamente. bEID por interpretación inadecuada del recuento de UFC/mL. cEn dos no consta el sexo. dTotal de incontinentes: 506. | |||||||||

El grupo de episodios con muestra inadecuada pertenecía a los pacientes con menor media de edad, y los diagnosticados sin urocultivo, a los de mayor edad.
La inadecuación diagnóstica fue más frecuente en menores de 24 meses. En el 14% de los episodios de niños incontinentes no patológicos el error diagnóstico fue por muestra inadecuada (71 de 505; Tabla 4). Por otro lado, los diagnósticos sin urocultivo fueron más comunes en ≥6 años respecto al grupo de 2-5 años, con diferencias estadísticamente significativas (66,1% vs. 33,9%; p = 0,015) (Tabla 3).
| Tabla 4. Incontinencia y factores de riesgo de los pacientes de todos los episodios registrados | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Factores de riesgo N (%) | EAD | EID | p | EID muestra inadecuadaa | p | EID sin urocultivo | p | EID recuento inadecuadob | p | |
| Sí | 455 (37,6) | 79 (41,6) | 0,297 | 20 (33,3) | 0,585 | 30 (58,8) | 0,659 | |||
| Sí en incontinentes no patológicosc | 263 (60,5) | 40 (56,3) | 0,517 | |||||||
| Sinequias (mujeres) | 19 (1,7) | 2 (1,4) | 0,756 | 2 (5,0) | 0,229 | |||||
| Fimosis (hombres) | 102 (31,5) | 16 (32,0) | 1,000 | 4 (36,4) | 0,747 | |||||
| Fimosis en niños incontinentesd | 82 (44,8) | 12 (38,7) | 0,560 | |||||||
| ITU previa | 253 (20,9) | 50 (26,3) | 0,107 | 17 (28,3) | 0,194 | 13 (25,5) | 0,482 | |||
| ITU previa en incontinentesb | 63 (14,5) | 15 (21,1) | 0,160 | |||||||
| RVU | 50 (4,1) | 6 (3,2) | 0,690 | 1 (2,0) | 0,719 | |||||
| Otra MFR | 54 (4,5) | 9 (4,7) | 0,851 | 1 (1,7) | 0,513 | 1 (2,0) | 0,165 | |||
| Otra MFR en incontinentesc | 37 (8,5) | 7 (9,9) | 0,653 | |||||||
| Disfunción vesical | 40 (3,3) | 1 (0,5) | 0,034 | |||||||
| Estreñimiento–Encopresis | 90 (7,4) | 10 (5,3) | 0,362 | 3 (5,0) | 0,618 | 2 (3,9) | 0,578 | |||
| Estreñimiento–Encopresis en incontinentesc | 13 (3,0) | 2 (2,8) | 1,000 | |||||||
| Hipercalciuria | 3 (0,3) | 3 (1,6) | 0,036 | 2 (3,3) | 0,020 | 1 (2,0) | 0,152 | |||
| EAD: episodios con diagnóstico adecuado; EID: episodios con diagnóstico inadecuado; ITU: Infecciones urinarias; MFR: malformación renal; RVU: reflujo vesicoureteral. aEID por muestra recogida incorrectamente. bEID por interpretación inadecuada del recuento de UFC/mL. cEAD en incontinentes no patológicos: 435. dEAD niños (hombres) incontinentes: 183. | ||||||||||

Asimismo, se encontró que los primeros episodios fueron significativamente más frecuentes en el grupo de EAD (87,3% vs. 80,5%) y los episodios sucesivos más frecuentes en el grupo de EID (19,5% vs. 12,6%; p = 0,016) (Tabla 3).
Presencia de factores de riesgo
La presencia de FR en conjunto no influyó en la realización de un diagnóstico inadecuado (37,6% vs. 41,6%; p = 0,297). Sin embargo, la disfunción vesical por sí sola se asoció significativamente a una menor probabilidad y la hipercalciuria la incrementó (Tabla 4).
Análisis por presentación clínica y realización uroanálisis
La presencia de hematuria (4,7% vs. 11,1%; p 0,001), pérdida de peso (2,4% vs. 5,8%; p = 0,016), polaquiuria (27,9% vs. 48,3%; p <0,001), disuria (48,6% vs. 90%; p <0,001) y urgencia miccional (13,2% vs. 25,5%; p = 0,008) se asociaron de forma significativa con un diagnóstico inadecuado. Sin embargo, la presencia de fiebre mayor de 38 °C fue significativamente menos frecuente en los diagnosticados con muestra inadecuada en pacientes incontinentes (42,3% vs. 59,5%; p = 0,009) y en los diagnosticados sin urocultivo (25,3% vs. 5%; p <0,001) (Tabla 5).
| Tabla 5. Características clínicas de los episodios registrados | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Clínica N (%) | EAD | EID | p | EID muestra inadecuadaa | p | EID sin urocultivo | p | EID recuento inadecuadob | p |
| Fiebre >38 °C | 376 (31,0) 259 (59,5)c |
48 (25,3) | 0,126 | 30 (42,3)c | 0,009 | 3 (5,0) | <0,001 | 11 (21,6) | 0,166 |
| Disuria | 589 (48,6) 39 (9,0)c |
94 (49,5) | 0,876 | 5 (7,0)c | 0,820 | 54 (90,0) | <0,001 | 31 (60,8) | 0,115 |
| Polaquiuria | 321 (26,5) | 53 (27,9) | 0,724 | 29 (48,3) | <0,001 | 19 (37,3) | 0,106 | ||
| Urgencia miccional | 145 (12,0) | 25 (13,2) | 0,633 | 11 (18,3) | 0,156 | 13 (25,5) | 0,008 | ||
| Cambios en color, olor | 106 (8,8) 34 (7,8)c |
14 (7,4) | 0,675 | 7 (9,9)c | 0,491 | 3 (5,0) | 0,476 | 4 (7,8) | 1,000 |
| Nicturia | 65 (5,4) | 8 (4,2) | 0,601 | 4 (6,7) | 0,562 | 4 (7,8) | 0,356 | ||
| Hematuria | 57 (4,7) 6 (1,4) |
21 (11,1) | 0,001 | 1 (1,4)c | 1,000 | 9 (15,0) | 0,003 | 10 (19,6) | <0,001 |
| Poliuria | 38 (3,1) | 6 (3,2) | 1,000 | 2 (3,3) | 0,713 | 3 (5,9) | 0,227 | ||
| Irritabilidad | 151 (12,5)126 (29,0)3 |
24 (12,6) | 0,906 | 19 (26,8)c | 0,778 | 3 (5,0) | 0,103 | 2 (3,9) | 0,078 |
| Anorexia | 131 (10,8) 105 (24,1)c |
28 (14,7) | 0,139 | 23 (32,4)c | 0,143 | 4 (7,8) | 0,646 | ||
| Vómitos | 115 (9,5) 70 (16,1)c |
14 (7,4) | 0,418 | 9 (12,7)c | 0,597 | 5 (9,8) | 0,811 | ||
| Pérdida de peso | 29 (2,4) 26 (6,0)c |
11 (5,8) | 0,016 | 10 (14,1)c | 0,022 | 1 (2,0) | 1,000 | ||
| Dolor abdominal | 176 (14,5) 15 (3,4)c |
15 (7,9) | 0,012 | 2 (2,8)c | 1,000 | 6 (10,0) | 0,449 | 4 (7,8) | 0,222 |
| Dolor lumbar | 26 (2,1) | 4 (2,1) | 1,000 | 1 (1,7) | 1,000 | 3 (5,9) | 0,108 | ||
| Puñopercusión (+) | 15 (1,2) | 2 (1,1) | 1,000 | ||||||
| EAD: episodios con diagnóstico adecuado; EID: episodios con diagnóstico inadecuado; ITU: Infecciones urinarias. aEID por muestra recogida incorrectamente. bEID por interpretación inadecuada del recuento de UFC/mL. cEpisodios en incontinentes no patológicos; EAD en incontinentes no patológicos totales: 435. | |||||||||

En cuanto los resultados de TRO, lo más relevante fue que la presencia de esterasa leucocitaria (EL) sin nitruria se asoció a una mayor y significativa probabilidad de realizar un diagnóstico sin urocultivo (42,8% vs. 58,8%; p = 0,030). Si ambos parámetros (EL y nitritos) fueron negativos, la probabilidad de inadecuación se redujo (32,5% vs. 15,1%; p <0,001) (Tabla 6).
| Tabla 6. Resultados del uroanálisis y su efecto en la inadecuación | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| TRO/Sistemático N (%) | EAD | EID | p | EID muestra inadecuadaa | p | EID sin urocultivo | p | EID recuento inadecuadob | p |
| Sí realizado | 1146 (94,6) | 166 (87,3) | <0,001 | 51 (100) | 47 (92,2) | 0,524 | |||
| Sí realizado en incontinentesc | 417 (54,3) | 60 (84,5) | 0,001 | ||||||
| N+/EL+ | 217 (18,9) | 43 (25,9) | 0,038 | 15 (29,4) | 0,071 | 7 (14,9) | 0,572 | ||
| N+/EL+ en incontinentesc | 73 (17,5) | 19 (31,7) | 0,014 | ||||||
| N+/EL- | 66 (5,8) | 9 (5,4) | 1,000 | 3 (5,9) | 1,000 | 2 (4,3) | 1,000 | ||
| N+/EL- en incontinentesc | 26 (6,2) | 4 (6,7) | 0,781 | ||||||
| EL+/N- | 491 (42,8) | 89 (53,6) | 0,009 | 30 (58,8) | 0,030 | 29 (61,7) | 0,015 | ||
| EL+/N- en incontinentesc | 162 (38,8) | 25 (41,7) | 0,674 | ||||||
| N-/EL- | 372 (32,5) | 25 (15,1) | <0,001 | 3 (5,9) | <0,001 | 9 (19,1) | 0,057 | ||
| N-/EL- en incontinentesc | 156 (15,1) | 12 (20,0) | 0,009 | ||||||
|
EAD: episodios con diagnóstico adecuado; EID: episodios con diagnóstico inadecuado; EL: esterasa leucocitaria; N: Nitruria; TRO: tira reactiva de orina. aEID por muestra recogida incorrectamente. bEID por interpretación inadecuada del recuento de UFC/mL. cIncontinentes no patológicos. Número de incontinentes no patológicos en EAD: 435. |
|||||||||

Análisis de los episodios infradiagnosticados
Se identificaron 8 episodios en pacientes continentes (Figura 1). Los motivos incluyeron la no consideración de aislamientos dobles (p. ej.: Proteus spp. + Klebsiella spp.), el descarte de gérmenes como E. faecalis o S. saprophyticus a pesar de la clínica compatible, y la no valoración de recuentos bacterianos significativos en pacientes con nefropatía preexistente.
Análisis en relación con la pandemia (Tabla 7)
| Tabla 7. Efecto de la pandemia en la inadecuación | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Efecto pandemia N (%) | EAD | EID | p | EID muestra inadecuadaa | p | EID sin urocultivo | p | EID recuento inadecuadob | p |
| Durante pandemia | 431 (35,6) | 85 (44,7) | 0,019 | 28 (46,7) | 0,098 | 19 (37,3) | 0,882 | ||
| Antes de pandemia | 781 (64,4) | 105 (55,3) | 32 (53,3) | 32 (62,7) | |||||
| Durante pandemia en incontinentes | 164 (37,7)c | 37 (52,1) | 0,116 | ||||||
| Antes de pandemia en incontinentes | 271 (62,3)c | 34 (47,9) | |||||||
| EAD: episodios con diagnóstico adecuado; EID: episodios con diagnóstico inadecuado. aEID por muestra recogida incorrectamente. bEID por interpretación inadecuada del recuento de UFC/mL. cNúmero total de incontinentes no patológicos en EAD: 435. | |||||||||

El estudio también evaluó el impacto de la pandemia de COVID-19 en la inadecuación. Se observó un mayor porcentaje de EID en relación al grupo de EAD durante este periodo (44,7% vs. 35,6%; p = 0,019), en comparación con los meses previos.
Análisis del manejo posterior inmediato
Se valoró la petición de UCc, que se solicitaron con más frecuencia en los EID frente a EAD (39% vs. 26,5%; p = 0,002) (Tabla 8). Además, en el 42,3% de los EID en los que se realizó un urocultivo, la demora en conocerse los resultados fue superior a 72 horas. Del total de los antibióticos prescritos, el 23,6% (n = 180) correspondieron a diagnósticos inadecuados. El tratamiento se inició inmediatamente tras la sospecha en el 80% de los casos, con una duración media de 7,9 ± 2 días. No hubo diferencias significativas en la duración frente a los EAD (Tabla 9).
| Tabla 8. Relación entre el urocultivo de control y la inadecuación diagnóstica | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Urocultivo de control N (%) | EAD | EID | p | EID muestra inadecuadaa | p | EID sin urocultivo | p | EID recuento inadecuadob | p |
| No se hizo | 425 (73,5) | 111 (61,0) | 0,002 | 34 (66,7) | 0,324 | 33 (64,7) | 0,190 | ||
| Sí se hizo | 153 (26,5) | 71 (39,0) | 17 (33,3) | 18 (35,3) | |||||
| Sí se hizo en incontinentes | 164 (80,4)c | 35 (49,3) | <0,001 | ||||||
| No se hizo en incontinentes | 40 (19,6)c | 36 (50,7) | |||||||
| EAD: episodios con diagnóstico adecuado; EID: episodios con diagnóstico inadecuado. aEID por muestra recogida incorrectamente. bEID por interpretación inadecuada del recuento de UFC/mL. cNúmero total de incontinentes no patológicos en EAD: 435. | |||||||||

| Tabla 9. Tiempo hasta el resultado del urocultivo y tratamiento antibiótico en los EID | |
|---|---|
| Tiempo en recibir los resultados del UCa | |
| Episodios con resultado del UC <48 horas | 4 (3,1%) |
| Episodios con resultado del UC 48-72 horas | 43 (33,1%) |
| Episodios con resultado del UC >72 horas | 55 (42,3%) |
| Episodios con tiempo desconocido | 28 (21,5%) |
| Episodios con AB | |
| N.º total de episodios con AB en EID | 182 (23,6%)b |
| Inicio del tratamiento AB | |
| Inmediato | 147 (80,8%) |
| Al día siguiente | 6 (3,3%) |
| 2 días | 7 (3,8%) |
| 3 días | 3 (1,6%) |
| >3 días | 16 (8,8%) |
| No consta cuando se inició | 3 (1,6%) |
| Duración (días) del tratamiento AB (media ± DE) | |
| Duración en EIDc | 7,9 ± 2,0 |
| Duración en EADc | 6,7 ± 3,1 |
| AB: antibiótico; DE: desviación estándar; EAD: episodios con diagnóstico adecuado; EID: episodios con diagnóstico inadecuado; UC: urocultivo; aNúmero de EID con UC: 130. bTotal de AB prescritos: 772 (76,4% en EAD). cNo existen diferencias significativas en la duración entre EID y EAD. | |

DISCUSIÓN
Un hallazgo relevante del estudio es que el 13,6% de los episodios diagnosticados de ITU no se ajustaron a las recomendaciones publicadas en 20192,3 y casi una cuarta parte (23,6 %) de los tratamientos antibióticos se prescribieran de manera innecesaria. Este hecho refleja una adherencia subóptima a las guías de práctica clínicas (GPC) vigentes3,16, aunque son datos inferiores a las tasas de inadecuación reportadas en otros estudios (53-75%), tanto en los realizados exclusivamente en SUH como en aquellos que incluyeron casos en centros de AP11,12,17-19. La inclusión en nuestra serie de pediatras de AP, con un seguimiento longitudinal de los pacientes, pudo favorecer una mayor adherencia.
Se observó que la experiencia laboral se asociaba a una menor y significativa adherencia a las recomendaciones (Tablas 2.1 y 2.2). Esta relación es un fenómeno ampliamente reconocido en la literatura médica. Profesionales con mayor experiencia pueden mostrarse más reticentes a adoptar nuevos protocolos, particularmente, si perciben que las recomendaciones son poco claras y heterogéneas. Motivos que pueden favorecer la persistencia de directrices previas, difíciles de abandonar16,20.
El análisis por nivel asistencial revela una mayor tasa de inadecuación diagnóstica cuando la sospecha se realizaba en los SUAP en relación a las realizadas en AP. Se observaron tasas mayores de diagnóstico sin urocultivo y menor aplicación de los puntos de corte recomendados para UFC/mL. La atención médica en estos contextos suele estar a cargo de médicos con formación principalmente en población adulta, lo que favorece la adopción de protocolos propios de esta población y la consecuente inadecuación diagnóstica21.
No obstante, en nuestro estudio el colaborador era el responsable de emitir un diagnóstico final tras valorar los resultados de las pruebas, confirmando o descartando la sospecha. Algunos errores se mantuvieron, probablemente, por la evolución clínica favorable o porque el tratamiento ya se había completado. En la misma línea, estudios sobre errores diagnósticos tras sospechas iniciales evidenciaron que en más de la mitad de los casos se mantuvo el tratamiento a pesar de contar con diagnósticos inapropiados basados, incluso, en los resultados del urocultivo17.
Profundizando en los errores de manejo más comunes, destacaron dos prácticas:
La primera fue por el uso persistente de bolsas colectoras en pacientes incontinentes (14% 71/506; Tabla 3). Es conocida su elevada tasa de falsos positivos que, según revisiones sistemáticas, podría ser del 35-45%22 o incluso mayor del 50%3. Aunque siguen usándose en AP por su simplicidad e incluso en las urgencias hospitalarias23, debería restringirse al cribado inicial en situaciones no urgentes4,24,25. Que el 22% de los diagnósticos en incontinentes por muestra inadecuada ocurrieran en SUH (Tabla 2.1) resulta especialmente relevante dada la disponibilidad de recursos materiales y humanos para realizar técnicas adecuadas de recogida19,23.
La segunda fue el diagnóstico de ITU sin urocultivo (Tabla 3). Un tercio de los EID se diagnosticaron solo por la clínica con/sin uroanálisis. La TRO es una herramienta útil en Pediatría para orientar el diagnóstico y descartar ITU con alta probabilidad, sobre todo en mayores de tres meses9,26. Sin embargo, la esterasa leucocitaria (EL) tiene una baja especificidad (78%)7,27-30 que puede ocasionar falsos positivos en situaciones como la fiebre, deshidratación, vulvovaginitis6. Además, la omisión del urocultivo afectó, principalmente, a pacientes ≥6 años. El predominio de ITU bajas en niñas y la elevada incidencia de vulvovaginitis en prepuberales, con clínica superponible, lleva a interpretar erróneamente estos síntomas como indicativos de ITU17,31. Por ello, la confirmación microbiológica resulta indispensable en la mayoría de los escenarios clínicos habituales1,29,30.
La interpretación de los factores clínicos, junto con la edad, aportan información relevante que influye en la menor adherencia a las recomendaciones. En este sentido, la fiebre se asoció a un diagnóstico más adecuado, probablemente por elevar el nivel de sospecha de una infección bacteriana grave, como la pielonefritis, lo que favorece un manejo más riguroso, y una mayor adherencia a las GPC16,32. En contraposición, síntomas más inespecíficos, como la pérdida de peso o la hematuria, actuaron como factores de confusión, incrementando la inadecuación1,3,30 (Tablas 1 y 3).
Es interesante conocer si la presencia de FR pudo favorecer una mayor adherencia a las recomendaciones, ya que pueden aumentar el riesgo o la gravedad de la ITU (Tabla 4). Se observó que, en conjunto, no cambiaban de forma significativa el manejo. De forma particular, solo la disfunción vesical se asoció a un manejo más preciso, práctica recomendada en las GPC por asociarse fuertemente con recurrencia de infecciones y daño renal1,5,6,33. La hipercalciuria, aunque fue un hallazgo infrecuente, se asoció a una mayor inadecuación diagnóstica. Si bien se reconoce como FR para ITU recurrente (hasta el 20%)34,35, también actúa como factor de confusión diagnóstica, sobre todo si la adherencia es subóptima y no se realiza una adecuada confirmación microbiológica. Su impacto en la sintomatología miccional y la interpretación del uroanálisis pueden favorecer el error diagnóstico en las situaciones descritas34.
Otro punto relevante fue el manejo inadecuado más frecuente en episodios sucesivos, frente a primeros episodios, independientemente de otros factores de riesgo, incluso cuando las GPC establecían recomendaciones claras en estas situaciones2,3,5. La evidencia respalda que la tendencia a la inadecuación en el manejo de los episodios recurrentes se debe principalmente a los hábitos y decisiones de los profesionales responsables más que a factores propios de los pacientes, favoreciendo la repetición de los mismos errores clínicos36.
Las implicaciones de estos hallazgos son considerables. Por un lado, el retraso en la obtención de los resultados de los urocultivos más allá de 72 horas, en casi la mitad de los EID, pudo favorecer el mantenimiento de los tratamientos de forma innecesaria. Una disponibilidad más precoz permitiría ajustar el manejo y evitar el sobretratamiento antibiótico12,29. Por otro lado, el estudio pone en evidencia el impacto que tiene la inadecuación diagnóstica sobre la prescripción de antibióticos. El 23,6% de las prescripciones de antibióticos se realizaron y se mantuvieron en pacientes sin un diagnóstico confirmado según las GPC, lo que no solo expone a los niños a los efectos adversos de fármacos, sino que contribuye al grave problema de las resistencias bacterianas36-38. Sin embargo, este análisis del manejo de la ITU por pediatras de AP revela tasas más bajas que otros estudios previos diseñados, principalmente, desde las urgencias hospitalarias, con tasas del 36-59% de sobretratamiento12,18.
Adicionalmente, se observó una utilización inapropiada del UCc, sobre todo en los EID, pero incluso en los EAD se solicitó en una cuarta parte de los mismos, a pesar de ser una práctica desaconsejada en todas las GPC2,3,5. Su realización rutinaria puede conducir a una cascada de pruebas y tratamientos adicionales innecesarios, aumentando la carga asistencial y los costes1,5,16,37,38.
Entre las fortalezas del estudio se encuentran su diseño prospectivo, el elevado número de registros analizados y su alcance nacional, que proporcionan una visión integral de la práctica diagnóstica de la ITU pediátrica en España. Como limitaciones, cabe señalar que la captación de colaboradores fue voluntaria y desigual entre regiones, lo que impidió una representación proporcional y homogénea de todas las comunidades autónomas.
CONCLUSIONES
Este estudio ha permitido identificar los errores diagnósticos de la ITU pediátrica más prevalentes en la práctica clínica diaria en España: (1) la realización de urocultivo con muestras obtenidas mediante bolsas colectoras en incontinentes; (2) la omisión del urocultivo en presencia de una TRO positiva, especialmente la EL positiva; (3) la interpretación errónea del recuento de colonias sin tener en cuenta el método de recogida; (4) la consideración de signos y síntomas inespecíficos para realizar un diagnóstico de ITU, sin confirmación microbiológica o con el uso de muestra inadecuada1,2,6 y (5) la falta de una valoración individualizada en casos de ITU atípicas37,39.
El porcentaje de errores en el manejo diagnóstico de la ITU ha sido limitado, lo que refleja una práctica clínica de calidad de los pediatras colaboradores16,18. Sin embargo, consideramos que todavía son necesarias intervenciones coordinadas de formación, enfocadas a los diferentes niveles asistenciales, para modificar hábitos y promover la adherencia a las GPC1,13,15,28,38, mejorando la calidad asistencial y la seguridad del paciente20,36.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
El presente estudio ha recibido una beca otorgada por la Asociación Española de Pediatría de Atención Primaria - Fundación para la Salud (AEPap-FPS) para Investigación en Atención Primaria en 2019.
Los datos preliminares y parciales de este estudio se presentaron como comunicación en el 19 Congreso de Actualización en Pediatría de AEPap en 2023.
RESPONSABILIDAD DE LOS AUTORES
Contribución de los autores: redacción del texto (JAA y MEMH), tratamiento estadístico de los datos (RJA), diseño del proyecto, coordinación con los colaboradohres, búsqueda bibliográfica y revisión final del manuscrito (todos).
AGRADECIMIENTOS
A todos los colaboradores que han participado en el reclutamiento de los pacientes y en el registro de episodios.
ABREVIATURAS
AB: antibiótico · AP: Atención Primaria · ConAP: consultas de Atención Primaria · DE: desviación estándar · EAD: episodios de infección de orina adecuadamente diagnosticados · EID: episodios de infección de orina inadecuadamente diagnosticados · EL: esterasa leucocitaria · FR: factor de riesgo · GPC: guías de práctica clínica · IC 95: intervalo de confianza del 95% · ITU: infección urinaria/infección del tracto urinario · MFR: malformación renal · N: nitruria · OR: odds ratio · RIC: rango intercuartílico · RVU: reflujo vesicoureteral · SHU: servicios de urgencias hospitalarias · SUAP: servicios de urgencias de Atención Primaria · TRO: tira reactiva de orina · UC: urocultivo · UCc: urocultivo de control · UFC: unidades formadoras de colonias.
BIBLIOGRAFÍA
- Grupo de trabajo de la Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Guía de Práctica Clínica. Infección del Tracto Urinario en la Población Pediátrica. Actualización 2024 [en línea] [consultado el 20/11/2025]. Disponible en https://serviciopediatria.com/wp-content/uploads/2024/05/2024_GPC-Infeccion-Tracto-Urinario-en-Pediatria.pdf
- Grupo de trabajo de la Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población. Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. 2011 [en línea] [consultado el 20/11/2025]. Disponible en https://portal.guiasalud.es/wp-content/uploads/2018/12/GPC_483_ITU_poblacion_pediatrica_ICS_compl.pdf
- Piñeiro Pérez R, Cilleruelo Ortega MJ, Ares Álvarez J, Baquero-Artigao F, Silva Rico JC, Velasco Zúñiga R, et al. Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria. An Pediatr (Barc). 2019;90:400.el-400.e9. https://doi.org/10.1016/j.anpedi.2019.02.009
- Olson P, Dudley AG, Rowe CK. Contemporary Management of Urinary Tract Infections in Children. Curr Treat Options Pediatr. 2022;8:192-210. https://doi.org/10.1007/s40746-022-00242-1
- SUBCOMMITTEE ON URINARY TRACT INFECTION. Reaffirmation of AAP Clinical Practice Guideline: The Diagnosis and Management of the Initial Urinary Tract Infection in Febrile Infants and Young Children 2-24 Months of Age. 2016;138(6):e20163026. https://doi.org/10.1542/peds.2016-3026
- González Rodríguez J, Justa Roldán M. Protocolos diagnósticos y terapéuticos de Nefrología Pediátrica. Asociación Española de Pediatría. Infección de las vías urinarias en la infancia. 2022. p. 103-9 [en línea] [consultado el 20/11/2025]. Disponible en www.aeped.es/documentos/protocolos-diagnosticos-y-terapeuticos-nefrologia-pediatrica
- Waterfield T, Foster S, Platt R, Barrett MJ, Durnin S, Maney JA, et al. Diagnostic test accuracy of dipstick urinalysis for diagnosing urinary tract infection in febrile infants attending the emergency department. Arch Dis Child. 2022;107:1095-9.
- Becknell B, Watson JR. Reexamining the Role of Pyuria in UTI Diagnosis. Pediatrics. 2024;154. https://doi.org/10.1542/peds.2024-068242
- Shaikh N, Campbell EA, Curry C, Mickles C, Cole EB, Liu H, et al. Accuracy of Screening Tests for the Diagnosis of Urinary Tract Infections in Young Children. Pediatrics. 2024;154. https://doi.org/10.1542/peds.2024-066600
- Shaikh N, Haralam MA, Kurs-Lasky M, Hoberman A. Association of Renal Scarring With Number of Febrile Urinary Tract Infections in Children. JAMA Pediatr. 2019;173:949-52. https://doi.org/10.1001/jamapediatrics.2019.2504
- Kucherov V, Russell T, Smith J, Zimmermann S, Johnston EK, Rana MS, et al. Antibiotic Overtreatment of Presumed Urinary Tract Infection Among Children with Spina Bifida. J Pediatr. 2024;272:114092.
- Hawkins S, Ericson JE, Gavigan P. Opportunities for Antibiotic Reduction in Pediatric Patients With Urinary Tract Infection After Discharge From the Emergency Department. Pediatr Emerg Care. 2023;39:184-7. https://doi.org/10.1097/PEC.0000000000002868
- Hoen LA, Bogaert G, Radmayr C, Dogan HS, Nijman RJM, Quaedackers J, et al. Update of the EAU/ESPU guidelines on urinary tract infections in children. J Pediatr Urol. 2021;17:200-7.
- Brandström P, Lindén M. How Swedish guidelines on urinary tract infections in children compare to Canadian, American and European guidelines. Acta Paediatr. 2021;110:1759-71. https://doi.org/10.1111/apa.15727
- Urinary tract infection in under 16s: diagnosis and management. Guidance. NICE [en línea]. NICE; 2022 [en línea] [consultado el 20/11/2025]. Disponible en www.nice.org.uk/guidance/ng224
- Hadjipanayis A, Grossman Z, Torso S Del, Van Esso D, Dornbusch HJ, Mazur A, et al. Current primary care management of children aged 1–36 months with urinary tract infections in Europe: large scale survey of paediatric practice. Arch Dis Child. 2015; 100:341-7. https://doi.org/10.1136/archdischild-2014-306119
- Ostrow O, Prodanuk M, Foong Y, Singh V, Morrissey l, Harvey G, et al. Decreasing Misdiagnoses of Urinary Tract Infections in a Pediatric Emergency Department. Pediatrics. 2022;150. https://doi.org/10.1542/peds.2021-055866
- Al-Sayyed B, Le J, Al-Tabbaa MM, Barnacle B, Ren J, Tapping R, et al. Uncomplicated Urinary Tract Infection in Ambulatory Primary Care Pediatrics: Are We Using Antibiotics Appropriately? J Pediatr Pharmacol Ther. 2019;24:39-44. https://doi.org/10.5863/1551-6776-24.1.39
- Sanpera Iglesias J, Garcia Nicoletti M. G231(P) Improving the diagnosis and management of urinary tract infections in under 3S in a busy district hospital. Arch Dis Child. 2019;A94.1-A94. https://doi.org/10.1136/archdischild-2019-rcpch.225
- Shehu E, Kugler CM, Schäfer N, Rosen D, Schaefer C, Kötter T, et al. Barriers and facilitators of adherence to clinical practice guidelines in Germany—A systematic review. J Eval Clin Pract. 2025;31:e14173. https://doi.org/10.1111/jep.14173
- Nelson Z, Tarik Aslan A, Beahm NP, Blyth M, Cappiello M, Casaus D, et al. Guidelines for the Prevention, Diagnosis, and Management of Urinary Tract Infections in Pediatrics and Adults: A WikiGuidelines Group Consensus Statement. JAMA Netw Open. 2024;7(11):e2444495. https://doi.org/10.1001/jamanetworkopen.2024.44495
- Ochoa Sangrador C, Pascual Terrazas A. Revisión sistemática de la validez de los urocultivos recogidos con bolsa estéril perineal. An Pediatr. 2016;84:97-105. https://doi.org/10.1016/j.anpedi.2015.04.003
- Cenzato F, Milani GP, Amigoni A, Sperotto F, Bianchetti MG, Agostoni C, et al. Diagnosis and management of urinary tract infections in children aged 2 months to 3 years in the Italian emergency units: the ItaUTI study. Eur J Pediatr. 2022;181:2663-71. https://doi.org/10.1007/s00431-022-04457-0
- Buettcher M, Trueck J, Niederer-Loher A, Heininger U, Agyeman P, Asner S, et al. Swiss consensus recommendations on urinary tract infections in children. Eur J Pediatr. 2021;180:663-74. https://doi.org/10.1007/s00431-020-03714-4
- Herreros ML, Barrios A, Sánchez A, del Valle R, Pacheco M, Gili P. Urine collection methods in precontinent children treated at the paediatric emergency department. Acta Paediatr. 2023;112:550-6. https://doi.org/10.1111/apa.16614
- Schroeder AR, Chang PW, Shen MW, Biondi EA, Greenhow TL. Diagnostic Accuracy of the Urinalysis for Urinary Tract Infection in Infants <3 Months of Age. 2015;135:965-71. https://doi.org/10.1542/peds.2015-0012
- Ares Álvarez J, García Vera C, González Rodríguez JD. Infección del tracto urinario (ITU). En: Guía ABE. 2024 [en línea] [consultado el 20/11/2025]. Disponible en guia-abe.es/temas-clinicos-infeccion-del-tracto-urinario-(itu)
- Khoury l, Schnapp Z, Konopnicki M. Improving Management Novel Guidelines for Diagnosing Urinary Tract Infection in Infants. Pediatr Infect Dis J. 2024;43:609-13. https://doi.org/10.1097/INF.0000000000004292
- Watson JR, Sánchez PJ, Spencer JD, Cohen DM, Hains DS. Urinary Tract Infection and Antimicrobial Stewardship in the Emergency Department. Pediatr Emerg Care. 2018;34:93-5. https://doi.org/10.1097/PEC.0000000000000688
- Kuster N, Robino l. Interpretación de los tests de sospecha e inicio de la terapia antibiótica empírica en infecciones urinarias. Arch Pediatr Urug. 2020;91:21-8. https://doi.org/10.31134/ap.91.1.4
- Romano ME. Prepubertal Vulvovaginitis. Clin Obstet Gynecol. 2020;63:479-85. https://doi.org/10.1097/GRF.0000000000000536
- Boon HA, Van den Bruel A, Struyf T, Gillemot A, Bullens DMA, Verbakel JY. Clinical features for the diagnosis of pediatric urinary tract infections: Systematic review and meta-analysis. Ann Fam Med. 2021;19:437-46. https://doi.org/10.1370/afm.2684
- Tullus K, Shaikh N. Urinary tract infections in children. 2020;395:1659-68. https://doi.org/10.1016/S0140-6736(20)30676-0
- Biyikli NK, Alpay H, Guran T. Hypercalciuria and recurrent urinary tract infections: incidence and symptoms in children over 5 years of age. Pediatric Nephrology 2005 20:10. 2005;20:1435-8. https://doi.org/10.1007/s00467-005-1892-y
- García-Nieto V, Moraleda-Mesa T, Tejera-Carreño P. Hipercalciuria e hipocitraturia. El concepto de prelitiasis en Pediatría. Pediatr Integral. 2022;XXVI:492-500.
- Saposnik G, Redelmeier D, Ruff CC, Tobler PN. Cognitive biases associated with medical decisions: a systematic review. BMC Medical Informatics and Decision Making 2016 16. 2016; 16:1-14. https://doi.org/10.1186/s12911-016-0377-1
- Bryant PA, Bitsori M, Vardaki K, Vaezipour N, Khan M, Buettcher M. Guidelines for Complicated Urinary Tract Infections in Children: A Review by the European Society for Pediatric Infectious Diseases. Pediatr Infect Dis J. 2025;44:e211. https://doi.org/10.1097/INF.0000000000004790
- Mattoo TK, Shaikh N, Nelson CP. Contemporary management of urinary tract infection in children. Pediatrics. 2021;147. https://doi.org/10.1542/peds.2020-012138
- Albañil Ballesteros MR, Cubero Santos A, Martínez Chamorro MJ, Muñoz Hiraldo ME, Ares Álvarez J, Morillo Gutiérrez B, et al. Etiología y resistencia a los antibióticos en la infección urinaria pediátrica. Estudio multicéntrico desde Atención Primaria. Rev Pediatr Aten Primaria. 2024;26:361-72. https://doi.org/10.60147/5d2a9a33





