Vol. 23 - Num. 89
Originales
Análisis de 37 casos de leishmaniasis en niños, diagnosticados en una comarca de Valencia, España
Yolanda Mañes Jiméneza, Gema M.ª Pedrón Marzala
aServicio de Pediatría. Hospital Lluís Alcanyís. Játiva. Valencia. España.
Cómo citar este artículo: Mañes Jiménez Y, Pedrón Marzal GM. Análisis de 37 casos de leishmaniasis en niños, diagnosticados en una comarca de Valencia, España. Rev Pediatr Aten Primaria. 2021;23:33-41.
Publicado en Internet: 17-03-2021 - Número de visitas: 26052
Resumen
Introducción: el objetivo fue analizar el aumento de incidencia de leishmaniasis observado en el Departamento Xàtiva-Ontinyent de la Comunidad Valenciana, España, y establecer un patrón clínico, valorando la forma de presentación, diagnóstico y respuesta al tratamiento.
Métodos: estudio epidemiológico retrospectivo en niños menores de 15 años, con diagnóstico de leishmaniasis visceral y cutánea, en el hospital Lluís Alcanyís de Xàtiva, desde enero de 2009 a diciembre de 2018.
Resultados: se recogieron 37 casos de leishmaniasis, 15 viscerales y 22 cutáneos. La mediana de edad fue de 17 meses para viscerales y de 2 años y 8 meses para cutáneos. En el momento del diagnóstico de leishmaniasis visceral, todos presentaron fiebre, anemia y esplenomegalia. En la leishmaniasis cutánea se presentaron en forma de placa o pápula eritematosa. Su confirmación diagnóstica se realizó en el 68% de los casos por visualización directa en la biopsia de la lesión de amastigotes, y en el 32% mediante reacción en cadena de la polimerasa (PCR) de frotis o biopsia de piel. En las leishmaniasis viscerales, el aspirado de médula ósea fue positivo en el 25% de los casos y en la PCR en sangre periférica en el 100%. Todas las leishmaniasis viscerales fueron tratadas con anfotericina B liposomal, con desaparición de la fiebre a las 72 horas. El 91% de las leishmaniasis cutáneas fueron tratadas con antimoniato de meglumina, y todas evolucionaron favorablemente.
Conclusiones: se confirma el aumento de incidencia de leishmaniasis en los años recogidos y se analiza el perfil clínico de estos pacientes de edad pediátrica, que es diferente al del adulto, y presentan una buena respuesta al tratamiento.
Palabras clave
● Diagnóstico ● Leishmania ● Leishmaniasis cutánea ● Leishmaniasis visceral ● NiñoINTRODUCCIÓN
Las leishmaniasis son un grupo de enfermedades parasitarias extendidas por todo el mundo con diferentes formas clínicas. La leishmaniasis visceral (LV) o kala-azar es la forma más grave de enfermedad, con una letalidad próxima al 100% sin tratamiento, y la leishmaniasis cutánea localizada (LCL) es de evolución usualmente benigna1. Están producidas por un protozoo del género Leishmania (familia Trypanosomatidae), trasmitida por la picadura de flebótomos infectados2.
La leishmaniasis es endémica en 88 países del mundo de regiones tropicales y templadas3,4. En España, la tasa de incidencia de leishmaniasis, a partir de los datos de ingresos hospitalarios, en el grupo de edad de menores de 5 años es de 1,56 por 100 000 habitantes/año, y en el grupo de 5-14 años de 0,13 por 100 000 habitantes/año4,5. En la toda la región mediterránea la forma endémica está producida por L. infantum1.
La LV se caracteriza clínicamente por fiebre, anorexia, pérdida de peso, esplenomegalia, hepatomegalia y alteraciones analíticas, como anemia, leucocitopenia, trombocitopenia, hipoalbuminemia e hipergammaglobulinemia.
Cuando el vector infectado pica a un huésped, le inocula entre 10 y 100 promastigotes, que son fagocitados por el sistema mononuclear fagocítico y se convierten en amastigotes, que son parásitos intracelulares obligados de los macrófagos. Los macrófagos infectados diseminan la infección por el sistema reticuloendotelial, acumulándose en el hígado, el bazo y la médula ósea3.
La LCL puede presentarse como una o varias lesiones cutáneas, después de un periodo de incubación (de dos semanas a dos meses), en forma de máculas eritematosas que se convierten en pápulas, cuya base es firme, indurada, hiperémica y a veces pruriginosa, localizadas generalmente en la piel expuesta. Se pueden ulcerar a lo largo de semanas o meses; es característica una ulcera no dolorosa y con bordes bien definidos. No hay supuración, a menos que se desarrolle sobreinfección bacteriana. Algunas lesiones curan espontáneamente, pero las ulceradas pueden presentar un curso crónico y generar deformidades6,7.
El diagnóstico definitivo de la leishmaniasis visceral se realiza mediante la visualización de amastigotes en el examen microscópico del aspirado de médula ósea o de sangre periférica, o por la observación de los promastigotes procedentes del cultivo7. Las técnicas de biología molecular (reacción en cadena de la polimerasa [PCR]) han mostrado ser más sensibles que las técnicas tradicionales8,9. La detección de anticuerpos específicos es sencilla, pero tiene limitaciones, ya que estos siguen siendo detectables hasta varios años después de la curación, y no permiten diferenciar entre infección aguda, pasada o reinfección1. El diagnóstico definitivo de la LCL se realiza mediante las mismas técnicas, pero obteniendo la muestra por raspado o biopsia de la lesión.
Actualmente el tratamiento de elección de la LV es anfotericina B liposomal (ABL) en pautas cortas, y, para la LCL, el antimonio pentavalente (antimoniato de meglumina) por vía intramuscular, intravenosa o perilesional.
La leishmaniasis es una enfermedad de declaración obligatoria en España desde 19821.
Nuestro Departamento de Salud (Xàtiva-Ontinyent) muestra la incidencia más elevada dentro de la Comunidad Valenciana (2017). Por lo tanto, el objetivo de este trabajo fue analizar el aumento de incidencia de leishmaniasis hallado en nuestra zona, y establecer un patrón clínico, valorando la forma de presentación, diagnóstico y respuesta al tratamiento.
POBLACIÓN Y MÉTODOS
Se realizó un estudio epidemiológico retrospectivo a partir de las historias clínica de los pacientes menores de 15 años con diagnóstico de LV y LCL desde enero de 2009 hasta diciembre de 2018 en el Hospital Lluís Alcañiz de Xàtiva, hospital de segundo nivel en la comarca de La Costera (Departamento 14 de Salud, Xàtiva-Ontinyent), en la provincia de Valencia, que centraliza la atención sanitaria de 194 682 habitantes, de los cuales 27 049 son menores de 15 años (datos demográficos, diciembre 2018).
La comarca de La Costera es un área encuadrada dentro de un ombroclima subhúmedo, con un terreno cálido, una humedad relativa elevada, pero con escasez, en general, de precipitaciones; donde existen numerosas zonas verdes y varios pantanos.
Los pacientes son diagnosticados y tratados en nuestro hospital por los Servicios de Pediatría y Dermatología. Hemos completado la revisión registrando los casos confirmados tanto por parte del Servicio de Microbiología como del Servicio de Anatomía Patológica, debido a que las formas cutáneas se atienden mayoritariamente de forma ambulatoria, sin requerir ingreso.
Los criterios de inclusión fueron: menores de 15 años con diagnóstico definitivo de leishmaniasis. Se consideró diagnóstico de LV la existencia de clínica compatible y positividad de pruebas complementarias: visualización directa del parásito o PCR en aspirado de médula ósea o sangre periférica. La sospecha clínica de LCL se confirmó con la visualización directa del parásito o PCR en frotis cutáneo o biopsia de piel. Se excluyeron los pacientes con historias clínicas incompletas.
Para la LV se recogieron las variables de edad, sexo, número de días con fiebre previos al diagnóstico (definida como una temperatura axilar ≥38 °C), existencia de hepatomegalia y esplenomegalia, mientras que para LCL se recogieron las variables de edad, sexo, tiempo de evolución, localización y número de lesiones.
En la LV se registraron hemograma, fórmula leucocitaria y parámetros bioquímicos relacionados, estudios serológicos, y determinación del antígeno de Leishmania sp. en orina. La anemia se definió como un valor de hemoglobina inferior a 2 desviaciones estándares para la edad, la leucocitopenia, como un recuento de leucocitos totales menor de 4 × 103/μl y la trombocitopenia, como un número de plaquetas inferior o igual a 150 × 103/μl. Se analizaron las técnicas utilizadas para el diagnóstico.
Se registró el tipo de tratamiento, dosis, duración, mejoría clínica, las posibles complicaciones asociadas y el seguimiento del paciente hasta los seis meses por parte del Servicio de Pediatría para todos los casos LV. Se consideró curación la respuesta clínica satisfactoria y sostenida con desaparición de la fiebre y normalización de las alteraciones analíticas tras el inicio del tratamiento, así como la resolución progresiva de las visceromegalias en el seguimiento. La recaída se definió como la recurrencia de signos y síntomas, asociados a la demostración de Leishmania sp. después de completar el tratamiento médico.
Se realizó un estudio descriptivo mediante el uso del programa del SPSS (26.0) haciendo un análisis de media/mediana, desviaciones estándar y tablas de contingencia.
RESULTADOS
Se diagnosticaron 37 pacientes de leishmaniasis; 15 casos fueron LV y 22 casos LVL. Veinticinco eran varones (67%) y 12 mujeres (33%), todos inmunocompetentes.
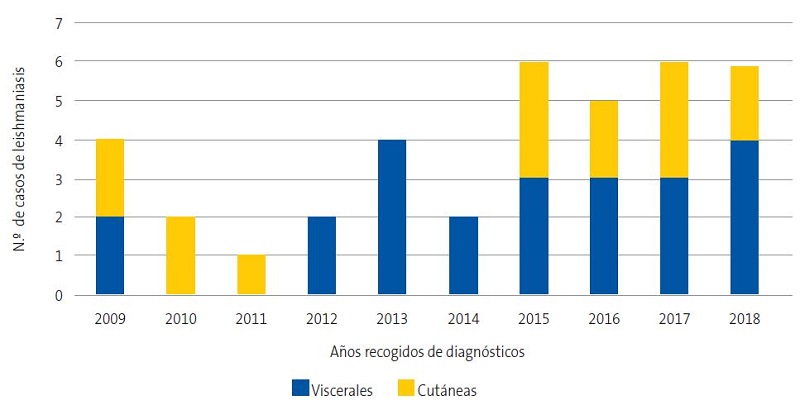
El aumento en el número de pacientes con LV y LCL recogidos se muestra en la Fig. 1.
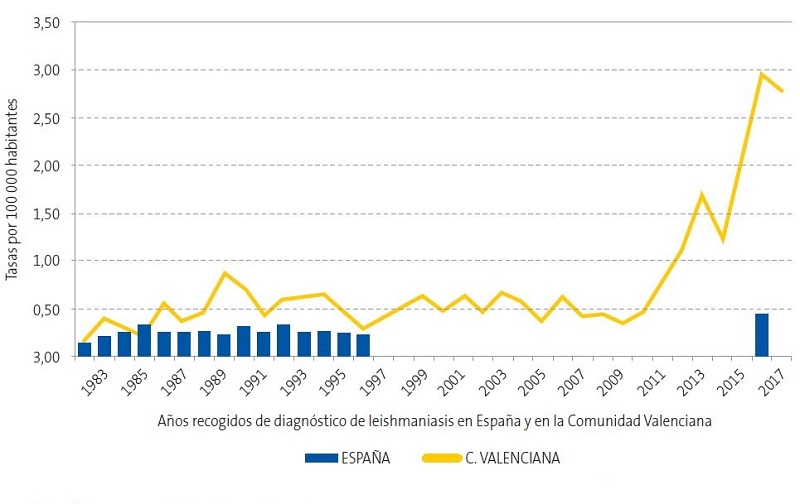
| Figura 1. Tasas de leishmaniasis; años 1982-2017*; distribución por Comunidad Valenciana y España |
|---|
 |

La media de edad fue de 10,7 meses para LV (rango: 3 meses-9 años) y una media de 22,4 meses para los casos de LCL (rango: 6 meses-14 años).
Clínicamente en la LV destaca la afectación del estado general, como principal motivo de ingreso desde urgencias, presentándose en el 100% con fiebre, con una mediana de duración hasta el diagnóstico de 12 días (rango: 5-30 días). La hepatomegalia y la esplenomegalia estaban presentes en el 80% y 100% respectivamente (Tabla 1).
| Tabla 1. Características clínicas al diagnóstico de los casos de leishmaniasis visceral | |||||
|---|---|---|---|---|---|
| Características clínicas al diagnóstico de leishmaniasis visceral (n = 15) |
Número de pacientes | % | Mediana | Rango | |
| Fiebre (días) | 15 | 100% | |||
| Duración de la enfermedad previa al ingreso (días) | 12 | 5 | 30 | ||
| Esplenomegalia/tamaño (cm*) | 15 | 100% | 3 | 1,5 | 10 |
| Hepatomegalia/tamaño (cm*) | 12 | 80% | 1,75 | 1 | 6 |

Todos los pacientes acudieron con anemia (Tabla 2). Cinco pacientes requirieron trasfusión de concentrado de hematíes, por disminución del valor de hemoglobina junto alteración del estado general, estancamiento ponderal, palidez, soplo cardiaco, y taquicardia. La leucopenia al ingreso estuvo presente en el 40% de los casos, y la trombopenia en el 66,6%. Cinco pacientes (33,3%) presentaron pancitopenia al diagnóstico.
| Tabla 2. Características analíticas al diagnóstico de los casos de leishmaniasis visceral | |||||
|---|---|---|---|---|---|
| Características analíticas al diagnóstico de leishmaniasis visceral | Mediana | Rango | Pacientes con valores alterados | % | |
| Hemoglobina (g/dl) n = 15 pacientes |
8,5 | 6 | 11,3 | 15 pacientes (anemia) | 100% |
| Leucocitos/µl n = 15 pacientes |
4900 | 3140 | 12 600 | 6 pacientes (leucopenia) | 40% |
| Plaquetas/µl n = 15 pacientes |
123 000 | 73 000 | 188 000 | 10 pacientes (trombopenia) | 66,6% |
| PCR (mg/l) n = 13 pacientes |
50 | 6 | 242,4 | 4 pacientes (PCR ≥ 80) | 30,7% |
| AST/GOT (UI/l) n = 14 pacientes |
175 | 104 | 274 | 6 pacientes (≥3 veces el valor normal) | 42,8% |
| ALT/GPT (UI/l) n = 14 pacientes |
163,5 | 90 | 40% | 4 pacientes (≥3 veces el valor normal) | 28,5% |

La mediana del valor de PCR (determinada en 13 pacientes) fue de 50 mg/l (rango: 6-242,4 mg/l), presentando un valor ≥80 mg/l en cuatro pacientes (30,7%). La elevación de enzimas hepáticas AST/GOT y ALT/GPT, con unas cifras tres veces superiores a su valor normal, se halló en 6 pacientes (42,8%) y 4 pacientes (28,5%) respectivamente (Tabla 2).
Respecto a los casos de LCL, se presentaron en forma de placa o pápula eritematosa, con diferente tamaño y con ulceración central sin supuración en las lesiones más tardías. La mediana de meses de evolución de la lesión fue de 6 meses (rango: 2-18 meses). La mayoría (75%) fueron complicadas, debido a la localización en: cara, párpado, hélix y dedos de las manos, y en menor porcentaje (13,3%), complicadas por fracaso terapéutico local después de 2-3 meses de tratamiento10.
Todas se localizaron en zonas expuestas, con un predominio de la cara (63%). Dos pacientes presentaron lesiones en el hélix derecho, localización poco frecuente, de difícil tratamiento y con tendencia a la cronificación. Dos pacientes (10%) tuvieron más de una lesión cutánea.
El diagnóstico definitivo de LCL en 15 pacientes (68%) se confirmó mediante visualización de amastigotes, y en 7 pacientes (32%), mediante técnica molecular (PCR) del frotis cutáneo o biopsia de piel.
En la LV la confirmación diagnóstica se muestra en las Tablas 3 y 4. Hay que señalar que en dos pacientes (n.º 2 y n.º 8) se inició tratamiento únicamente con resultados de serología positiva, con títulos por inmunofluorescencia indirecta superior a 1/40, junto con clínica compatible. En dos pacientes se obtuvieron dos resultados positivos en diferentes pruebas diagnósticas.
| Tabla 3. Técnicas diagnósticas utilizadas en los casos de leishmaniasis visceral | |||||
|---|---|---|---|---|---|
| Diagnóstico mediante pruebas complementarias de leishmaniasis visceral | |||||
| Pacientes | Año diagnóstico | AMO | Frotis SP | PCR SP | Serología (IFI) |
| 1 | 2009 | No realizado | Leishmania spp. | No realizado | Positiva |
| 2 | 2009 | Negativo | No realizado | No realizado | Positiva |
| 3 | 2010 | No realizado | Leishmania spp. | No realizado | Negativa |
| 4 | 2010 | Positivo | Leishmania spp. | No realizado | Positiva |
| 5 | 2011 | No realizado | Leishmania spp. | Positiva | Positiva |
| 6 | 2015 | Positivo | Negativo | No realizado | Negativa |
| 7 | 2015 | No realizado | Leishmania spp. | No realizado | Positiva |
| 8 | 2015 | No realizado | No realizado | No realizado | Positiva |
| 9 | 2016 | No realizado | No realizado | Positiva | Positiva |
| 10 | 2016 | No realizado | Leishmania spp. | No realizado | Positiva |
| 11 | 2017 | Negativo | Negativo | Positiva | Negativa |
| 12 | 2017 | No realizado | No realizado | Positiva | Positiva |
| 13 | 2017 | No realizado | No realizado | Positiva | No realizada |
| 14 | 2018 | No realizado | No realizado | Positiva | Positiva |
| 15 | 2018 | No realizado | No realizado | Positiva | Positiva |

| Tabla 4. Pruebas diagnósticas de leishmaniasis visceral | ||||
|---|---|---|---|---|
| Pruebas diagnósticas | Número de pacientes | Positiva | Negativa | Sensibilidad |
| Visualización en AMO | 4 | 2 | 2 | 50% |
| Frotis SP | 8 | 6 | 2 | 75% |
| PCR SP | 7 | 7 | 0 | 100% |
| Serología (IFI) | 14 | 11 | 3 | 78,50% |
| AG de Leishmania en orina | 3 | 0 | 3 | 0% |

Ningún paciente precisó cuidados intensivos.
El tratamiento para la LV fue con ABL (Ambisome) en dosis 3-5 mg/kg/día por vía intravenosa, con administración diaria en los días primero a quinto y la sexta dosis el día décimo (dos pacientes de los primeros años del estudio siguieron otro régimen de tratamiento; el primero de ellos: 3 mg/kg/día durante 5 días y repetir día 14.º y 21.º; el otro paciente: 3 mg/kg/día los días 1.º, 5.º, 10.º, 14.º y 21.º). Todos recibieron una dosis total acumulada de 20 mg/kg de ABL, normalizándose la temperatura antes de las 72 horas. Ningún caso presentó efectos secundarios.
Solo un paciente presentó recaída con fiebre, irritabilidad nocturna y discreta hepatoesplenomegalia a los tres meses del tratamiento, con PCR para Leishmania infantum positiva en el aspirado de médula ósea. Recibió nuevo régimen de tratamiento con ABL en dosis de 3 mg/kg/día IV, durante 10 días consecutivos, sin recaída en el seguimiento a 12 meses.
En el tratamiento de la LCL en el 91% de los pacientes se realizaron infiltraciones perilesionales, con antimoniato de meglumina (Glucantime). En un paciente de 12 meses, se mantuvo actitud expectante, con buena evolución y resolución espontánea. En otro paciente, de dos años, con una lesión localizada en la cara y el labio inferior, se le administró tratamiento con ABL. Siete pacientes (31,8%) requirieron una o dos infiltraciones y 11 pacientes (50%) entre tres y cinco infiltraciones Solo dos casos, de dos y cinco años, con localización en la mejilla, presentaron una evolución más tórpida, requiriendo tratamiento combinado con imiquimod y, posteriormente, infiltraciones con Glucantime hasta 12 meses de tratamiento. La evolución fue favorable en todos los casos, sin precisar exéresis.
DISCUSIÓN
Según la Red Nacional de Vigilancia Epidemiológica se han ampliado las regiones endémicas de leishmaniasis en el mundo, y esta extensión se ha acompañado de un aumento de los casos notificados de esta enfermedad. Según la Organización Mundial de la Salud, España se considera uno de los países más afectados de la Unión Europea11. Se estima una prevalencia de 12 a 14 millones de enfermos en el mundo, con una incidencia de dos millones de nuevos casos anuales, de los que 1,5 millones serían cutáneos y 500 000 viscerales.
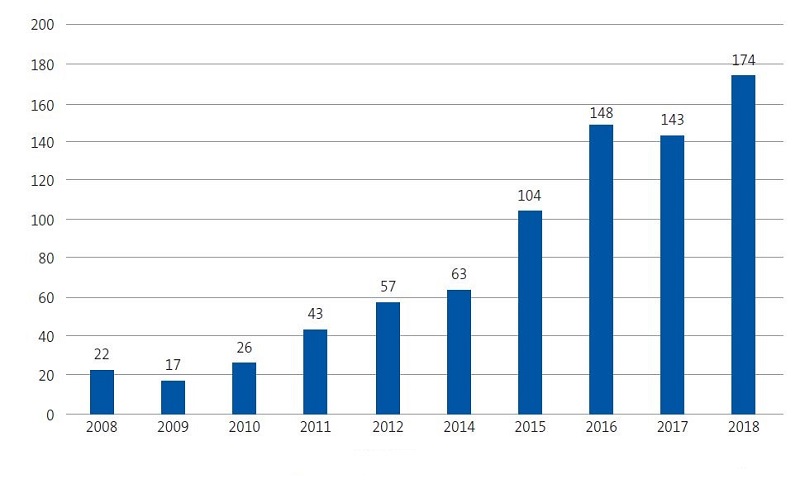
En 2017 la Comunidad Valenciana presentó una tasa de incidencia por leishmaniasis del 2,9 por 100 000 habitantes/año en la población general12. Revisando los informes epidemiológicos más recientes publicados en nuestra comunidad por el Servicio de Salud Pública12,13, se observa un aumento exponencial de casos desde 2010 a 2017 (Figs. 1 y 2), como mostramos también en nuestro estudio, con un aumento en los últimos cuatro años (Fig. 3).
| Figura 2. Evolución temporal de los casos de leishmaniasis en la Comunidad Valenciana en el último decenio |
|---|
 |

Coincidiendo nuestros resultados con la bibliografía publicada4,11,14-16, observamos que, en los niños, especialmente en lactantes, es mucho más frecuente la LV, comparado con la población adulta. Aunque de forma global, en la población pediátrica la forma clínica más frecuente es la LCL17. Este predominio de la LV en lactantes probablemente se podría justificar por un sistema inmune inmaduro.
Las características clínicas de presentación en nuestros pacientes de LV, con fiebre, esplenomegalia y anemia, coinciden con los estudios publicados5,11,15, y es la base de la sospecha diagnóstica en lactantes.
Las lesiones clínicas en la LCL se localizan preferente en la cabeza y el cuello, y esto coincide con otros trabajos como el de Dunya et al.17, realizado en 168 pacientes sirios con LCL, en los que observan un predominio de esta localización (57,1%), afectando sobre todo la mejilla. En el estudio de Roth-Damas et al., realizado en una zona geográfica de la misma Comunidad Valenciana15, también observan una mayor incidencia de lesiones únicas (61%), y al igual que nosotros, presentaron dos pacientes con lesiones en el pabellón auricular.
En el diagnóstico de confirmación de la leishmaniasis observamos un cambio notable a lo largo de los años, sobre todo en la visceral. Nuestros primeros casos disponen de serología y confirmación por visualización directa del parásito. En los últimos años se han desarrollado herramientas de diagnóstico menos invasivas como el análisis de PCR en sangre periférica, que ha mostrado más sensibilidad que la observación directa8,14. Su sensibilidad es del 92-98% y su especificidad del 100%17. Ha habido dos casos en los que se ha llegado al diagnóstico exclusivamente con resultados positivos serológicos, como también se describe en el estudio de Ramos et al.11.
Clásicamente los antimoniales han sido el tratamiento de elección de la LV, aunque la larga duración de estos tratamientos en regímenes hospitalarios, su potencial toxicidad y una mayor incidencia de fracasos terapéuticos llevaron a buscar alternativas como la ABL, aprobándose su uso por la Food and Drug Administration norteamericana en 1997. Todos nuestros pacientes con LV fueron tratados con anfotericina B con buena tolerancia.
La evolución de los pacientes con LV fue favorable en todos los casos, excepto una recaída (6,6%), similar a la observada en estudios previos como el de Prieto Tato et al., que presentó una recaída de 11 pacientes5.
En los pacientes con LCL el tratamiento fue Glucantime perilesional y en dos casos asociando imiquimod. En nuestra serie un paciente de dos años con una lesión de 9 meses de evolución localizada en cara-labio inferior, precisó tratamiento con ABL, como opción terapéutica ya indicada en el estudio de Del Rosal T et al.7. Todos los pacientes tuvieron evolución favorable con resolución completa de la lesión.
CONCLUSIONES
- Existe un aumento de incidencia de leishmaniasis en los últimos 4 años.
- En zonas endémicas ante un lactante con cuadro febril prolongado con hepatoesplenomegalia y disminución de una o varias series sanguíneas, debemos tener en cuenta la LV.
- Se sospechará la LCL ante una placa o pápula eritematosa en zonas expuestas, de larga evolución.
- Los métodos diagnósticos con PCR son menos agresivos y más sensibles. Los pacientes con LV presentan una buena respuesta y evolución al tratamiento con anfotericina B liposomal.
CONFLICTO DE INTERESES
Las autoras declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
ABL: anfotericina B liposomal · LCL: leishmaniasis cutánea localizada · LV: leishmaniasis visceral · PCR: reacción en cadena de la polimerasa.
AGRADECIMIENTOS
Agradecemos la colaboración de todas las personas vinculadas a este estudio.
BIBLIOGRAFÍA
- Cano Portero R, Sierra Moros MJ, Tello Anchuela O. Protocolos de la Red Nacional de Vigilancia Epidemiológica. Madrid: Centro Nacional de Epidemiología, Instituto de Salud Carlos III, Red Nacional de Vigilancia Epidemiológica; 2013.
- Leishmaniasis. En: Organización Mundial de la Salud [en línea] [consultado el 04/12/2020]. Disponible en www.who.int/es/news-room/fact-sheets/detail/leishmaniasis
- Melby PC. Leishmaniasis (Leishmania). En: Kliegman RM, Stanton BF, St Geme JW, Schor NF (eds.). Nelson Tratado de Pediatría. 20.ª edición. Barcelona: Elsevier; 2016. p. 1241-5.
- Errasti I, Aracil FJ. Zoonosis en Pediatría. En: Guerrero-Fdez J, Cartón A, Barreda A, Menéndez J, Ruíz J (eds.). Manual de diagnóstico y terapéutica en Pediatría. 6.ª edición. Madrid: Panamericana; 2018. p. 1625-8.
- Prieto LM, La Orden E, Guillén S, Salcedo E, García C, García-Bermejo I, et al. Diagnóstico y tratamiento de la leishmaniasis visceral infantil. An Pediatr (Barc). 2010;72:347-51.
- Valcárcel Y, Bastero R, Anegón M, González S, Gil A. Epidemiología de los ingresos hospitalarios por leishmaniasis en España (1999-2003). Enferm Infecc Microbiol Clin. 2008;26:278-81.
- Del Rosal T, Baquero-Artigao F, Gómez C, García MJ, de Lucas R. Tratamiento de la leishmaniasis cutanea con anfotericina B liposomal. An Pediatr (Barc). 2010;73:101-2.
- Cruz I, Chicharro C, Nieto J, Bailo B, Cañavate C, Figueras MC, et al. Comparison of new diagnostic tools for management of pediatric mediterranean visceral leishmaniasis. J Clin Microbiol. 2006;44:2343-7.
- Reithinger R, Dujardin JC. Molecular diagnosis of leishmaniasis: current status and future applications. J Clin Microbiol. 2007;45:21-5.
- Aronson N. Cutaneous leishmaniasis: Treatment. En: UpToDate [en línea] [consultado el 03/03/2021]. Disponible en www.uptodate.com/contents/cutaneous-leishmaniasis-treatment?search=leishmaniacutaneaniñosclasificacion&source=search_result&selectedTitle=2~149&usage_type=default&display_rank=2
- Ramos JM, Clavijo A, Moral L, Gavilán C, Salvador T, González de Dios J. Epidemiological and clinical features of visceral leishmaniasis in children in Alicante Province, Spain. Paediatr Int Child Health. 2018;38:203-8.
- Servicio de Vigilancia y Control Epidemiológico; Subdirección General de Epidemiología, Vigilancia de la Salud y Sanidad Ambiental; Dirección General de Salud Pública; Conselleria de Sanitat Universal y Salut Pública. Informe Enfermedades trasmitidas por vectores Comunitat Valenciana. Vigilancia Epidemiológica Año 2017. En: Conselleria de Sanitat Universal y Salut Pública [en línea] [consultado el 03/03/2021]. Disponible en www.sp.san.gva.es/DgspPortal/docs/informe_etv_CV2017.pdf
- Servicio de Vigilancia y Control Epidemiológico; Subdirección General de Epidemiología, Vigilancia de la Salud y Sanidad Ambiental; Dirección General de Salud Pública; Conselleria de Sanitat Universal y Salut Pública. Informe Enfermedades trasmitidas por vectores Comunitat Valenciana. Vigilancia Epidemiológica Año 2018. Valencia: Conselleria de Sanitat Universal y Salut Pública [en línea] [consultado el 03/03/2021]. Disponible en www.sp.san.gva.es/DgspPortal/docs/informe_etv_CV2018.pdf
- Cascio A, Calattini S, Colomba C, Scalamogna C, Galazzi M, Pizzuto M, et al. Polymerase chain reaction in the diagnosis and prognosis of mediterranean visceral leishmaniasis in immunocompetent children. Pediatrics. 2002;109:e27.
- Roth-Damas P, Sempere-Manuel M, Mialaret-Lahiguera A, Fernández-García C, Gil-Tomas JJ, Colomina-Rodríguez J, et al. Brote comunitario de leishmaniasis cutánea en la comarca de La Ribera: a propósito de las medidas de Salud Pública. Enferm Infecc Microbiol Clin. 2017;35:338-43.
- Palomares Gimeno MJ, Segura Navas L, Renau Solaz S, Bueno Claros D. Leishmaniasis cutáneo-visceral, sospecharla para diagnosticarla. Rev Pediatr Aten Primaria. 2020;22:49-53.
- Dunya G, Habib R, Moukarbel R V, Khalifeh I. Head and neck cutaneous leishmania: clinical characteristics, microscopic features and molecular analysis in a cohort of 168 cases. Eur Arch Otorhinolaryngol. 2016;273:3819-26.