Vol. 20 - Num. 27
Flashes pediátricos AEPap
Novedades en vacunas, ¿qué tenemos que saber para estar actualizados?
aPediatra. CS Delicias Sur. Zaragoza. España.
Cómo citar este artículo: García Sánchez N. Novedades en vacunas, ¿qué tenemos que saber para estar actualizados? Rev Pediatr Aten Primaria. Supl. 2018;(27):51-60.
Publicado en Internet: 08-06-2018 - Número de visitas: 16651
Resumen
Las vacunas son un área de interés para muchos profesionales sanitarios, pero en especial para los pediatras. Podríamos afirmar, independientemente del área de dedicación, que todos los pediatras investigan qué vacunas han recibido sus pacientes cuando realizan una historia clínica.
En nuestro trabajo, en especial en el ámbito de la Atención Primaria, necesitamos saber mucho sobre vacunas, pero el mundo de la Vacunología es complicado, existen muchas publicaciones cada año, en 2017 por ejemplo se incluyeron 5095 trabajos en MEDLINE referentes a vacunas. En Trip Database con el descriptor vaccines aparecen 76 344 publicaciones. Parece imposible conocer las novedades de interés por parte de cada pediatra individualmente por estos medios.
El comportamiento epidemiológico de algunas enfermedades infecciosas, la reaparición de enfermedades que parecían eliminadas, como la parotiditis o el sarampión, la disponibilidad de nuevas vacunas, el cambio en la práctica de la vacunación, etc., son algunos aspectos que debemos considerar. En este panorama tan cambiante, ¿hay algo que deba centrar nuestra atención en las novedades en vacunas? Se ha seleccionado cinco puntos de actualización que se expondrán como cinco flashes:
- Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2018.
- Las vacunas frente a parotiditis y sarampión en la triple vírica ¿han dejado de funcionar?
- Mejor abordaje del recelo a la vacunación.
- Novedades puntuales: rotavirus, hepatitis A, rabia. Nuevas formas de administrar vacunas.
- ¿Debemos seguir vacunándonos cada año?
CALENDARIO DE VACUNACIONES DE LA ASOCIACIÓN ESPAÑOLA DE PEDIATRÍA: RECOMENDACIONES 2018
Desde 1994, año en que se constituyó el primer Comité de Vacunas de la Asociación Española de Pediatría (CAV-AEP), hasta la fecha, se han elaborado 19 documentos de recomendaciones de vacunación o calendarios de vacunación infantil. En estos momentos la distancia del calendario del Consejo Interterritorial del Sistema Nacional de Salud (CISNS) al del CAV-AEP es pequeña y se ha visto que muchas de sus sugerencias han sido incluidas en el calendario del Ministerio de Sanidad.
Una forma de estar actualizado es estar al tanto de las recomendaciones del CAV-AEP a través de la publicación del calendario, que se realiza tanto en la web del CAV-AEP como en la revista Anales de Pediatría a primeros de año.
En años recientes ha habido modificaciones importantes o recomendaciones nuevas, por ejemplo, la vacunación de tosferina en la embarazada, la vacuna frente a meningococo B, el esquema de vacunación 2 + 1 para difteria, tétanos, tosferina, polio inactivada, Haemophilus influenzae tipo b (Hib) y hepatitis B (DTP-VPI-Hib-HB), la recomendación de una dosis de polio a los 6 años, etc.
En el año 20181 las recomendaciones no incluyen grandes novedades, aun así, debemos destacar las vacunas no incluidas en los calendarios oficiales (no financiadas) como rotavirus, meningococo B, papilomavirus humano en varones y meningococo tetravalente. Para la segunda dosis de triple vírica y varicela, de haber disponibilidad, en la segunda dosis se podría utilizar la vacuna tetravírica. Se informa de la existencia de la nueva vacuna de nueve genotipos para el virus del papiloma humano que ya está disponible, ampliando la cobertura de protección para ambos sexos. Se recomienda individualmente la vacuna antimeningocócica conjugada tetravalente (MenACWY) en adolescentes (14-18 años) que vayan a residir en países con vacunación sistemática frente a los serogrupos ACWY. Así como para mayores de seis semanas de vida con factores de riesgo o viajeros a países de elevada incidencia de los serogrupos incluidos.
LAS VACUNAS FRENTE A PAROTIDITIS Y SARAMPIÓN EN LA TRIPLE VÍRICA ¿HAN DEJADO DE FUNCIONAR?
Parotiditis
En España y en otros países como EE. UU. u otros países europeos se ha observado un incremento de la incidencia de parotiditis, a pesar de haberse alcanzado una cobertura vacunal muy alta2. La vacuna fue introducida en el calendario de vacunación infantil en 1981 (Fig. 1), y una segunda dosis en 1995. Si bien la incidencia no ha alcanzado la tasa de la era prevacunal (211 casos por 100 000 habitantes) hemos de destacar los 4696 casos de 2016 que supone una tasa de 10,1 casos por 100 000 habitantes3. Parece haber cambiado la edad de la población susceptible, ya que el mayor número de casos se da en los grupos etarios de 15-24 y 25-34 años. La mayoría de los casos habían recibido la vacunación triple vírica (TV) y muchos de ellos con dos dosis.
| Figura 1. Vacuna triple vírica: cepas del componente de parotiditis y año de introducción de 1.ª y 2.ª dosis. España, 1981-20142 |
|---|
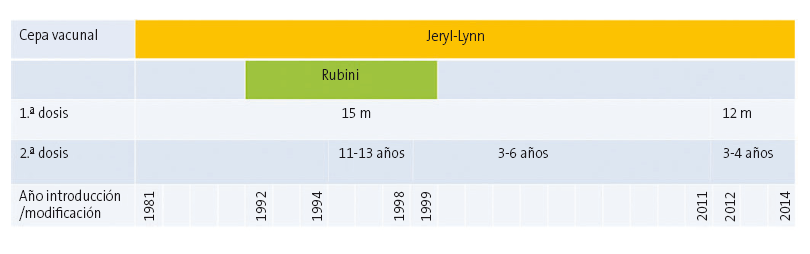 |

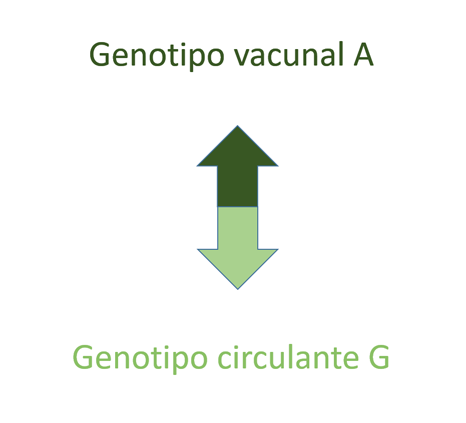
La primera explicación a estas ondas epidémicas, y probablemente muy importante, es el posible debilitamiento de la inmunidad conferida por la vacuna, ya que al parecer los casos se agrupan en aquellos que recibieron la vacuna con una anterioridad de 10-13 o más años, es decir, la enfermedad aparece en la última fase de la adolescencia y en jóvenes adultos. Algunos autores4 en Escocia estudian la secuenciación genética de los virus aislados de los casos de parotiditis encontrando que el 97% de ellos se clasifican como genotipo G, sugiriendo que es genéticamente diferente del que circulaba en años previos y del de la cepa vacunal, el genotipo A, asegurando también que la poca efectividad vacunal se deba a una pérdida de inmunidad con el paso del tiempo. En Bélgica también se ha detectado diferencias antigénicas entre la cepa vacunal y la que circula ocasionando los casos5 (Fig. 2). En Holanda también se concluye que epítopos heterólogos en el virus circulante que difieren del vacunal, junto con el desvanecimiento de la inmunidad explican estos brotes de parotiditis. Se sugiere un nuevo esquema vacunal que incluya una tercera dosis, hasta ahora solo contemplada para el control de brotes6,7, hasta que una nueva vacuna polivalente sea desarrollada8.
| Figura 2. Diferencias entre la cepa vacunal y la cepa circulante que ocasiona brotes de parotiditis. Representación esquemática5 |
|---|
 |

¿Debemos pensar que la vacuna frente a parotiditis ya no funciona y no merece la pena? En absoluto. Durante las ondas epidémicas y brotes en sujetos vacunados no se han visto las complicaciones descritas en la parotiditis en sujetos no vacunados, típicamente un 1-15% de meningitis aséptica o un 30% de orquitis. En los datos de vigilancia se describe un incremento de la incidencia, pero un menor número de hospitalizaciones, lo que nos anima a poder afirmar que el componente de parotiditis de la vacuna TV funciona evitando la enfermedad grave, complicaciones y secuelas.
SARAMPIÓN, LA CULPA DE SU INCREMENTO, ADEMÁS DE WAKWEFIELD, ES DEL R0
Desde aquel 5 de enero de 2015 en que un adolescente de 11 años, no vacunado, tras visitar un parque temático en California, comenzó con un cuadro típico de sarampión, muchos casos se han sucedido en una enfermedad que tanto EE. UU. como España han creído eliminada.
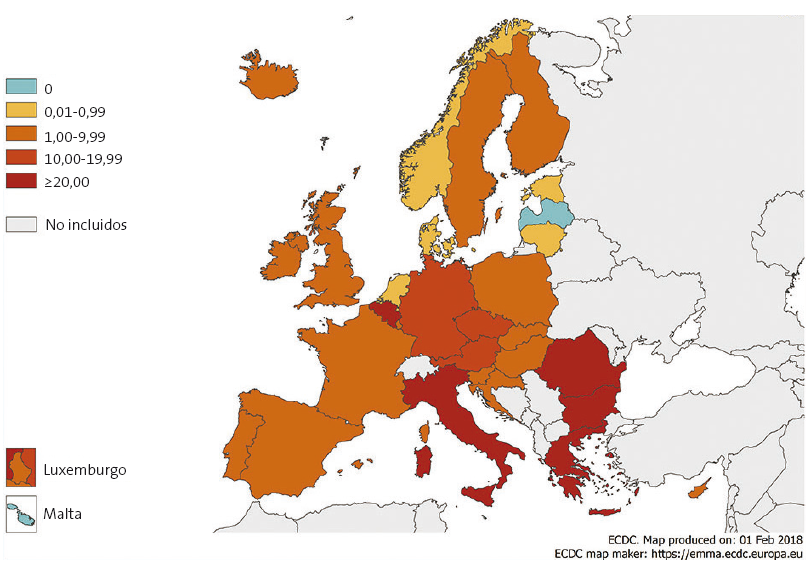
La Organización Mundial de la Salud (OMS) recientemente nos informa de la lamentable situación del sarampión en Europa: en 2017 se registraron 21 315 casos de sarampión y 37 fallecimientos, siendo inaceptable que mueran personas cuando existe una vacuna eficaz. Los países que más casos han comunicado son Rumanía, Italia, Grecia y Alemania (Fig. 3). La mayor incidencia se ha dado en menores de 1 año seguido de los menores de cuatro años. En el 86% de los casos no se había recibido la vacuna y en el 11% solo una dosis9.
Estos datos sugieren que, al contrario que con la vacuna de parotiditis, el sarampión resurge por la tendencia a dejar de vacunar de sarampión, no por fallo vacunal, ya que este es muy bajo. Todavía reverbera en la población la falsa noticia de que la vacuna triple vírica produce autismo. ¿Pero realmente ha descendido tanto la cobertura vacunal? Quizá no tanto, lo que ocurre es que por la alta contagiosidad del sarampión se necesitan coberturas muy altas para que exista inmunidad de rebaño y no progrese una epidemia. Estamos en el concepto de umbral de inmunidad de grupo, que es la proporción de individuos inmunes en una población por encima de la cual la incidencia de la infección disminuye.
Este umbral puede expresarse matemáticamente con la siguiente fórmula10:
H = 1 ‐ 1/ R0 = (R0 ‐ 1) / R0.
H es el umbral de inmunidad de grupo y R0 es el número de reproducción, que nos indica cuantos susceptibles son contagiados de la enfermedad en promedio por un solo infectado, para que se produzca una epidemia el R0 debe ser >1. En el caso del sarampión el R0 es el más alto de las enfermedades trasmisibles, de 12 a 18 (Tabla 1).
| Tabla 1. Valores de R0 para enfermedades infecciosas bien conocidas | |
|---|---|
| Enfermedad | R0 |
| Sarampión | 12-18 |
| Tosferina | 12-17 |
| Difteria | 6-7 |
| Viruela | 5-7 |
| Polio | 5-7 |
| Rubeola | 5-7 |
| Paperas | 4-7 |
| VIH/SIDA | 2-5 |
| SARS | 2-5 |
| Influenza (pandemia de 1918) | 2-3 |
| Ébola | 2-3 |

Por estas razones se precisan coberturas vacunales elevadas para sarampión para que una epidemia no progrese. Solamente manteniendo coberturas vacunales frente al sarampión por encima del 95% se evita la transmisión y la posibilidad de brotes que causen importante número de casos y muertes. Como indica el Plan para la eliminación del sarampión y la rubeola en España es necesario alcanzar y mantener altas coberturas de vacunación (≥95%) con dos dosis frente a sarampión y al menos una dosis frente a rubeola mediante vacunación sistemática11.
Por eso es clave trabajar con los padres que puedan tener recelo ante la vacunación, en especial con la vacuna triple vírica.
MEJOR ABORDAJE DEL RECELO A LA VACUNACIÓN
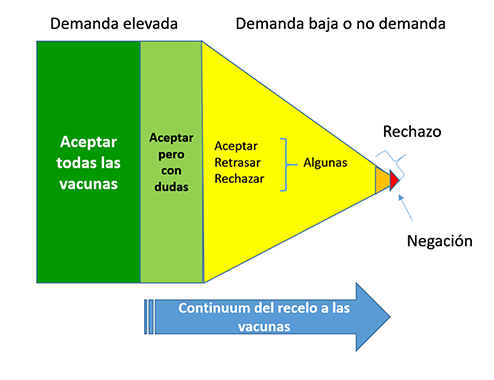
Se define el recelo o la indecisión ante la vacunación como el retraso o rechazo a la vacunación a pesar de la disponibilidad de servicios de vacunación12. Existen diversos grados en la reticencia a la vacunación, desde la aceptación con dudas al rechazo total (Fig. 4).
| Figura 4. Definición gráfica del recelo a las vacunas |
|---|
 |

Algunos países han establecido la vacunación obligatoria, pero nosotros, a nivel individual, ¿qué podemos hacer ante el rechazo a vacunas? El papel del pediatra en las decisiones de los padres es muy importante. Debemos proporcionar una información veraz y detallada. Explicar el beneficio de las vacunas sobre la enfermedad que previene y sus complicaciones. Detallar las limitaciones de las vacunas, ninguna está libre de riesgos, ninguna es efectiva 100%.
Existe una guía canadiense13 para trabajar con padres indecisos ante la vacunación, especialmente con padres que manifiestan dudas respecto a la seguridad de las vacunas.
Se recomiendan cinco pasos:
- Entender las preocupaciones específicas de los padres. Escuchar atentamente, no a todos les preocupa lo mismo. Contrastar las dudas de los padres. Poner en valor las vacunas, destacar datos negativos de las enfermedades, como muertes y amputaciones. Utilizar imágenes que los padres probablemente nunca habrán visto.
- Utilizar técnicas de entrevista motivacional. Usar supuestos que generen el escenario “¿Cómo te sentirías si tu hijo tuviera una enfermedad grave por no haberle vacunado?”. Usar cifras positivas: “la vacuna es efectiva en un 99%”, mejor que hay un 1% de efectos secundarios.
- Ser firmes en el mensaje, usar lenguaje claro al hablar de riesgos de la enfermedad. Repetir el mensaje, informar sobre evidencias de beneficios y riesgos equitativamente y adecuadamente.
- Poner a los padres técnicas para el control del dolor al vacunar.
- Evitar el rechazar o dejar de atender a los niños no vacunados.
NOVEDADES PUNTUALES: ROTAVIRUS, HEPATITIS A, LA VÍA INTRADÉRMICA: UNA FORMA DE OPTIMIZAR LAS VACUNAS DISPONIBLES
Rotavirus. Nueva normativa: vacunación en las unidades de neonatal
La aplicación de la vacuna frente a virus tiene un momento muy preciso para que sea iniciada la pauta, de esta forma se minimiza el riesgo de invaginación. Lo ideal es empezar entre las 6-12 semanas, pero según el preparado usado podría variar la edad límite para la primera dosis. La cuestión es que los niños prematuros, que tienen mayor riesgo de infección por rotavirus, en ocasiones superar la edad de 12 semanas estando ingresado en el hospital y pierden la oportunidad de ser vacunados. Hasta ahora se negaba su administración en las unidades neonatales por el supuesto riesgo de diseminación. En la actualidad, se ha constatado que es segura la administración en prematuros hospitalizados bajo unas adecuadas condiciones higiénicas, por lo que debería ser una práctica habitual en las unidades de Neonatología, pues, de lo contrario, algunos de estos niños no podrán ser vacunados tras el alta, al haber sobrepasado la edad máxima para recibir la primera dosis14.
Además, el País Vasco financia la vacunación de rotavirus en los prematuros de menos de 32 semanas.
Hepatitis A. Se puede adelantar su administración a los seis meses
Ante un riesgo por viaje internacional, los Centers for Disease Control and Prevention (CDC)15 han autorizado su administración a niños de seis meses, pero esta dosis no será contabilizada.
La vía intradérmica: vacunas a flor de piel
Ante determinadas emergencias de salud pública y en determinadas enfermedades y tipos de vacunas, se ha utilizado la vía intradérmica como una forma de optimizar las dosis disponibles. La administración intradérmica de dosis fraccionadas ha permitido utilizar un quinto de vial por dosis, lo cual ha sido muy importante en una situación de emergencia en India16.
La vía intradérmica también ha sido recomendada por la OMS para la administración de vacuna de la rabia tanto en profilaxis pre- y posexposición en un nuevo posicionamiento17.
En EE. UU. acaban de ser autorizadas las vacunas intradérmicas de gripe a niños de 12 años en adelante.
GRIPE. ¿DEBEMOS SEGUIR VACUNÁNDONOS CADA AÑO?
Predominio del virus gripal B en la temporada 2017-2018
Durante la última estación gripal el estudio virológico ha puesto de manifiesto que ha predominado la circulación del virus gripal tipo B sobre el A. En España en la temporada 2017-18, según datos del Sistema de Vigilancia de la Gripe del Instituto de Salud Carlos III18, del total de detecciones virales, desde el inicio de la temporada 2017-2018 se han notificado que son tipo B (51-59%), tipo A (40,9-48%) y tipo C (0,1%). El 59-66% de los virus tipo A subtipados hasta el momento son virus A(H3N2) (23% respecto al total de virus).
En lo que respecta a virus B, se han caracterizado 435 virus, 53 de ellos del linaje Victoria y 382 virus del linaje Yamagata. Como podemos recordar, esta cepa Yamagata no estaba presente en las vacunas trivalentes en la temporada 2017-2018, tal como recomendó la OMS para la composición de vacunas para el hemisferio norte esta temporada19.
Vacunas tetravalentes
Este acontecimiento virológico ha hecho aumentar el interés por las vacunas antigripales tetravalentes, como una forma más segura de poder conseguir una mejor concordancia entre las cepas vacunales y las posibles cepas circulantes en cada estación, ya que el predominio de un linaje u otro en las cepas tipo B es imposible de predecir.
Al mismo tiempo se han producido novedades en el campo de las vacunas tetravalentes; existen dos preparados inactivados que estarán disponibles la próxima temporada: Fluarix Tetra y Vaxigrip Tetra, ambas con autorización a partir de los seis meses de edad, que previamente eran a partir de los tres años. El preparado atenuado tetravalente, Fluenz Tetra, podrá estar disponible también en la próxima temporada. Desconocemos si las administraciones sanitarias de las comunidades autónomas se decidirán por estos preparados tetravalentes como forma más segura de cubrir las posibles cepas circulantes. (Tabla 2)
El CAV-AEP recomienda preferentemente las vacunas tetravalentes20.
| Tabla 2. Vacunas antigripales autorizadas en menores de 18 años comercializadas en España (última revisión: abril de 2018) | |||||||
|---|---|---|---|---|---|---|---|
| Nombre (fabricante) | Características | Presentación | Edad | Vía | Dosificación | ||
| Afluria® (Seqirus) | Inactivada | Fraccionada | Trivalente | Jeringa precargada 0,5 ml | ≥60 meses | i.m. | Niños a partir de 60 meses: 0,5 ml |
| Chiroflu® (Novartis) | Inactivada | Subunidades | Trivalente | Jeringa precargada 0,5 ml | ≥6 meses | i.m. | Niños de 6-35 meses: 0,25 ml o 0,5 ml
A partir de 36 meses: 0,5 ml |
| Influvac® (Abbott) | Inactivada | Subunidades | Trivalente | Jeringa precargada 0,5 ml | ≥6 meses | i.m. | Niños de 6-35 meses: 0,25 ml o 0,5 ml
A partir de 36 meses: 0,5 ml |
| Mutagrip® (SP-MSD) | Inactivada | Fraccionada | Trivalente | Jeringa precargada 0,5 ml | ≥6 meses | i.m. | Niños de 6-35 meses: 0,25 ml o 0,5 ml
A partir de 36 meses: 0,5 ml |
| Vaxigrip® (SP-MSD) | Inactivada | Fraccionada | Trivalente | Jeringa precargada 0,5 ml | ≥6 meses | i.m. | Niños de 6-35 meses: 0,25 ml o 0,5 ml
A partir de 36 meses: 0,5 ml |
| Fluarix Tetra® (GSK) | Inactivada | Fraccionada | Tetravalente | Jeringa precargada 0,5 ml | ≥6·meses | i.m. | A partir de 6 meses: 0,5 ml |
| Vaxigrip Tetra® (Sanofi) | Inactivada | Fraccionada | Tetravalente | Jeringa precargada 0,5 ml | ≥6·meses | i.m./ s.c | A partir de 6 meses: 0,5 ml |
| Fluenz Tetra (Astra Zeneca) | Atenuada | Viriones enteros | Tetravalente | Aplicador nasal | 2 a 18 años | Intranasal | >2 años |

La alergia al huevo ya no es una contraindicación para vacunar de gripe
Actualmente se recomienda según indicaciones de la Academia Americana de Pediatría y del Comité de Enfermedades Infecciosas que21:
- Todos los niños con alergia al huevo de cualquier gravedad pueden recibir la vacuna antigripal sin ninguna precaución adicional, más allá de las recomendadas para la administración de cualquier vacuna.
- Las vacunas inactivadas administradas en dosis única conforme a su edad son bien toleradas para receptores de la vacuna con una historia de alergia a huevo de cualquier gravedad.
- No se precisan medidas especiales para la vacunación de alérgicos al huevo porque el riesgo de anafilaxia no es mayor que en sujetos no alérgicos.
- La práctica de la vacunación estándar en niños debe incluir la habilidad de responder a reacciones de hipersensibilidad, aunque estas son muy poco frecuentes.
- Como norma general se mantiene que una reacción alérgica grave a la vacuna antigripal, independientemente del componente que sea la causa de la reacción, es una contraindicación para recibir futuras dosis de la vacuna.
¿Es necesario vacunarse cada año de la gripe?
Por el momento, debido a los cambios antigénicos, sí es necesaria la vacunación anual. Se estudia el desarrollo de una vacuna universal como una prioridad importante, pero esta realidad no será inmediata.
Una vacuna antigripal universal debería reunir las siguientes condiciones22:
- Efectividad vacunal de, al menos, un 75%.
- Protección frente a distintos tipos virales, estacionales y pandémicos.
- Duración de la protección de, al menos, un año, idealmente alrededor de diez.
- Ser utilizable a todas las edades.
CONFLICTO DE INTERESES
La autora declara no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
CAV-AEP: Comité de Vacunas de la Asociación Española de Pediatría • CDC: Centers for Disease Control and Prevention • CISNS: Consejo Interterritorial del Sistema Nacional de Salud • Hib: Haemophilus influenzae tipo b • MenACWY: vacuna antimeningocócica conjugada tetravalente • OMS: Organización Mundial de la Salud.
BIBLIOGRAFÍA
- Moreno-Pérez D, Álvarez García FJ, Álvarez Aldeán J, Cilleruelo Ortega MJ, Garcés Sánchez M, García Sánchez N, et al. Calendario de vacunaciones de la Asociación Española de Pediatría (CAV-AEP): recomendaciones 2018. An Pediatr (Barc). 2018;88:53.e1-9.
- López-Perea N, Masa-Calles J, Torres de Mier MV, Fernández-García A, Echevarría JE, de Ory F, et al. Shift within age-groups of mumps incidence, hospitalizations and severe complications in a highly vaccinated population. Spain, 1998-2014. Vaccine. 2017;35:4339-45.
- Centro Nacional de Epidemiología, CIBERESP, Instituto de salud Carlos IIII. Situación de la parotiditis en España, 1982-2016. En: Instituto de Salud Carlos III [en línea] [consultado el 04/05/2018]. Disponible en www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilancias-alertas/fd-enfermedades/fd-enfermedades-prevenibles-vacunacion/pdf_2017/Situacion_Parotiditis_ES_1982_2016.pdf
- Willocks LJ, Guerendiain D, Austin HI, Morrison KE, Cameron RL, Templeton KE, et al. An outbreak of mumps with genetic strain variation in a highly vaccinated student population in Scotland. Epidemiol Infect. 2017;145:3219-25.
- Vermeire T, Francart A, Hamouda A, Litzroth A, Hutse V, Martens L, et al. Limited cross-neutralization between the mumps vaccine and a recent outbreak strain in sera from different age cohorts of the Belgian population. En: European Congress of Clinical Microbiology and Infectious Diseases [en línea] [consultado el 04/05/2018]. Disponible en www.eccmidlive.org/#resources/limited-cross-neutralization-between-the-mumps-vaccine-and-a-recent-outbreak-strain-in-sera-from-different-age-cohorts-of-the-belgian-population
- May M, Rieder CA, Rowe RJ. Emergent lineages of mumps virus suggest the need for a polyvalent vaccine. Int J Infect Dis. 2018;66:1-4.
- Marín M, Marlow M, Moore KL, Patel M. Recommendation of the Advisory Committee on Immunization Practices for use of a third dose of mumps virus-containing vaccine in persons at increased risk for mumps during an outbreak. MMWR Morb Mortal Wkly Rep. 2018;67:33-8.
- Cardemil CV, Dahl RM, James L, Wannemuehler K, Gary HE, Shah M, et al. Effectiveness of a third dose of MMR vaccine for mumps outbreak control. N Engl J Med. 2017;377:947-56.
- European Centre for Disease Prevention and Control. Measles and rubella surveillance – 2017. Estocolmo: ECDC; 2018.
- Grima C, Borja EF. Epidemias y sus modelos. Las matemáticas vigilan tu salud. Modelos sobre epidemias y vacunas. Pamplona: Next Door Publishers; 2017. p. 95-124.
- Limia Sánchez A. Plan for the Elimination of Measles and Rubella in Spain. Rev Esp Salud Publica. 2015;89:393-6.
- MacDonald NE; SAGE Working Group on Vaccine Hesitancy. Vaccine hesitancy: definition, scope and determinants. Vaccine. 2015;33:4161-4.
- MacDonald NE, Finlay JC, Canadian Paediatric Society, Infectious Diseases and Immunization Committee. Working with vaccine-hesitant parents. Paediatr Child Health. 2013;18:265-7.
- CAV-AEP. La vacunación frente al rotavirus es segura en los prematuros hospitalizados. 16 marzo 2018. En: CAV-AEP [en línea] [consultado el 04/05/2018]. Disponible en http://vacunasaep.org/profesionales/noticias/vacuna-rotavirus-prematuros
- Resolution No. 02/18-2 Advisory Committee on Immunization Practices Vaccines for Children Program Vaccines to Prevent Hepatitis A. En: CDC [en línea] [consultado el 04/05/2018]. Disponible en www.cdc.gov/vaccines/programs/vfc/downloads/resolutions/0607-1hepa.pdf
- Okayasu H, Sein C, Chang Blanc D, González AR, Zehrung D, Jarrahian C, et al. Intradermal administration of fractional doses of inactivated poliovirus vaccine: a dose-sparing option for polio immunization. J Infect Dis. 2017;216:S161-S167.
- Rabies vaccines: WHO position paper – April 2018. En: Organización Mundial de la Salud [en línea] [consultado el 04/05/2018]. Disponible en http://apps.who.int/iris/handle/10665/272372
- Centro Nacional de Epidemiología, Instituto de Salud Carlos III. Informe de Vigilancia de la Gripe en España. Temporada 2017-2018. Informe semanal del Sistema de Vigilancia de la Gripe en España (SVGE). Semana 16/2018 (16 de abril al 22 de abril de 2018). En: Instituto de Salud Carlos III [en línea] [consultado el 04/05/2018]. Disponible en http://vgripe.isciii.es/inicio.do
- Recommended composition of influenza virus vaccines for use in the 2018- 2019 northern hemisphere influenza season. February 2018. En: Organización Mundial de la Salud [en línea] [consultado el 04/05/2018]. Disponible en www.who.int/influenza/vaccines/virus/recommendations/2018_19_north/en/
- CAV-AEP. Vacunación frente a la gripe estacional en la infancia y la adolescencia. Recomendaciones 2017-2018. Octubre 2017. En: CAV-AEP [en línea] [consultado el 04/05/2018]. Disponible en http://vacunasaep.org/documentos/recomendaciones-vacunacion-gripe-2017-18
- Greenhawt M, Turner PJ, Kelso JM. Administration of influenza vaccines to egg allergic recipients: a practice parameter update 2017. Ann Allergy Asthma Immunol. 2018;120:49.
- Erbelding EJ, Post D, Stemmy E, Roberts PC, Augustine AD, Ferguson S, et al. A universal Influenza vaccine: the Strategic Plan for the National Institute of Allergy and Infectious Diseases. J Infect Dis. 2018 [en prensa].