Vol. 18 - Num. 71
Lectura crítica en pequeñas dosis
El metaanálisis en red
aServicio de Gastroenterología. Hospital Infantil Universitario La Paz. Madrid. España.
Correspondencia: M Molina. Correo electrónico: mma1961@gmail.com
Publicado en Internet: 29-08-2016 - Número de visitas: 14795
Resumen
Los metaanálisis son estudios cuya finalidad es sintetizar toda la información disponible sobre un tema específico para obtener una medida resumen de resultado. Cuando existen más de dos comparaciones posibles, los metaanálisis tradicionales no permiten establecer las comparaciones si no se dispone de los estudios con las comparaciones específicas. Para estos casos se han diseñado los metaanálisis en red, que permiten incorporar la información de comparaciones directas e indirectas a partir de una red de estudios que examina los efectos de los diversos tratamientos de manera más completa.
Palabras clave
● Comparaciones directas ● Comparaciones indirectas ● Metaanálisis en red ● Revisión sistemáticaINTRODUCCIÓN
No cabe duda de que la revisión sistemática y el metaanálisis se han consolidado como una herramienta fundamental para la metodología de la medicina basada en la evidencia1. Cuando queremos responder a una pregunta sobre la eficacia comparada de dos intervenciones o tratamientos, lo ideal es disponer de ensayos clínicos que evalúen esas dos intervenciones. Sin embargo, en algunas ocasiones es difícil encontrar ensayos en los que se realice de manera específica la comparación de interés.
Otro problema se produce cuando queremos comparar más de dos intervenciones. En estos casos el metaanálisis tradicional no nos sirve, ya que no suelen existir ensayos que comparen más de dos intervenciones, sino múltiples ensayos que comparen las intervenciones con un comparador común, que frecuentemente es el placebo.
Para todas estas situaciones se han desarrollado técnicas de metaanálisis en red (MAR) que permiten obtener estimaciones de los efectos relativos de las intervenciones a través de comparaciones directas e indirectas que tienen en cuenta la red completa de los estudios disponibles2.
Para entender su funcionamiento, veamos en primer lugar qué son las comparaciones directas e indirectas.
TIPOS DE COMPARACIONES DE ESTUDIOS
En la situación más sencilla, cuando queramos comparar dos intervenciones A y B, podremos encontrar los ensayos clínicos que realicen la comparación de estas intervenciones en sus ramas del ensayo (Fig. 1). En este caso, realizaríamos un metaanálisis tradicional para estimar el tamaño de efecto entre dos tratamientos, ya que podemos hacer una comparación directa entre las dos intervenciones.
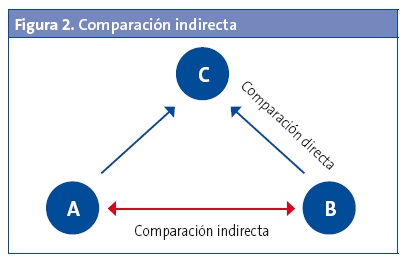
Otra posibilidad es que no tengamos ningún estudio que las compare directamente, pero dispongamos de estudios primarios que comparan dichos tratamientos de manera independiente con un mismo tratamiento de control, que con mucha frecuencia resulta ser el placebo (Fig. 2). En este caso, podemos hacer una comparación indirecta entre A y B en función de su eficacia relativa frente a C: las medidas directas entre A y C y entre B y C nos permiten obtener un resultado indirecto entre A y B, siempre que se ajuste la variabilidad de eficacia de C para cada brazo independiente1.
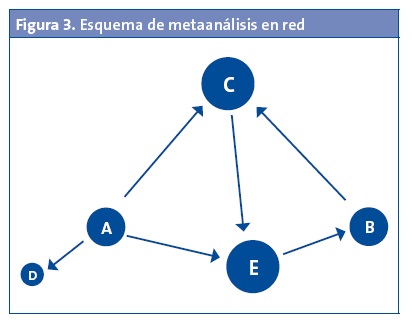
Pues bien, la realización de múltiples comparaciones directas e indirectas es lo que da lugar al MAR. Este representa de forma gráfica la red de las múltiples comparaciones entre las distintas intervenciones estudiadas, obteniendo información de las múltiples comparaciones directas, indirectas y mixtas2. Para representar cada tratamiento se utilizan nodos, que pueden ser de distinto tamaño en función del peso específico de cada estudio primario de la revisión, dibujándose una línea entre aquellos nodos para los cuales existen comparaciones directas (Fig. 3). La red completa pondrá de manifiesto todas las comparaciones de tratamientos identificadas a partir de los estudios primarios de la revisión sistemática.

VALIDEZ DEL METAANÁLISIS EN RED
La validez de los MAR en red depende de que se cumplan una serie de supuestos. Como en cualquier revisión sistemática con metaanálisis, la validez de las comparaciones, especialmente de las indirectas, dependerá de la calidad de los estudios primarios, de la heterogeneidad entre ellos y de la existencia de sesgos de información. La evidencia indirecta se considera de carácter observacional y requiere de la asunción de la propiedad de transitividad: si B es mejor que A y A es mejor que C, se asume que B es mejor que C. Será el investigador el que tenga que decidir si esta propiedad es aplicable en función de la calidad de los estudios y de sus conocimientos sobre las intervenciones y la enfermedad.
Otro aspecto importante a tener en cuenta se relaciona con la consistencia o coherencia en el nivel de acuerdo entre evidencia procedente de comparaciones directas e indirectas. Los resultados de las comparaciones deben tener la misma dirección, no pueden ser divergentes. Si lo son, habrá que investigar las razones, siendo lo más frecuente la falta de validez interna de los estudios primarios, la heterogeneidad o la existencia de sesgos de confusión3.
Por último, es esencial tener en cuenta los aspectos comunes a cualquier metaanálisis, como que se haya realizado una búsqueda exhaustiva, que se hayan tenido en cuenta las covariables que pueden actuar como confusoras en las comparaciones y la posible existencia de sesgos de publicación.
Existe una ampliación de la declaración PRISMA4, la PRISMA-NMA5, que incluyen entre sus nuevos ítems aspectos como la descripción de la geometría de la red de tratamientos, la consideración de los supuestos de transitividad e inconsistencia y la descripción de los métodos utilizados para explorar y analizar la estructura de la red para detectar la idoneidad de las comparaciones y si alguna puede tener un grado de evidencia menor. En este sentido, se recomienda que los autores proporcionen un gráfico de la red de estudios y discutan brevemente sus características.
LIMITACIONES DEL METAANÁLISIS EN RED
La primera es la necesidad de asumir la existencia de transitividad y de consistencia. Esto es esencial para la validez de los resultados del MAR. Existen técnicas estadísticas en desarrollo para detectar este tipo de inconsistencias6, pero no vamos a entrar a detallarlas.
La segunda, como en cualquier metaanálisis, es la dependencia de la calidad y validez interna de los estudios primarios, cuya heterogeneidad no debe ser excesiva. Es fundamental que cualquier comparación indirecta se realice siempre en el contexto de una revisión sistemática con metaanálisis rigurosos, evitando en lo posible cualquiera de los tipos de sesgos característicos de estos estudios.
Por último, comentar que el análisis estadístico es complejo, recurriéndose habitualmente al uso de paquetes estadísticos tales como Stata7 para el análisis de los resultados.
VEAMOS UN EJEMPLO DE LA BIBLIOGRAFÍA
Para poner en práctica los conceptos referidos previamente vamos a valorar un trabajo sobre el uso de medicaciones no intravenosas para el control de convulsiones en niños8. Los interesados pueden leer la valoración del trabajo que fue publicada en la sección de "Novedades bibliográficas" de la plataforma Continuum9.
Se trata de un MAR de 16 ensayos clínicos para medir la eficacia de las medicaciones no intravenosas para el tratamiento de las crisis convulsivas y el estatus epiléptico. Se hace una búsqueda de ensayos que incluyan medicación no intravenosa en al menos un brazo del ensayo y se realiza una red para comparar los efectos terapéuticos de las distintas parejas de comparación. En este caso se realiza un análisis bayesiano de los datos y se calcula la probabilidad de mayor efectividad con respecto a la rapidez en abortar la crisis tras la administración y desde la entrada al hospital, el tiempo empleado en administrar el tratamiento y el tiempo en parar la convulsión tras los primeros diez minutos de la misma y tras la primera hora.
Fijémonos ahora en la metodología del MAR propiamente dicho. Los autores declaran seguir las recomendaciones de la declaración PRISMA en cuanto a criterios de búsqueda, valoración de la calidad de los estudios y definición de criterios de inclusión y exclusión. Dado que disponen de pocos estudios, con falta de comparaciones dos a dos entre varios de los fármacos estudiados, deciden que el MAR es la forma más adecuada de sintetizar los datos para proporcionar una serie de efectos no sesgados obtenidos de comparaciones directas e indirectas.
Como método de análisis utilizan un modelo bayesiano que captura el tamaño del efecto como una odds ratio que se deriva de la distribución resultante de usar un modelo matemático previo y de la observación de los datos obtenidos. Para las comparaciones directas con más de cuatro estudios, los autores estudian la posible existencia de un sesgo de publicación mediante el forest plot y la heterogeneidad de los estudios primarios mediante los estadísticos I2 y τ2. Aquí surge una limitación importante de este estudio, que es la variabilidad entre las poblaciones y las pautas de administración de los diferentes estudios primarios de la revisión. Los trabajos con datos faltantes o desconectados de la red de comparaciones se excluyen del metaanálisis.
Los autores refieren utilizar métodos de división10 para valorar la existencia de inconsistencia entre comparaciones directas e indirectas. Posteriormente, en el apartado de resultados, representan gráficamente las diferentes redes de comparación establecidas y comentan su estructura al explicar los resultados de las comparaciones.
Vemos, pues, que este trabajo cumple básicamente las normas que deben exigirse a todo MAR para poder considerarlo con la validez interna suficiente. Para finalizar, únicamente señalar que los autores concluyen que el midazolam intramuscular e intranasal son las medidas de tratamiento no intravenosas más eficaces para el control de la crisis convulsiva y el estatus epiléptico en niños. El segundo más eficaz para abortar la crisis y mantener el efecto posteriormente es el midazolam oral, aunque su mayor lentitud en actuar puede limitar su uso fuera del ámbito hospitalario.
CONFLICTO DE INTERESES
El autor declara no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: MAR: metaanálisis en red.
BIBLIOGRAFÍA
- Guyat GH, Oxman AD, Kunz R, Vist GE, Falk-Ytter Y, Schunemann HJ, et al. What is “quality of evidence” and why is it important to clinicians? Br Med J. 2008;336:995-8.
- Catalá-López F, Tobías A, Roqué Conceptos básicos del metanálisis en red. Aten Primaria. 2014;46:573-81.
- Glenny AM, Altman DG, Song F, Sakarovitch C, Deks JJ, D’Amico R, Bradburn M, et al. Indirect comparisons of competing interventions. Health Technol Assess. 2005;9:1-134.
- Moher D, Liberati A, Tetzlaff J, Altman DG, PRISMA Group. Preferring reporting items for systematic reviews and meta-analysis: the PRISMA statement. Ann Intern Med. 2009;151:264-9.
- Hutton B, Catalá-López F, Mother D. La extensión de la declaración PRISMA para revisiones sistemáticas que incorporan metaanálisis en red: PRISMA-NMA. Med Clin (Barc). 2016; pii: S0025-7753(16)00151-2.
- Song F, Clark A, Bachmann MO, Maas J. Simulation evaluation of statistical properties of methods for indirect and mixed treatment comparisons. BMC Med Res Methodol. 2012;12:138.
- White R. Multivariate random-effect meta-analysis. Stata J. 2009;9:40-56.
- Arya R, Kothari H, Zhang Z, Han B, Horn PS, Glauser TA. Efficacy of nonvenous medications for acute convulsive seizures: a network meta-analysis. Neurology. 2015;85:1859-68.
- Molina Gutiérrez MA. Eficacia de las medicaciones no intravenosas en las convulsiones. En: Continuum [en línea] [consultado el 2/08/2016]. Disponible en http://continuum.aeped.es/courses/info/334#.V6BcdbiLTIU
- Dias S, Welton NJ, Caldwell DM, Ades AE. Checking consistency in mixed treatment comparison meta-analysis. Stat Med. 2010;29:932-44.





