Vol. 17 - Num. 66
Originales
Efecto de la lactancia materna en la calidad de vida y en el desarrollo de la dermatitis atópica
Marta Ibáñez Tortajadaa, J. V. Sorlí Guerolab
aCS de Atención Primaria de Alaquás. Valencia. España.
bDepartamento de Medicina Preventiva y Salud Pública. Universitat de València. CIBER Fisiopatología de la Obesidad y Nutrición. Valencia. España.
Correspondencia: M Ibáñez. Correo electrónico: marta_690@hotmail.com
Cómo citar este artículo: Ibáñez Tortajada M, Sorlí Guerola JV. Efecto de la lactancia materna en la calidad de vida y en el desarrollo de la dermatitis atópica. Rev Pediatr Aten Primaria. 2015;17:115-24.
Publicado en Internet: 18-06-2015 - Número de visitas: 20422
Resumen
Introducción: la dermatitis atópica (DA) es una patología de prevalencia creciente y de gran repercusión social. Siendo su etiología de origen multifactorial, analizamos si factores ambientales, especialmente la lactancia materna (LM), intervienen en su desarrollo y evolución. Los objetivos son evaluar la gravedad clínica y la calidad de vida de los niños con DA, detectar diferencias en la edad de diagnóstico según el tipo de lactancia recibida y estimar la asociación de padecer DA según las variables de interés analizadas.
Material y métodos: estudio de casos y controles apareado por edad y sexo en población infantil de Atención Primaria. Se realiza mediante el cumplimiento de tres cuestionarios a niños que acuden a las revisiones de salud establecidas por la Consellería de Sanidad de Valencia. Los datos recogidos se analizarán con el programa SPSS®.
Resultados: la DA se presenta más precozmente en los varones. Se observó un efecto protector de la LM frente a la lactancia artificial (LA) sobre el desarrollo de la DA (odds ratio [OR]: 0,15; intervalo de confianza del 95% [IC 95%]: 0,09-0,24), frente a procesos de alergia al polen o rinitis alérgica (OR: 0,35; IC 95%: 0,17-0,73), frente a la piel seca (OR: 0,22; IC 95%: 0,14-0,36), al picor (OR: 0,50; IC 95%: 0,27-0,93) y paralelamente en la repercusión de características clínicas y en la calidad de vida (puntuación del cuestionario Índice de Calidad de Vida de la Dermatitis Atópica Infantil [ICVDAI]: 2,3 ±3,5 frente a 0,7 ±0,1; p<0,001).
Conclusión: la elección de la LM mejora la calidad de vida en los niños, protege frente a la aparición de DA, de alergia al polen o rinitis alérgica y frente a algunas características clínicas cutáneas.
Palabras clave
● Calidad de vida ● Dermatitis atópica ● Lactancia maternaINTRODUCCIÓN
La dermatitis atópica (DA) puede ser definida como una enfermedad inflamatoria de la piel que se inicia en la infancia, caracterizada por lesiones de morfología y distribución específica y un curso crónico y recidivante, que afecta fundamentalmente a niños con antecedentes personales o familiares de atopia (“triada” asma, rinoconjuntivitis y DA)1. Es una enfermedad difícil de definir por la variabilidad que presenta en cuanto a morfología de las lesiones y en su distribución topográfica y por los cambios evolutivos en un mismo paciente a lo largo del tiempo. A pesar de los múltiples estudios realizados en los últimos 40 años no se ha localizado un marcador biológico que la identifique, por lo que el diagnóstico es siempre clínico2.
Los datos que hacen referencia a la incidencia y prevalencia real de la DA son variados e incluso contradictorios, porque los criterios diagnósticos y de valoración no están estandarizados. La atopia afecta a un 5-15% de la población general. En cuanto a la edad de aparición, un 80-90% debuta antes de los cinco años, siendo el primer año de vida, con el 60%, el de mayor frecuencia de inicio de los síntomas3.
La DA es un proceso en aumento en los últimos 30 años y todos los estudios epidemiológicos coinciden en que su prevalencia (como en el resto de las enfermedades alérgicas) es mayor en las ciudades y zonas industrializadas que en las áreas rurales. Durante los últimos decenios, la mayoría de las líneas de investigación de la DA se han dirigido hacia el estudio de los mecanismos etiopatogénicos de la enfermedad, pero de momento, en la práctica clínica seguimos sin tener marcadores diagnósticos o predictivos de la posible evolución en cada paciente4,5, así como del impacto en la calidad de vida demostrado en niños con dermatitis atópica6.
La leche materna (LM) es el método preferido de alimentación en la infancia, debido a sus beneficios nutricionales, inmunológicos y psicológicos7. Desde que Grulee y Sanford, en 1936, encontraron siete veces menos DA en niños alimentados con LM, la controversia del papel de esta en la prevención de las enfermedades alérgicas viene en aumento8,9. Esta controversia tiene varias razones, por un lado la complejidad inmunológica de la leche y las diferencias genéticas entre la madre y el niño; por el otro, las diferencias metodológicas en los estudios a favor y en contra de la protección y de la capacidad sensibilizante de la leche materna10.
En resumen, en niños de alto riesgo de dermatitis atópica existe evidencia de que la lactancia materna exclusiva o mixta con fórmulas hidrolizadas por un mínimo de cuatro meses disminuye el desarrollo de dermatitis atópica y de alergia a la proteína de leche de vaca en los primeros años de vida9,11. Esta evidencia es menos clara para lactantes sin riesgo de atopia. La LM más allá de los cuatro meses de edad parece no tener mayor beneficio o impacto en la incidencia de la dermatitis atópica, aunque algunos estudios indican un efecto protector de la LM frente a DA y asma7,12,13.
En este trabajo se plantea como objetivo el análisis de la relación de la LM y en el desarrollo de DA, evaluar la gravedad clínica y la calidad de vida de los niños con DA, detectar diferencias en la edad de diagnóstico según el tipo de lactancia recibida, y estimar la asociación de padecer DA según las variables de interés analizadas.
MATERIAL Y MÉTODOS
Se ha realizado un estudio de casos y controles apareado por edad y sexo en la población infantil de un centro de salud situado en una zona urbana del área metropolitana de Valencia (España), en los niños que acudieron a las revisiones del “Programa de salud infantil” desde la primera de recién nacido hasta los 14 años de edad, con el objetivo de identificar factores de riesgo asociados a niños que padezcan DA y analizar su calidad de vida, en este caso, relacionado con la influencia de la lactancia materna.
El tamaño muestral se calculó teniendo en cuenta la prevalencia de DA y la frecuencia de exposición en estudios previos2,14,15, asumiendo una población diana de 5088 niños, seleccionando dos controles por caso, aceptando un error α tipo I de 0,05 y aplicando la fórmula de cálculo se obtuvo una estimación mínima de 390 individuos (130 casos y 260 controles).
La definición del tipo de lactancia se ajustó a las recomendaciones internacionales16. Se clasificaron como casos de DA aquellos que cumplían los criterios diagnósticos de Hanifin y Rajka (1980)17, y si el resultado del cuestionario marcó una puntuación mayor que el punto de corte establecido y/o las respuestas de las preguntas hicieron sospechar la enfermedad, se comentaron los resultados individualmente con el pediatra y se prosiguió con la evaluación del proceso para alertar sobre un posible diagnóstico y finalmente, determinar o no la enfermedad. La selección de pacientes se realizó de manera aleatoria. El estudio fue aprobado por el Comité de Ética y se solicitó el consentimiento informado de los padres/madres/tutores legales de cada niño, quienes contestaron los diferentes cuestionarios. Se incluyeron 420 individuos (140 casos: 63 niñas y 77 niños, y 280 controles: 126 niñas y 154 niños).
Se cumplimentaron tres cuestionarios. En todos los participantes se recogió información sobre variables clínicas, sociodemográficas y ambientales, tipo de lactancia y reacciones alimentarias. En los casos de DA se realizó el cuestionario índice Scoring Atopic Dermatitis (SCORAD)18 para cuantificar la gravedad, preguntando también la edad al diagnóstico, la superficie corporal afectada y la estacionalidad de las manifestaciones clínicas20 y se evaluó la calidad de vida de la DA infantil mediante la escala ICVDAI19.
Se creó una base de datos con los datos obtenidos en las encuestas y se analizaron utilizando el programa informático SPSS® versión 19.0, empleando técnicas estadísticas estándar.
RESULTADOS
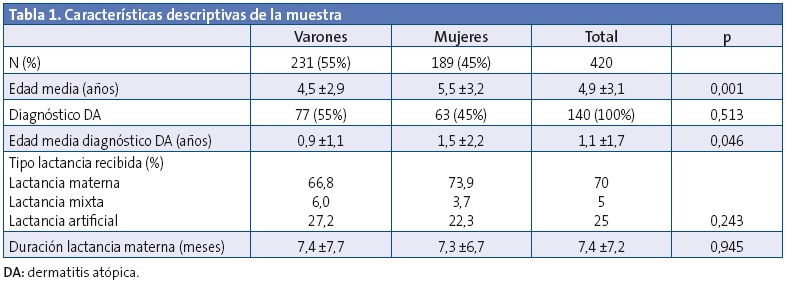
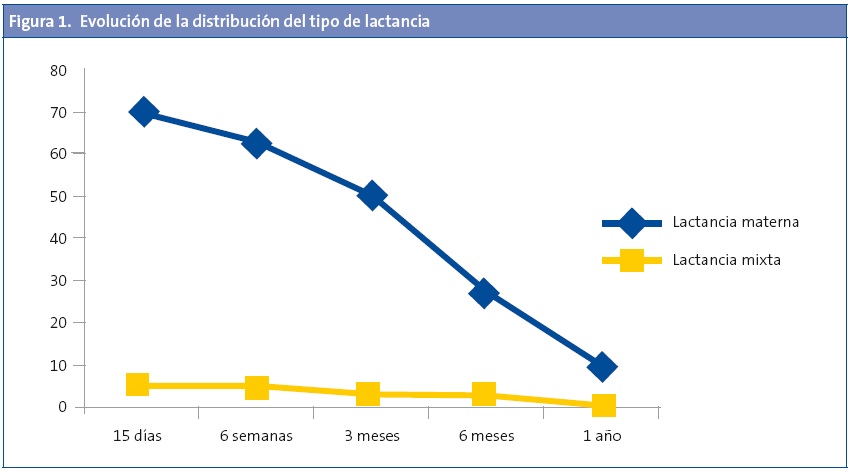
Las características descriptivas de la muestra se presentan en la Tabla 1. No se encontraron diferencias significativas entre casos y controles según las variables edad y sexo. La evolución de la distribución del tipo de lactancia se muestra en la Fig. 1. Como el grupo de lactancia mixta fue reducido, se unifica en los análisis estadísticos realizados junto al grupo de LM. No se observaron diferencias estadísticamente significativas al valorar el tipo de lactancia escogida y la clase social, así como el tiempo de lactancia y clase social. Tampoco se detectaron diferencias entre el tipo de lactancia escogida y el nivel de estudios de los padres, ni el tiempo de lactancia con el nivel de estudio de los padres.
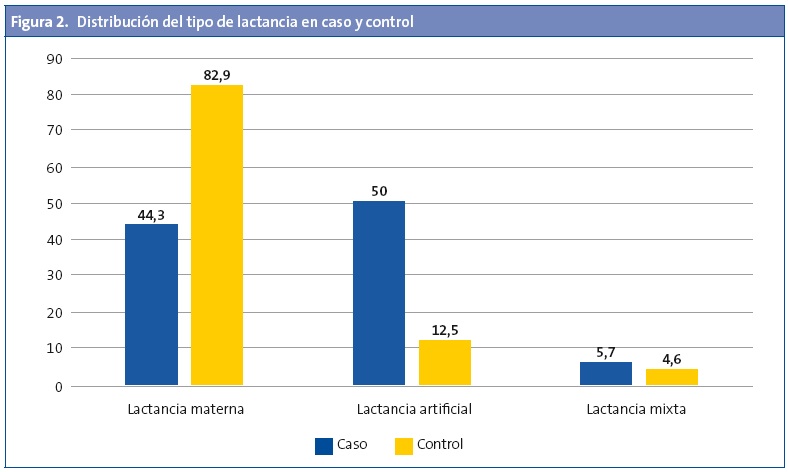
La LM fue más frecuente en el grupo de los controles (Fig 2), pero no se observaron diferencias según el tiempo de duración de esta 7,1 ±6,9 y de 7,6 ±7,5 meses para el grupo de los casos y controles respectivamente (p=0,609). Al calcular el riesgo de ser caso según la variable de si ha recibido LM se observó un claro efecto protector (odds ratio [OR]: 0,30; intervalo de confianza del 95% [IC 95%]: 0,21-0,44; p<0,001), incluso tras ajustar por edad, sexo y antecedentes familiares (OR: 0,15; IC 95%: 0,09-0,24; p<0,001).
Entre los motivos que justificaron la elección de la lactancia artificial (LA) destacan en un 9,5% una dificultad de adaptación al pecho, seguido por un 8,6% de hipogalactia, una experiencia negativa en una lactancia anterior y problemas laborales de las madres en un 6,7%, un 30,4% por diversos motivos, mientras que el 44,8% sin ningún motivo en especial que lo justificara. Por otro lado, justificaron la elección de lactancia mixta debido a la no subida (si no hay subida, no hay leche; será más bien hipogalactia o escasez) de leche materna, con un 66,7%, mientras que el 19,0% porque “el niño/a era muy tragón” y “la madre necesitaba un respiro”; un 14,3% alegaron otros motivos.
La media global de la superficie corporal afectada en los casos de DA medida por el índice SCORAD fue de 27,8 ±27,3 puntos, siendo de 33,6 ±29,8 para los niños y de 20,7 ±22,3 en las niñas (p=0,005), y, según el tipo de lactancia recibida, no se observaron diferencias en el conjunto de la muestra ni en aquellos niños y niñas con DA. No se observaron diferencias estadísticamente significativas por sexo ni por tipo de lactancia en las puntuaciones de intensidad ni en los síntomas subjetivos (prurito y pérdida de sueño). Al analizar el nivel de intensidad del eritema, edema, costra, excoriación y liquenificación de los niños diagnosticados de DA, no se observaron diferencias estadísticamente significativas por sexo ni por tipo de lactancia; por el contrario al valorar el nivel de sequedad sí fue más intensa en el género masculino (p=0,049).
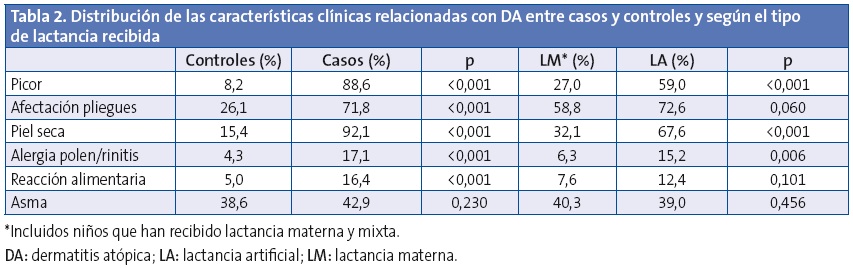
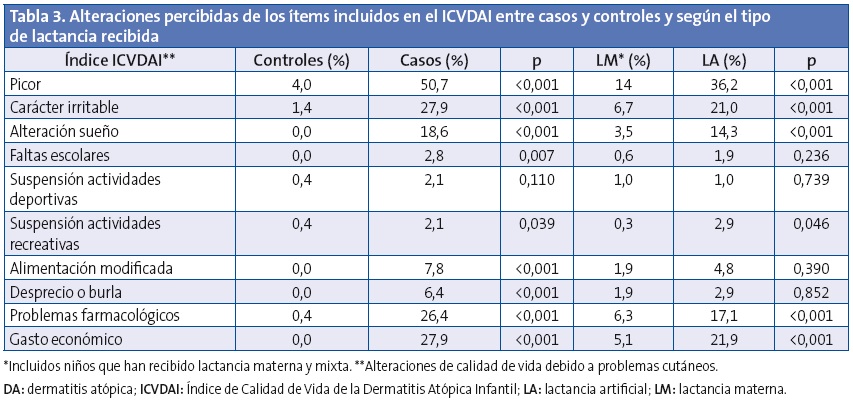
En la Tabla 2 se muestra la distribución de las características clínicas relacionadas con DA entre casos y controles, así como su distribución en la muestra según la lactancia recibida. El picor fue más frecuente en los casos y además su edad de aparición fue más temprana (1,0 ±1,3 frente a 4,4 ±3,1 años; p<0,001), sin embargo se observa que la LM retrasa el inicio del picor (LM 1,9 ±2,3 frente a LA 1,1 ±1,5 años; p=0,016), con efecto protector contra su aparición (OR: 0,50; IC 95%: 0,27-0,93; p=0,029) tras ajustar por edad y sexo y piel seca. Destaca el efecto protector de la LM frente a la aparición de piel seca con una OR de 0,22; IC 95%: 0,14-0,36; p<0,001 tras ajustar por edad y sexo, y frente a algún tipo de alergia al polen o rinitis alérgica (OR: 0,35; IC 95%: 0,17-0,73; p=0,005) ajustando por edad y sexo. En ambos efectos no se detectaron diferencias estadísticamente significativas al segmentar en tiempo de duración de la LM.
Al valorar los antecedentes familiares referidos a problemas cutáneos, respiratorios o mixtos, se observó que fueron más frecuentes en los niños con DA (72,9% frente a 44,6%; p<0,001) y menos frecuentes en aquellos que recibieron LM (50,5% frente a 64,8%; p=0,007). Al calcular el riesgo de DA según los antecedentes familiares se obtuvo en el análisis crudo una OR: 3,3 (IC 95%: 2,1-5,2; p<0,001) y para el análisis ajustado por edad, sexo y tipo de lactancia una OR: 3,2 (IC 95%: 1,9-5,2; p<0,001).
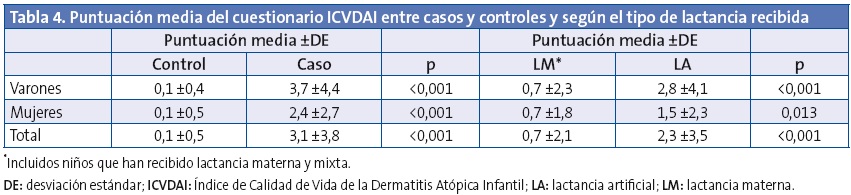
En la puntuación del cuestionario de calidad de vida ICVDAI se obtuvo una media global de 1,1 ±2,6 puntos, siendo de 0,85 ±1,9 puntos en las niñas y de 1,27 ±3,0 puntos en el caso de los niños (p=0,105). En la Tabla 3 se muestran las alteraciones percibidas de los ítems incluidos en el ICVDAI y en la Tabla 4 la puntuación media de dicho cuestionario, entre casos y controles y según el tipo de lactancia recibida. No se observaron diferencias estadísticamente significativas en cuanto al tiempo de duración de la lactancia materna y la puntuación del ICVDAI.
DISCUSIÓN
La lactancia materna actualmente es el método preferido de alimentación en la infancia, debido a sus beneficios nutricionales, inmunológicos y psicológicos7. Las recomendaciones del personal sanitario sobre la LM han ido variando a lo largo del tiempo y pueden observarse diferencias según la zona geográfica, la clase social, el nivel de estudios, la incorporación de la mujer al entorno laboral y la ampliación del permiso de maternidad21-23. En España se recuperaron los niveles de LM a partir de la década de los noventa, tras dos décadas de dominio del biberón en los años setenta y ochenta23. En un estudio que valoraba la prevalencia de la LM a lo largo de los últimos 15 años (1991-2005), se observaron cifras de LM a los 30 días del 60,4%, que descendían pero de forma menos pronunciada que en años atrás al 45,9% a los tres meses y al 33,3% a los cinco meses, triplicando esta última las tasas presentadas en 199124 y ligeramente superiores en estudios posteriores15. En nuestro trabajo observamos la misma tendencia descrita por Valbuena Barrasa en 2005, aunque con un ligero incremento en la frecuencia de LM detectada, similar a la descrita por J. M. Rius (2014) en población de la misma área de salud de este trabajo.
Debido a la gran diversidad de formas de presentación, varios grupos de trabajo han intentado constituir criterios uniformes para el diagnóstico de la DA, los más aceptados son los de Hanifin y Rajka de 1980. Existen diversas herramientas para cuantificar la severidad de la DA, pero hasta hace pocos años no se disponían de instrumentos específicos para evaluar el impacto de la enfermedad en la calidad de vida del paciente. Esta valoración es fundamental para adecuar los recursos sanitarios y evaluar la efectividad de las estrategias terapéuticas llevadas a cabo. La herramienta más comúnmente utilizada para cuantificar la gravedad de la DA es el índice SCORAD, teniendo en cuenta la extensión y la intensidad de las lesiones, así como los síntomas prurito y pérdida de sueño. SCORAD ha demostrado una buena correlación en la variabilidad intra e interobservador, pero al combinar parámetros subjetivos se puede complicar la interpretación de la puntuación y se puede perder información respecto al impacto en la calidad de vida25,26. Debido a este déficit de información, se optó por el cuestionario ICVDAI, el cual valora a través de diez preguntas el índice de calidad de vida.
La DA suele aparecer dentro del primer año de vida y, más concretamente, a partir de los dos o tres meses3, no obstante en el presente estudio obtenemos una edad media de diagnóstico superior a la descrita por estos autores, aunque observando que aparece más tempranamente en los niños que en las niñas. Algunos autores afirman que la incidencia es mayor en mujeres (2:1), aunque en la infancia predomina en los varones, no existiendo diferencias raciales significativas27, sin embargo en el estudio ELIHO no se identifica el sexo como un factor de riesgo para esta patología28.
Desde que se describió un menor riesgo de DA en niños alimentados con LM8, la controversia del papel preventivo de la LM en el desarrollo de las enfermedades alérgicas se debe en parte a la complejidad inmunológica de la leche, las diferencias genéticas y por las diferencias metodológicas de los estudios. En nuestro trabajo observamos un claro efecto protector de la LM respecto a la LA para el desarrollo de la DA como describen otros trabajos, pero en nuestro estudio el efecto es independiente del tiempo de lactancia materna, ya que aparece por el simple hecho de haberla recibido, aunque algunos estudios indican un efecto protector en niños con alto riesgo y un tiempo mínimo de tres a cuatro meses exclusivos con LM7,10,11.
En el presente estudio observamos que más de la mitad de los individuos con DA presentaron reacciones alimentarias, en concordancia a los resultados de diversos trabajos29-31. Aunque si comparamos nuestros datos con los descritos por Acevedo-Villafañe (2009), en nuestra población la prevalencia de alergias alimentarias es mucho menor en los niños con DA, posiblemente debido a las diferencias metodológicas.
Respecto a la relación de las alergias alimentarias con el tipo de lactancia, también existen contradicciones. Algunos autores describen que no hay pruebas claras de que el uso precoz de fórmulas hidrolizadas se asocie con las enfermedades alérgicas11,32, sin embargo, según la revisión Cochrane (2006) el uso de fórmulas hidrolizadas para el lactante en lugar de la fórmula de leche de vaca habitual podría reducir la alergia. Otros estudios en niños con riesgo atópico alimentados exclusivamente al seno materno por más de cuatro meses tuvieron una reducción significativa de la incidencia de alergia a la leche de vaca y DA los primeros cuatro años de vida33. En este trabajo observamos que el riesgo de padecer algún tipo de alergia fue notoriamente menor en aquellos que recibieron LM, aunque independientemente del tiempo de duración.
La DA está estrechamente vinculada a trastornos alérgicos como asma, rinitis, y conjuntivitis estacional7,34. En esta línea detectamos tres veces más algún tipo de alergia al polen o rinitis alérgica con respecto al grupo control. Por lo tanto, observamos en nuestro trabajo como la LM parece tener un efecto protector contra rinitis alérgica y dermatitis atópica, en consonancia con otros autores31,34.
Al valorar el factor de antecedentes familiares o genéticos, diferentes metaanálisis han mostrado que la LM durante al menos tres meses comparado con LA en lactantes con herencia atópica es un factor protector contra la DA, pero señalan un efecto protector más que dudoso en los niños sin historia familiar de enfermedades atópicas7,10,11,34,35. En nuestro trabajo observamos un mayor efecto protector de la LM frente a la DA, si tenemos en cuenta los antecedentes familiares, superior al descrito por Bloch (2002).
Las enfermedades cutáneas tienen un impacto significativo en la calidad de vida, la repercusión de la DA en la calidad de vida de los niños varía mucho según su intensidad y sus manifestaciones clínicas6,36. De todos los puntos valorados en este estudio con el cuestionario ICVDAI se detectó una afectación en aquellos que presentan una DA en el picor, carácter, sueño, faltas al colegio, actividades deportivas, recreativas, modificación alimentación, problemas con el tratamiento, peso económico y burlas. El niño atópico es un niño inquieto, con alteraciones del sueño, con una falta de concentración que le hace retroceder en el colegio y en el que los acontecimientos que lo rodean tienen influencia, generalmente negativa, sobre la evolución de la propia enfermedad37. Reafirmando nuestras observaciones, García Sicilia (2010) reconoce que “[...] la magnitud y persistencia del picor, sin duda, condicionan tremendamente la calidad de vida. La sensación de piel muy seca, sin elasticidad, puede llegar a ser muy molesta y cuando se localiza en zonas fácilmente visibles puede generar rechazo que afecta a las relaciones y autoestima, limitando significativamente el desarrollo de la personalidad durante la infancia”.
Limitaciones
La información recogida con carácter retrospectivo, así como el tipo de estudio utilizado, puede generar los sesgos característicos de este tipo de información y de los estudios de casos y controles. Como el grupo de lactancia mixta fue reducido, se unifica en los análisis estadísticos realizados junto al grupo de LM.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: DA: dermatitis atópica; IC 95%: intervalo de confianza del 95%; ICVDAI: Índice de Calidad de Vida de la Dermatitis Atópica Infantil; LM: lactancia materna; OR: odds ratio; SCORAD: Scoring Atopic Dermatitis.
AGRADECIMIENTOS
A todo el equipo que forma parte del centro de salud de Alaquás, especialmente a las pediatras y enfermeras de Pediatría.
BIBLIOGRAFÍA
- Simpson EL, Hanifin JM. Atopic dermatitis. Med Clin N Am. 2006;90:149-67.
- Fonseca Capdevila E. El niño con dermatitis atópica. Una visión global. Madrid: Loki and Dimas; 2006.
- Akdis CA, Akdis M, Biber T, Bindslev-Jensen C, Boquniewicz M, Eigenmann P. Diagnosis and treatment of atopic dermatitis in children and adults: European Academy of Allergology and Clinical Immunology/American Academy of Allergy, Asthma and Immunology/PRACTALL. Consensus Report. J Allergy Clin Immunol. 2006;118:152-69.
- Williams HC. Epidemiology of atopic dermatitis. Clin Dermatol. 2000;25:522-9.
- Zambrano Pérez E, Zambrano Zambrano A. Eccemas en la infancia. En: Muñoz Calvo MT, Hidalgo Vicario MI, Clemente Pollán J. Pediatría extrahospitalaria. Fundamentos clínicos para atención primaria. 4.ª edición. Madrid: Ergón; 2008. p. 901-8.
- Simonsen AB, Sommerlund M, Deleuran M, Mortz CG, Johansen JD. Course of skin symptoms and quality of life in children referred for patch testing–a long-term follow-up study. Acta Derm Venereol. 2015;95:206-10.
- Comité de nutrition de la Société française de pédiatrie, Turck D, Vidailhet M, Bocquet A, Bresson JL, Briend A, et al. Breastfeeding: health benefits for child and mother. Arch Pediatr. 2013;20:S29-48.
- Grulee CG, Sanford HN. The influence of breast and artificial feeding on infantile eczema. J Pediatr. 1936;9:223-5.
- Bath-Hextall F, Williams H. Eczema (atopic). Clinical Evidence. 2005.
- Gdalevich M, Mimouni D, David M, Mimouni M. Breast-feeding and the onset of atopic dermatitis in childhood: a systematic review and meta-analysis of prospective studies. J Am Acad Dermatol. 2001;45:520-7.
- Blattner CM, Murase JE. A practice gap in pediatric dermatology: does breast-feeding prevent the development of infantile atopic dermatitis? J Am Acad Dermatol. 2014;71:405-6.
- Laubereau B, Brockow I, Zirngibl A, Koletzko S, Gruebl A, von Berg A, et al. Effect of breast-feeding on the development of atopic dermatitis during the first 3 years of life: results from the GINI-birth cohort study. J Pediatr 2004;144:602-7.
- Friedman NJ, Zeiger RS. The role of breast-feeding in the development of allergies and asthma. J Allergy Clin Immunol. 2005;115:1238-48.
- Morales Suárez-Varela M, García-Marcos Álvarez L, González Díaz C, Arnedo Pena A, Domínguez Aurrecoechea B. Prevalencia de dermatitis atópica y factores nutricionales en niños de 6-7 años. Aten Primaria. 2007;39:355-60.
- Rius J.M, Ortuño J, Rivas C, Maravall M, Calzado M.A, López A, et al. Factores asociados al abandono precoz de la lactancia materna en una región del este de España. An Pediatr (Barc). 2014;80:6-15.
- OMS/UNICEF. Indicators for Assesing Health Facility Practices That Affect Breastfeeding. Ginebra: Organización Mundial de la Salud; 1993.
- Hanifin JM, Rajka G. Diagnostic features of atopic eczema. Acta Dermatovenereol Suppl (Stockh). 1980;92:44-7.
- Costa C, Rilliet A, Nicolet M, Saurat JH. Scoring atopic dermatitis: the simpler the better? Acta Derm Venereol. 1989;69:41-5.
- Consenso Nacional de Dermatitis Atópica. En: Sociedad Argentina de Dermatología (SAD) [en línea] [consultado el 12/06/2015]. Disponible en www.dermatolarg.org.ar/index.php/dermatolarg/article/viewFile/379/189
- García-Díez A, Puig L, Ortiz J, Blanco A. Validity of a telephone survey for determining the prevalence of atopic dermatitis and its seasonal variation in Spain. Actas Dermosifiliogr. 2009;100:298-306.
- Yaque M, Castillo E, Praena M, Sancho C, Fernández A, Herrera C, et al. Factores relacionados con el inicio de la lactancia materna en nuestro medio. Rev Pediatr Aten Primaria. 2000;5:35-46.
- Sacristán Martín AM, Lozano Alonso JE, Gil Costa M, Vega Alonso AT. Situación actual y factores que condicionan la lactancia materna en Castilla y León. Rev Pediatr Aten Primaria. 2011;13:33-46.
- Colodro-Conde L, Sánchez-Romera JF, Tornero-Gómez MJ, Pérez-Riquelme F, Polo-Tomás M, Ordoñana JR. Relationship between level of education and breastfeeding duration depends on social context: breastfeeding treneds over a 40-year period in Spain. J Hum Lact. 2011;27:272-8.
- Valbuena Barrasa L, de Lucas Veguillas A, Coca Méndez R, Paciencia de la Fuente C, Madroñal López P, Hernández Fernández E. Evolución de la lactancia materna y de algunos de sus factores condicionantes en nuestro medio. Talavera de la Reina; 2005.
- Kunz B, Oranje AP, Labrèze L, Stalder JF, Ring J, Taïeb A. Clinical validation and guidelines for the SCORAD index: Consensus Report of the European Task Force on Atopic Dermatitis. Dermatology. 1997;195:10-9.
- Charman CR, Venn AJ, Williams HC. The patient-oriented eczema measure: development and initial validation of a new tool for measuring atopic eczema severity from the patients' perspective. Arch Dermatol. 2004;140:1513-9.
- Méndez-Cabeza Velázquez J, Alache Zúñiga H, Cerrada Cerrada E. Manejo de la dermatitis atópica en Atención Primaria. MEDIFAM. 2003;13:75-84.
- Blanco QA, Díaz Castella JM, Balañá Vilanova M, Valveny Llobet N. Factores de riesgo de dermatitis atópica y su prevalencia en España (estudio ELIHO). An Pediatr (Barc). 2005;63:480-8.
- Lack G. Clinical practice. Food allergy. N Engl J Med. 2008;359:1252-60.
- Chafen JJ, Newberry SJ, Riedl MA, Bravata DM, Maglione M, Suttorp MJ, et al. Diagnosing and managing common food allergies: a systematic review. JAMA. 2010;303:1848-56.
- Acevedo Villafañe C, Latorre Latorre F, Cifuentes Cifuentes L, Díaz-Martínez LA, Garza Acosta O. Influencia de la lactancia materna y la alimentación en el desarrollo de alergias en los niños. Aten Primaria. 2009;41:675-80.
- Osborn DA, Sinn J. Fórmulas que contienen proteínas hidrolizadas para la prevención de alergias y de la intolerancia alimentaria en lactantes (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.bibliotecacochrane.com. (Traducida de The Cochrane Library, 2008 Issue 3. Chichester, UK: John Wiley & Sons, Ltd.).
- Halken S, Hansen KS, Jacobsen HP, Estmann A, Faelling AE, Hansen LG, et al. Comparison of a partially hydrolyzed infant formula with two extensively hydrolyzed formulas for allergy prevention: a prospective, randomized study. Pediatr Allergy Immunol. 2000;11:149-61.
- Kramer MS. Breastfeeding and allergy: the evidence. Ann Nutr Metab. 2011;59:20-6.
- Bloch AM, Mimouni D, Mimouni M, Gdalevich M. Does breastfeeding protect against allergic rhinitis during childhood? A meta-analysis of prospective studies. Acta Paediatr. 2002;91:275-9.
- Lio PA, Lee M, LeBovidge J, Timmons KG, Schneider L. Clinical management of atopic dermatitis: practical highlights and updates from the atopic dermatitis practice parameter 2012. J Allergy Clin Immunol Pract. 2014;2:361-9.
- Moreno Giménez JC. Dermatitis atópica (revisión). Alergol Inmunol Clin. 2000;15:279-95.





