Vol. 17 - Num. 65
Originales
Gastroenteritis bacteriana en un área de Zaragoza (España)
Elena Laín Mirandaa, Sonia Ruiz Aliendea, Carmen Marne Traperob, María José Revillo Pinillab
aMIR-Microbiología. Hospital Universitario Miguel Servet. Zaragoza. España.
bServicio de Microbiología. Hospital Universitario Miguel Servet. Zaragoza. España.
Correspondencia: E Laín. Correo electrónico: melainm@salud.aragon.es
Cómo citar este artículo: Laín Miranda E, Ruiz Aliende S, Marne Trapero C, Revillo Pinilla MJ. Gastroenteritis bacteriana en un área de Zaragoza (España). Rev Pediatr Aten Primaria. 2015;17:29-35.
Publicado en Internet: 10-03-2015 - Número de visitas: 23072
Resumen
Objetivo: las infecciones agudas del tracto gastrointestinal figuran entre las enfermedades infecciosas más frecuentes en atención primaria. La participación de los distintos microorganismos difiere de unas áreas geográficas a otras, con variaciones estacionales y según el grupo de población estudiada. El objetivo de este trabajo es estudiar retrospectivamente los coprocultivos y la investigación de toxina A/B de Clostridium difficile realizados de 2010 a 2012 en el Hospital Universitario Miguel Servet (Zaragoza, España) en pacientes pediátricos, que recibe las muestras de la población del área II de Zaragoza.
Materiales y métodos: se recibieron 24 058 heces para coprocultivo (46,6% de Pediatría) y 4132 para investigación de toxina (3,4% de Pediatría).
Resultados: el 9,6% de los coprocultivos fueron positivos para una o varias bacterias enteropatógenas (el 14,8% de las muestras de adultos y el 5,1% de las muestras pediátricas). El 5% de las determinaciones de toxina A/B de C. difficile fueron positivas (8,6% de las muestras pediátricas y 4,9% de las muestras de adultos).
Conclusiones: las bacterias más frecuentemente aisladas, tanto en niños como en adultos, fueron Campylobacter (el 49,9% de los positivos en niños y el 37,1% en adultos) y Salmonella (el 33,8% de los positivos en niños y el 32,9% en adultos). La especie más frecuente de Campylobacter fue Campylobacter jejuni y el serotipo de Salmonella más habitual fue Salmonella enteritidis.
Palabras clave
● Diarrea ● Enteropatógeno ● GastroenteritisINTRODUCCIÓN
Las infecciones del tracto gastrointestinal son, junto con las infecciones del tracto respiratorio y genitourinario, unas de las enfermedades infecciosas más frecuentes en Atención Primaria. Aunque muchas veces se trata de un proceso benigno en adultos sanos, un desequilibrio hidroelectrolítico puede provocar una deshidratación en niños, ancianos y en personas con factores de riesgo. A nivel mundial, las infecciones gastrointestinales siguen siendo una de las causas más importantes de morbilidad y mortalidad entre los lactantes1.
La participación de los distintos microorganismos difiere de unas áreas geográficas a otras y también depende del grupo de población estudiada. La gastroenteritis de etiología bacteriana es la segunda en importancia tras la vírica, siendo la etiología parasitaria menos frecuente. En cuanto al predomino estacional, hay mayor incidencia de gastroenteritis víricas en otoño-invierno, mientras que las bacterianas afectan preferentemente en primavera-verano2.
Los síntomas principales de las gastroenteritis son diarrea, fiebre, vómitos y dolor abdominal. Según el tipo de diarrea puede ser acuosa (secretora) o invasiva (disentería). La diarrea acuosa o secretora es la más frecuente y suele cursar con heces líquidas. En la diarrea invasiva o disentería las heces pueden contener sangre, moco y pus y puede cursar con fiebre, dolor abdominal y tenesmo. El diagnóstico definitivo solo se puede obtener mediante pruebas de laboratorio.
El objetivo del presente estudio es conocer los resultados de los coprocultivos y de la investigación de toxina A/B de Clostridium difficile realizados en la población pediátrica del Área II de Zaragoza (España).
MATERIALES Y MÉTODOS
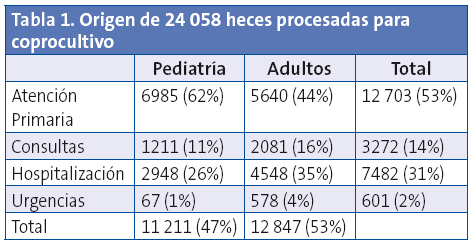
Desde enero 2010 hasta diciembre 2012 se recibieron para coprocultivo en el Servicio de Microbiología del Hospital Universitario Miguel Servet de Zaragoza 24 058 muestras de heces, de las que el 46,6% correspondía a pacientes en edad pediátrica. La distribución por sexos fue similar. La mayor parte de las heces eran de pacientes de Atención Primaria (Tabla 1).
Las muestras de heces se recibieron en contenedor estéril sin medio de transporte y se sembraron directamente en los medios de cultivos habituales para aislamiento de los gérmenes más frecuentes causantes de diarrea, que incluían:
- Agar sangre para una visión general de la flora intestinal presente.
- Agar XLD (xiloxa, lisina, desoxicolato) para aislamiento de Salmonella y Shigella.
- Agar CIN agar (cefsulodina, irgasan, novobiocina) para aslamiento de Yersinia y Aeromonas.
- Agar CCD (carbón, cefoperazona, desoxicolato, anfotericina) para aislamiento de campylobacter.
- En caso de heces líquidas se añadió una placa de agar MacConkey sorbitol (SMAC) para aislamiento de Escherichia coli enterohemorrágica O157.
- Además se sembraron en caldo tetrationato para enriquecimiento en Salmonella, con posterior resiembra a las 24 horas en agar Hektoen.
Las placas de agar sangre, XLD, SMAC y Hektoen se incubaron aeróbicamente a 35 °C durante 24 horas, la placa de CIN a 30 °C 24 horas y la placa de agar CCD se incubó a 42 °C en atmósfera microaerofílica con lecturas a las 24 y 48 horas.
La identificación de los microorganismos se realizó por espectrometría de masas MALDI-TOF® Brucker Daltonik. En los casos de Salmonella, Shigella y Yersinia se completó la identificación con aglutinación mediante antisueros comerciales. Las cepas de Salmonella se enviaron al Centro Nacional de Microbiología para estudio epidemiológico de serotipado y fagotipado. El estudio de sensibilidad antibiótica se realizó por microdilución (MicroScan Walkaway®, Siemens) y en el caso de Campylobacter mediante difusión disco placa en agar sangre.
Se recibieron 4132 heces para la investigación de Clostridium difficile, siendo el 3,41% de Pediatría. Se realizó la detección de la toxina A/B de Clostridium difficile mediante inmunoensayo en microplaca y se confirmó la positividad por citotoxicidad en cultivos tisulares.
RESULTADOS
De los 24 058 coprocultivos realizados, 9,6% fueron positivos para uno o varios enteropatógenos. El 14,8% de las 11 211 muestras pediátricas y el 5,1% de las 12 847 muestras de adultos fueron positivas.
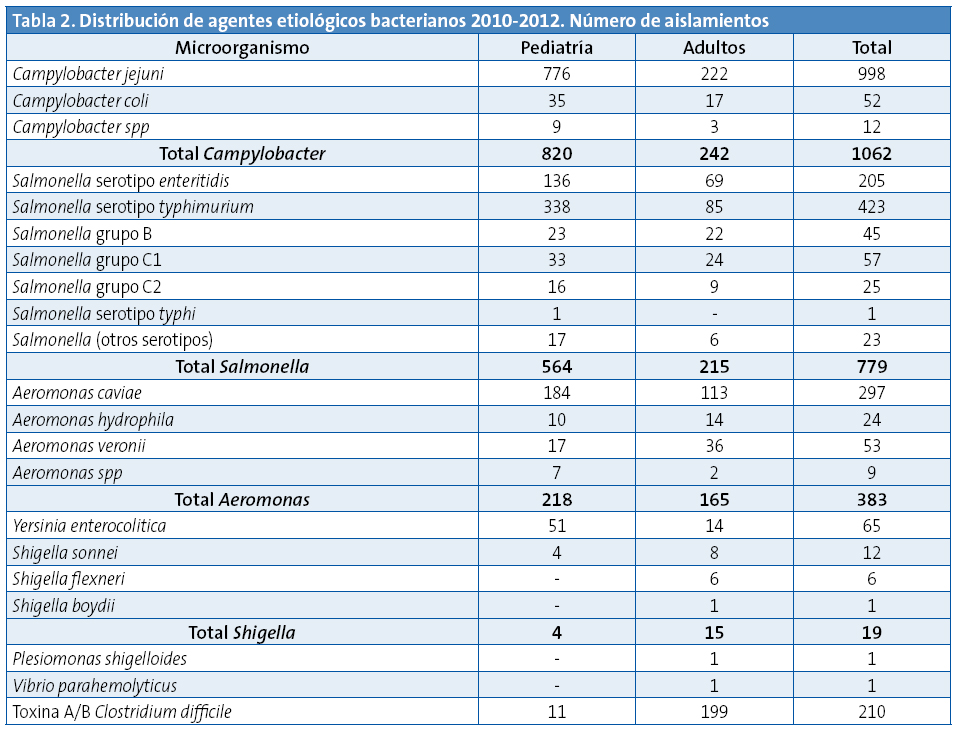
Enla Tabla 2 se desglosan los resultados microbiológicos obtenidos en Pediatría en comparación con los de adultos. Las bacterias más frecuentemente aisladas, tanto en niños como en adultos, fueron Campylobacter (el 49,9% de los positivos en niños y el 37,1% en adultos)y Salmonella (el 33,8% de los positivos en niños y el 32,9%en adultos). Dentro de la gran variabilidad antigénica de Salmonella predominó el serotipo typhimurium. Le sigue por orden de frecuencia Aeromonas. Dentro del género Campylobacter la especie másfrecuentemente aislada fueC. jejuni (Tabla 2). De las 4132 determinaciones de toxina A/B de C. difficile fueron positivas el 5% (el 8,6% de las 128 muestras pediátricas y el 4,9% de las 4004 muestras de adultos) (Tabla 2).
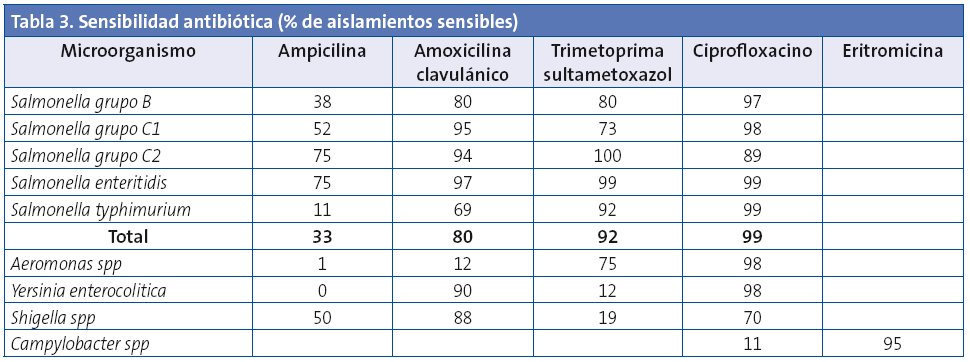
Los resultados de sensibilidad antibiótica de las principales bacterias enteropatógenas aisladas en coprocultivo se reflejan en la Tabla 3.
DISCUSIÓN
La investigación bacteriológica de procesos diarreicos representa una parte importante del trabajo de un laboratorio de Microbiología en coste, tanto por el número de placas utilizado como por el tiempo empleado. Sin embargo, es habitual obtener un bajo rendimiento en resultados de positividad con aislamiento e identificación del agente etiológico bacteriano. Las causas son múltiples. La falta de datos demográficos y clínicos del paciente y de orientación diagnóstica en la solicitud impide la elección de la técnica adecuada por la variedad de agentes infecciosos implicados (bacterias, virus, toxinas, parásitos). La edad, síntomas, tipo de diarrea, brote o caso aislado, viajes a países de riesgo y cualquier otro dato de interés facilita el diagnóstico microbiológico.
En el caso de bacterias enteropatógenas su labilidad es alta por los cambios de pH, temperatura y humedad sufridos por las heces, lo que hace que deba ser considerada una muestra que se debe tomar al inicio del cuadro diarreico, transportar y procesar con rapidez. El envío de muestras múltiples supone una sobrecarga para el laboratorio sin aportar una mejora sustancial del rendimiento, ya que la muestra óptima es la inicial. No se recomienda el envío de muestras en proceso de mejoría clínica por la alta probabilidad de obtener un resultado falsamente negativo. En nuestro laboratorio, el 28% de las heces recibidas eran inadecuadas por ser formes de consistencia sólida.
Las bacterias más frecuentemente aisladas en nuestro estudio no difieren del resto de la literatura médica revisada y fueron, tanto en niños como en adultos, Campylobacter y Salmonella2,3. El aumento de especies exóticas como mascotas infantiles domiciliarias, sobre todo animales de sangre fría, hace que aparezcan esporádicamente serotipos de Salmonella inusuales en nuestro país4. Dentro del género Campylobacter la especie másfrecuentemente aislada fueC. jejuni, datos acordes con estudios previos5. Shigella y Yersinia no representan un problema epidemiológico en salud pública por su baja frecuencia.
El papel patógeno de Aeromonas en cuadros diarreicos es controvertido, ya que no se ha podido reproducir en modelos animales, aunqueA. hydrophila yA. veroni son especies potencialmente invasivas. Su aislamiento en heces puede responder a colonización transitoria. En países desarrollados la tasa de portador de Aeromonas está entre el 2 y el 10%7. El incremento estival de los aislamientos de Aeromonas sin una clara implicación patógena en el proceso diarreico puede deberse fundamentalmente a su mayor desarrollo en alimentos y medios acuáticos de recreo, por la elevación de la temperatura ambiental. En general son cuadros benignos autolimitados, asociados principalmente con el consumo previo de pescado o marisco. Su presencia puede estar subestimada en casos de diarrea subaguda (de dos semanas a dos meses) o crónica (más de dos meses). Aunque no hay datos concluyentes, su papel en la diarrea del viajero puede ser importante. Ocasionalmente puede presentarse como diarrea secretora acuosa. En casos extremos se ha asociado con síndrome hemolítico urémico7.
Recientemente ha cobrado especial relevancia la investigación de toxina de C. difficile. Aunque estaba reservada para pacientes hospitalizados, en casos especiales debe tenerse en cuenta en Atención Primaria, siempre según pautas de actuación consensuadas con el laboratorio. No se recomienda en edades inferiores a dos años por la dificultad de interpretación de los resultados, dado que es muy frecuente el estado de portador en esas edades6. Aunque el número total de determinaciones de toxina A/B de C. difficile no fue elevado, el 8,6% de las determinaciones pediátricas y el 4,9 % de las de adultos fueron positivas. La implantación de protocolos revelará la incidencia real de este cuadro en Atención Primaria6.
El tratamiento principal de la enteritis infecciosa bacteriana es la rehidratación oral y, con la introducción precoz de la alimentación habitual, la diarrea remite en pocos días. La lactancia materna no debe interrumpirse8,9. Solamente está justificado el ingreso hospitalario en caso de intolerancia oral o deshidratación. Los tratamientos sintomáticos y sobre todo los antibióticos no están recomendados de forma habitual en todos los casos. Se tendrá en cuenta el tipo de diarrea, la situación clínica y el patógeno implicado. En la gastroenteritis por Shigella y en las formas disentéricas por Campylobacter y Salmonella, el tratamiento precoz reduce los síntomas, el riesgo de bacteriemia y la contagiosidad, al acortar la duración de la eliminación fecal de la bacteria8. En general, en los casos de diarrea acuosa por Salmonella la mejoría con el tratamiento es solo aparente, ya que el cultivo se negativiza en etapas tempranas, pero posteriormente aumentan los cultivos positivos. Además podrían aumentar las recaídas, provocar reacciones adversas y aumentar las resistencias8,10. Estaría indicado en neonatos y en pacientes inmunodeprimidos. No se recomienda por innecesaria la realización de coprocultivos de control en procesos autolimitados en pacientes inmunocompetentes11.
Entre los antibióticos más utilizados para el tratamiento de las infecciones producidas por Salmonella figuran la amoxicilina-clavulánico, las fluoroquinolonas (en adultos o en niños de más edad cuando no existe otra alternativa) o trimetoprima-sulfametoxazol12-17. En los aislados de Salmonella estudiados, la tasa de resistencia global a la ampicilina fue del 77%. Los mayores porcentajes de resistencia se observaron entre los aislados del serotipo typhimurium (88%) en comparación con el serotipo enteritidis (25%). La resistencia a amoxicilina-clavulánico fue del 20%. Todos los serotipos presentaron una sensibilidad cercana al 100% a ciprofloxacina. Estos resultados de sensibilidad antibiótica son similares a otros estudios nacionales14-17.
A partir de la década de los noventa, la resistencia de Campylobacter a fluoroquinolonas se ha incrementado rápidamente en diferentes países, reconociéndose como un problema de salud pública. Este aumento coincide con la aprobación del uso de quinolonas fluoradas en aplicaciones veterinarias. En nuestro estudio se observó un 89% de aislados resistentes a ciprofloxacina y un 5% resistentes a eritromicina, cifras en sintonía con las referidas por otros autores. Si bien en la mayoría de los países desarrollados la tasa de resistencia a macrólidos en aislados clínicos de Campylobacter no es alarmante, se ha documentado una tendencia a un incremento, tanto en animales como en humanos18.
Las medidas más eficaces de prevención consisten sobre todo en la educación sanitaria, el cuidado de la higiene para evitar el contagio persona-persona y, en el caso de Salmonella, en el control de portadores. El portador crónico es el que presenta Salmonella en heces u orina durante más de un año10. La erradicación en un portador crónico solo estaría indicada en trabajadores sanitarios y de centros de ancianos, en pacientes con virus de la inmunodeficiencia humana (VIH) positivos, en manipuladores de alimentos y si se convive con inmunodeprimidos11.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: CCD: carbón, cefoperazona, desoxicolato, anfotericina; CIN: cefsulodina, irgasan, novobiocina; SMAC: agar Macconkey sorbitol; VIH: virus de la inmunodeficiencia humana; XLD: xiloxa, lisina, desoxicolato.
BIBLIOGRAFÍA
- Vila J, Álvarez-Martínez MJ, Buesa J, Castillo J. Diagnóstico microbiológico de las infecciones gastrointestinales. Enferm Infecc Microbiol Clin. 2009;27:406-11.
- Álvarez Martínez M, Buesa Gómez J, Castillo García J, Vila Estape J. Diagnóstico microbiológico de las infecciones gastrointestinales. Procedimientos en Microbiología Clínica. En: Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica [en línea] [consultado el 27/02/2015]. Disponible en www.seimc.org/
- Fischer Walker CL, Sack D, Black RE. Etiology of diarrhea in older children, adolescents and adults: a systematic rewiew.PloS Negl Trop Dis. 2010;4:e768.
- Palomar Saiz S, Lopes Semedo G, Montejo Martínez MC, Cortés Rico O, María Tablado MA.Abordaje de una microepidemia de salmonelosis en el seno de una familia. Rev Pediatr Aten Primaria. 2011;20:e14.
- Van Trieu T, De Pontual L. Conduite à tenir devant une diarrhée aigüe chez l’enfant. Presse Med. 2013;42:60-5.
- Bouza E, Marín M, Peláez T, Group for Clostridium difficile infection of the Spanish Society for Chemotherapy. The situation and management of Clostridium difficileinfection in Spain: an opinion document. Rev Esp Quimioter. 2013;26:261-86.
- Janda MJ, Abbott SL. The genus Aeromonas: raxonomy, pathogenicity and infection.Clin Microbiol Rev. 2010;23:35-73.
- Costa i Pagès J, Polanco Allué I, Gonzalo de Liria CR. Guía de Práctica Clínica. Gastroenteritis aguda en el niño. Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica [en línea] [consultado el 27/02/2015]. Disponible en www.guiasalud.es
- Gutiérrez Castrellón P, Polanco Allue I, E. Salazar Lindo E. Manejo de la gastroenteritis aguda en menores de 5 años: un enfoque basado en la evidencia. Guía de práctica clínica Íbero-Latinoamericana. An Pediatr (Barc). 2010;72:220.e1-220.e20.
- Colaboración Cochrane. Antibióticos en infecciones intestinales por salmonela. Rev Pediatr Aten Primaria. 1999;1:453-6.
- Pegues DA, Miller SI.Salmonellaspecies, includingSalmonellatyphi.En: Mandell GL, Bennet JE, Dolin R (eds). Mandell, Douglas and Bennett’s principles and practice of infectious diseases. 7.ª edición. Filadelfia (PA): Churchill Livingstone Elsevier; 2010. p. 2887-2903.
- Mensa J, Gatell JM, García-Sánchez JE, Letang E, López-Suñé E, Marco F. Guía de terapéutica antimicrobiana. 23.ª edición.Barcelona: Antares; 2014.
- Gendrel D, Cohen R. Diarrhées bactériennes et antibiotiques: les recommandations européenes. Arch Pediatr. 2008;15:S93-6.
- Delgado Ronda N, Muñoz Bellido JL, Ibáñez Pérez R, García García MI, Serrano Heranz R, Muñoz Criado S, et al. Resistencia a antimicrobianos en Salmonella no typhien Castilla y León. Rev Esp Quimioterap. 2004;1729-36.
- Guerri Santos ML, Rotger R. Evolución de la resistencia a quinolonas y betalactámicos en distintos serogrupos de Salmonelladurante la última década en un centro hospitalario de Madrid. Rev Esp Quimioter. 2004;17:37-43.
- Onwuezobe IA, Oshun O, Odigwe CC.Antimicrobials for treating symptomatic non-typhoidalSalmonella infection. Cochrane Database Syst Rev. 2012 Nov 14;11:CD001167.
- De Toro M, Seral C, Rojo-Bezares B, Torres C, Castillo J, Saénz Y, et al. Resistencia a antibióticos y factores de virulencia en aislados clínicos de Salmonella entérica. Enferm Infecc Microbiol Clin. 2014;32:4-10.
- González-Abad MJ, Alonso-Sanz M. Incidencia y sensibilidad de Campylobacter jejunien pacientes pediátricos: implicación en bacteriemia. Rev Esp Quimioter. 2013;26:92-6.





