Vol. 16 - Num. 62
Colaboraciones especiales
Vacunaciones en el niño con síndrome de Down
Josep M.ª Corretger Raueta, AEP en representación del Comité Asesor de Vacunas de lab
aConsell Assessor de Vacunacions. Departament de Salut. Generalitat de Catalunya. Barcelona. España.
bComité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP, http://vacunasaep.org/): D. Moreno Pérez, F. J. Álvarez García, J. de Arístegui Fernández, M. J. Cilleruelo Ortega, J. M. Corretger Rauet, N. García Sánchez, A. Hernández Merino, M.
Cómo citar este artículo: Corretger Rauet JM, en representación del Comité Asesor de Vacunas de la AEP. Vacunaciones en el niño con síndrome de Down. Rev Pediatr Aten Primaria. 2014;16:159-67.
Publicado en Internet: 30-06-2014 - Número de visitas: 29592
Resumen
Se hace una revisión de las circunstancias y características de los niños y jóvenes con síndrome de Down en lo que se refiere a la especial susceptibilidad de los mismos a padecer infecciones y las oportunidades de optimización que suponen las inmunizaciones sistemáticas disponibles.
Se propone un calendario de vacunaciones sistemáticas aplicables a los pacientes con síndrome de Down que pretende responder al objetivo citado, y que incluye a las vacunas frente a: hepatitis B, difteria, tétanos y tosferina, sarampión, rubeola y parotiditis, poliomielitis, enfermedad invasiva por neumococo y Haemophilus influenzae tipo b, gripe, varicela, rotavirus y hepatitis A.
INTRODUCCIÓN
El síndrome de Down (SD) comporta una variedad de anomalías inmunológicas en los compartimentos humoral y celular1-3. Corresponden a diversas variantes de los distintos elementos que participan en la respuesta inmunitaria, sobre todo de la específica (linfocitos, inmunoglobulinas), aunque sin la uniformidad que caracteriza a las inmunodeficiencias primarias catalogadas. Los conocimientos actuales la contemplan como una anomalía intrínseca al síndrome, siendo más improbable o marginal el efecto de una senescencia precoz del sistema inmunitario, paralela a un precoz envejecimiento3,4. Concentran la principal responsabilidad de la elevada morbimortalidad de las personas con SD por enfermedades infecciosas, sobre todo del tracto respiratorio, especialmente durante sus primeros cinco años de vida y en edades avanzadas, cada vez más alcanzables. Otros factores inherentes o asociados al síndrome contribuyen a ello: sus frecuentes contactos con otros pacientes con discapacidad funcional neurológica en centros de educación o atención especial, la acendrada afectividad que comporta su fenotipo conductual y la frecuente coexistencia de anomalías de los aparatos cardiaco y respiratorio, tanto congénitas como adquiridas.
Las primeras aportaciones sobre la particular susceptibilidad de las personas con SD a las infecciones se deben a Blumberg et al. en 19675. Detectaron, en residentes en instituciones cerradas para discapacitados mentales, una prevalencia de marcadores de infección por el virus de la hepatitis B (VHB) mayor de la habitual y significativamente superior en los afectos de SD. La observación se ratificó en un gran número de trabajos posteriores y promovió el estudio de sus mecanismos inmunitarios, al apreciar que evidenciaban también un riesgo más elevado de convertirse en portadores crónicos del virus y de mantener activa su replicación viral, con la consiguiente prolongación de su infecciosidad5-7.
Las infecciones del tracto respiratorio (ITR) representan en este momento la segunda causa de muerte en niños con SD –tras las debidas a cardiopatías congénitas– y la primera de las tasas de hospitalización, recaídas y complicaciones8. La trisomía 21 ha sido, asimismo, reconocida como un factor independiente de riesgo de bronquiolitis por virus respiratorio sincitial (VRS)9. Otras infecciones, como las gastrointestinales, cursan a menudo con una especial intensidad, recurrencias o cronicidad. Los niños con SD hospitalizados por sepsis sufren un 30% más de mortalidad que los demás en similares condiciones10.
Un buen número de estas enfermedades son inmunoprevenibles. Sin embargo, las características inmunológicas del SD levantaron interrogantes sobre la reactogenicidad y eficacia de las vacunaciones en este colectivo. Posteriores estudios y la propia experiencia clínica han clarificado muchos de ellos. Su tolerancia general es similar a la de la población general. Su inmunogenicidad, en cambio, puede ser subóptima y menos duradera. Las respuestas inmunógenas a diferentes antígenos vacunales son dispares, probablemente debido a la heterogeneidad de las deficiencias inmunitarias propias del síndrome. La frecuente coexistencia de comorbilidades –obesidad, celiaquía, diabetes mellitus– puede contribuir a la reducción de la efectividad de ciertas vacunas, como la de la hepatitis B. Es necesario que estos conocimientos sustenten las recomendaciones más apropiadas para las personas con SD y que se reflejen en su calendario de vacunaciones11.
Se comentan a continuación las que cabe considerar en niños con SD en relación a las enfermedades prevenibles mediante vacunas, y a partir de las recomendaciones del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP)12, advirtiendo de que algunas de ellas cuentan con insuficientes pruebas objetivas y están basadas en datos indirectos y presunciones que se estiman razonables (Tabla 1).
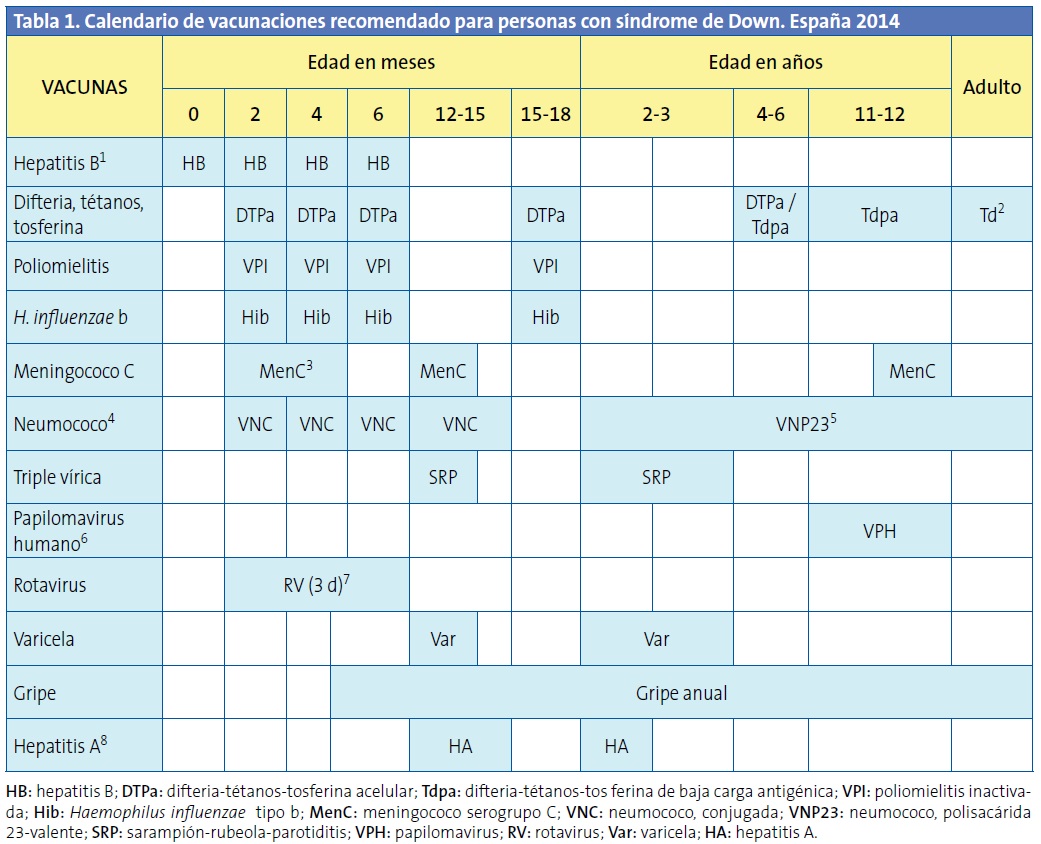
1De acuerdo con la pauta vigente en cada comunidad autónoma. A cualquier edad, en ausencia de vacunación previa, se administrará una serie de 3 dosis (0, 1 y 6 meses). 2Dosis de refuerzo durante la vida adulta, siguiendo la pauta de cada comunidad autónoma; asegurar la recepción total mínima de 5 dosis. 31 o 2 dosis según la vacuna utilizada. 4El CAV-AEP recomienda la vacunación antineumocócica con las vacunas conjugadas desde los 2 meses hasta los 5 años de vida (en grupos de riesgo hasta los 17 años), siendo la VNC13 la que más cobertura ofrece en España con los datos epidemiológicos y microbiológicos actuales. 5Una dosis única de VNP23 a partir de los 2 años de vida, como mínimo 8 semanas después de la última dosis de VNC. En caso de inmunodeficiencia grave, administrar una 2.ª y última dosis de VNP23 a los 5 años de la primera. En mayores de 5 años, se considerará administrar una dosis de VCN13 a quienes no la hayan recibido previamente. 6En niñas. 73 dosis de RotaTeq®, la vacuna actualmente disponible. 8La 2.ª dosis, a los 6-12 meses de la 1.ª.
HEPATITIS B
La normalización de la vida familiar, escolar y social ha reducido la prevalencia de la enfermedad en los niños con SD a niveles cercanos a los de la población infantil general13,14, sobre todo a partir de la implantación de la vacunación sistemática de todos los lactantes. Pero, si se produce la infección, no abandonan la tendencia a su cronicidad y elevada contagiosidad15. Se ha atribuido a una respuesta específica humoral ineficiente, en particular de la IgG116, y a déficits funcionales de los linfocitos T y las células natural killer2,3.
Numerosos estudios, iniciados en los años 1990, han mostrado que la vacunación induce en estos niños tasas de seroconversión del 93 al 100%17,18. Resultados que se alinean con los comunicados en adultos19-23 y avalan el criterio de que la población Down no debe actualmente considerarse como un grupo especial al formular las estrategias vacunales frente a la hepatitis B20.
Sin embargo, en un reciente estudio, la vacunación de párvulos y adolescentes brasileños generó tasas de seroconversión llamativamente inferiores, del 48,3%24. En la Fundació Catalana Síndrome de Down (FCSD) se determinan aleatoriamente las concentraciones séricas de anticuerpos anti-HBs en niños vacunados correctamente frente al VHB durante su primer año de vida: entre las 61 determinaciones realizadas, 15 se practicaron entre los 11 y 18 meses de edad, de las cuales solo el 73,3% desarrolló una respuesta considerada protectora (≥10 mUI/ml) (datos de la FCSD aún no publicados). Estos resultados justificarían que, entre los exámenes analíticos periódicos indicados en los programas de salud para los niños con SD, se incluyera una serología específica a los 9-12 meses de edad en los lactantes vacunados, del mismo modo que se recomienda para otros niños en situaciones de riesgo, para plantear la revacunación en caso de una insuficiente respuesta humoral.
DIFTERIA, TÉTANOS, TOSFERINA
La administración de una vacuna antitosferina acelular tricomponente a 24 niños no institucionalizados de tres meses a cuatro años de edad indujo altas tasas de seroconversión, equivalentes a las del grupo de referencia. Sin embargo, los GMT (media geométrica del título de anticuerpos) de IgG séricos alcanzados frente a Bordetella pertussis, aun siendo elevados, fueron significativamente menores tras la recepción de la segunda (p<0,04) y la tercera dosis (p<0,001) de la serie vacunal25. Esta observación fue interpretada por los autores como una respuesta reducida a las sucesivas dosis de la primovacunación, sugiriendo la necesidad de una cuarta dosis en los niños con SD, para garantizarles una protección suficiente25. Es una estrategia de difícil implementación general, exigente de nuevos estudios, pero cabría tenerla en cuenta en situaciones clínicas o epidemiológicas concretas, sobre todo ante la falta de indicadores inmunitarios claros de protección frente a la tosferina.
Trabajos de las décadas 1960 y 1970 documentaron la obtención de niveles similares de anticuerpos frente al toxoide tetánico (TT), en adultos con SD institucionalizados y en los controles, tras su vacunación antitetánica26,27. Posteriormente, en 1986, Philip et al. detectaron, en estudios in vitro, alteraciones significativas de la inmunidad humoral y celular frente al TT en pacientes vacunados de 8 a 40 años de edad,manifestadas por descensos en las IgG específicas, la producción de IL2 y la proliferación de células mononucleares por los linfocitos T28. Recientemente, Kusters et al. informaron sobre la obtención posvacunal de niveles correctos de anticuerpos “protectores” en niños con SD, pero una insuficiente maduración de la avidez de las IgG1 anti-TT tras administrar la dosis de refuerzo, traduciendo una insuficiente formación de anticuerpos específicos, así como una deficiente memoria inmunológica29. Estas respuestas deficitarias deberían considerarse al evaluar la eficacia de las dosis de refuerzo o adicionales de la vacuna antitetánica.
La inmunogenicidad de la vacuna antidiftérica en el SD se ha estudiado en adultos institucionalizados. Indujo GMT de IgG frente al toxoide diftérico adecuados, como en los restantes internos27.
SARAMPIÓN, RUBEOLA, PAROTIDITIS
La vacuna triple vírica (SRP) indujo tasas de seroconversión del 100% frente al sarampión y a la parotiditis en adultos con SD seronegativos institucionalizados. Fueron inferiores, aunque no significativas, frente a rubeola: 70 frente a 90% en el grupo de referencia27. Entre 91 niños y adolescentes con SD vacunados con SRP, controlados en el programa de salud de la FCSD, un 9% no mostró seroconversión frente a la rubeola, un porcentaje superior al habitual, alrededor del 1%30. Son hallazgos que abogan por su control, ante la posible necesidad de dosis adicionales o revacunación.
POLIOMIELITIS
La vacuna antipoliomielítica oral (VPO) induce títulos de anticuerpos específicos equivalentes a los obtenidos en la población general para los poliovirus 2 y 3, pero inferiores para el tipo 1, en individuos institucionalizados seronegativos con SD31. Serian necesarios estudios con las actuales vacunas inactivadas parenterales en la población Down.
ENFERMEDAD NEUMOCÓCICA
Las ITR constituyen la principal causa de morbimortalidad por enfermedades infecciosas en las personas con SD8,32. El neumococo es uno de sus principales agentes causales y les confiere una especial gravedad. Se conoce poco sobre la respuesta inmunológica de los niños con SD a estas infecciones. Investigaciones recientes relacionan la frecuente gravedad de las neumonías neumocócicas con un incremento de la respuesta del tejido pulmonar a una sobreproducción de IL-1033. Por otra parte, el neumococo es un agente etiológico principal de la sepsis en niños, especialmente graves en los afectos de SD. De ahí la recomendación “fuerte” de vacunación antineumocócica sistemática de estos niños.
Costa-Carvalho et al. analizaron la respuesta inmunitaria a cinco serotipos (1, 3, 4, 8, 9N y 19F) de la vacuna antineumocócica polisacárida 23-valente (VNP23) en niños con SD de 6 a 13 años de edad34. La vacunación indujo anticuerpos protectores en un 65-100% de los distintos serotipos, no menores en los que presentaban un déficit de IgG2. Los niveles registrados fueron significativamente inferiores a los del grupo control, traduciendo una respuesta menor, pero no deficiente, apoyando la recomendación de su uso en los niños trisómicos a la edad adecuada.
Joshi et al., en un estudio sobre la respuesta sérica a los 23 serotipos de la VNP23 en 12 casos y 12 controles de 2 a 18 años de edad, la encuentran subóptima en ambos grupos, inferior en el grupo SD, pero sin que el tamaño de la muestra permitiera significar sus diferencias. Constatan que niños que habían recibido previamente dosis de la vacuna neumocócica conjugada heptavalente (VNC7) ofrecieron mejores respuestas a la vacunación, sugiriendo un efecto potenciador de las mismas sobre la inmunogenicidad de la VNP2335.
Los resultados de estos trabajos evocan la necesidad de conocer la inmunogenicidad de las vacunas antineumocócicas conjugadas en las personas con SD. Kusters et al. han estudiado por primera vez la inmunogenicidad de una pauta secuencial consistente en la administración de tres dosis de la VNC7, seguidas –al menos ocho semanas después– de una dosis de VNP23, en 18 pacientes de 5 a 24 años de edad con SD36. Todos experimentaron respuestas a todos los serotipos de la VNC7, comparables a las del grupo control, excepto para el 14 y el 23F, significativamente mayores en los sujetos sindrómicos. La serie vacunal indujo una respuesta humoral protectora adecuada en los casos con SD estudiados. Ensayos de opsonofagocitosis (OPA) mostraron, adicionalmente, una funcionalidad adecuada de los anticuerpos generados con esta estrategia. Estos resultados avalan su indicación en párvulos y adolescentes con SD, como recomienda el CAV-AEP12. La pauta más utilizada comprende la aplicación sistemática de la serie infantil estándar con la VNC13, seguida, entre los dos y los cinco años de edad, de una dosis de VNP23. Diversos calendarios, como el australiano37 y el neozelandés38, contemplan y financian específicamente esta pauta en el SD, al considerarlo una entidad médica de riesgo incrementado de enfermedad neumocócica invasiva39. En España, numerosas comunidades autónomas financian la VNC13 para los niños con trisomía 21, excluida inicialmente de sus calendarios de vacunaciones sistemáticas oficiales.
GRIPE
El Down Syndrome Medical Interest Group (DSMIG), entidad de referencia para los cuidados de las personas con SD, incluye su vacunación universal frente a la gripe como una recomendación fuerte8,39,40. Las peculiaridades somáticas e inmunitarias propias del síndrome predisponen a la enfermedad y favorecen un curso grave y complicado28,32,35,41. Se han señalado últimamente como factores agravantes un insuficiente número de células T reguladoras32) y la producción de altos niveles de citocinas proinflamatorias42.
Los estudios disponibles sobre la vacunación antigripal en el SD muestran, comparativamente con los controles, respuestas humorales equivalentes en adultos27 y solo marginalmente inferiores en niños y adolescentes35. Tradicionalmente, se han usado títulos séricos ≥1:40 de anticuerpos inhibidores de la hemaglutinación como correlatos séricos de protección del 50% de infecciones por el virus gripal. En la gran mayoría de niños con SD se consiguen estos niveles frente a los virus influenza A y B tras su vacunación35,43. Sin embargo, estos valores han sido recientemente cuestionados por Black et al.44, que dudan que este punto de corte, válido para adultos, lo sea para niños. Para estos autores, serían precisos títulos ≥1:110 para lograr porcentajes similares de protección clínica en niños menores de seis años44, lo que se consigue con menos frecuencia en el SD35,43. En síntesis, las vacunas antigripales actualmente indicadas en niños no les proporcionan siempre los niveles de protección deseables, lo que puede acentuarse en los afectos de SD. A pesar de lo cual, la vacunación universal de los niños con SD, a partir de los seis meses de vida, puede aportarles beneficios, aunque quizás precisen una adaptación de las pautas de vacunación actuales43. La introducción de vacunas adyuvadas infantiles permitirá sin duda incrementarlos.
HEPATITIS A
El SD no comporta un riesgo incrementado de infección por el virus de la hepatitis A (VHA), a diferencia de lo comprobado para el del VHB15. En un estudio sobre la inmunogenicidad de la vacuna frente a la hepatitis A en 63 niños de 1 a 12 años de edad, se detectaron unos niveles de seroconversión y de GMT solo moderadamente inferiores, no significativos, a las de un grupo control. Sus autores concluyen que estos niños “no deben ser tratados como un grupo especial para las recomendaciones de la vacuna” frente al VHA45.
Sin embargo, ciertas consideraciones apoyan una inmunización activa precoz: los índices de seroconversión aportados en el estudio citado son inferiores en los niños menores de seis años; las máximas deficiencias de las GMT en los probandos del trabajo son las posteriores a la segunda dosis vacunal; la posibilidad de una coinfección con una hepatitis B crónica, no infrecuente en los niños con SD, multiplicaría el riesgo de una forma grave o fulminante de hepatitis A46. La mejor estrategia para estos niños es iniciar la vacunación sistemática frente a la hepatitis A a los 12 meses de vida, incluida si es factible en el calendario oficial de vacunaciones infantiles, como rige ya en algunas comunidades españolas.
OTRAS ENFERMEDADES INMUNOPREVENIBLES
No se dispone de estudios sobre las vacunaciones frente a Haemophilus influenzae tipo b (Hib), rotavirus, varicela, meningococo y papilomavirus humano en el SD. Algunas de ellas forman parte de todos los calendarios de vacunaciones sistemáticas infantiles, sin que la trisomía 21 represente una excepción. La experiencia muestra que se toleran bien y ni su composición ni las características inmunitarias del síndrome las contraindican, e incluso apoyan su recomendación.
En el caso de la vacunación frente al Hib, cabría considerar si los déficits de IgG2, detectados con una frecuencia superior a la habitual en niños con SD, a la par que favorecedores de infecciones por bacterias con polisacáridos capsulares –como el Hib–, podrían reducir su inmunogenicidad. Parece improbable, dado que unos niveles deficitarios de IgG2 no representan necesariamente una inmunodeficiencia funcional34, que se ha demostrado inalterada para otras vacunas enfrentadas a otros antígenos polisacarídicos, como los neumocócicos36.
Las vacunaciones frente a varicela y rotavirus están integradas en los calendarios de vacunaciones sistemáticas de numerosos países, no en los españoles. Algunos, como Australia y Nueva Zelanda, las recomiendan y financian para los niños con SD, al considerar que sus defectos inmunitarios y constitucionales les confieren un riesgo incrementado de gravedad clínica37,38.
Conrespecto a la bronquiolitis por VRS, aunque la inmunoprofilaxis pasiva no es objeto del presente tema, cabe recordar aquí que la predisposición de los recién nacidos con SD a sufrir formas graves de bronquiolitis por VRS aconseja valorar su inclusión en los programas de prevención con anticuerpos monoclonales, independientemente de la posible coexistencia de otros factores de riesgo para la bronquiolitis grave47,48.
CONCLUSIONES
Las disfunciones inmunitarias de los niños con SD, asociadas a sus defectos estructurales, les condicionan una morbimortalidad significativamente superior a la habitual, sobre todo por infecciones respiratorias y durante los primeros cinco años de vida. La conceptuación del síndrome como una “condición de riesgo” para enfermedades inmunoprevenibles requiere asegurarles el acceso a un calendario de vacunaciones de máximos, que abarque la indicación sistemática de vacunas consideradas de uso selectivo para la población infantil general (Tabla 1). Es una recomendación fuerte, la cual, junto a la eventualidad de una respuesta subóptima a algunas vacunas, respalda la necesidad de su estricto cumplimiento y la ocasional adopción de medidas complementarias. Entre estas, merecen considerarse algunas sugeridas por estudios recientes: a) confirmación sistemática de la respuesta sérica a la vacunación frente a la hepatitis B; b) indicación de una dosis de VNP23 a partir de los dos años de edad, tras la inmunización sistemática con VNC13 del lactante; c) potencial utilidad de una dosis adicional de vacuna antitosferina ante una exposición a esta enfermedad, de forma individual o colectiva; d) posible interés de la administración precautoria de inmunoglobulina hiperinmune antitetánica junto a una dosis vacunal de refuerzo, en caso de sospecha de contaminación de una herida aun no inequívocamente tetanígena, y e) sustitución de las actuales vacunas antigripales de indicación infantil por vacunas adyuvadas en cuanto estén autorizadas para niños.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: CAV-AEP: Comité Asesor de Vacunas de la Asociación Española de Pediatría • FCSD: Fundació Catalana Síndrome de Down • GMT: media geométrica del título de anticuerpos • Hib: Haemophilus influenzae tipo b • ITR: infecciones del tracto respiratorio • OPA: opsonofagocitosis • SD: síndrome de Down • SRP: vacuna triple vírica • TT: toxoide tetánico • VHA: virus de la hepatitis A • VHB: virus de la hepatitis B • VNC7: vacuna neumocócica conjugada heptavalente • VNP23: vacuna antineumocócica polisacárida 23-valente • VRS: virus respiratorio sincitial.
BIBLIOGRAFÍA
- Martín-Mateos A. Inmunidad en el síndrome de Down. En: Corretger JM, Serés A, Casaldáliga J, Trias K (eds.). Síndrome de Down. Aspectos médicos actuales. Barcelona: Masson; 2005. p. 109-17.
- Nespoli L, Burgio GR, Ugazio AG, Maccario R. Immunological features of Down’s Syndrome: a review. J Intel Disabil Res. 1993;37:543-51.
- De Hingh YC, Petrus W, van der Vossen PW, Gemen EF, Mulder AB, Hop WCJ, et al. Intrinsic abnormalities of lymphocyte counts in children with Down Syndrome. J Pediatr. 2005;147:144-7.
- Kusters MA, Verstegen RH, Gemen EF, de Vries E. Intrinsic defect of the immune system in children with Down syndrome: a review. Clin Exp Immunol. 2009;156:189-93.
- Blumberg BS, Gerstley BJS, Hungerford DA, London WT, Sutnick AI. A serum antigen (Australia antigen) in Down's syndrome, leukemia, and hepatitis. Ann Intern Med. 1967;66:924-31.
- García Bengoechea M, Legarda JJ, Cortés A, Enríquez I, Arriola JA, Arenas JI. Los deficientes mentales y la infección por el virus de la hepatitis B. Prevalencia en nuestro medio. Med Clin (Barc). 1989;93:10-3.
- Rua Armesto MJ, Ramírez Marín V, Onaindia Ercoreca MT, García Aguado J, Ruiz Moreno M. Predisposición del síndrome de Down a la infección crónica por el virus B de la hepatitis. An Esp Pediatr. 1993;38:529-31.
- Wats R, Vyas H. An overview of the respiratory problems in children with Down’s syndrome. Arch Dis Child. 2013;98:812-7.
- Bloemers BL, van Furth AM, Veijerman ME, Gemke RJ, Broers CJ, van den Ende K, et al. Down syndrome: a novel risk factor for respiratory syncytial virus bronchiolitis--a prospective birth-cohort study. Pediatrics. 2007;120:e1076-81.
- Garrison MM, Jeffres H, Chistakis DA. Risk of death for children with Down syndrome and sepsis. J Pediatr. 2005;147:748-52.
- Corretger Rauet JM. Vacunaciones y calendario de vacunaciones en el síndrome de Down. Vacunas. 2012;13:112-7.
- Moreno Pérez D, Álvarez García FJ, Arístegui Fernández J, Cilleruelo Ortega MJ, Corretger Rauet JM, García Sánchez N et al. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2014. Rev Pediatr Aten Primaria. 2014;16:13-20.
- Pueschel SM, Bodenheimer HC Jr., Giesswein P, Dean MK. The prevalence of hepatitis B surface antigen and antibody in home-reared individuals with Down syndrome. Res Develop Disabil. 1991;12:243-9.
- Di Giommo V, Ferrario F, Rossi de Gasperi M, De Masrchis C, Albertini G. Epidemiology of hepatitis B virus in non-institutionalized children and adolescents affected by handicap. J Intel Disabil Res. 1993;37:255-99.
- Renner F, Andrle M, Horak W, Rett A. Hepatitis A and B in Non-institutionalized Mentally Retarded Patients. Hepato-gastroenterol. 1985;32:175-7.
- Avanzini MA, Söderström T, Wahl M, Plebani A, Burgio GR, Hanson LA. IgG Subclass Deficiency in Patients with Down’s Syndrome and Aberrant Hepatitis B Vaccine Response. Scand J Immunol. 1988;28:465-70.
- Vajro P, Lettera P, Fontanella A, Sbreglia C, Manzillo E, Sartorio R, et al. Vaccination against hepatitis B in preschool children with Down’s syndrome. J Intel Disab Res. 1992;36:77-81.
- Piccione M, De Curtis M, La Vecchia ML, Novissimo A, Vajro P. Hepatitis B and C infection in children with Down Syndrome. Eur J Pediatr. 1997;156:420-1.
- García O, Bruguera M, Mayor A, Sánchez Tapias JM, Vall O, Rodés J. Hepatitis B en una institución abierta para retrasados mentales. Efecto inmunogénico de una vacuna recombinante antihepatitis B. Enf Infec Microbiol Clin. 1990;8:34-8.
- Troisi C, Helberg DA, Hollinger FB. Normal Immune Response to Hepatitis B Vaccine in Patients With Down Syndrome. A Basis for Immunization Guidelines. JAMA. 1985;254:3196-9.
- Van Damme P, Vranckx R, Meheus A. Immunogenicity of a recombinant DNA hepatitis B vaccine in institutionalized patients with Down’s syndrome. Vaccine. 1990;8 (Suppl):S53-S55.
- García Bengoechea M, Cortés A, Cabriada J, Albizu I, Dorronsoro M, Arriola JA, et al. Respuesta a la vacuna DNA recombinada antihepatitis B en los deficientes mentales con síndrome de Down. Estudio controlado. Med Clin (Barc). 1990;94:528-30.
- Cobo Soriano J, Gil Miguel A, Rey Calero J, Herrazo Cabrera, Martín Hernández D. Inmunogenicidad de la vacuna contra el VHB en deficientes mentales. Aten Primaria. 1991;8:536-41.
- Nisihara R, De Bem RS, Negreiros PH, Utiyama SR, Oliveira NP, Amarante H. Low hepatitis B vaccine response in children with Down syndrome from Brazil. Child Care Health Dev. 2014;40:607-9.
- Li Volti S, Mattina T, Mauro L, Blanch S, Alfuso S, Ursino A, et al. Safety and efectiveness of an acellular pertussis vaccine in subjects with Down’s syndrome. Childs Nerv Syst. 1996;12:100-2.
- Griffiths AW, Sylvester PE. Mongols and non-mongols compared in their response to active tetanus immunisation. J Ment Def Res. 1967;11:263-6.
- Hawkes RA, Boughton CR, Schroeter DR. The antibody response of institutionalized Down’s syndrome to seven antimicrobial antigens. Clin Exp Immunol. 1978;31:298-304.
- Philip R, Berger AC, McManus NH, Warner NH, Peacock MA, Ebstein LB. Abnormalities of the in vitro cellular and humoral responses to tetanus and influenza antigens with concomitant numerical alterations in lymphocyte subsets in Down syndrome (Trisomy 21). J Immunol. 1986;136:1661-7.
- Kusters MA, Jol-van der Zijde CM, van Tol MJ, Bolz WE, Bock LA, Visser M, et al. Impaired avidity maturation after tetanus toxoid booster in children with Down syndrome. Pediatr Infect Dis J. 2011;30:357-9.
- Plotkin SA, Reef S. Rubella vaccine. En: Plotkin SA, Orenstein WA. Vaccines. 4th Ed. Philadelphia, Pennsylvania; 2004. p. 707-43.
- Hawkes RA, Philbrook SC, Boughton CR. The response of institutionalized Down’s syndrome subjects to enterovirus infections. J Hyg Camb. 1980;84:433-41.
- Broers CJ, Gemke RJ,Weijerman ME, Kulk DJ, van Hoogstraten INW, van Furth AM. Frequency of lower respiratory tract infections in relation to adaptative immunity in children with Down syndrome compared to healthy siblings. Acta Paediatr. 2012;101:862-7.
- Broers CJ, Gemke RJ, Morré SA, Weijerman ME, van Furth AM. Increased production of interleukin-10 in children with Down syndrome upon ex vivo stimulation with Streptococcus pneumoniae. Pediatr Res. 2014;75:109-13.
- Costa-Carvalho BT, Martínez RM, Dias AT, Kubo CA, Barros-Nunes P, Leiva L, et al. Antibody response to pneumococcal capsular polysaccharide vaccine in Down syndrome patients. Braz J Med Biol Res. 2006;39:1587-92.
- Joshi AY, Abraham RS, Snyder RS, Boyce TG. Immune evaluation and vaccine responses in Down syndrome: Evidence of immunodeficiency? Vaccine. 2011;29:5040-6.
- Kusters MA, Manders NC, de Jong BA, van Hout RW, Rijkers GT, de Vries E. Functionality of the pneumococcal antibody response in Down syndrome subjects. Vaccine. 2013;31:6261-5.
- The Australian Immunisation Handbook, 10th ed. Canberra: Australian Government Department of Health; 2013.
- Pneumococcal Disease. En: Ministry of Health. Immunization handbook 2011. Wellington: Ministry of Health; 2011. p. 181-202.
- Down Syndrome: Immunisation. Key Points [en línea] [consultado el 10/03/2014]. Disponible en: http://goo.gl/bEZYGM
- American Academy of Pediatrics. Health Supervision for Children with Down Syndrome the Committee on Genetics. Pediatrics. 2011;128:393-406.
- Pérez-Padilla R, Fernández R, García-Sancho C, Franco-Marina F, Aburto O, López-Gatell H, et al. Pandemic (H1N1) 2009 virus and Down syndrome patients. Emerg Infect Dis. 2010;16:1312-4.
- Broers CJ, Gemke RJ, Weijerman ME, van der Sluijs KF, van Furth AM. Increased pro-inflammatory cytokine production in Down Syndrome children upon stimulation with live influenza A virus. J Clin Immunol. 2012;32:323-9.
- Kusters MA, Bok VL, Bolz WE, Huijskens EG, Peeters MF, de Vries E. Influenza A/H1N1 vaccination response is inadequate in down syndrome children when the latest cut-off values are used. Vaccine. 2012;31:1284-5.
- Black S, Nicolay U, Vesikari T, Knuf M, Del Giudice G, Della Cioppa G, et al. Hemagglutination inhibition antibody titers as a correlate of protection for inactivated influenza vaccines in children. Pediatr Infect Dis J. 2011;30:1081-5.
- Ferreira CA, Leite JC, Taniguchi A, Vieira SM, Pereira-Lima J, Reverbel da Silveira T. Immunogenicity and Safety of an Inactivated Hepatitis A Vaccine in Children with Down Syndrome. J Ped Gastroent Nutr. 2004;39:337-40.
- CDC. Prevention of hepatitis A through active or passive immunization. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2006;55(RR-7):1-23.
- Figueras Aloy. Virus respiratorio sincitial y síndrome de Down (Editorial). Rev Med Int Sindrome Down. 2011;15:33.
- Paes B, Michell I, Yi H, Lancôt KL; and the CARESS Investigators. Hospitalisation for Respiratory Syncitial Virus Illness in Down Syndrome Following Prophylaxis With Paivizumab. Pediatr Infect Dis J. 2014;33:e29-33.





