Vol. 16 - Num. 23
Talleres
El niño roncador (SAHS)
aCS Montequinto. Sevilla. España.
Cómo citar este artículo: Cruz Navarro I. El niño roncador (SAHS). Rev Pediatr Aten Primaria. 2014;(23):89-100.
El ronquido constituye la manifestación sonora de la resistencia de la vía aérea superior durante el sueño y constituye el signo cardinal de los trastornos respiratorios del sueño (TRS). Estos forman un espectro continuo que abarca desde el ronquido primario hasta el síndrome de apnea hipopnea del sueño (SAHS), pasando por estadios intermedios (como el síndrome de resistencia aumentada de la vía aérea superior [SRAVAS] y el síndrome de hipoventilación central).
¿POR QUÉ INCLUIR UN TALLER SOBRE EL NIÑO RONCADOR EN UNA REUNIÓN DE PEDIATRAS DE ATENCIÓN PRIMARIA?
- En primer lugar, por su frecuencia: aunque existen importantes discrepancias en las cifras de prevalencia del ronquido habitual infantil en los diferentes trabajos de la literatura (oscila entre el 1,5 y el 27%, fruto de la dificultad para definir cuándo un ronquido es ocasional y cuándo se hace habitual), podríamos aceptar una prevalencia media del 10%. En cuanto al SAHS, la Academia Americana de Pediatría (AAP) en su Guía de Práctica Clínica (GPC) sobre Diagnóstico y Manejo del SAHS infantil1 acepta una prevalencia que oscila del 1,2 al 5,7% (cuando el diagnóstico se realiza en base a la polisomnografía (PSG) nocturna en un laboratorio de sueño) o del 0,8 al 2,8% cuando se lleva a cabo según PSG domiciliarias o ambulatorias.
- En segundo lugar, por sus importantes implicaciones clínicas: los TRS, en especial el SAHS pero también el SRAVAS y el ronquido simple o primario (antes llamado benigno), provocan multitud de alteraciones y consecuencias clínicas: alteraciones neurocognitivas, conductuales, cardiovasculares (hipertensión arterial [HTA], disfunción autonómica, alteraciones endoteliales y remodelación de la pared ventricular producto del estrés oxidativo y del estado inflamatorio que se produce por los ciclos repetidos de hipoxia y reoxigenación), endocrinas y metabólicas, comportándose también como un trastorno comórbido de diferentes procesos crónicos (obesidad, discapacidad intelectual, síndrome de Down, asma y otros trastornos respiratorios, enuresis, etc.), empeorando en ocasiones el curso de estos (epilepsia), y provocando siempre un deterioro en la calidad de vida del niño y sus familias.
En los últimos años se investiga sobre la relación entre SAHS infantil y signos de envejecimiento celular acelerado.
- En tercer lugar, por el enorme coste directo e indirecto que ocasionan los TRS en el gasto sociosanitario, aumentando la frecuentación de los servicios sanitarios (en Atención Primaria y en Atención Especializada) tanto por el propio TRS como por la morbilidad asociada (obesidad, HTA, síndrome metabólico, etc.), provocando una demanda creciente de los servicios públicos; evaluaciones y atención psicopedagógicas, terapias congnitivo-conductuales, salud mental infantil, etc. Esto hace de los TRS un auténtico problema de salud pública.
- Por último, porque son procesos subsidiarios de un tratamiento, en la mayoría de las ocasiones quirúrgico, aunque en algunos casos se complementa o sustituye por tratamiento médico. Dichos tratamientos son de una eficacia elevada para eliminar el problema, o al menos para disminuir las consecuencias clínicas y mejorar la calidad de vida de los pacientes, aunque el pediatra debe conocer que en algunos casos fracasan o el TRS recidiva, debiendo mantener un adecuado seguimiento postoperatorio de esos pacientes.
Por todo ello, los trastornos respiratorios del sueño en general y el SAHS en particular, son objeto de creciente interés en la investigación médica y en la práctica clínica. Como prueba de ello, baste citar los más de 4000 artículos publicados sobre el tema en los últimos 30 años, en más de 800 revistas, escritas por autores de 64 países diferentes, en 19 lenguas diferentes. Solo en el año 2011 se publicaron 204 artículos sobre los trastornos respiratorios infantiles: 1 metaanálisis, 5 guías de práctica clínica, 6 estudios aleatorizados controlados, 23 artículos de revisión y 169 artículos originales.
Así, en los últimos años se han sucedido, en nuestro país, la publicación del Consenso Nacional del Síndrome de apneas-hipopneas durante el sueño en niños2 (2011) y la Guía de Práctica Clínica sobre trastornos del sueño en la infancia y adolescencia en Atención Primaria3 (2011), y en EE. UU., la Guía de Práctica Clínica sobre el uso de la PSG en los TRS infantiles antes de la amigdalectomía de la Academia Americana de Otorrinolaringología y Cirugía de Cabeza y Cuello4 (2011), y la más reciente Guía de Práctica Clínica sobre el diagnóstico y el manejo del SAHS infantil de la AAP1 (2012).
TIPOS DE TRASTORNOS RESPIRATORIOS DEL SUEÑO
- Ronquido simple o primario: se trata del ruido respiratorio durante el sueño, sin apneas, hipoventilación ni fragmentación del sueño, aunque sí disminuye el porcentaje de sueño REM y aumenta los microdespertares relacionados con el esfuerzo respiratorio.
- Antes era considerado “benigno”, aunque dicha inocuidad ha sido cuestionada desde hace años por las pruebas acumuladas de sus consecuencias tanto en el desarrollo neurogognitivo como sobre la tensión arterial.
- Síndrome de resistencia aumentada de la vía aérea superior: se trata de episodios recurrentes de obstrucción de la vía aérea en ausencia de apneas o hipopneas, con microdespertares relacionados con el esfuerzo respiratorio que fragmentan el sueño y presentan consecuencias clínicas.
- Síndrome de apnea hipopnea del sueño: ausencia parcial o total de flujo aéreo nasal y oral de duración superior al doble de un ciclo respiratorio en presencia de actividad muscular torácica y abdominal, producida durante el sueño, que ocasiona una desaturación de oxígeno con o sin retención de dióxido de carbono.
- Síndrome de hipoventilación central.
DIAGNÓSTICO DE SOSPECHA DE TRASTORNOS RESPIRATORIOS DEL SUEÑO
Hay que insistir en que el manejo diagnóstico y terapéutico del SAHS es claramente multidisciplinar. Diferentes especialistas (pediatras, neurólogos, otorrinolaringólogos, neumólogos, neurofisiólogos, psicólogos, etc.) están implicados en el proceso asistencial de los niños afectados de trastornos respiratorios relacionados con el sueño, siendo la puerta de entrada habitual a dicho proceso la consulta del pediatra de Atención Primaria.
Hemos de ser conscientes de que el TRS no va a constituir prácticamente nunca el motivo de consulta explícito. Ello provoca que los TRS sean con frecuencia infradiagnosticados en la práctica clínica diaria.
Como estrategia de despistaje general, se debería realizar, tal como recomendaba la AAP en el año 2002 y vuelve a hacerlo la nueva GPC de la AAP de 2012 con un grado de evidencia B (basada en ensayos clínicos aleatorizados), el cribado del ronquido en cada control de salud infantil, así como en otras circunstancias en la consulta diaria (por ejemplo, en la evaluación de una amigdalitis).
Para ello disponemos de un cuestionario sencillo, el BEARS5 (Fig. 1) que evalúa de forma rápida las características principales y los problemas más comunes del sueño en niños de 2 a 18 años de edad, mejorando la probabilidad de reconocer el ronquido en el niño (de un 4,6% en los controles de salud sin aplicarlo a un 10,7% cuando se cumplimenta el cuestionario).
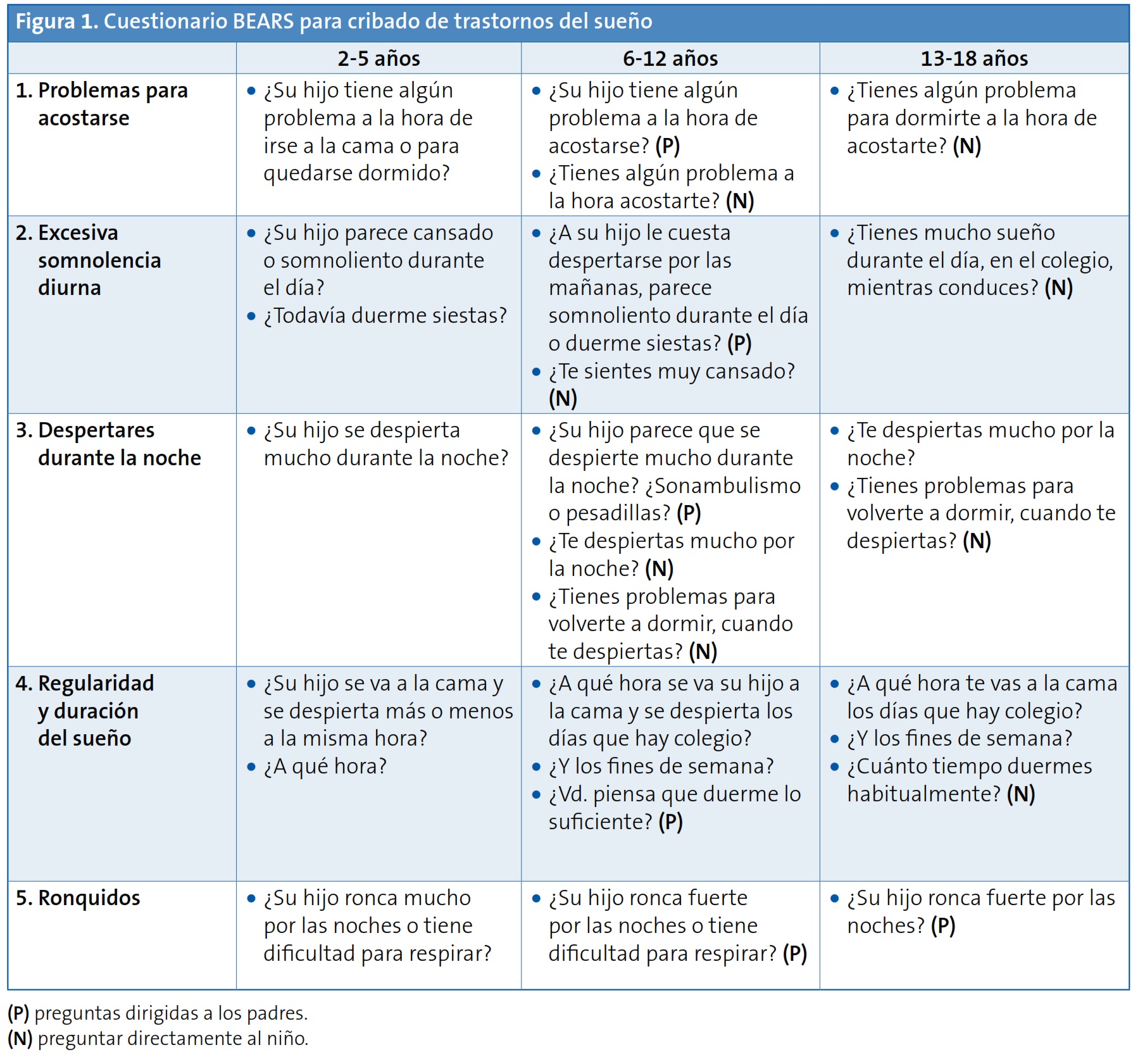
Existen, además, determinadas circunstancias que aumentan la probabilidad de que el paciente sufra un TRS, y ante las que el pediatra debe esmerar su atención:
Grupos de riesgo de trastornos respiratorios del sueño
- Antecedentes familiares de SAHS y de adenoamigdalectomía en los padres.
- Prematuridad.
- Factores socioeconómicos y medioambientales: el SAHS es más frecuente y tiene repercusiones clínicas más nocivas en las clases sociales desfavorecidas y en convivientes de fumadores.
- Preocupación de los padres respecto a la respiración nocturna del niño: con una odds ratio (OR) de 4,4, más valorable aún dado el escaso nivel de conocimientos de los padres con respecto al SAHS infantil (solo un 20% de padres de niños roncadores conoce que el SAHS tiene repercusiones clínicas en sus hijos y puede tratarse mediante cirugía).
- Obesidad: existen trabajos que muestran un incremento de 3,5 veces en el riesgo de presentar SAHS por cada aumento de un punto en el valor z del índice de masa corporal (IMC). La obesidad se comportaría como un factor de riesgo independiente para el ronquido y el SAHS. Parece que la distribución de grasa corporal es el factor con más relevancia en la aparición del SAHS en niños obesos. Por ello, la AAP recomienda centrar más la atención en el control del perímetro de cintura que solo en el IMC.
- HTA: para algunos autores existe una relación directa entre cifras de tensión arterial y el índice de apneas-hipopneas, aunque para otros la existencia de un TRS, independientemente de su tipo o gravedad, se acompaña de mayor prevalencia de HTA. La posibilidad de presentar HTA aumenta de forma exponencial en niños obesos con SAHS.
- Alteraciones respiratorias: asma (la OR de asociar un asma grave en niños con SAHS es de 3,62) alteraciones rinosinusales, laringomalacia, fibrosis quística y neumonía.
- Síndrome de Down y otras alteraciones craneofaciales: la condición de presentar síndrome Down aumenta la OR de SAHS a 5,1. Hasta un 75% de niños con craneosinostosis sindrómica presentan un SAHS.
- Enuresis: la OR de SAHS es de 5,29 en enuresis secundaria. La adenoamigdalectomía resuelve la enuresis hasta en un 50% de los casos.
- Epilepsia.
- Cambios conductuales y/o escolares: especialmente reseñable la comorbilidad con el trastorno por déficit de atención-hiperactividad (TDAH): hasta en un 23% de casos de niños con TDAH aparece un TRS.
La AAP recomienda realizar un estudio de sueño en todos los pacientes con sospecha de presentar un TDAH pero que no cumplan los criterios de TDAH del DSM-IV.
- Excesiva somnolencia diurna (ESD): relacionada sobre todo con casos graves y en niños obesos. La ESD presenta una OR de SAHS de 6,3.
- Hipertrofia adenoamigdalar: la observación de una respiración bucal diurna obligada presenta una OR de 3,7 respecto a SAHS. Aunque es fácil de entender la relación entre el volumen libre de la vía aérea y su posible obstrucción, la valoración subjetiva del tamaño adenoamigdalar en vigilia (índice de Friedman), no se correlaciona directamente con la colapsibilidad de la vía aérea durante el sueño nocturno ni con la existencia ni la gravedad del SAHS.
En elDocumento de consenso del síndrome de apneas-hipopneas durante el sueño en niñosy en la reciente GPC sobre Trastornos del sueño en la infancia y adolescencia en Atención Primariase plasma el interés creciente de las organizaciones implicadas (Sociedad Española del Sueño, Asociación Española de Pediatría de Atención Primaria, Asociación Española de Pediatría, Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria, Sociedad Española de Neumología y Cirugía Torácica, etc.) en mejorar la sospecha diagnóstica de los TRS en Atención Primaria y en aportar técnicas básicas de cribado y aproximación diagnóstica al alcance de la mayoría de la población. El objetivo del pediatra de Atención Primaria sería identificar el grupo de población infantil más susceptible de presentar un TRS cuya derivación a una Unidad de Sueño/ORL sea viable y rentable.
En el caso de que el cuestionario BEARS sea positivo para el ronquido, o en el caso de que nos hallemos ante un paciente con factores de riesgo de padecer un TRS, la AAP propone que se realice una historia clínica y un examen clínico detallados para determinar si es necesaria una evaluación a fondo ante la posibilidad de que el paciente sufra un SAHS.
Así, para llevar a cabo dicha historia clínica orientada tenemos a nuestra disposición otro cuestionario, el Pediatric Sleep Questionnaire (PSQ) de Chervin orientado al SAHS6(Fig. 2), recientemente validado para el español, para ayudarnos a diferenciar el ronquido primario del SAHS (con una sensibilidad del 78% y una especificidad del 72%). La AAP, en sus últimas recomendaciones, invita a usar el cuestionario de Chervin más como una herramienta de cribado que como una de diagnóstico debido a su escaso valor predictivo positivo (VPP).

El Consenso Nacional del SAHS infantil y la GPC sobre Ttrastornos del Sueño proponen el algoritmo diagnóstico que se muestra en la Fig. 3.
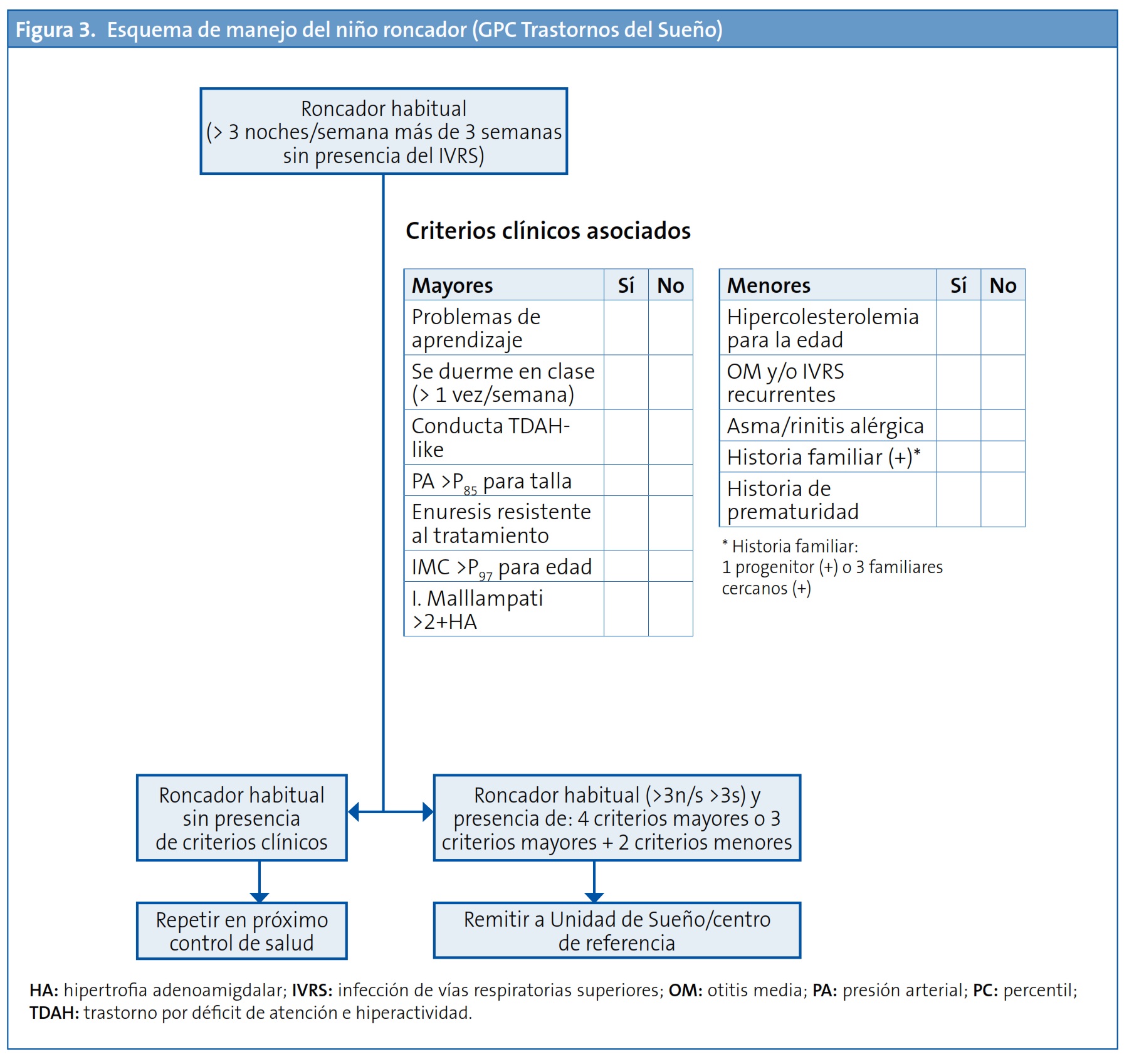
El algoritmo incluye como herramienta de ayuda al diagnóstico en todo niño roncador habitual (aquel que ronca más de tres noches a la semana más de tres semanas seguidas sin presentar infección de las vías respiratorias superiores) unos criterios mayores y otros menores:
Criterios mayores
- Problemas de aprendizaje.
- Somnolencia diurna (se duerme en clase >1 vez/semana).
- Conducta TDAH.
- Presión arterial > percentil 85 (P85) para la talla.
- Enuresis resistente al tratamiento.
- IMC >P97 para la edad.
- Indice de Mallampati >2 + hipertrofia adenoidea. La Escala de Mallampati describe la anatomía de la vía aérea superior en función de la dificultad de intubación (del grado I: fácilmente intubable-sin hipertrofia amigdalar, al grado IV: de muy difícil intubación-con amígdalas hiperplásicas que impiden la visión de la úvula).
Criterios menores
- Hipercolesterolemia para la edad.
- Otitis media aguda y/o infecciones de la vía aérea superior recurrentes.
- Asma/rinitis alérgica.
- Historia familiar de SAHS (un progenitor o tres familiares cercanos).
- Historia de prematuridad.
La existencia en un niño roncador habitual de al menos cuatro criterios mayores o tres mayores y dos menores sería indicación de derivación a una Unidad de Sueño/ORL.
stos criterios diagnósticos pueden presentar una limitación a la hora de valorar alguno de los ítems (somnolencia, rendimiento escolar, enuresis) en niños menores de cinco años de edad.
Se dispone, como prueba complementaria para apoyar o no la decisión de remitir al paciente a la Unidad de Sueño/ORL, de la posibilidad de realizar un vídeo doméstico durante el sueño: la observación del ronquido y del esfuerzo respiratorio nocturno puede aportar muchos datos. Sivan7 desarrolló una escala de puntuación para valorar el vídeo realizado en el hogar durante media hora por los padres en niños de dos a seis años de edad y obtuvieron una sensibilidad y una especificidad del 89 y el 77% en el diagnóstico del SAHS, respectivamente. Su punto de corte predice el 55% de los casos de TRS (Fig. 4).
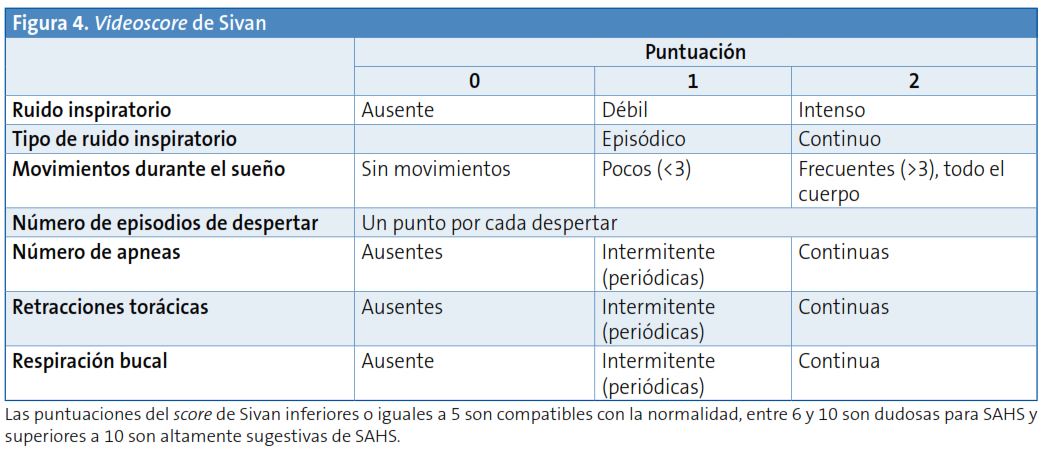
Los requisitos que debe de cumplir el vídeo para ser valorable son:
- Duración de media hora.
- Buscar posición en decúbito supino.
- Sin ropa (ni de cama ni pijama) de cintura para arriba.
- Correcto funcionamiento del audio (dada la importancia de los ruidos respiratorios).
- El mejor momento de la grabación: de 05:00 a 05:30 horas, ya que a esas horas hay un mayor porcentaje de sueño REM y por tanto mayores posibilidades de presentar TRS. Según Spruit y Gozal, en fase REM existen cuatro veces más probabilidades de presentar un SAHS que en fase no REM.
¿Por qué y cuándo derivar a un paciente con sospecha de TRS a una Unidad de Sueño/ORL? (Fig. 5)
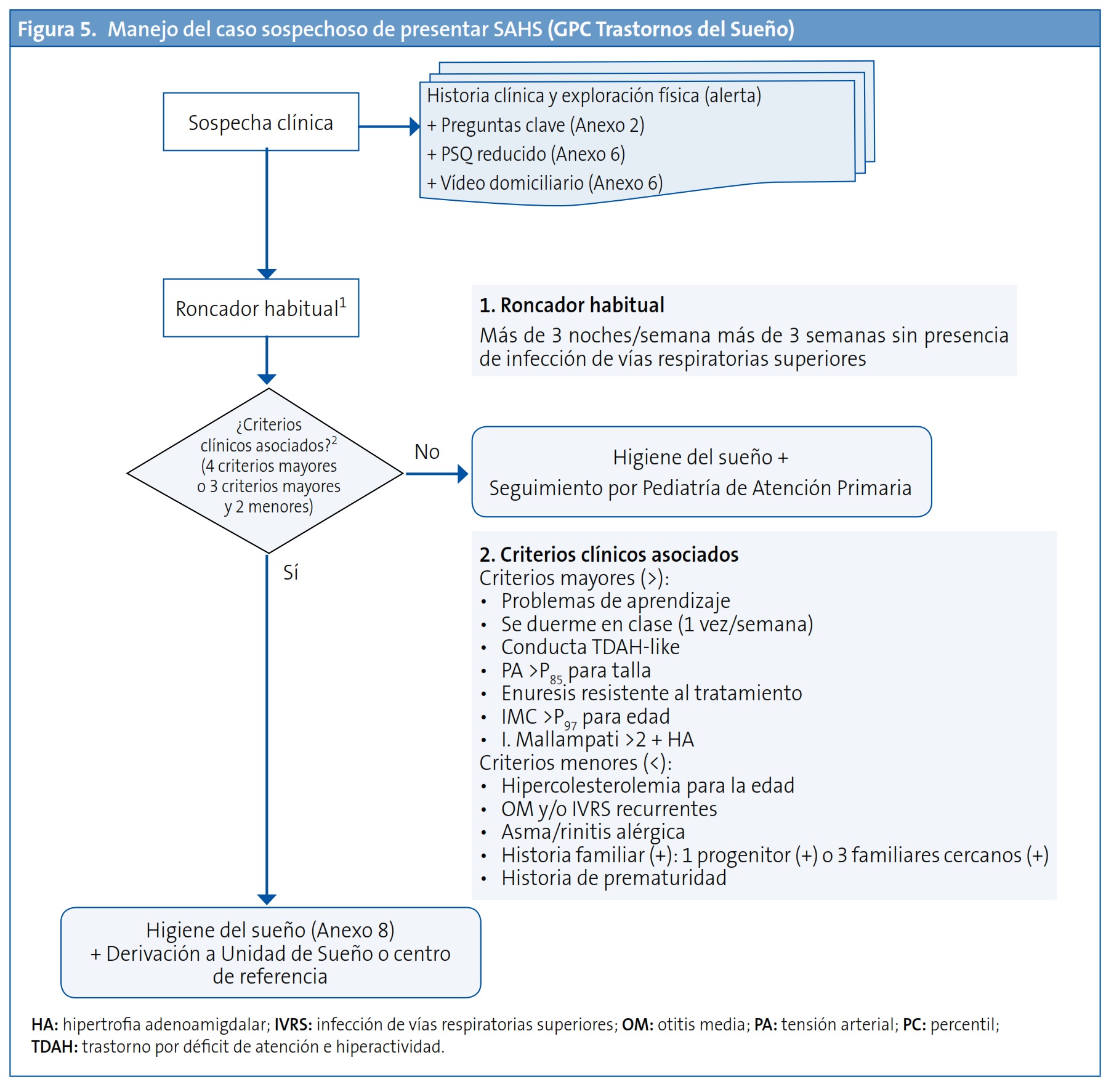
Por la imposibilidad de llegar a un diagnóstico de certeza del TRS por datos de la historia clínica y la exploración física.
La recientemente publicada GPC de la AAP recomienda con un grado de evidencia A la realización, en el niño que ronca y en el que la exploración física y/o la historia clínica sean sospechosas de SAHS, de una PSG nocturna. Solo en caso de que esta derivación no sea viable, y con un grado de evidencia D, la AAP plantea la opción (no recomendación) de que sea derivado a un especialista en ORL/Medicina de Sueño.
Es preciso recalcar que la actitud expectante o conservadora frente a los TRS no está justificada, pues la evolución de estos será en la mayoría de casos a mantenerse o empeorar con la edad.
¿Y a qué especialista derivar: a ORL o a una Unidad de Sueño?
En nuestro país no existen por el momento Unidades de Sueño suficientes para atender a la población pediátrica que las precisa, por lo que en ocasiones deberemos coordinarnos con las Unidades de ORL o Neumología Pediátrica de referencia. Estudios realizados en otros países no muestran diferencias en cuanto al diagnóstico y al manejo del TRS entre los pacientes remitidos desde Atención Primaria a ORL o a la Unidad de Sueño, aunque sí se constató que aquellos con mayor tamaño amigdalar eran remitidos con más frecuencia al ORL.
La AAP plantea como una opción realista, con grado de evidencia C, que si la PSG nocturna no es accesible, se pueden realizar otras pruebas diagnósticas alternativas, como la videograbación del sueño nocturno, la pulsioximetría nocturna, la PSG de siestas o la PSG ambulatoria (“some objetive testing is better than none”).
MANEJO DE LA SOSPECHA DE TRASTORNO RESPIRATORIO DEL SUEÑO EN LA UNIDAD DE SUEÑO
Existen varias técnicas diagnósticas disponibles:
Pulsioximetría nocturna continua
Serviría como una prueba de screening; los casos sospechosos de padecer un SAHS con un resultado normal en la pulsioximetría nocturna deberían someterse a otras pruebas diagnósticas.
Poligrafía respiratoria
La poligrafía respiratoria (PR) estudia variables cardiorrespiratorias: flujo oronasal, esfuerzo respiratorio, saturación de oxígeno por pulsioximetría, posición corporal, ronquido y frecuencia cardiaca. Presenta dos limitaciones fundamentales: no detecta microdespertares electroencefalográficos (no puede diagnosticar SRAVAS) y no reconoce el tiempo real de sueño (lo equipara al tiempo total en cama, por lo que pueden aumentar los falsos negativos de SAHS).
Su coincidencia diagnóstica con la polisomnografía nocturna (PSG) es del 84%.
Según recientes publicaciones8, basar el manejo de los TRS en la PR llevaría a un cambio en las decisiones terapéuticas en el 23% de los niños con SAHS (sobre todo en los casos de SAHS leve) en comparación con el manejo usando la PSG.
Constituye, pues una técnica válida en pacientes con alta o baja probabilidad de padecer un SAHS. Los pacientes con probabilidad intermedia, comorbilidades asociadas o con elevada probabilidad y PR negativa deberían realizarse una PSG.
Polisomnografía nocturna
Técnica de referencia, gold standard en el diagnóstico de los TRS. Incorpora a las variables cardiorrespiratorias de la PR otras neurofisiológicas (electroencefalograma, electrooculograma y electromiograma) que permiten la valoración de los estadios y la arquitectura del sueño.
Según los resultados de la PSG, la International Classification of Sleep Disorders propone la siguiente clasificación del SAHS:
- Leve: con un índice de apnea/hipopnea (IAH) <5.
- Moderado: con un IAH entre 5 y 10.
- Grave: con un IAH>10.
En los últimos se ha abierto la posibilidad de realizar PSG domiciliarias con un 90% de resultados válidos.
Otras pruebas complementarias
- Nasofibroscopia con endoscopia flexible: que permite valorar la permeabilidadde las fosas nasales, la hipertrofia adenoidea y las alteraciones laríngeas.
- Cefalometría: aunque ninguna de las medidas propuestas hasta el momento resulta con una suficiente sensibilidad ni especificidad para que sirva en el diagnóstico del SAHS infantil, parece que el paciente con SAHS y una morfología craneofacial desfavorable presenta más probabilidades de precisar cirugía.
- Faringometría acústica.
- Rinometría para medir la presión intranasal.
- Presión intraesofágica.
- Determinación de biomarcadores en suero, en orina, en saliva y en aire exhalado: en base a la patogénesis inflamatoria del SAHS, diferentes autores han publicado prometedores estudios de diagnóstico basados en la determinación de diferentes proteínas en diferentes fluidos corporales.
- Resonancia magnética de cabeza y cuello: para valorar el espacio de la vía aérea.
TRATAMIENTO DEL SÍNDROME DE APNEA HIPOPNEA DEL SUEÑO
Adenoamigdalectomía
Tal como indicaba la última Revisión Cochrane9 del año 2009, resulta complicado elaborar recomendaciones basadas en pruebas debido a la escasa calidad metodológica de los estudios sobre el tratamiento de los TRS publicados hasta la fecha.
No obstante, se acepta por la práctica totalidad de los autores que el tratamiento electivo es la adenoamigdalectomía. Así, la AAP recomienda, con un grado de evidencia B, que en caso de diagnosticar un SAHS la existencia de hipertrofia adenoamigdalar y la ausencia de contraindicaciones de la cirugía debe ir seguida de la realización de una adenoamigdalectomía. En caso de no apreciarse dicha hipertrofia adenoamigdalar, aconseja valorar otros tratamientos posibles.
La eficacia de esta técnica oscila entre el 78% y el 27,2%. Tal disparidad de resultados se explica por la heterogeneidad de los estudios publicados en cuanto al concepto de curación o mejoría (clínica o polisomnográfica) y a las características clínicas de los pacientes incluidos.
Existen grupos de pacientes con peores resultados, lo que se traduce en mayor riesgo de persistencia y/o recurrencia tras la cirugía: obesos, alteraciones craneofaciales, síndrome de Down (el 73% de estos precisaron otros tratamientos además de la cirugía), niños menores de tres años (en los que se producen hasta un 65% de fallos del tratamiento), historia familiar de SAHS y asmáticos.
Según la AAP, la OR de presentar un SAHS persistente tras la adenoamigdalectomía en niños obesos es de 3,2-4,7. En un metaanálisis se concluyó que tras la adenoamigdalectomía en niños obesos, el 88% de los niños presentaba un IAH>1 y en el 51% el IAH era >5.
A pesar de ello, y dada la mejoría evidente del SAHS en los niños obesos tras la cirugía, esta sigue siendo la primera opción de tratamiento, y más cuando en diferentes estudios se evidencia que la pérdida de peso solo es eficaz cuando es de gran magnitud, precisando para ello de programas intensivos en régimen de ingreso hospitalario o del empleo de cirugía bariátrica.
La AAP recomienda la pérdida de peso en niños obesos con un grado de evidencia C.
Con respecto a la técnica quirúrgica empleada, aunque no existen datos concluyentes parece que la adenoamigdalectomía intracapsular por radiofrecuencia presenta la misma efectividad con menos dolor y tiempo de recuperación postquirúrgicos. La AAP alerta sobre la posibilidad de una recurrencia de la hipertrofia amigdalar tras la amigdalectomía parcial hasta en un 16% de los casos, siendo más frecuente a los 30 meses de la intervención, y en niños menores de cinco años y asociado a infecciones amigdalares de repetición y alergia respiratoria.
Es importante resaltar el riesgo postquirúrgico de los TRS (de un 0-1,3% en el conjunto de cirugía infantil a un 16-29% en niños con SAHS), lo que nos lleva a recomendar una monitorización postquirúrgica más cuidadosa en todos los niños (la AAP preconiza la hospitalización en las primeras 24 horas tras cirugía y el uso de presión positiva continua en la vía respiratoria (CPAP) en el postoperatorio inmediato con un grado de evidencia B), con especial atención a grupos de mayor riesgo: menores de tres años, niños con alteraciones craneofaciales, obesos, fallo de medro, parálisis cerebral infantil, enfermedades neuromusculares, alteraciones cardiovasculares, presencia de una infección respiratoria superior concomitante y alteraciones importantes en la PSG preoperatoria (nadir de saturación de oxígeno menor del 80%, IAH>24/hora, e hipercapnia con pico de PCO2 superior a 60 mm Hg).
Otros procedimientos quirúrgicos
Tales como septoplastia, glosoplexia o uvulofaringopalatoplastia. Están indicados en casos muy seleccionados.
Presión positiva en la vía aérea
La CPAP y la presión positiva con dos niveles de presión son efectivas para disminuir los síntomas y el IAH, constituyen la segunda línea de tratamiento en niños que no mejorar con la cirugía o en los que esta está contraindicada (se trata de una recomendación con grado de evidencia B según la AAP). Precisan de un seguimiento cuidadoso tanto de sus indicaciones, como de su titulación y sus posibles efectos secundarios.
En relación a la preocupante posible afectación del crecimiento de la cara con el uso de la mascarilla de presión positiva, en un reciente estudio en pacientes escolares (nueve años) no se encontró afectación de las variables cefalométricas tras un uso de seis meses durante una media de seis horas/noche). Queda por determinar su inocuidad en pacientes de menor edad.
Resulta fundamental realizar una evaluación objetiva de la adherencia porque la impresión de los padres la sobrestima. La ayuda de un terapeuta respiratorio en el domicilio del paciente mejora la adherencia al tratamiento.
Tratamiento médico: corticoides nasales-antagonistas de los leucotrienos
Constituyen una alternativa en casos de SAHS leve con hipertrofia adenoidea moderada-grave. Hay estudios que apoyan una prueba con corticoides nasales (budesonida durante seis semanas) en casos de SAHS moderado, con una mejoría clínica y polisomnográfica mantenidas de más de ocho semanas. La fluticasona nasal también parece ser efectiva al disminuir la inflamación del tejido adenoideo. Aunque los efectos clínicos parecen se pequeños, la AAP recomienda con un grado de evidencia B el ensayo con corticoides intranasales en niños con SAHS leve en los que la cirugía esté contraindicada o en aquellos con SAHS residual leve (IAH<5).
Con respecto al montelukast, aunque existen algunos estudios de limitada extensión sobre su eficacia, la AAP concluye que no existen suficientes datos para recomendar esta línea de tratamiento.
Un reciente ensayo clínico publicado recientemente10 evaluó la terapia antiinflamatoria a medio plazo (corticoides intranasales durante tres meses y montelukast oral durante 6-12 meses) en niños de 2 a 14 años de edad con SAHS leve no tributarios de tratamiento quirúrgico, encontrando efectos clínicos beneficiosos en un 80% de los casos, y mejoría de las variables PSG en un 62% de ellos, sobre todo en los niños de menos edad y no obesos.
Ortodoncia (expansión maxilar rápida)
Se basa en el aumento del diámetro trasverso del paladar mediante la reapertura de la sutura del paladar medio. Son escasas las evidencias disponibles en cuanto a sus indicaciones y efectividad,aunque parece que puede ser útil en niños con alteraciones craneofaciales.
Traqueotomía
Técnica extremadamente efectiva pero reservada para SAHS graves con fallo de otros tratamientos previos.
SEGUIMIENTO TRAS EL TRATAMIENTO
Todos los niños deben ser evaluados clínicamente tras el tratamiento quirúrgico. La AAP y la GPC sobre trastornos del sueño en la infancia y adolescencia en Atención Primaria recomiendan con un grado de evidencia B dicha evaluación de todos los pacientes intervenidos a las 6-8 semanas Esta la llevará a cabo el pediatra de Atención Primaria y debe ser continua y mantenida, pues se describen casos de recurrencia del TRS incluso años después de un tratamiento satisfactorio. Debemos atender a los cambios auxológicos (con especial atención al incremento excesivo de peso tras la cirugía) y en el carácter del niño, su comportamiento y su rendimiento escolar. Debe cumplimentarse de nuevo el PSQ de Chervin orientado al SAHS. La mejoría en su calidad de vida debe ser reevaluada mediante el cuestionario de calidad de vida de Serres.
Aquellos pacientes con un mayor riesgo de persistencia o recurrencia del TRS –SAHS grave, comorbilidad y/o persistencia de factores de riesgo (obesidad, alteraciones craneofaciales, síndrome de Down)– y/o de síntomas deberán ser evaluados de nuevo por la Unidad de Sueño/ORL mediante la realización de una PSG de control (recomendación de la AAP con grado de evidencia B) en el plazo de 3-6 meses valorando la necesidad o no de tratamientos complementarios o alternativos.
Las líneas de investigación en torno al SAHS infantil se centran en la actualidad en conocer la historia natural de los TRS infantiles. Qué niños y por qué roncan, cuáles están en mayor riesgo de sufrir un SAHS, y entre estos, qué factores inciden en que aparezcan o no las diferentes comorbilidades (en este campo adquiere cada vez más importancia la influencia genética).
Se deben proporcionar al clínico herramientas diagnósticas más sencillas y asequibles (son muy esperanzadoras las últimas publicaciones sobre determinación de biomarcadores inflamatorios).
En relación al tratamiento, se avanza en la caracterización de los pacientes candidatos a tratamiento antiinflamatorio único o combinado con el quirúrgico.
CONFLICTO DE INTERESES
El autor declara no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: AAP: Academia Americana de Pediatría • CPAP: presión positiva continua en la vía respiratoria • ESD: excesiva somnolencia diurna • GPC: Guía de Práctica Clínica • IAH: índice de apnea/hipopnea • IMC: índice de masa corporal • OR: odds ratio • ORL: Otorrinolargingología • Pn: percentil n • PR: poligrafía respiratoria • PSG: polisomnografía • PSQ: Pediatric Sleep Questionnaire • SAHS: síndrome de apnea hipopnea del sueño • SRAVAS: síndrome de resistencia aumentada de la vía aérea superior • TDAH: trastorno por déficit de atención-hiperactividad • TRS: trastorno respiratorio del sueño • VPP: valor predictivo positivo.
BIBLIOGRAFÍA
- Marcus CL, Brooks LJ, Draper KA, Gozal D, Halbower AC, Jones J, et al.; American Academy of Pediatrics. Diagnosisandmanagementofchildhoodobstructivesleep apnea syndrome. Pediatrics. 2012;130:e714-55.
- Alonso-Álvarez ML, Canet T, Cubell-Alarco M, Estivill E, Fernández-Julián E, Gozal D, et al. Documento de consenso del síndrome de apneas-hipopneas durante el sueño en niños. Arch Bronconeumol. 2011;47(Supl 5):2-18.
- Guía de Práctica Clínica sobre Trastornos del Sueño en la Infancia y Adolescencia en Atención Primaria. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Unidad de Evaluación de Tecnologías Sanitarias de la Agencia Laín Entralgo; 2011.
- Roland PS, Rosenfeld RM, Brooks LJ, Friedman NR, Jones J, Kim TW, et al.; American Academy of Otolaryngology—Head and Neck Surgery Foundation. Clinical practice guideline: Polysomnography for sleep-disordered breathing prior to tonsillectomy in children. Otolaryngol Head Neck Surg. 2011;145(1 Suppl):S1-15.
- Owens JA, Dalzell V. Use of the 'BEARS' sleep screening tool in a pediatric residents' continuity clinic: a pilot study. Sleep Med. 2005;6:63-9.
- Chervin RD, Weatherly RA, Garetz SL. Pediatric sleep questionnaire: prediction of sleep apnea and outcomes. Arch Otolaryngol Head Neck Surg. 2007;133:216-22.
- Sivan Y, Kornecki A, Schonfeld T. Screening obstructive sleep apnoea syndrome by home videotape recording in children. Eur Respir J. 1996;9:2127-31.
- Tan HL, Gozal D, Ramírez HM, Bandla HP, Kheirandish-Gozal L. Overnight polysomnography versus respiratory polygraphy in the diagnosis of pediatric obstructive sleep apnea. Sleep. 2014;37:255-60.
- Lim J, McKean MC. Adenotonsillectomy for obstructive sleep apnoea in children. Cochrane Database Syst Rev. 2009;(2):CD003136.
- Kheirandish-Gozal L, Bhattacharjee R, Bandla HP, Gozal D. Anti-Inflammatory Therapy Outcomes for Mild OSA in Children. Chest. 2014. doi: 10.1378/chest.13-2288.





