Vol. 14 - Num. 55
Grupo PrevInfad/PAPPS Infancia y Adolescencia
Actividades preventivas y de promoción de la salud para niños prematuros con una edad gestacional menor de 32 semanas o un peso inferior a 1500 g. Del alta hospitalaria a los siete años (2.ª parte)
Carmen Rosa Pallás Alonsoa, Grupo PrevInfad/PAPPS Infancia y Adolescenciab
aServicio de Neonatología. Hospital Universitario 12 de Octubre. Madrid. España.
bJosé María Mengual Gil (coord.).
Correspondencia: CR Pallás. Correo electrónico: kpallas.hdoc@gmail.com
Cómo citar este artículo: Pallás Alonso CR, Grupo PrevInfad/PAPPS Infancia y Adolescencia. Actividades preventivas y de promoción de la salud para niños prematuros con una edad gestacional menor de 32 semanas o un peso inferior a 1500 g. Del alta hospitalaria a los siete años (2.ª parte). Rev Pediatr Aten Primaria. 2012;14:249-63.
Publicado en Internet: 24-09-2012 - Número de visitas: 33982
Resumen
Los problemas de desarrollo específicos de los niños que pesan al nacer menos de 1500 g se han estudiado recientemente. Los niños prematuros que pesan menos de 1500 g o con una edad gestacional menos de 32 semanas se sientan sin apoyo y caminan mas tarde que los niños a término. Una de las peculiaridades observadas en estos niños es el desarrollo de hipertonía transitoria. Algunas patologías como la displasia broncopulmonar o el bajo peso pueden retrasar la edad a la cual el niño es capaz de sentarse sin apoyo o caminar. El cerebro en desarrollo de los niños prematuros es extremadamente vulnerable a cualquier daño. Las consecuencias a largo plazo de estas alteraciones suponen alteraciones motoras, la más frecuente la parálisis cerebral (daño no progresivo del sistema nervioso central caracterizado por un control anormal del movimiento y de la postura) así como problemas cognitivos y del comportamiento. El riesgo de problemas del desarrollo aumenta según disminuye la edad gestacional; por tanto, para estos niños prematuros existe un riesgo relativamente alto de parálisis cerebral, retraso del desarrollo, déficit auditivo y visual o de problemas académicos. La relación que se establece entres estos niños y sus padres también se ve afectada. Ciertos cuidados aplicables tanto a los niños como a sus familias pueden ayudar a mejorar el pronóstico de estos niños.
Palabras clave
● Prematuro ● Salud infantilNota:
bGrupo PrevInfad (AEPap): F. J. Soriano Faura (coord.), J. Colomer Revuelta, O. Cortés Rico, M. J. Esparza Olcina, J. Galbe Sánchez-Ventura, J. García Aguado, A. Martínez Rubio, M. Merino Moína, C. R. Pallás Alonso, J. Pericas Bosch, F. J. Sánchez Ruiz-Cabello.
DESARROLLO MOTOR DEL PREMATURO MENOR DE 1500 G O MENOR DE 32 SEMANAS DE EDAD GESTACIONAL
Conceptos generales
La evaluación del desarrollo motor de los niños con peso menor de 1500 g al nacimiento o una edad gestacional inferior a 32 semanas es un aspecto fundamental, aún así la exploración de estos niños no está bien descrita ni estandarizada1,2. Con la valoración del desarrollo motor se pueden identificar niños con alteraciones leves, moderadas o graves. Algunas alteraciones leves o moderadas pueden ser transitorias o pueden mejorar con el tiempo, sin embargo los niños con alteraciones motoras graves serán los que tengan una peor evolución. El riesgo de parálisis cerebral u otras alteraciones graves del desarrollo motor puede predecirse, en parte, por la información que aportan las técnicas de neuroimagen, sin embargo los problemas cognitivos y del comportamiento pueden ocurrir en ausencia de alteraciones de la neuroimagen. En la Tabla 1 se resumen las características biológicas que suponen un riesgo incrementado de problemas del desarrollo. De todas ellas la constatación de leucomalacia periventricular quística es la que conlleva un peor pronóstico, ya que casi sin excepción se asocia a la presencia de parálisis cerebral.
Valoración motora
Como en cualquier otra exploración neurológica, se evaluará el tono, los reflejos, la postura y la calidad del movimiento. Por otro lado se debe constatar la adquisición progresiva de los diferentes ítems motores (sujeción cefálica, sedestación, marcha). Actualmente cada vez se da más importancia a la valoración de la capacidad funcional, que en definitiva será la que determine la calidad de vida del niño. Para ello se han desarrollado una serie de algoritmos y de escalas funcionales que pueden ser de utilidad en la práctica y que se van a presentar a continuación.
Algoritmo
Para valorar la capacidad motora de los niños entre los 24 y 28 meses de edad corregida el NIDCH1 propone un algoritmo muy simple (Fig. 1) que permite clasificar la gravedad de la alteración motora, basándose en la escala del Gross Motor Function Classification System (sistema de valoración de la función motriz grosera; GMFCS) y valorando la limitación funcional3.
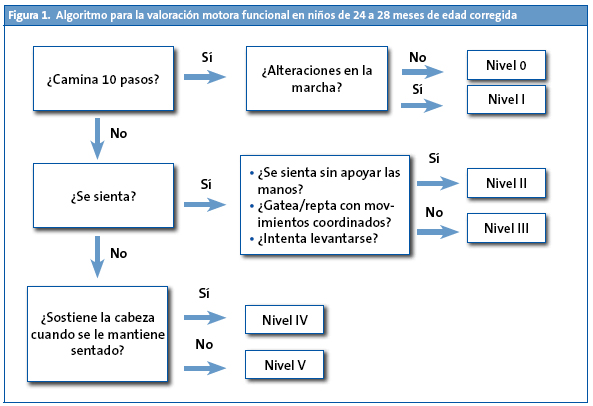
Para valorar las alteraciones motoras en los niños más mayores se dispone de otro algoritmo (Fig. 2) que va orientado fundamentalmente al diagnóstico de la parálisis cerebral y que se muestra en el apartado que se dedica a esta patología.
Escalas funcionales
Las escalas funcionales son instrumentos útiles porque permiten de forma sencilla y objetiva clasificar el nivel de afectación motora de los niños. Las dos más utilizadas son el GMFCS3, que valora la función motora grosera, y la escala BFMF4, que pondera la función fina.
- GMFCS3: el GMFCS se basa en la valoración del movimiento que se inicia voluntariamente, sobre todo en relación con la sedestación y la marcha. La distinción entre los niveles de función motora está fundamentada en las limitaciones funcionales, la necesidad de ayuda técnica, incluyendo aparatos para el desplazamiento (como andadores, muletas y bastones), la movilidad en silla de ruedas y hasta cierto punto la calidad del movimiento. Como la valoración de la función motora depende de la edad, se dispone de descripciones adecuadas según esta. La clasificación de las habilidades y limitaciones funcionales para cada edad tienen como objeto servir como guía y apoyo para evaluar la situación del niño, pero no se debe considerar como algo absoluto ni definitivo. Un aspecto atractivo de esta escala es que pone énfasis en la capacidad del niño más que en sus limitaciones.
- Valoración de la función motriz fina (BFMF)4: valora la habilidad del niño para manipular objetos en actividades diarias importantes, por ejemplo durante el juego y tiempo libre, comer y vestir. Discrimina en qué situación es independiente el niño y qué cantidad de soporte y adaptación necesita.
Adquisición de la sedestación y la marcha
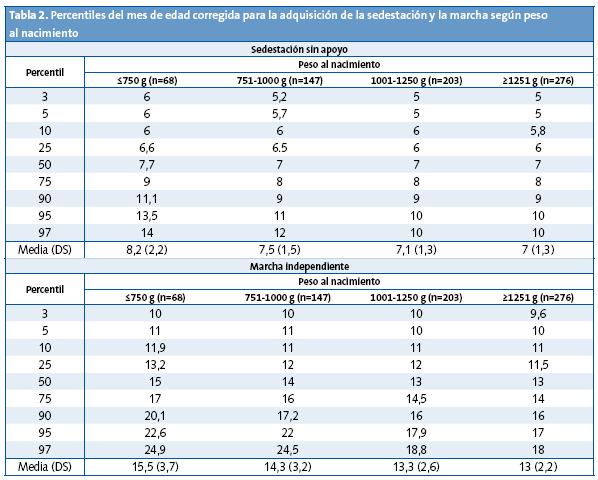
El retraso en las adquisiciones motoras no siempre indica patología, sin embargo, que el niño vaya adquiriendo una mayor destreza motora en las edades esperadas, es un dato que apoya un desarrollo neurológico adecuado. Se considera que se ha alcanzado la sedestación sin apoyo cuando el niño es capaz de mantenerse sentado sin ningún tipo de apoyo, jugando con las manos durante al menos un minuto. Se considera que se ha alcanzado la marcha autónoma cuando es capaz de caminar cinco pasos sin ningún tipo de apoyo. El 50% de los menores de 1500 g han adquirido la sedestación sin apoyo a los siete meses de edad corregida y el 90% a los nueve meses de edad corregida. Con respecto a la marcha, el 50% la han adquirido a los 12 meses de edad corregida y el 90% a los 18 meses de edad corregida5. Los puntos de corte de los nueve meses para la sedestación y los 18 meses de edad corregida para la marcha, pueden servir para identificar a los recién nacidos menores de 1500 g con retraso en las adquisiciones motoras y esto puede ser un primer signo de alarma de una evolución motora alterada (Tabla 2).
Variantes de la normalidad
Aunque la gran mayoría de los niños con peso de nacimiento menor de 1500 g o una edad gestacional inferior a 32 semanas evolucionan favorablemente, algunos de ellos van a presentar ciertas peculiaridades en su desarrollo, que no pueden llegar a considerarse patológicas, pero que sí son particulares de los niños muy prematuros. Es importante conocerlas para poder detectarlas y no alarmar de forma innecesaria a la familia, ya que, a los dos años de edad corregida, el desarrollo motor de estos niños será normal6.
Hipertonía transitoria
Alrededor de los tres meses de edad corregida en muchos niños prematuros se presenta un cuadro de hipertonía que progresa cefalocaudalmente y que se manifiesta inicialmente como retracción escapular (hombros hiperextendidos) y posteriormente va descendiendo hasta afectar a los miembros inferiores, no produce retracciones, no presenta asimetrías ni retrasa la adquisición de la sedestación y la marcha. Desaparece antes de los 18 meses de edad corregida, sin repercutir en la evolución del niño. Si el cuadro de hipertonía es asimétrico o retrasa las adquisiciones motoras o no tiene un patrón claro de progresión cefalocaudal, se debería enviar al niño para valoración neurológica y derivarlo a un centro de atención temprana. No se sabe bien por qué aparece, aunque se cree que la maduración de los músculos se ve alterada con el nacimiento prematuro. Los músculos están preparados para madurar en un medio líquido hasta la semana 40 de edad gestacional. Cuando un niño nace prematuro, sus músculos deben soportar toda la acción de la fuerza de la gravedad cuando todavía no están preparados para ello y esto condiciona una peculiar diferenciación de las miofibrillas. Por otra parte, al nacer de forma anticipada, no se adquiere la flexión fisiológica máxima que se produce al final de la gestación. Hasta hace muy poco, prácticamente el 50% de los prematuros menores de 32 semanas de gestación presentaban este cuadro de hipertonía transitoria, actualmente, sin embargo, menos de un tercio de los prematuros presentan hipertonía transitoria. Quizás esta disminución en su frecuencia esté en relación con los nuevos cuidados posturales que se han introducido en las unidades neonatales, en el entorno de los cuidados centrados en el desarrollo. Se intenta mantener al niño prematuro en posición de flexión dentro de la incubadora y con los miembros en la línea media.
Retraso motor simple
En los dos primeros años algunos niños que han nacido prematuramente se retrasan en la adquisición de las habilidades motoras. No suelen presentar ningún hallazgo patológico en la exploración neurológica o acaso una leve hipotonía que no justifica el retraso. La característica de los niños con retraso motor simple es que presentan múltiples patologías de base de cierta gravedad o un retraso del crecimiento importante. Este cuadro suele aparecer, por ejemplo, en niños con displasia broncopulmonar que presentan frecuentes empeoramientos o infecciones respiratorias con ingresos repetidos y enlentecimiento de la curva de crecimiento. Cuando mejora la patología de base, el niño suele progresar rápidamente en el aspecto motor, igualándose con los niños de su misma edad corregida.
Parálisis cerebral
La parálisis cerebral es la alteración motora que aparece más frecuentemente en los niños de muy bajo peso. Aparece en aproximadamente el 7% de los niños de muy bajo peso. Por otro lado hay que recordar que casi el 50% de los niños a los que se les diagnóstica de parálisis cerebral tienen el antecedente de prematuridad7. La parálisis cerebral se utiliza generalmente como marcador de la calidad de los cuidados y desde hace ya varias décadas se realizan estudios que tratan de documentar la tendencia en su prevalencia; sin embargo, las diferencias encontradas pueden estar relacionadas con las características de la población, agresividad de los tratamientos o con modificaciones en la frecuencia de mortalidad. Algunos estudios de prevalencia no encuentran cambios8 y otros encontraban un incremento9. Los estudios más recientes tienden a mostrar una reducción en su frecuencia, sobre todo en el grupo de 1000 a 1500 g, mientras que en los menores de 1000 g no se observan cambios10.
Concepto
El término parálisis cerebral comprende un grupo de alteraciones que conllevan una alteración del movimiento, de la postura y de la función motora. Esta alteración es permanente pero no inmutable; no es progresiva y la noxa que causa la alteración actúa en el cerebro inmaduro o en desarrollo11. Se considera criterio de exclusión toda condición progresiva que implique pérdida de las adquisiciones, la patología de la médula espinal y los cuadros cuya única manifestación sea la hipotonía. El diagnóstico es clínico y la información que pueden aportar los estudios de neuroimagen ayudará a esclarecer la etiología, pero no a hacer el diagnóstico de parálisis cerebral. El grupo Surveillance of Cerebral Palsy in Europe (SCPE) está constituido por expertos europeos que, además de proponer una definición común de parálisis cerebral, han aportado instrumentos diagnósticos y de clasificación que pueden ser de mucha utilidad para el pediatra. La parálisis cerebral implica únicamente daño motor, además puede llevar o no asociado déficit sensorial o cognitivo.
Diagnóstico y clasificación
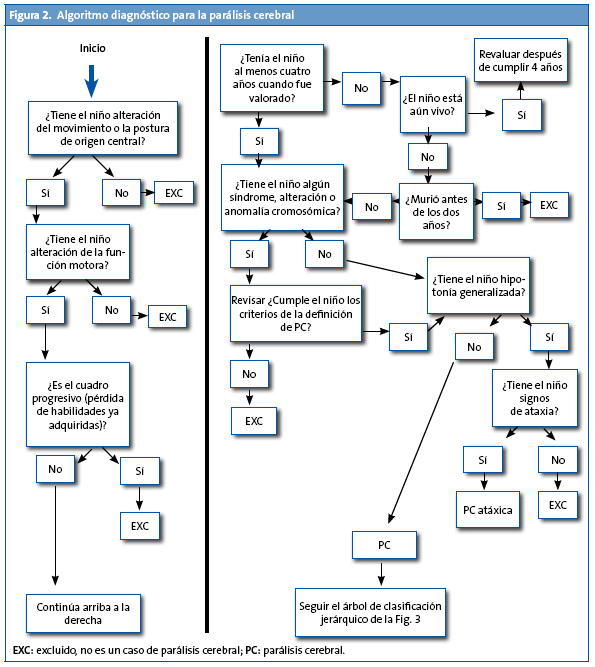
Como se acaba de referir, el diagnóstico es clínico. En la Fig. 2 se muestra el algoritmo diagnóstico propuesto por el grupo SCPE11. Por acuerdo se ha decidido no incluir casos de parálisis cerebral en los registros de casos hasta los cuatro años de edad, que es cuando el diagnóstico se puede considerar definitivo. Sin embargo, el algoritmo diagnóstico se puede utilizar a partir de los dos años de edad corregida.
Este mismo grupo SCPE también ha diseñado un algoritmo para la clasificación de la parálisis cerebral (Fig. 3).
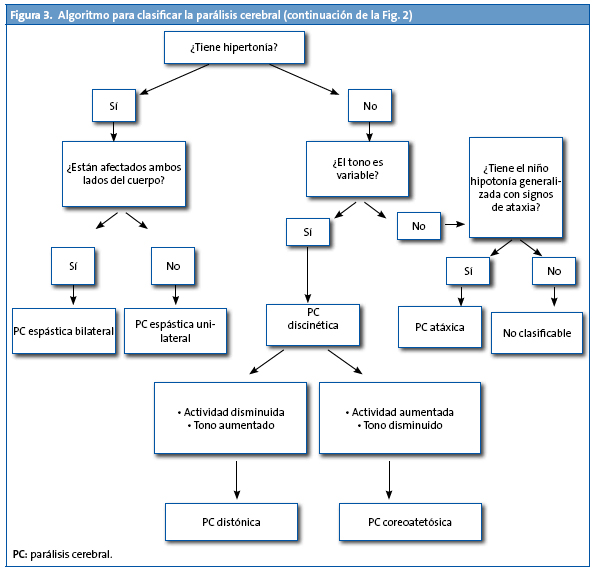
Se ha propuesto una clasificación mucho más sencilla y que mejora el grado de acuerdo en las evaluaciones por distintos profesionales11. Hasta ahora en la clasificación topográfica se hablaba de cuadriplejía, hemiplejía y diplejía, pero para cada una de estas categorías se encontraban varias definiciones bien diferentes. Por ello el grupo SCPE propone que la parálisis cerebral espástica (más del 90% de los casos en los niños con peso inferior a 1500 g) se clasifique como unilateral o bilateral y la gravedad se establezca utilizando las escalas de función motora. Sería interesante que los profesionales se familiarizaran con estos instrumentos que están validados y que ya se están utilizando en varios países de Europa por muchos profesionales.
Intervenciones
Ningún tipo de intervención durante el seguimiento del niño ha mostrado que pueda prevenir o disminuir la gravedad de la parálisis cerebral. De todas formas, los niños que presenten alguno de los factores de riesgo que se refieren en la Tabla 1 y que no estén incluidos en un programa de seguimiento formal, sería conveniente derivarlos a los equipos de atención temprana para evaluación, seguimiento y tratamiento si lo consideraran adecuado. Con la fisioterapia se consigue evitar la rigidez articular y así favorecer el confort y el cuidado del niño, pero no hay estudios controlados que hayan podido mostrar un claro efecto en la función motora con la fisioterapia12,13. Una vez confirmado el diagnóstico, el niño se mantendrá con tratamiento de fisioterapia, pero habrá que ayudar a la familia a aceptar las limitaciones motoras de su hijo y a que ayuden al niño a desarrollar sus capacidades fuera del ámbito motor. Se tiende a sobrecargar a los niños con muchas horas de tratamiento con fisioterapia, limitándoles la posibilidad de desarrollarse en otros aspectos. Ninguno de los tratamientos médicos que hasta ahora se han aplicado han mostrado beneficios significativos, la toxina botulínica o la administración de baclofeno pueden producir ciertos beneficios, casi siempre transitorios, en un grupo muy seleccionado de niños14,15. No se dispone de ensayos clínicos que muestren el efecto del tratamiento con los métodos de fisioterapia de Vojta y Bobath, que están muy extendidos en España y que en algunos casos, sobre todo con el Vojta, son muy mal tolerados por el niño y por la familia. Los niños con parálisis cerebral suelen tener dolor con mucha frecuencia y es uno de los aspectos que más les afecta en la calidad de vida. Hay que interrogar activamente sobre la presencia de dolor y mantener el tratamiento analgésico el tiempo que sea preciso16. El dolor con mucha frecuencia es de origen dental. Los niños con similar grado de afectación perciben su calidad de vida de forma bien diferente dependiendo del país en el que viven, por tanto el que el niño pueda desarrollarse como persona y tener una vida participativa parece depender mucho más del entorno, que de sus limitaciones motoras17.
Pronóstico motor
Los niños con parálisis cerebral de afectación unilateral alcanzan la marcha en el 90% de los casos, los niños con afectación bilateral la alcanzan solo en el 40-50% de los casos18. Si el niño adquiere la sedestación sin apoyo antes de los dos años de edad corregida, casi con seguridad alcanzará la marcha, por el contrario, si a los dos años no se sienta, las posibilidades de marcha autónoma serán muy escasas.
Recomendaciones
- Se debe realizar una detenida evaluación motora al menos dos veces en el primer año de vida, aunque aparentemente el desarrollo sea adecuado (fuerza de la recomendación I).
- Los niños con riesgo de problemas de desarrollo motor que no estén incluidos en un programa de seguimiento formal, se deben remitir a atención temprana así como todos aquellos en los que se detecte alguna alteración motora (fuerza de la recomendación I).
- Para excluir o diagnosticar parálisis cerebral se recomienda el uso de los algoritmos propuestos por el grupo SCPE (fuerza de la recomendación I).
- Se recomienda el uso de escalas de función motora para evaluar a los niños en los que se sospeche o se haya confirmado una alteración motora (fuerza de la recomendación I).
VISIÓN
Conceptos generales
Se tiende a pensar que los problemas oftalmológicos de los niños prematuros están en relación con la presencia de retinopatía de la prematuridad (ROP), pero el riesgo de alteraciones oftalmológicas está incrementado en la población de niños prematuros aunque no hayan padecido este problema. Más de la mitad de los niños con peso de nacimiento menor de 1500 g o una edad gestacional inferior a 32 semanas presentan problemas oftalmológicos19-21. La frecuencia de factores de riesgo asociados con ambliopía es elevada con respecto a la población general, presentan estrabismo con una frecuencia entre 13-22%, anisometropía en el 9%, miopía entre 15-22% e hipermetropía con más de tres dioptrías en el 18%20-23. La frecuencia global de errores de refracción se sitúa en torno al 30%. También presentan problemas de percepción y de discriminación visual que son difíciles de detectar. Los niños con retinopatía grado 3 o mayor, o los que hayan precisado tratamiento con láser o crioterapia, y los niños con problemas neurológicos tienen una probabilidad aún mayor de alteraciones oftalmológicas. Los niños que presentan retinopatía de grado 1 o 2 tienen un riesgo de sufrir problemas oftalmológicos, similar al de los niños menores de 1500 g sin retinopatía.
Seguimiento
Cribado de la retinopatía de la prematuridad
El cribado de la ROP para diagnosticar y tratar los casos de retinopatía grave se ha mostrado efectivo para prevenir casos de ceguera24. Por tanto, lo primero que tiene que confirmar el pediatra de atención primaria es que a todos los niños que pesaron al nacimiento menos de 1500 g o que tenían una edad gestacional inferior a 32 semanas se les ha realizado, alrededor de las seis semanas de edad, el cribado para la ROP y que este cribado se ha mantenido hasta que se ha confirmado la vascularización de toda la retina o la regresión de la ROP, en los casos en los que se haya diagnosticado. Algunos centros hospitalarios limitan el cribado de la ROP a los niños con peso igual o inferior a 1250 g o con una edad gestacional igual o inferior a 30 semanas. Estos centros han comprobado que no tienen casos de retinopatía susceptible de tratamiento por encima de este peso y esa edad gestacional25,26. Si el pediatra no conoce el protocolo del hospital de referencia o tiene dudas de si se debería haber hecho o no, puede contactar con el hospital. En caso de que el cribado no se haya llevado a cabo, se debe remitir al niño de forma preferente a un oftalmólogo experto para que realice su valoración.
Seguimiento de niños sin patología añadida
La mayoría de los niños con peso inferior a 1500 g o una edad gestacional inferior a 32 semanas estarán incluidos en programas de seguimiento del que formarán parte evaluaciones oftalmológicas seriadas anuales o bianuales. Casi el 20% de los niños menores de 1500 g dejan de acudir a los programas de seguimiento, por lo que el pediatra debe asegurarse de que realmente se están realizando las evaluaciones oftalmológicas2,27. En caso de que no se estén realizando, es aconsejable que el niño sea valorado por un oftalmólogo experto, antes de los tres años de edad28, ya que algunas de las alteraciones que presentan no se pueden diagnosticar con las exploraciones que pueden realizar los pediatras y por otro lado se ha demostrado que el tratamiento precoz de la ambliopía conlleva un mejor pronóstico29. Si esa evaluación es normal, el niño puede continuar con las revisiones rutinarias de la visión que se recomiendan para todos los niños.
Seguimiento de los niños con retinopatía de la prematuridad grado 3 o que requirió tratamiento y de los niños con patología neurológica
Estos niños presentan un riesgo muy elevado de problemas visuales graves, algunos de ellos muy difíciles de detectar por las evaluaciones rutinarias, por lo que deben estar en seguimiento oftalmológico especializado hasta la adolescencia2,28.
Recomendaciones
- El pediatra confirmará que se ha realizado el cribado para la retinopatía de la prematuridad. Si no se hubiera realizado o no se hubiera completado, se debe remitir al niño sin demora a un oftalmólogo experto en el cribado de retinopatía de la prematuridad (fuerza de la recomendación A).
- Si el niño está incluido en un programa de seguimiento hospitalario debe confirmar que realmente acude a las revisiones y que se realizan las evaluaciones oftalmológicas (fuerza de la recomendación B).
- Si no estuviera en seguimiento oftalmológico y no tuviera patología añadida (retinopatía grave o patología neurológica), será recomendable realizar una evaluación oftalmológica antes de los tres años de vida (fuerza de la recomendación B).
- Ante cualquier alteración detectada por el pediatra o referida por los padres, aunque esta no se pueda poner de manifiesto en la consulta, se deberá remitir al niño para una nueva evaluación por el oftalmólogo (fuerza de la recomendación A).
- Los niños con retinopatía de la prematuridad de grado 3 o que hayan requerido tratamiento y los que presentan patología neurológica precisan de seguimiento oftalmológico especializado hasta la adolescencia (fuerza de la recomendación B).
AUDICIÓN
Conceptos generales
Se recomienda cribado auditivo universal en el periodo neonatal a todos los recién nacidos30. La prueba de elección es la de los potenciales auditivos automatizados de tronco cerebral. Por tanto, en principio, a los recién nacidos con peso menor de 1500 g o una edad gestacional menor de 32 semanas se les debe realizar el cribado auditivo antes del alta de la unidad neonatal. Si, en esta población, el cribado se realiza con otoemisiones acústicas existen una serie de limitaciones. Por un lado, con las otoemisiones se obtienen falsos negativos porque no se explora la vía retrococlear y es donde se detecta patología en un porcentaje relevante de menores de 1500 g con déficit auditivo31, por otro, hasta en el 13% de los de los niños de muy bajo peso aparecen falsos positivos en la prueba de otoemisiones32. Por tanto, independientemente de con qué instrumento se realice el cribado universal, la población de niños con peso menor de 1500 g o menor de 32 semanas debe valorarse con potenciales auditivos automatizados de tronco cerebral.
La frecuencia de déficit auditivo moderado o grave en la población general es de 2‰ y en los niños de muy bajo peso de 2%, por lo que este grupo se considera de especial riesgo31. No está claro actualmente si, en sí mismo, el pesar menos de 1500 g o tener una edad gestacional inferior a 32 semanas son realmente factores de riesgo o son otras circunstancias que se suman durante su ingreso las que los hacen especialmente vulnerables al déficit auditivo. Los niños prematuros tienen con frecuencia pérdidas auditivas de transmisión por derrames en el oído medio32, que tienden a resolverse espontáneamente, pero si persisten, debe plantearse su tratamiento, ya que también pueden limitar la aparición del lenguaje y su desarrollo en general. En los casos de ingreso muy prolongado se puede retrasar mucho la realización del cribado auditivo, así que es aconsejable realizarlo tiempo antes del alta para que el niño pueda beneficiarse cuanto antes del tratamiento, ya sean amplificadores o implantes cocleares33. Algunos de los niños de muy bajo peso con problemas auditivos presentan otras dificultades en el desarrollo, por lo que es una prioridad ofrecerles tratamiento audiológico de la forma más precoz posible, para no limitar aún más sus capacidades.
Seguimiento
Como se ha mencionado, a los niños menores de 1500 g o menores de 32 semanas se les realizará cribado auditivo antes del alta con potenciales auditivos automatizados de tronco cerebral. Aunque el cribado se pase, parece que existe riesgo de pérdida auditiva progresiva en esta población, por lo que es conveniente hacer un adecuado seguimiento de la adquisición del lenguaje y sería deseable que, hacia los dos años de edad corregida, se les volviera a realizar una prueba objetiva de audición31,34. No se conoce bien la causa por la que aparecen estos déficits auditivos de comienzo tardío.
Recomendaciones
- Se recomienda realizar cribado auditivo con potenciales evocados automatizados antes del alta de la unidad neonatal a todos los recién nacidos con peso menor de 1500 g o una edad gestacional inferior a 32 semanas (fuerza de la recomendación B).
- Se recomienda realizar otra valoración audiológica hacia los dos años de edad corregida para detectar los déficits auditivos de comienzo tardío (fuerza de la recomendación B).
ALTERACIONES COGNITIVAS Y DEL COMPORTAMIENTO
Conceptos generales
Numerosos estudios de seguimiento han demostrado que los niños con peso inferior a 1500 g o con una edad gestacional menor de 32 semanas presentan una frecuencia elevada de alteraciones cognitivas y del comportamiento, incluso los que no tienen ninguna alteración neurosensorial.
Cociente intelectual
La mayoría de los niños con peso menor de 1500 g tienen un cociente intelectual (CI) dentro de los límites normales, sin embargo es significativamente más bajo que en los niños a término. El metaanálisis realizado en el 200235, que incluía resultados de 16 estudios, concluyó que el CI disminuye entre 1,5 y 2,5 puntos de media por cada semana que disminuya la edad gestacional. Existe una asociación muy fuerte entre el nivel socioeconómico de los padres y el cociente intelectual. En los niños prematuros las diferencias con los controles, aunque se reducen, persisten al ajustar por el nivel socioeconómico36,37. En los prematuros de edad gestacional extrema (24-26 semanas de gestación) los factores biológicos son determinantes y por tanto son los niños en los que los programas de atención temprana tienen menos impacto38.
Alteraciones del comportamiento y psicopatología
Los niños con peso menor de 1500 g o menores de 32 semanas de gestación tienen mayor riesgo de alteraciones del comportamiento y emocionales. Los resultados de los estudios que tratan estos aspectos son más difíciles de comparar porque el tipo de herramientas que se utilizan para detectar las alteraciones es muy variado y no tienen la consistencia de la medida del CI. Tampoco es fácil identificar si estas alteraciones están en relación con la prematuridad o con la crianza que reciben estos niños y que está marcada por la experiencia de sus padres en relación con el nacimiento y el ingreso de su hijo muy prematuro, y que en general induce conductas muy sobreprotectoras. En el metaanálisis realizado35 se mostró como el 81% de los estudios revisados que incluían población entre 5 y 14 años mostraba una mayor prevalencia de las llamadas alteraciones internalizadas (ansiedad, depresión, síntomas de deprivación), y el 69% de los estudios, alteraciones en la sociabilización (comportamientos agresivos, delincuencia). En un estudio reciente39 que compara a los cinco años una cohorte de prematuros de menos de 32 semanas con controles nacidos a término encontraron que los trastornos emocionales y del aprendizaje eran 1,6 veces mas frecuentes en los niños prematuros.
Hiperactividad y déficit de atención
La importancia que ha adquirido el diagnóstico de esta alteración del comportamiento merece que se trate de forma separada del resto de alteraciones peor definidas. Actualmente se dispone de información consistente que demuestra que el trastorno por déficit de atención con hiperactividad (TDAH) es más frecuente en los niños prematuros que en la población general. En el metaanálisis ya mencionado35 se encontró que el riesgo relativo era de 2,64 (intervalo de confianza del 95%: 1,85 a 3,78) comparado con los controles. Además, se ha descrito que un número significativo de niños con peso menor de 1500 g presentaría alteraciones de la atención, pero sin cumplir criterios de TDAH, lo que sugiere quizás que estos niños puedan presentar un déficit de atención “puro” y específico de los niños muy prematuros40. El bajo peso parece ser el factor que se asocia de forma más consistente con las alteraciones de la atención y sin embargo estas alteraciones del comportamiento no parecen estar relacionadas con el CI de los niños41.
Otras alteraciones del aprendizaje
Se ha demostrado cómo los niños muy prematuros presentan dificultades en los procesamientos visoespaciales y visomotores42,43. Estos déficits tienen un impacto negativo en los procesos de aprendizaje, incluso en niños sin ninguna alteración sensorial o del desarrollo. Aún a los 18 años se mantienen estas dificultades en el aprendizaje y una menor velocidad de respuesta ante nuevas tareas44. Mucho falta por saber sobre el proceso de aprendizaje, pero en general en muchas de las áreas que se van conociendo cuando se exploran en los recién nacidos prematuros se encuentran limitaciones y diferencias con los niños nacidos a término.
La familia
El nacimiento de un niño muy prematuro provoca una gran alteración en la familia, que a veces se mantiene durante años. Numerosos estudios44-49 han mostrado que si los padres participan directamente del cuidado de su hijo durante el ingreso, se sienten más capaces de asumir el cuidado tras el alta, tienen menos síntomas depresivos y disminuye la ansiedad, y que esto a su vez produce beneficios en diferentes áreas del desarrollo en el niño a corto plazo. Sin embargo, aunque probablemente un mayor bienestar emocional en la familia repercuta positivamente en la evolución de los niños a medio y largo plazo, todavía no ha podido demostrarse. Si para el pediatra, el paciente debe ser la familia más que el niño de forma individual, en el caso de los niños prematuros todavía es más importante considerar a la familia como “el paciente”. La experiencia de los padres en las unidades de cuidados intensivos neonatales y los procesos de duelo anticipado que han sufrido les hace, como familia, especialmente vulnerables.
Intervenciones
Los programas de atención temprana, que están desarrollados en todas las comunidades autónomas españolas, se dirigen a reducir los problemas motores y cognitivos y realizan tareas educativas en los padres y además plantean programas de trabajo individualizado con cada niño. Los problemas cognitivos se pueden entender desde una perspectiva amplia, es decir, incluyendo problemas del pensamiento, del aprendizaje y del comportamiento y sociabilización. Una revisión de los ensayos clínicos50 llevados a cabo con niños prematuros, para valorar el impacto de los programas de atención temprana en el ámbito cognitivo, ha mostrado que son efectivos para mejorar el desarrollo cognitivo a corto y medio plazo. Hay pruebas más limitadas de que mejoran el desarrollo cognitivo a largo plazo. Los programas que solo incluyen educación de los padres51 para ayudar al proceso de crianza de estos niños han mostrado una mejoría en los estilos educativos de los padres, más adaptados aparentemente a las necesidades de los niños. Sin embargo, a pesar de ello, no se ha encontrado el esperado impacto positivo en el niño. Una intervención muy sencilla y que sí ha mostrado resultados positivos consiste en animar a los padres a que hablen “más” a sus hijos, aun en el periodo de lactantes52. No solo se deben dirigir al niño cuando necesiten comunicarse con él, sino también deberían comentarles situaciones diversas, aunque las ideas sean complejas y el vocabulario más amplio del que se esperaría que pudieran comprender. Parece que los resultados intelectuales de los niños podrían mejorarse de esta forma tan simple. Otra intervención con resultados favorables bien demostrados y que ya se ha mencionado es la promoción y apoyo a la lactancia materna ya que mejora claramente los cocientes de desarrollo y tiene un claro efecto dosis respuesta52,53. Con respecto al pediatra de atención primaria, la detección de muchas de las alteraciones descritas anteriormente es compleja, por lo que con los niños muy prematuros se debe trabajar de forma coordinada con los equipos de atención temprana y en algunos casos con salud mental y con los maestros de las escuelas. Para mejorar el resultado de los niños muy prematuros en el ámbito cognitivo se requiere un abordaje interdisciplinar, que requiere una coordinación de equipos que no siempre es fácil, dadas las estructuras de algunas comunidades autónomas de nuestro país.
Recomendaciones
- Los niños menores de 1500 g o con una edad gestacional inferior a 32 semanas presentan con mayor frecuencia que los niños a término problemas cognitivos y del comportamiento. Se recomienda enviarlos a los equipos de atención temprana, ya que se mejoran los resultados a corto y medio plazo (fuerza de la recomendación A).
- Los niños menores de 1500 g o con una edad gestacional inferior a 32 semanas presentan con mayor frecuencia que los niños a término alteraciones más complejas del comportamiento y psicopatología. Si se sospechan, se requiere derivación a atención especializada en centros de salud mental para su diagnóstico y tratamiento y también requieren un trabajo coordinado con los equipos educativos (fuerza de la recomendación B).
- Se debe recomendar a los padres de los niños muy prematuros que les hablen más de lo que requiere la propia comunicación con el niño, que dediquen tiempo especial a ello. Se les debe hablar aun con ideas complejas y con vocabulario más amplio del que aparentemente entenderían, ya que así se mejoran sus resultados intelectuales (fuerza de la recomendación B).
- Apoyar y promocionar la alimentación con leche materna tras el alta. Además de proteger frente a la enterocolitis necrotizante y las infecciones, mejora el cociente de desarrollo y disminuye la tasa de reingreso hospitalario (fuerza de la recomendación A).
CONFLICTO DE INTERESES
Los autores declaran no presentar conflicto de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: BFMF: valoración de la función motriz fina • CI: cociente intelectual • GMFCS: Gross Motor Function Classification System; sistema de valoración de la función motriz grosera • ROP: retinopatía de la prematuridad • SCPE: Surveillance of Cerebral Palsy in Europe • TDAH: trastorno por déficit de atención con hiperactividad.
BIBLIOGRAFÍA
- NICHD. Follow-up care of High Risk Infants. Pediatrics. 2004;114:1377-97.
- Wang CJ, McGlynn EA, Brook RH, Leonard CH, Piecuch RE, Hsueh SI, et al. Quality-of-care indicators for the neurodevelopmental follow-up of very low birth weight children: results of an expert panel process. Pediatrics. 2006;117:2080-92.
- Wood E, Rosenbaum P. The gross motor function classification system for cerebral palsy: a study of reliability and stability over time. Dev Med Child Neurol. 2000;42:292-6.
- Beckung E, Hagberg G. Neuroimpairments, activity limitations, and participation restrictions in children with cerebral palsy. Dev Med Child Neurol. 2002;44:309-16.
- Marin Gabriel MA, Pallás Alonso CR, de la Cruz Bértolo J, Caserío Carbonero S, López Maestro M, Moral Pumarega M, et al. Age of sitting unsupported and independent walking in very low birth weight preterm infants with normal motor developmental at 2 years. Acta Paediatrica. 2009;98:1815-21.
- McCormick MC, Stewart JE, Cohen R, Joselaw M, Osborne PS, Ware J. Follow-up of NICU graduates: Why, What and by Whom. J Intensive Care Med. 1995;10:213-25.
- Behrman RE, Stith Butler A (eds.). Preterm birth: causes, consequences, and prevention. Washington, DC: National Academies Press; 2007.
- Winter S, Autry A, Boyle C, Yeargin-Allsopp M. Trends in the prevalence of cerebral palsy in a population based study. Pediatrics. 2002;110:1220-5.
- Vincer MJ, Allen AC, Joseph KS, Stinson DA, Scott H, Wood E. Increasing prevalence of cerebral palsy among very preterm infants: a population based study. Pediatrics. 2006;118:e1621-6.
- Platt MJ, Cans C, Johnson A, Surman G, Topp M, Torrioli MG, et al. Trends in cerebral palsy among infants of very low birth weight (<1500 g) or born prematurely (<32 weeks) in 16 European centres: a database study. Lancet. 2007;369:43-50.
- Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Surveillance of Cerebral Palsy in Europe (SCPE). Dev Med Child Neurol. 2000;42(12):816-24.
- Anttila H, Suoranta J, Malmivaara A, Mäkelä M, Autti-Rämö I. Effectiveness of physiotherapy and conductive education interventions in children with cerebral palsy: a focused review. Am J Phys Med Rehabil. 2008;87:478-501.
- Anttila H, Autti-Rämö I, Suoranta J, Mäkelä M, Malmivaara A. Effectiveness of physical therapy interventions for children with cerebral palsy: a systematic review. BMC Pediatr. 2008;8:14.
- de Lissovoy G, Matza LS, Green H, Werner M, Edgar T. Cost-effectiveness of intrathecal baclofen therapy for the treatment of severe spasticity associated with cerebral palsy. J Child Neurol. 2007;22:49-59.
- Moore AP, Ade-Hall RA, Smith CT, Rosenbloom L, Walsh HP, Mohamed K, et al. Two-year placebo-controlled trial of botulinum toxin A for leg spasticity in cerebral palsy. Neurology. 2008;71:122-8.
- Dickinson HO, Parkinson KN, Ravens-Sieberer U, Schirripa G, Thyen U, Arnaud C, et al. Self-reported quality of life of 8-12-year-old children with cerebral palsy: a cross-sectional European study. Lancet. 2007;369(9580):2171-8.
- Michelsen SI, Flachs EM, Uldall P, Eriksen EL, McManus V, Parkes J, et al. Frequency of participation of 8-12-year-old children with cerebral palsy: A multi-centre cross-sectional European study. Eur J Paediatr Neurol. 2009;13:165-77.
- Beckung E, Hagberg G, Uldall P, Cans C. Surveillance of Cerebral Palsy in Europe. Probability of walking in children with cerebral palsy in Europe. Pediatrics. 2008;121:e187-92.
- O’Connor AR, Stephenson TJ, Johnson A, Tobin MJ, Moseley MJ, Ratib S, et al. Long term ophthalmologic outcome of low birth weight children with and without retinopathy of prematurity. Pediatrics. 2003;109:12-8.
- O’Connor AR, Stephenson TJ, Johnson A, Tobin MJ, Ratib S, Fielder AR. Change of refractive state and eye size in children of birth weight less than 1701g. Br J Ophthalmol. 2006;90:456-60.
- Larsson EK, Rydberg AC, Holmstrom GE. A population-based study of the refractive outcome in 10 year old preterm and full term children. Arch Ophthalmol. 2003;121:1430-6.
- Darlow BA, Clemett RS, Horwood J, Mogridge N. Prospective study of New Zealand infants with birth weight less than 1500g and screened for ROP: visual outcome at age 7-8 years. Br J Ophthalmol. 1997;81:935-40.
- Holmstrom GE, el Azzazi M, Kugelberg U. Ophthalmological follow-up of preterm infants: a population based prospective study of visual acuity and strabismus. Br J Ophthalmol. 1999; 83:143-50.
- Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicenter trial of cryotherapy for retinopathy of prematurity: preliminary results. Pediatrics. 1988;81:697-706.
- Pallás CR, de la Cruz J, Tejada P, Fernández C, Muños MC, Carreño MP. Impacto de los nuevos criterios de cribado para la retinopatía de la prematuridad. Un año de experiencia. An Esp Pediatr. 2001;55:53-7.
- Martín Begué N, Perapoch López J. Retinopatía de la prematuridad: incidencia, gravedad y seguimiento. An Pediatr (Barc). 2003;58:156-61.
- López Maestro M, Pallás CR, de la Cruz J, Pérez I, Gómez E, de Alba C. Abandonos en el seguimiento de recién nacidos de muy bajo peso y frecuencia de parálisis cerebral. An Esp Pediatr. 2002;57:354-60.
- O’Connor AR, Stewart CE, Singh J, Fielder AR. Do infants of birth weight less than 1500 g require additional long term ophthalmic follow up? Br J Ophthalmol. 2006;90:451-5.
- Williams C, Northstone K, Harrad RA, Sparrow JM, Harvey I. Amblyopia treatment outcomes after screening before or at age 3 years: follow up from randomised trial. BMJ. 2002;324:1549.
- Delgado Domínguez JJ. Detección precoz de la hipoacusia infantil. Recomendación. En: Recomendaciones PrevInfad/PAPPS [en línea] [consultado el 18-01-2012] [actualizado en octubre de 2007.]. Disponible en http://www.aepap.org/previnfad/rec_audicion.htm
- Cristobal R, Oghalai JS. Hearing loss in children with very low birth weight: current review of epidemiology and pathophysiology. Arch Dis Child Fetal Neonatal Ed. 2008;93:F462-8.
- Ari-Even Roth D, Hildesheimer M, Maayan-Metzger A, Muchnik C, Hamburger A, Mazkeret R, et al. Low prevalence of hearing impairment among very low birth weight infants as detected by universal neonatal hearing screening. Arch Dis Child Fetal Neonatal Ed. 2006;91:F257-F262.
- Robertson CMT, Watt MJ, Dinu IA. Outcomes for the extremely premature infant: What is new? And where are we going? Pediatr Neurol. 2009; 40:186-96.
- AAP. Joint Committee on Infant Hearing. Year 2007 position statement: principles and guidelines for early hearing detection and intervention programs. Pediatrics. 2007;120:898-921.
- Buttha A, Cleves M, Casey P, Cradok M, Anand K. Cognitive and behavioural outcomes of school-aged children who were born preterm. A meta-analysis. JAMA. 2002;288:728-37. Anderson P, Doyle LW. Neurobehavioral outcomes of school age children born extremely low birth weight or very preterm in the 1990s. JAMA. 2003;289:3264-72.
- Botting N, Powls A, Cooke R, Marlow N. Cognitive and educational outcome of very low birth weight children in early adolescence. Dev Med Child Neurol. 1998;40:652-60.
- Gross RT, Spiker D, Haynes C (eds.). Helping Low Birth Weight Premature Babies Palo Alto, CA: Stanford University Press; 1997.
- Reijneveld SA, de Kleine MJK, Van Baar AL. Behavioural and emotional problems in very preterm and very low birthweight infants at age 5 years. Arch Dis Child Fetal Neonatal Ed. 2006;91:F423-8.
- Indredavik MS, Vik T, Heyerdahl S, Kulseng S, Fayers P, Brubakk A. Psychiatric symptoms and disorders in adolescents with low birth weight. Arch Dis Child Fetal Neonat Ed. 2004;89:F445-50.
- Deforge H, Andre M, Hascoet JM, Fresson J, Toniolo AM. Conséquences de la grande prématurité dans le domaine visuo-spatial, á l´âge de cinq ans. Archives Pédiatrie. 2009;16:227-34.
- Litt J, Taylor HG, Klein N, Hack M. Learning disabilities in children with very low birthweight: prevalence, neuropsychological correlates, and educational interventions. J Learning Disabilities. 2005;38:130-41.
- Strang-Karlsson S, Andersson S, Paile-Hyvarinen M, Darby D, Hovi P, Räikkönen K, et al. Slower reaction times and impaired learning in youth adults with birth weight <1500. Pediatrics. 2010;125:e74-e82.
- Flacking R, Ewald U, Hedberg Nyqvist K, Starrin B. Trustful bonds: a key to “becoming mother” and to reciprocal breastfeeding. Stories of mothers of very preterm infants at neonatal unit. Soc Sci Med. 2006;62:70-80.
- Arockiasamy V, Holsti L, Albersheim S. Fathers’ experience in the neonatal intensive care unit: a search for control. Pediatrics. 2008;121:e-215-22.
- Bialoskurski M, Cox C, Hayes JA. The nature of attachment in a Neonatal Intensive Care Unit. J Perinat Neonat Nurs. 1999;13:66-77.
- Fregan L, Helseth S, Fagermoen MS. A comparision of mother’s and father’s experiences of the attachment process in a neonatal intensive care unit. J Clin Nurs. 2008;17(6):810-6.
- Yin Y, Wang R, Lee MM, Yuh Y. Mothers’ satisfaction: KC vs. traditional nursing care for premature babies. J Nurs. 2003;50(2):93-7.
- Feldman R, Weller A, Leckman JF. The nature of the mother’s tie to her infant: maternal bonding under conditions of proximity, separation, and potential loss. J Child Psychiatr. 1999;40(6):929-39.
- Spittle AJ, Orton J, Doyle LW, Body R. Programas de intervención del desarrollo después del alta hospitalaria para la prevención de los trastornos motores y cognitivos en neonatos prematuros. (Revisión Cochrane traducida). En: la Biblioteca Cochrane Plus, 2008. Numero 2. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com (traducida de The Cochrane Library, 2008 Issue 2. Chichester, UK: John Wiley&Sons, Ltd.
- Msall ME, Park JJ. The Spectrum of behavioural outcomes after extreme prematurity: regulatory, attention, social, and adaptive dimensions. Semin Perinatol. 2008;32:42-50.
- Watt NF, Ayoub C, Bradley RH (eds.). The crisis in youth mental health: Volume four, Early Interventions Programs and Policies. West-port, CT: Praeger Publishers; 2006. p. 83-88.
- Vohr BR, Poindexter BB, Dusick AM, McKinley LT, Wright LL, Langer JC, et al. NICHD Neonatal Research Network. Beneficial effects of breast milk in the neonatal intensive care unit on the developmental outcome of extremely low birth weight infants at 18 months of age. Pediatrics. 2006;118:e115-23.
- Vohr BR, Poindexter BB, Dusick AM, McKinley LT, Higgins RD, Langer JC, et al. National Institute of Child Health and Human Development National Research Network. Persistent beneficial effects of breast milk ingested in the neonatal intensive care unit on outcomes of extremely low birth weight infants at 30 months of age. Pediatrics. 2007;120:e953-9.






