Reacción adversa a paracetamol en lactante de 2 meses: importancia de los factores coadyuvantes
Sandra Llorente Pelayoa, Ana Orizaola Ingelmoa, M.ª Gabriela Vaca Recaldeb, M.ª Ángeles de Cos Cossíob, Daniel Gutiérrez Pascuala, Luis Ramón de la Rubia Fernándeza
aServicio de Pediatría. Hospital Universitario Marqués de Valdecilla. Santander. España.
bServicio de Farmacología Clínica. Hospital Universitario Marqués de Valdecilla. Santander. España.
Correspondencia: S Llorente. Correo electrónico: sandrallorentepelayo@gmail.com
Cómo citar este artículo: Llorente Pelayo S, Orizaola Ingelmo A, Vaca Recalde MG, de Cos Cossío MA, Gutiérrez Pascual D, de la Rubia Fernández LR. Reacción adversa a paracetamol en lactante de 2 meses: importancia de los factores coadyuvantes. Rev Pediatr Aten Primaria. 2022;24:e135-e139.
Publicado en Internet: 15-03-2022 - Número de visitas: 22270
Resumen
La intoxicación por paracetamol es la principal causa de intoxicación farmacológica en Pediatría. Aunque en el grupo de lactantes es menos frecuente, los menores de 2 meses presentan particularidades metabólicas que predisponen a la intoxicación por este fármaco. Presentamos el caso de una lactante de 2 meses con daño hepático secundario a intoxicación por paracetamol tras administración de una dosis terapéutica del mismo.
Palabras clave
● Hepatotoxicidad ● Intoxicación ● ParacetamolINTRODUCCIÓN
El paracetamol es el fármaco analgésico y antipirético más utilizado en la infancia en nuestro medio y también es la principal causa de intoxicación farmacológica en los menores de cinco años1. Las intoxicaciones en lactantes menores de seis meses son inusuales2,3 y tienen unas características especiales, dada la inmadurez y las peculiaridades metabólicas de esta población. Presentamos el caso de un lactante de dos meses con afectación hepática secundaria a la administración de dosis terapéutica de paracetamol.
CASO CLÍNICO
Lactante mujer de dos meses y una semana de vida, que pertenece a una familia de perfil sociocultural bajo. Consulta por un cuadro de 24 horas de febrícula de hasta 37,7 °C, asociado a irritabilidad y rechazo de tomas. Se trata de una recién nacida a término, de peso adecuado y nacida fruto de un cuarto embarazo de curso normal. Alimentada con lactancia artificial desde el nacimiento, está en seguimiento por su pediatra por estancamiento ponderal, con percentil de peso al nacimiento en P50, al mes de vida en P24, y en el momento del ingreso en P1 (3820 g, -2,28 desviaciones estándar). Se constata además una pérdida ponderal adicional de 210 g en las últimas 48 horas. Los padres refieren avidez por las tomas de forma habitual sin vómitos ni rechazo de la ingesta hasta el día previo. Deposiciones escasas de características normales, disminución del ritmo miccional. Niegan posible administración de fármacos o tóxicos y no existe ambiente epidémico en domicilio. Se detectan dificultades económicas y sociales que han causado problemas de aporte de alimentación de base (dilución de los biberones y aportes de aproximadamente la mitad de lo indicado, especialmente en las últimas semanas).
A la exploración al ingreso está afebril con polipnea (50 rpm) y resto de constantes normales. Presenta sequedad de mucosas y palidez cutánea con relleno capilar normal (<2 segundos). A nivel neurológico destaca hiporeactividad y somnolencia, con escasos movimientos espontáneos y ligera hipotonía con reflejos neonatales y osteotendinosos normales. Fontanela normotensa. Resto de exploración, incluido abdomen, sin hallazgos significativos.
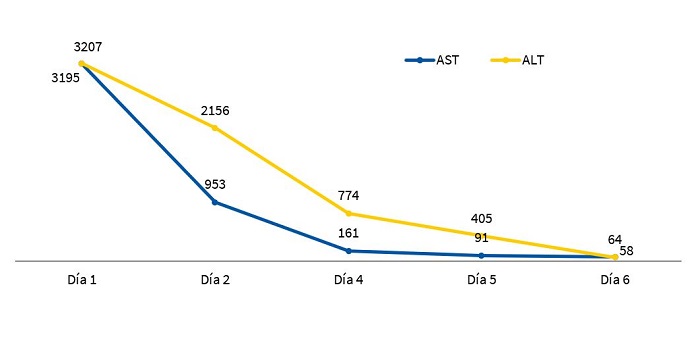
Se realiza gasometría que muestra acidosis metabólica compensada (pH 7,39, pCO2 30,9 mmHg, HCO3 20,1 mmol/l, exceso de bases -5,1 mmol/l) con lactato de 23 mg/dl; hemograma con 11 300 leucocitos con fórmula normal, hemoglobina de 11,3 mg/dl y plaquetas de 510 000/µl. En la bioquímica presenta glucosa e iones normales, con datos de insuficiencia renal prerrenal (urea 141 mg/dl, creatinina de 0,47 mg/dl) y de citólisis hepática sin colestasis (alanina aminotransferasa [ALT]: 3207 U/l, aspartato aminotransferasa [AST]: 3195 U/l, gamma glutamil transpeptidasa: 107 U/l, fosfatasa alcalina: 752 U/l, bilirrubina total: 0,8 mg/dl, directa: 0,4 mg/dl), con proteínas y albúmina en límite bajo de la normalidad, proteína C reactiva de 0,1 mg/dl y procalcitonina de 10,8 ng/ml. En la coagulación se observa un tiempo de protrombina del 48%, con un international normalized ratio (INR) de 1,69, sin otras alteraciones. Amonio de 52 µmol/l. Se recoge hemocultivo, serologías de virus hepatotropos, lavado nasofaríngeo para virus respiratorios, enterovirus y cultivo de heces. También se recoge orina para cuantificación, análisis bioquímico, urocultivo y realización de tóxicos en orina. Se recogen muestras para estudio metabólico en sangre y orina.
Dada la situación clínica se deja a dieta absoluta con sueroterapia endovenosa con aportes de glucosa e iones y se inicia antibioterapia empírica a la espera de cultivos. Se administra vitamina K endovenosa. Dado el estado neurológico alterado se inicia monitorización de función cerebral que presenta patrón continuo sin objetivarse crisis. Ecografía cerebral sin alteraciones. Punción lumbar con bioquímica y tinción de Gram negativas, pendientes cultivos.
Durante el ingreso se mantiene respiratoria y hemodinámicamente estable. Durante las primeras 24 horas presenta mejoría del estado neurológico y de los datos de azoemia, así como mejoría en los niveles de transaminasas (ALT: 2156 U/l, AST: 953 U/l) con normalización de la coagulopatía (TP: 70%, INR: 1,3). Los tóxicos en orina resultan negativos. Se obtienen de forma precoz los resultados del estudio metabólico, sin hallazgos significativos. Cifras de alfa-1-antitripsina normal para la edad. Posteriormente se reciben los resultados microbiológicos (hemocultivo, serologías de virus hepatotropos, virus respiratorios, enterovirus, urocultivo, cultivo de líquido cefalorraquídeo) que resultan negativos. Se realizan estudios de electroencefalografía y resonancia magnética, que resultan normales.
Tras reinterrogar a la familia sobre la posible administración de fármacos, tóxicos o compuestos de herbolario, refieren haber administrado 60 horas antes del ingreso, por irritabilidad, una dosis única de paracetamol, en dosis terapéutica (12 gotas de la solución 100 mg/ml, 48 mg; 12,6 mg/kg). Ya habían administrado el fármaco en alguna ocasión previa. Se solicita entonces un análisis cuantitativo de los niveles de paracetamol en una muestra de sangre obtenida el día del ingreso, en la que se observan niveles tóxicos (15,8 μg/ml) en relación con las horas postingesta (>24 horas). Dado que este resultado se obtiene a posteriori (4.º día de ingreso), no se administró N-acetilcisteína.
La evolución de la paciente fue satisfactoria, con normalización de la neuroconducta. Los datos de insuficiencia renal mejoraron con aportes endovenosos de líquidos, y se normalizaron a lo largo de la primera semana. Los datos analíticos de daño hepático se corrigieron progresivamente hasta su normalización completa al 6.º día de ingreso (Fig. 1). Se reinició alimentación por vía oral con fórmula de inicio (122 kcal/kg/día) a las 36 horas de ingreso, presentando durante las 3 semanas que permaneció ingresada una curva ponderal ascendente (peso al alta P10-25). Tras el alta continúa seguimiento estrecho por parte de asistencia social, Pediatría de Atención Primaria y consulta de Neonatología, con buena evolución.
| Figura 1. Evolución temporal de los niveles de transaminasas (U/l) en paciente de 2 meses con intoxicación por paracetamol |
|---|
 |

DISCUSIÓN
El paracetamol es un fármaco con metabolismo hepático en el que participan tres vías metabólicas: la sulfatación, la glucoronización y la oxidación microsomal en el citocromo p450. Cuando se administra una dosis terapéutica, más del 90% del fármaco se metaboliza a través de las dos primeras vías, y aproximadamente el 5% es metabolizado por el citocromo P450, produciéndose N-acetil-benzoquinoinaina (NAPQ1), metabolito hepatotóxico, que habitualmente se conjuga con el glutatión y se elimina vía renal. Cuando se administran dosis tóxicas, las dos primeras vías se saturan y aumenta la producción de NAPQ1 que, cuando las reservas de glutatión se agotan, se liga a macromoléculas hepáticas produciendo necrosis centrolobulillar1-5.
La clínica característica cursa en fases, inicialmente se presenta con síntomas inespecíficos como anorexia, vómitos y palidez en primeras 24 horas, progresando en las siguientes 24-48 horas hacia fallo hepático con dolor en hipocondrio derecho, alteración de pruebas de función hepática y oliguria, con máxima alteración generalmente en torno al 3.º-4.º día y resolución progresiva con normalización de pruebas de función hepática entre los 4 días y las 2 semanas tras la ingesta.
En la actualidad se considera dosis potencialmente tóxica la que supera los 200 mg/kg en lactantes mayores de 6 meses y a partir de 8 gramos en adolescentes y adultos sanos1. No obstante, existen factores que aumentan la susceptibilidad a la intoxicación1,4,5 entre los que se describen diferencias hereditarias en la actividad enzimática, tratamiento con inductores del CYP450 (isoniazida, rifampicina, fenobarbital, fenitoína, carbamazepina, etc.), fármacos que enlentecen el vaciado gástrico y aumentan la absorción (opioides, anticolinérgicos), malnutrición, caquexia, fallo de medro, trastornos alimentarios, hepatopatía de base, alcoholismo, fibrosis quística e infección por virus de la inmunodeficiencia humana. Además, también tienen mayor susceptibilidad a la intoxicación los neonatos y lactantes menores de seis meses1-3.
Los neonatos y lactantes menores de seis meses son especialmente susceptibles por su inmadurez metabólica. El hígado del neonato contiene menor número de hepatocitos (20% inferior al adulto), y con menor capacidad biotransformante6. En cuanto a las vías de metabolización para el paracetamol, se considera que tiene una adecuada capacidad de sulfatación; sin embargo, el lactante no desarrolla la capacidad total de acetilación hasta los 20 días y la de glucoronoconjugación hasta los dos meses de vida6-8. Por este motivo, en los lactantes menores de dos meses se recomienda considerar potencialmente tóxicas dosis superiores a 75 mg/kg y en lactantes de 2-6 meses las superiores a 150 mg/kg1. Además, se debe de tener en cuenta que el aclaramiento de paracetamol es más bajo en los recién nacidos que en los niños y adultos, prolongando su vida media3,8, lo que puede favorecer la toxicidad por acumulación de dosis repetidas.
La paciente presenta a su ingreso analítica de fallo renal en probable relación con deshidratación aguda y evidentes signos clínicos de malnutrición crónica. Es conocido que estos pacientes son especialmente susceptibles a la deshidratación y malnutrición en contexto de enfermedades intercurrentes, factores que pueden aumentar la potencial toxicidad del paracetamol2. Se ha sugerido que la malnutrición puede aumentar la toxicidad del paracetamol, posiblemente debido a la mayor acumulación de NAPQ1 que se produce en su metabolismo a través de la vía del CYP450. Por otro lado, se ha observado depleción de glutatión en casos de desnutrición crónica5,9.
En nuestro caso confluyen tres factores determinantes de una mayor susceptibilidad a la intoxicación por paracetamol como son la edad, la desnutrición crónica por falta de aportes; y una noxa desencadenante no constatada (probablemente una infección banal) que conduce a una situación de deshidratación. En este contexto, la administración de paracetamol a dosis terapéuticas ha podido generar la toxicidad hepática observada.
Se trata pues de un caso complejo, fundamentalmente debido a la falta de información inicial, que hizo plantear el diagnóstico diferencial con una enfermedad metabólica de base y sepsis asociada. Dado que los niveles en sangre eran superiores a 15 μg/ml tras más de 48 horas de la supuesta administración, se supone que el pico en las primeras 24 horas podría haber sido mucho más elevado. A pesar de las dudas que puedan quedar sobre la dosis realmente administrada, consideramos posible que, en nuestra paciente, por la convergencia de los diversos factores coadyuvantes descritos, nos encontremos ante un caso de toxicidad real por paracetamol, pese a haberse administrado a su dosis adecuada.
Como conclusión, queremos destacar la especial sensibilidad de los lactantes menores de seis meses (en los que confluyen factores como la desnutrición y deshidratación, entre otros) a la intoxicación por paracetamol, lo que requiere un uso cauteloso por parte de pediatras y cuidadores, evitando errores de dosificación, así como su uso repetido o indiscriminado. Además, y de acuerdo con otros autores10, creemos que es necesario valorar la intoxicación por paracetamol, mediante anamnesis exhaustiva a los padres y determinación de niveles plasmáticos, ante la presencia de fallo hepático con alteraciones de conciencia en pacientes de este rango de edad.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
ALT: alanina aminotransferasa · AST: aspartato aminotransferasa · CYP450: citocromo P450 · INR: International normalized ratio · NAPQ1: N-acetil-benzoquinoinaina.
BIBLIOGRAFÍA
- Mintegi S. Grupo de Trabajo de Intoxicaciones de la Sociedad Española de Urgencias de Pediatría. Manual de intoxicaciones en Pediatría. 2012. 3.ª edición. p. 119-132.
- Fernández Landaluce A, Mintegi Raso S, Martínez González MJ. Intoxicación por paracetamol en menores de 6 meses: error de dosificación. An Pediatr (Barc). 2004;60:177-9.
- Figueroa-Uribe AF, Pérez-Sandoval LL. Sobredosis de paracetamol en un recién nacido: reporte de un caso. Rev Mex Pediatr. 2017;84:66-71.
- Heard KJ. Acetylcysteine for acetaminophen poisoning. N Engl J Med. 2008;359:285-92.
- Molina-Ortiz D, Camacho-Carranza R, Domínguez-Ramírez AM, Vences-Mejía A. Modulación de la expresión de enzimas del citocromo P450 hepáticas durante las etapas fetal y pediátrica. Rev Educ Bioquimica. 2012;31:60-71.
- Flórez J, Armijo JA, Mediavilla A. Farmacología humana. 2.ª edición. Barcelona: Masson-Salvat Medicina, 1993; p. 112-3.
- Pacici GM, Allegaert K. Clinical pharmacology of paracetamol in neonates: a review. Curr Ther Res Clin Exp. 2014;77:24-30.
- Ward RM, Bates BA, Benitz WE, Burchfield DJ, Ring JC, Walls RP, et al. Acetaminophen toxicity in children. Pediatrics. 2001;108:1020-4.
- Mitchell JR, Jollow DJ, Potter WZ, Gillette JR, Brodie BB. Acetaminophen-induced hepatic necrosis. IV. Role of glutathione. J Pharmacol Exp Ther. 1973;187:211-21.
- Arnáiz Solís J, Avilla Hernández JM, Garrido Borreguero E, Cuñarro Alonso A. Presentación atípica en la intoxicación aguda por paracetamol. An Pediatr (Barc). 2005;63:457-68.
Comentarios
Este artículo aún no tiene comentarios.






