Vol. 22 - Num. 87
Casos clínicos en Digestivo
Disfagia secundaria a arteria subclavia derecha aberrante
Elima Pérez de Diegoa, David Recio Arcauza, Belén Huguet Rodríguezb, Iván Carabaño Aguadoa, David Coca Robinotc, Enrique Salcedo Lobatoa, Enrique Medina Beníteza
aSección de Gastroenterología, Hepatología y Nutrición Pediátrica. Servicio de Pediatría. Hospital Universitario 12 de Octubre. Madrid. España.
bSección de Gastroenterología, Hepatología y Nutrición Infantil. Servicio de Pediatría. Hospital Universitario 12 de Octubre. Madrid. España.
cSección de Radiología Infantil. Servicio de Radiodiagnóstico. Hospital Universitario 12 de Octubre. Madrid. España.
Cómo citar este artículo: Pérez de Diego E, Recio Arcauz D, Huguet Rodríguez B, Carabaño Aguado I, Coca Robinot D, Salcedo Lobato E, et al. Disfagia secundaria a arteria subclavia derecha aberrante. Rev Pediatr Aten Primaria. 2020;22:305-9.
Publicado en Internet: 22-09-2020 - Número de visitas: 16489
Resumen
El arco aórtico izquierdo con arteria subclavia derecha aberrante (ARSA) es la anomalía más frecuente del arco aórtico. El diagnóstico prenatal mediante ecocardiografía ha permitido su diagnóstico precoz, pero sigue siendo generalmente un diagnóstico incidental. La mayoría de los casos son asintomáticos, pero una proporción de pacientes cursa con disfagia de predominio para sólidos. En menor medida puede provocar fallo de medro o clínica respiratoria por compresión extrínseca de la vía aérea. El diagnóstico se suele realizar mediante estudio esófago-gastroduodenal con contraste baritado, y otras técnicas útiles son la tomografía computarizada (TC) y la resonancia magnética (RM) con angiografía, así como el ecocardiograma con Doppler color. El tratamiento de elección en pacientes sintomáticos es la cirugía.
Palabras clave
● Arco aórtico ● Arteria subclavia ● Disfagia ● VascularINTRODUCCIÓN
La arteria subclavia derecha aberrante (ARSA) con arco aórtico izquierdo es la anomalía congénita más frecuente del arco aórtico, con una incidencia estimada del 0,5% en la población general. En la mayoría de los casos cursa de forma asintomática, pero en algunos pacientes puede provocar la compresión extrínseca de estructuras adyacentes, como el esófago, y manifestarse con disfagia.
CASO CLÍNICO
Niña de ocho años, derivada a consultas de Gastroenterología Infantil por su pediatra de Atención Primaria. Consulta por un cuadro de disfagia episódica desde hace varios meses. Cursa clínicamente con sensación de dificultad para la progresión del bolo al ingerir sólidos, sin dolor retroesternal asociado, y atragantamientos ocasionales con posterior emisión de lo ingerido. No episodios de impactación. Entre episodios se encuentra asintomática. Dolor abdominal muy ocasional, en relación con disquecia.
Como antecedente de interés, presenta un anillo vascular incompleto, con arteria subclavia derecha aberrante y arco aórtico izquierdo (diagnóstico prenatal), sin repercusión cardiológica.
La exploración física es normal, con adecuado desarrollo ponderoestatural. Se realiza un estudio esófago-gastroduodenal con contraste baritado, en el que se pone de manifiesto una impronta sobre la pared posterior de la porción torácica del esófago, en relación con diagnóstico ya conocido de arteria subclavia derecha aberrante (Figs. 1, 2 y 3).
| Figura 1. Estudio esófago-gastroduodenal con contraste baritado. Proyección anteroposterior. Se observa la impronta oblicua de la arteria subclavia derecha aberrante (ARSA) en el tercio medio esofágico |
|---|
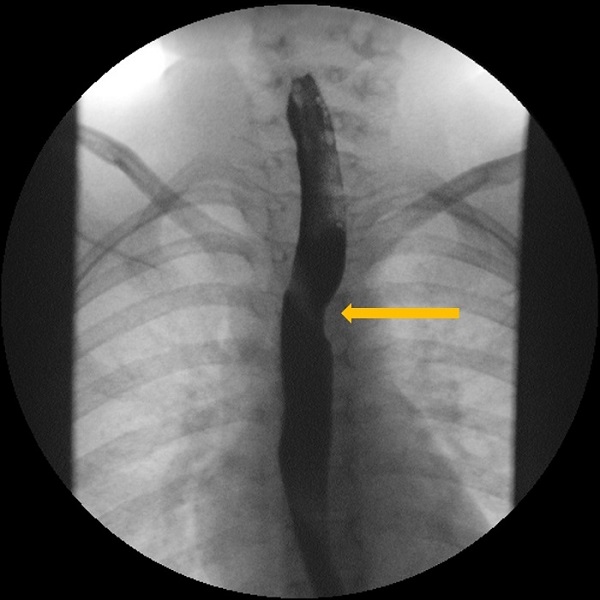 |

| Figura 2. Estudio esófago-gastroduodenal con contraste baritado. Proyección anteroposterior. Se observa la impronta oblicua de la arteria subclavia derecha aberrante (ARSA) en el tercio medio esofágico y la ralentización del flujo del contraste baritado a su través |
|---|
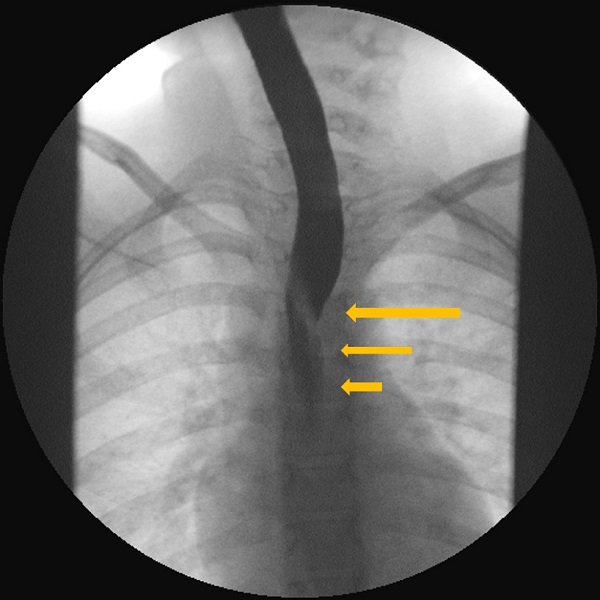 |

| Figura 3. Estudio esófago-gastroduodenal con contraste baritado. Proyección lateral. Se identifica la indentación en la pared posterior del tercio medio del esófago |
|---|
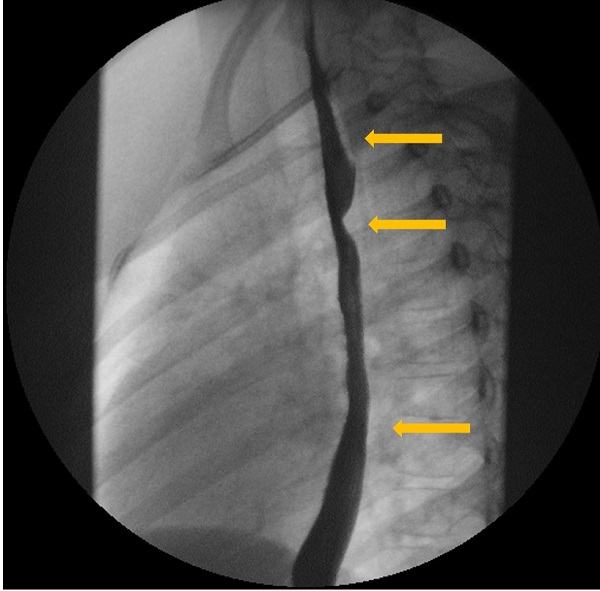 |

Se inicia seguimiento de la paciente en consultas de Gastroenterología Infantil. Mejoría espontánea inicial de la disfagia con modificaciones conductuales (ingesta de trozos pequeños, masticación profusa y tranquila), por lo que se decide actitud expectante por el momento.
DISCUSIÓN
Recuerdo embrionario
Durante el desarrollo embrionario, las estructuras vasculares sufren una serie de transformaciones secuenciales hasta dar la anatomía definitiva. Inicialmente coexisten dos arcos aórticos: uno derecho y otro izquierdo, en espejo; de cada uno de ellos surgen, proximalmente, la carótida; y distalmente, las subclavias ipsilaterales. Después, ocurre una regresión de la región distal a la subclavia del arco derecho, y el arco proximal derecho con carótida y subclavia derechas forman el tronco braquiocefálico derecho. El arco izquierdo no sufre regresión, y en su zona proximal nacen la carótida y la subclavia izquierdas. Su región distal da lugar a la aorta descendente, por lo que esta se sitúa a la izquierda1-9.
La arteria subclavia derecha aberrante con arco aórtico izquierdo ocurre cuando el arco aórtico derecho distal no sufre regresión, por lo que la subclavia derecha nace de la aorta descendente, y es la cuarta y última rama del arco áortico1,6,7. Por tanto, no existe tronco braquiocefálico derecho, sino que la primera rama del arco aórtico es directamente la carótida derecha y la subclavia derecha está separada del arco aórtico ascendente.
De los pacientes que padecen ARSA, el 3-15% presentan un origen más dilatado que el resto de su trayecto, denominado divertículo de Kommerel1,7,9.
Diagnóstico prenatal
En los últimos años el avance del diagnóstico ecográfico fetal, y en concreto de la ecocardiografía con Doppler color, con la introducción del plano 3VT por Yagel, ha permitido el diagnóstico prenatal de las anomalías del arco aórtico y sus ramas en el segundo y tercer trimestre de gestación7, y demostrar que la ARSA con arco aórtico izquierdo es la más frecuente7,8.
Se estima una incidencia del 0,5% en la población general1, 3, 7, con predominio femenino en una relación 3:23,6,7, pero su diagnóstico prenatal en los últimos años ha puesto de manifiesto su asociación con otras malformaciones tanto intra- como extracardiacas7. Entre las asociaciones intracardiacas existen defectos septales, lesiones obstructivas del corazón izquierdo o anomalías conotruncales1,7,9. El nervio laríngeo no recurrente derecho inferior es una constante en estos pacientes1,6,9. Recientemente, se ha evaluado la asociación de ARSA con síndrome de Down, ya que existe una incidencia aumentada en los pacientes con esta alteración genética, y se postula que podría ser empleado como marcador de diagnóstico fetal de cromosomopatía6,7.
Manifestaciones clínicas
Clásicamente, el diagnóstico de ARSA ha sido incidental en la edad adulta, ya que la mayoría de los pacientes cursan de forma asintomática5,6,8. En una serie de casos con seguimiento longitudinal se ha observado que los pacientes con ARSA aislada presentan un peso y talla más bajos al nacimiento, aunque el ritmo de crecimiento es comparable a la población general3. Al no suponer un anillo vascular completo, los fenómenos de compresión no son tan frecuentes como en otras anomalías del arco aórtico1,8. Sin embargo, en ocasiones sí que puede provocar sintomatología, incluso en periodo neonatal. La clínica de debut más habitual es la disfagia, secundaria habitualmente a la compresión del esófago en su tercio medio, ya que la mayoría de las veces la ARSA lleva un trayecto retroesofágico1,6.
La deglución consta de tres fases (oral, faríngea y esofágica), y la alteración de cada una cursa con una sintomatología específica, aunque pueden presentarse en combinación. La disfagia orofaríngea suele manifestarse con atragantamientos, arcadas o tos con la ingesta de sólidos o líquidos, y además neumonía recurrente por aspiración o estridor. En cambio, la disfagia esofágica se presenta como sensación de no progresión del bolo alimenticio, con dolor, ardor o presión retroesternal, y habitualmente buena tolerancia a líquidos2. En los pacientes con ARSA, al deberse a compresión esofágica, típicamente se trata de una disfagia para sólidos. Además, cursa con impactación y rumiación5, rechazo a la ingesta de sólidos y prolongación del tiempo de ingesta (por enlentecimiento en la progresión del bolo)8. En lactantes suele describirse como un cuadro de regurgitación con irritabilidad, por lo que a menudo se diagnostica de enfermedad por reflujo gastroesofágico, sin mejoría con inhibidores de la bomba de protones o antisecretores2. Al alcanzar la edad de introducción de la alimentación complementaria pueden presentar un empeoramiento clínico, con rechazo de la ingesta, e incluso retraso ponderoestatural2,8.
Se postula que, en casos asintomáticos, la clínica puede aparecer cuando el divertículo de Kommerell aumenta de tamaño, o por aterosclerosis secundaria1,6,8, así como con procedimientos como intubación orotraqueal o ecografía transesofágica4,6.
En caso de que el trayecto de la ARSA sea entre esófago y tráquea, puede provocar además estridor, tos crónica o episodios de dificultad respiratoria similares a la traqueomalacia, por compresión extrínseca traqueal1,6,8.
En raras ocasiones se han descrito complicaciones, principalmente relacionadas con la dilatación aneurismática, como isquemia del miembro superior derecho por embolización, fistulización esofágica o compresión local, que se puede manifestar como síndrome de vena cava superior, además de la ruptura aneurismática1,7.
Diagnóstico posnatal
Ante un paciente con disfagia, debemos realizar una anamnesis cuidadosa que incluya antecedentes familiares y personales, incluyendo la historia prenatal, ya que en la actualidad el estudio ecográfico durante la gestación puede identificar la entidad. La exploración física de rutina ha de realizarse en todo paciente, incluyendo la antropometría, puesto que en casos graves la dificultad para la deglución puede suponer un retraso ponderoestatural, al comprometer la ingesta. Sin embargo, el resto de la exploración física no suele revelar otros estigmas2,9. En niños pequeños que aún no pueden expresar su sintomatología verbalmente, el primer paso ha de ser la observación de una comida, para tratar de identificar el patrón de predominio orofaríngeo o esofágico2.
Para el diagnóstico se sigue empleando el estudio esófago-gastroduodenal con contraste baritado como primera línea6, ya que permite poner de manifiesto la compresión extrínseca del esófago. La imagen típica consiste en un defecto de repleción oblicuo en la porción posterior del esófago, a nivel del arco aórtico, que se dirige cefálicamente de izquierda a derecha y que puede ser pulsátil1. Otras técnicas de imagen útiles son la tomografía computarizada (TC) y la resonancia magnética (RM) con angiografía, que permiten incluso la reconstrucción tridimensional de la anomalía vascular6. En la ecocardiografía-Doppler se pueden evaluar los troncos de salida del arco aórtico6,7. Para el diagnóstico diferencial, a menudo se realiza una endoscopia digestiva alta, que permite la visualización macroscópica de la mucosa y la recogida de biopsias para descartar esofagitis de diversa índole5, pero también permite poner de manifiesto en ocasiones la compresión extrínseca en la pared posterior del tercio medio del esófago por la ARSA2.
Tratamiento
En los casos asintomáticos-paucisintomáticos no se recomienda ninguna acción terapéutica3,8, salvo recomendaciones conductuales como ingesta de trozos más pequeños con masticación profusa5 y seguimiento a largo plazo para detectar empeoramiento clínico y fracaso ponderoestatural de forma precoz. En pacientes con disfagia progresiva, especialmente niños, es de elección la corrección quirúrgica, que además permite prevenir la dilatación aneurismática progresiva en los pacientes que presenten divertículo de Kommerell. La técnica de elección consiste en la sección y reinserción de la ARSA a nivel de la arteria carótida común derecha5,10, con una alta tasa de éxito y resolución de los síntomas5,8. Originalmente no se reinsertaba la ARSA, dejando el flujo sanguíneo del miembro superior derecho dependiente de colaterales desde la carótida derecha. No obstante, se ha de tener en cuenta que, a mayor edad, mayor riesgo de síndrome de robo de la subclavia1,8. En pacientes no candidatos a cirugía se puede plantear la dilatación endoscópica del esófago, aunque en la mayoría de los casos requiere de intervenciones periódicas10.
CONCLUSIÓN
La ARSA con arco aórtico izquierdo es una causa de disfagia para sólidos que ha de tenerse en cuenta a la hora del diagnóstico diferencial en la población pediátrica. Solo los pacientes sintomáticos requieren intervención terapéutica, pero se recomienda el seguimiento periódico de todos los pacientes para detectar de forma precoz el debut clínico.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
ARSA: arteria subclavia derecha aberrante · RM: resonancia magnética · TC: tomografía computarizada.
BIBLIOGRAFÍA
- Myers PO, Fasel JH, Kalangos A, Gailloud P. Arteria lusoria: developmental anatomy, clinical, radiological and surgical aspects. Ann Cardiol Angiol. 2010;59:147-54.
- Erami C, Charaf-Eddine A, Aggarwal A, Rivard AL, Giles HW, Nowicki MJ. Dysphagia lusoria in an infant. J Pediatr. 2013;162:1289-90.
- Jan SL, Lin MC, Chan SC. Mid-term follow-up study of neonatal isolated aberrant right subclavian artery. Cardiol Young. 2018;28:1024-30.
- Garg V, Joshi R, Joshi R. Compression of undiagnosed aberrant right subclavian artery during transesophageal echocardiography probe insertion. Ann Card Anaesth. 2012;15:233-5.
- Blanquicett C, Dunn T, Nanda A, Weber F. An uncommon cause of dysphagia in a 35 year old male. Pract Gastroenterol. 2017;41:40-2.
- Natsis K, Didagelos M, Gkiouliava A, Lazaridis N, Vyzas V, Piagkou M. The aberrant right subclavian artery: cadaveric study and literature review. Surg Radiol Anat. 2017;39:559-65.
- Song MJ, Han BH, Kim YH, Yoon SY, Lee YM, Jeon HS, et al. Prenatal diagnosis of aberrant right subclavian artery in an unselected population. Ultrasonography. 2017;36:278-83.
- Darwazah AK, Eida M, Khalil RA, Ismail H, Hanbali N. Non-aneurysmal aberrant right subclavian artery causing dysphagia in a young girl: challenges encountered using supraclavicular approach. J Cardiothorac Surg. 2015;10:92.
- Epstein DA, Debord JR. Abnormalities associated with aberrant right subclavian arteries-a case report. Vasc Endovascular Surg. 2002;36:297-303.
- Sadeghian H, Moritz TA. Dysphagia of aberrant right subclavian artery treated by endoscopic dilation: an alternative to surgical treatment in select cases-A case report. Int J Surg Case Rep. 2020;66:118-21
Comentarios
Este artículo aún no tiene comentarios.





