Prevalencia de las enfermedades alérgicas en niños parasitados. Reporte negativo de causalidad
Elías I. Ibrahim Kassissea, José Surga Félixb, Joselit Torres Bermúdezc, Jorge Elías Kassissed
aServicio de Neumología Infantil. Hospital Dr. Santos Aníbal Dominicci. Carúpano. Estado Sucre. Venezuela. Hospital Clínico Herminda Martín. Chillán. Región del Ñuble. Chile .
bMIR. Posgrado de Puericultura y Pediatría. Sahuapa. Cumaná. Estado de Sucre. Venezuela.
cPediatra inmunólogo. Sociedad Venezolana de Alergia, Asma e Inmunología. Caracas. Venezuela.
dMédico rural. Hospital tipo I Dr. Alberto Musa Yibirin. El Pilar. Estado de Sucre. Venezuela. CESFAM Villa Prat. Sagrada Familia. Curicó. Región del Maule. Chile.
Correspondencia: EII Kassisse. Correo electrónico: ekassisse@gmail.com
Cómo citar este artículo: Kassisse EII, Surga Félix J, Torres Bermúdez J, Kassisse JE. Prevalencia de las enfermedades alérgicas en niños parasitados. Reporte negativo de causalidad. Rev Pediatr Aten Primaria. 2020;22:e111-e119.
Publicado en Internet: 24-07-2020 - Número de visitas: 8298
Resumen
Introducción: el estudio de la relación entre las parasitosis intestinales y las enfermedades atópicas, como el asma o la rinoconjuntivitis, ha arrojado resultados contradictorios. El objetivo de este estudio fue evaluar la relación existente entre la parasitosis intestinal y la prevalencia de las enfermedades atópicas.
Material y métodos: se realizó un estudio observacional, transversal de campo, en niños mayores de 2 años, cuyos padres contestaron los cuestionarios para investigación de prevalencia de enfermedades atópicas. A todos los niños seleccionados les fueron realizados exámenes seriados de heces y pruebas alérgicas cutáneas. El análisis estadístico se realizó por medio de la prueba de χ2, asimismo se calcularon las razones de riesgo (odds ratio [OR]) y los intervalos de confianza del 95% (IC 95). Se consideró de significancia estadística cuando p <0,05.
Resultados: fueron evaluados 185 niños, la edad fue 6,82 ± 2,69 años, el 52% fueron masculinos, el 94% se ubicaron entre los estratos sociales III/IV. La prevalencia de cualquier enfermedad atópica fue del 41% y la reactividad en piel del 43%, la detección de cualquier parásito se hizo en el 47% de todos los niños. Se encontró relación con significación entre el cuestionario ISAAC y la prueba cutánea (p = 0,000). No se encontró asociación entre prueba cutánea y parasitosis intestinal (p = 1,29), así como tampoco entre los resultados de ISAAC y parasitosis (p = 0,447).
Conclusión: el estudio permitió considerar que la condición alérgica no guarda relación con el diagnóstico de la parasitosis.
Palabras clave
● Asma ● Atopia ● Helmintiasis ● Parasitosis ● Pruebas cutáneasINTRODUCCIÓN
Las prevalencias de las enfermedades alérgicas como el asma, la rinoconjuntivitis (RC) o el eccema atópico (EA) en el trópico han sido consideras tan altas como en otras regiones del mundo, muchos factores de riesgo son comunes tanto para las zonas tropicales como las templadas; sin embargo, hay dos condiciones de riesgo que las hacen distintas: primero, la exposición perenne a los ácaros del polvo doméstico y segundo las infecciones por helmintos1.
El efecto que tienen las condiciones de vida y las infecciones en la prevención de la atopia y el asma es lo que se ha denominado hipótesis de la higiene y se ha basado en la relación inversa encontrada entre las infecciones en la infancia y la prevalencia de estas enfermedades2,3.
Los factores de riesgo ambientales, considerados mayormente relacionados con la hipótesis de la higiene, han sido la residencia rural, que incluye la actividad relacionada con la agricultura y exposición a animales y las infecciones con parásitos4,5.
Las infecciones por helmintos ocurren frecuentemente por los geohelmintos, donde se incluyen Ascaris lumbricoides, Trichuris trichiura y los ancylostomas (Necator americanus y Ancylostoma duodenalis); estos agentes poseen una distribución mundial, estimándose que aproximadamente un cuarto de la población mundial pudiera estar infectada6.
Los helmintos poseen antígenos que estimulan la respuesta inflamatoria alérgica por parte del huésped, que está asociada a una elevada producción de IgE y de citoquinas predominantemente IL-4, IL-5 y IL-13, lo cual caracteriza una respuesta inmunológica Th2, que genera una respuesta inflamatoria con elevada carga eosinofilica7.
La interacción existente ente helmintos y la atopia está condicionada por múltiples factores, entre los que se pueden mencionar, el tiempo y la duración de la primera infección, la intensidad de la infección, los factores genéticos del huésped y el tipo de parásito8,9.
La asociación entre parasitosis intestinales y enfermedades alérgicas no ha sido del todo establecida y continúa aun siendo contradictoria; por un lado, han sido relacionadas como factores protectores al desarrollo de las enfermedades alérgicas y por otro se señala que la alta carga parasitaria es un factor de riesgo y contribuye a la alta prevalencia del asma y de las otras enfermedades alérgicas en la infancia10-12. Esta relación igualmente ha sido estudiada para protozoarios como por ejemplo G. lamblia13.
El objetivo de este estudio es establecer la relación existente entre las parasitosis intestinales y las enfermedades atópicas en un grupo de niños escolares de un área urbana.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional, transversal de campo, en la comunidad educativa EB Federal Sucre del Municipio Sucre, estado Sucre, Venezuela, durante el periodo escolar del 1 de octubre de 2016 al 30 de julio de 2017.
Se incluyeron todos aquellos niños mayores de dos años cuyos padres respondieron el formulario para determinar la prevalencia de enfermedades alérgicas y a los cuales se les realizó examen de heces seriado.
Fueron excluidos del estudio los alumnos que habían ingerido algún antihelmíntico o cualquier otro antiparasitario en las últimas cuatro semanas, si no eran estudiantes regulares de la comunidad educativa o si habían ingerido algún antihistamínico en los últimos siete días previos a la realización de las pruebas de reactividad en piel.
De cada individuo se recolectaron tres muestras seriadas de heces en días sucesivos, en recipientes plásticos con tapa, limpios y debidamente rotulados con nombre y edad del paciente, los cuales fueron trasladados de forma inmediata al laboratorio en cajas refrigeradas, ya que no se contaba con soluciones fijadoras inmediatas, a una temperatura que oscilaba entre los 2 y los 6 °C, para su análisis respectivo.
La identificación coproparasitológica se realizó mediante análisis directo en solución salina al 0,9% y lugol al 1%. Se consideró positiva la identificación de cualquier forma tanto para helmintos como protozoarios.
La prevalencia del asma se estimó mediante la aplicación del cuestionario del Programa Internacional de Asma y Alergia en Niños (ISAAC en inglés), validado para el idioma español, de acuerdo con las preguntas 1 y 2 de ISAAC, “¿Sibilancias en el pasado o en los últimos 12 meses?”14.
La prevalencia de la rinoconjuntivitis también se estimó utilizando el cuestionario ISAAC fase 3 aplicado en América Latina, la presencia de rinitis alérgica se consideró positiva cuando las respuestas fueron afirmativas a las preguntas: “¿En los últimos 12 meses, tiene usted (tiene su hijo) problemas con estornudos o una nariz que moquea o bloqueada, cuando usted (él o ella) no tenía un resfriado o la gripe?” y “¿En los últimos 12 meses, este problema en la nariz ha estado acompañado por ojos llorosos y con picazón?”15.
De la misma manera, el cuestionario ISAAC en la fase 3 en idioma español fue utilizado para determinar la presencia de eccema, las respuestas afirmativas se tomaron como un índice de prevalencia: “¿Ha tenido (su hijo) esta erupción con picazón en cualquier momento en los últimos 12 meses?” y “¿Este sarpullido con picazón afectó en algún momento a alguno de los siguientes lugares: los pliegues de los codos, detrás de las rodillas, delante de los tobillos, debajo de las nalgas o alrededor del cuello, las orejas o los ojos?”16.
La determinación del estado alérgico se hizo por medio de test del pinchazo, skin prick test (SPT) (Inmunotek®, Madrid, España), que contenía una cantidad de alérgenos estandarizada, diluidos en glicerina al 50% y fenol al 0,5%, para el control positivo se usó histamina y para el negativo solución salina al 0,9%; para las pruebas se usaron alérgenos de Dermatophagoides, Blomia tropicalis, hongos, gato, perro, mosquito, cucaracha (Periplaneta americana), trigo, pescado blanco, pescado azul, naranja, cacao, clara de huevo, yema de huevo, leche de vaca y mariscos. La lectura se realizó siguiendo los estándares internacionales recomendados. A los 15 minutos de aplicar el antígeno, se midió la pápula y se consideró positiva si era igual o mayor a su control respectivo, los resultados se expresaron de forma cualitativa: + = <½ control; ++ = ½ control; +++ = control; ++++ = > control; y +++++ = 3 veces el control17.
La estratificación socioeconómica de la población en estudio se determinó aplicando la escala de Graffar-Méndez18.
Se efectuaron estadísticas descriptivas (medias, rangos y desviaciones estándar) además de análisis de χ2 y se calculó el riesgo (odds ratio [OR]), se consideró como significancia estadística p <0,05.
El estudio fue evaluado y aprobado por la Comisión de Estudio de Posgrado del Hospital Antonio Patricio de Alcalá, quien reconoció los aspectos éticos ajustados a la Declaración de Helsinki. De todos los pacientes se solicitó consentimiento informado.
RESULTADOS
Doscientos ochenta y cuatro cuestionarios fueron distribuidos, 185 fueron devueltos con toda la información requerida (65%), se excluyeron siete por no completar los estudios seriados de heces y 48 por no asistir el día de la realización de las pruebas cutáneas, por lo tanto, la muestra analizada objeto del estudio fueron 130 niños.
La edad promedio fue de 6,82 ± 2,69 años, la prevalencia global para cualquiera de las enfermedades atópicas fue del 41%, la detección de cualquier parásito se hizo en el 47% de todos los niños. Los datos están resumidos en la Tabla 1.
| Tabla 1. Características generales de la población estudiada | |||||||
|---|---|---|---|---|---|---|---|
| Variables* | Parasitosis | ||||||
| Parasitados (n = 61) |
No parasitados (n = 69) |
Total (n = 130) |
OR | IC | p | ||
| Edad (años) | 6,66 ± 2,704 (3-12) |
7,02 ± 2,692 (3-12) |
6,82 ± 2,698 (3-12) |
||||
| Sexo | Masculino | 40 (30,8) | 28 (21,5) | 68 (52,3) | 2,789 | 1,366-5,696 | 0,005 |
| Femenino | 21 (16,2) | 41 (31,5) | 62 (47,7) | ||||
| Escala de Graffar | I | 0 (0) | 0 (0) | 0 (0) | |||
| II | 1 (0,8) | 6 (4,6) | 7 (5,4) | ||||
| III | 32 (24,6) | 44 (33,8) | 76 (58,5) | 0,627 | 0,311-1,266 | 0,215 | |
| IV | 28 (21,5) | 19 (14,6) | 47 (36,2) | 2,233 | 1,076-4,632 | 0,044 | |
| V | 0 (0) | 0 (0) | 0 (0) | ||||
| Test ISAAC | Positivo | 20 (15,4) | 33 (25,4) | 53 (40,8) | 0,532 | 0,261-1,086 | 0,108 |
| Negativo | 41 (31,5) | 36 (27,7) | 77 (59,2) | ||||
| Grupo etario | Preescolar | 20 (15,4) | 21 (16,2) | 41 (31,5) | 0,083 | ||
| Escolar | 41 (31,5) | 48 (36,9) | 89 (68,5) | ||||
| Prick test | Positivo | 22 (16,9) | 34 (26,2) | 56 (43,1) | 0,581 | 0,287-1,174 | 0,157 |
| Negativo | 39 (30) | 35 (26,9) | 74 (56,9) | ||||
| Total | 61 (46,9) | 69 (53,1) | 130 (100) | ||||

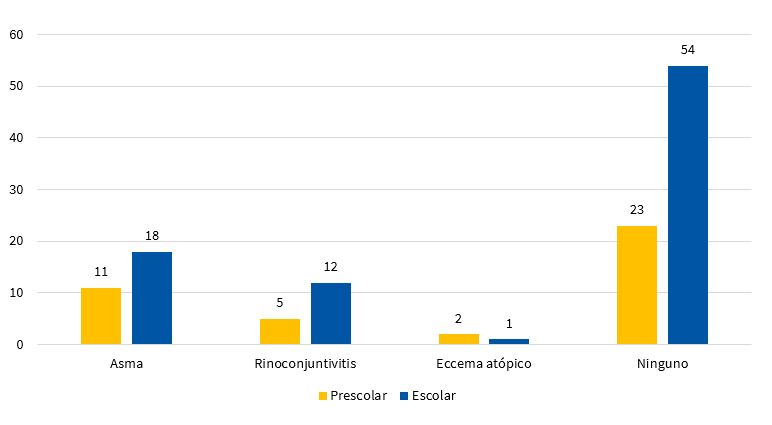
La prevalencia del asma fue del 22,3%, y la de RC fue del 13,1%, en ambas el porcentaje se incrementó con la edad, mientras que el EA fue del 2,4%. La combinación de estas enfermedades solo estuvo presente en el 3% de los niños (Fig. 1).
| Figura 1. Resultados del cuestionario ISAAC y su relación con el grupo de edad. Prevalencia del asma del 22,3% |
|---|
 |

La prueba en piel fue positiva en 56 niños, esto es una prevalencia del 43,1%, la mayoría correspondió a un solo alérgeno (30%).
Los alérgenos mayormente detectados fueron los ácaros (Dermatophagoides, Blomia tropicalis) 33/56, representando un 58,9%, seguido por los mosquitos con 17,8% y las cucarachas 12,5%, muy pocos para cualquier alimento (1,8%).
En 61 niños se detectó al menos un agente parasitario, esto es, una prevalencia del 47%, 40 de estos eran masculinos (40/61), predominó la identificación de protozoarios (27%) y los helmintos fueron encontrados en el 13,1%, la parasitosis mixta se observó en el 9,2%.
El protozoario predominante fue el Blastocystis hominis (10,8%), seguido de la Giardia lamblia, mientras que el helminto de mayor frecuencia fue el Ascaris lumbricoides (6,9%).
No se encontró asociación con significación estadística entre la edad y la parasitosis (p = 0,083), así como tampoco entre la edad y el tipo de parásito detectado (χ2 = 0,65<7,81(3; 0,05), p = 0,883), se observó asociación entre el Graffar y la parasitosis, los niños de Graffar más bajo (IV) tuvieron con significación estadística mayor parasitosis (χ2 = 6,72 > 5,99(2; 0,05)); este nivel tuvo por lo menos dos veces mayor riesgo de estar parasitados (OR = 2,23; IC 95: 1,07 a 4,63; p = 0,004) (Tabla 1), no así con el tipo de parásito detectado (χ2 =7,71 < 12,59(6; 0,05), p = 0,260).
Los del género masculino (χ2 = 8,10 > 6,63(1; 0,01); p = 0,004)], estuvieron mayormente parasitados, asimismo tuvieron mayor detección de helmintos o protozoario en comparación al género femenino (χ2 = 8,58 > 7,81(3; 0,05); p = 0,035; OR = 2,78; IC 95: 1,36 a 69; p = 0,005]) (Tabla 1).
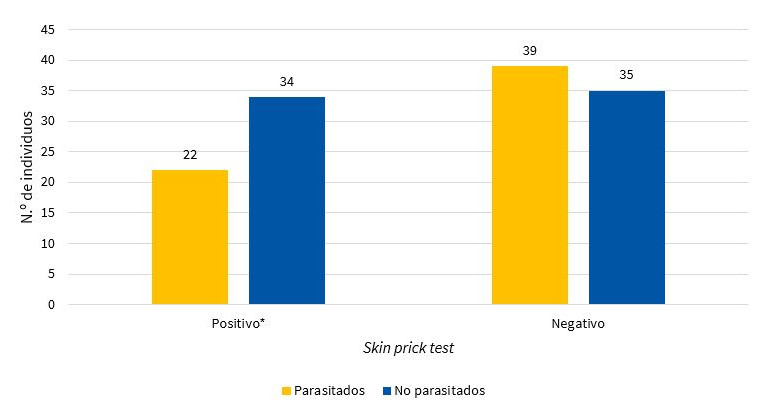
No se encontró significación estadística (χ2 = 2,30 < 3,84(1; 0,005), p = 1,29) entre la positividad de la prueba en piel y parasitosis, pero es de resaltar que más de la mitad de los niños con prick positivo no estaban parasitados (Tabla 1, Fig. 2). Pese a no encontrase diferencias significativas, se analizó el riesgo de la positividad en piel en relación al tipo de parásito encontrado con mayor frecuencia, los niños con infecciones por Giardia lamblia tuvieron un riesgo de casi el doble cuando se compararon con los infectados por Ascaris lumbricoides (OR = 1,14; IC 95: 0,36 a 3,62; p = 0,813 frente a OR = 0,16; IC 95: 0,02 a 1,36; p = 0,058), respectivamente.
| Figura 2. Resultados del skin prick test y su relación con la presencia de cualquier parásito |
|---|
 |

El resultado de ISAAC no guardó significación estadística con la parasitosis (χ2 = 3,03 < 3,84(1; 0,05), p = 0,082) ni con el tipo de parásitos (χ2 = 3,59 < 7,81(3; 0,05), p = 0,447) (Tabla 1).
Sin embargo, la asociación estadística fue altamente importante (χ2 = 42,88 > 10,82(1; 0,01), p = 0,000) cuando este cuestionario se comparó con los resultados de las pruebas cutáneas, estos niños tuvieron hasta 14 veces mayor riesgo de tener pruebas positivas y este riesgo se incrementó con la edad (χ2 = 4,14 > 3,84(1; 0,05), p = 0,042; OR: 14,12; IC 95: 6,00 a 33,22, p = 0,000 y OR: 2,16; IC 95: 1,02 a 4,59, p = 0,042) (Tabla 2).
| Tabla 2. Asociación entre el prick test, la edad, género y los resultados de ISAAC | ||||||
|---|---|---|---|---|---|---|
| Prick test | OR | IC | p | |||
| Positivo* | Negativo* | |||||
| n (%) | n (%) | |||||
| Edad | Preescolar | 23 (17,7) | 18 (13,8) | 2,168 | 1,022-4,599 | 0,042 |
| Escolar | 33 (25,4) | 56 (43,1) | ||||
| Género | Masculino | 25 (19,2) | 43 (33,1) | 0,581 | 0,289-1,171 | 0,128 |
| Femenino | 31(23,8) | 31 (23,8) | ||||
| ISAAC | Positivo | 41 (31,5) | 12 (9,2) | 14,122 | 6,003-33,223 | 0,000 |
| Negativo | 15 (11,5) | 62 (47,7) | ||||
| Total | 56 (43,1) | 74 (56,9) | ||||

No se encontró significación entre la positividad de las pruebas y el género (χ2 = 2,31 < 3,84(1; 0,05), p = 0,128), tampoco con el nivel de Graffar (χ2 = 1,60 < 5,99(1; 0,05), p = 0,447) (Tabla 2) ni relación con la presencia de parásitos (χ2 = 3,57 < 7,81(3; 0,05), p = 0,311) (Tabla 1).
DISCUSIÓN
En nuestro estudio observacional, llevado a cabo para demostrar la relación entre el estado atópico, las enfermedades alérgicas y la parasitosis intestinal, no encontramos relación entre estas condiciones.
Las diferentes observaciones contrastadas con la presencia de geohelmintos continúan arrojando datos contradictorios. Por ejemplo, los estudios de Bragagnoli et al.10, Webb et al.12 y Endara et al.19 sugieren que la carga parasitaria o la simple presencia de los parásitos intestinales guardan relación directa con la expresión alérgica, lo cual constituye un factor de riesgo que contribuye a la alta prevalencia del asma y sus síntomas. Por otro lado, los estudios de Leonardi-Bee, et al.20 indican que las infestaciones parasitarias, de forma general, no protegen contra el desarrollo del asma; y, más recientemente, Cooper, et al.21 encontraron que la disminución del riesgo de tener sibilancias o asma en niños parasitados era provista por un mecanismo no alérgico.
Los resultados de nuestra investigación sugieren que, en nuestra población, el asma debería ser considerada de alta prevalencia y con alto origen alérgico a pesar del nivel alto de niños parasitados lo cual establece una relación negativa y no protectora para la presencia de la atopia.
Un estudio en 1004 niños encuentra que 260 estaban infectados por A. lumbricoides y 233 tenían asma. La carga parasitaria se relacionó de manera directa con los episodios de sibilancias recurrentes. En los niños con mayor carga parasitaria, la presencia de sibilancias fue mucho mayor (p = 0,003, OR = 0,41, IC 95: 0,22 a 0,75), lo que sugiere que esta alta carga de parásitos es un factor de riesgo que contribuye a la alta prevalencia del asma y sus síntomas10.
Igualmente, un estudio transversal demuestra que los individuos parasitados eran más propensos a ser atópicos12.
Los datos anteriores contrastan con un estudio donde se compararon dos comunidades, una rural y otra urbana, en Ecuador. Se encontró una alta asociación entre la sensibilización al polvo doméstico y sibilancias en los niños residentes de las áreas urbanas y que esta diferencia estaba atenuada y explicada por la diferencia de la alta prevalencia del geohelmintos en la población rural19.
No solo los helmintos han sido motivo de estudio para establecer su relación con la alergia, sino también los protozoarios. Un estudio en niños residentes de un área urbana encontró en el 45% de ellos la presencia de Giardia lamblia sin embargo, esta no estuvo relacionada ni con los síntomas alérgicos, ni con las pruebas cutáneas22.
El estado socioeconómico es una de las variables que ha demostrado ser capaz de modificar las enfermedades alérgicas23,24.
En una población de 481 niños de baja condición socioeconómica se investigan los factores de riesgo relacionados con los resultados de las pruebas alérgicas encontrando factores que pudieran comportarse como protectores y brindar apoyo a la hipótesis de la higiene25.
El análisis de nuestra población permitió, con respecto al nivel socioeconómico, afirmar que esta fue una población escolar de bajo nivel (Graffar III/IV). No obstante, no se pudo demostrar ninguna relación con la atopia, pero se puede resaltar que, a menor nivel, el riesgo estar parasitado es de más del doble.
Wördemann, et al.26, en niños cubanos observan que las infecciones actuales por A. lumbricoides fueron un factor protector para la dermatitis atópica mientras que las infestaciones pasadas con E. vermicularis y ancylostomas fueron más bien factores de riesgo promotores para mayor rinoconjuntivitis y dermatitis atópica, lo que sugiere efectivamente que el tipo de parásito y el tiempo de infección se comportan de manera diferente aun en un mismo individuo.
En nuestro estudio la positividad del cuestionario ISAAC se relacionó de manera altamente significativa con los resultados de las pruebas cutáneas.
Este hallazgo ha sido sugerido igualmente por un estudio alemán, donde se encontró un valor predictivo negativo muy alto para SPT (0,94) y un valor predictivo positivo bajo (0,09). Esto quiere decir que sería muy poco probable relacionar una prueba negativa con el desarrollo del asma27.
A propósito de la relación encontrada entre el género masculino y el riesgo mayor de estar parasitado, no se ha encontrado en otras investigaciones28,29.
Un hecho interesante a tener en cuenta, que formaría parte de futuras investigaciones, es la relación de las hormonas sexuales y su impacto en la respuesta inmunológica y el desarrollo de la alergia en las personas parasitadas, que pueda hacer a las niñas más resistentes al desarrollo de infección parasitaria.
Podemos señalar algunas limitaciones. La primera puede estar relacionada con el efectivo muestral; sin embargo, consideramos que es suficientemente representativo para poder sacar conclusiones. En segundo lugar, no haber utilizado técnicas de análisis por concentración al estimar la magnitud de la infección y el no conocer el estado de infección previo.
En conclusión, este estudio no nos permite sugerir para esta población el factor protector de las infecciones parasitarias relacionadas con el diagnóstico de las enfermedades alérgicas, así como tampoco asociación con las pruebas alérgicas.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
EA: eccema atópico · IC 95: intervalo de confianza del 95% · ISAAC: Programa Internacional de Asma y Alergia en Niños (en inglés, International Study of Asthma and Allergies in Childhood) · OR: odds ratio · RC: rinoconjuntivitis · SPT: skin prick test.
BIBLIOGRAFÍA
- Zakzuk J, Lee BW, Acevedo N, Soh JY, Sánchez-Borges M, et al. Particularities of allergy in the Tropics. World Allergy Organ J. 2016;9:20.
- Briggs N, Weatherhead J, Sastry KJ, Hotez PJ. The hygiene hypothesis and its inconvenient truths about helminth infections. PLoS Negl Trop Dis. 2016;10:e0004944.
- Daley D. The evolution of the hygiene hypothesis: the role of early-life exposures to viruses and microbes and their relationship to asthma and allergic diseases. Curr Opin Allergy Clin Immunol. 2014;14:390-6.
- Von Mutius E. The microbial environment and its influence on asthma prevention in early life. J Allergy Clin Immunol. 2016;137:680-9.
- Maizels RM, McSorley HJ. Regulation of the host immune system by helminth parasites. J Allergy Clin Immunol 2016;138:666-75.
- Bethony J, Brooker S, Albonico M, Geiger SM, Loukas A, Diemert D, et al. Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm. Lancet. 2006;367:1521-32.
- Yasuda K, Nakanishi K. Host responses to intestinal nematodes. Int Immunol. 2018;30:93-102.
- Cooper PJ, Barreto M, Rodrigues LC. Human allergy and geohelminth infections: a review of the literature and a proposed conceptual model to guide the investigation of possible causal associations. Br Med Bull. 2006;79-80:203-18.
- Wammes LJ, Mpairwe H, Elliott AM, Yazdanbakhsh M. Helminth therapy or elimination: epidemiological, immunological, and clinical considerations. Lancet Infect Dis. 2014;pii:S1473-3099.
- Bragagnoli G, Silva MT. Ascaris lumbricoides infection and parasite load are associated with asthma in children. J Infect Dev Ctries. 2014;8:891-7.
- Stein M, Greenberg Z, Boaz M, Handzel ZT, Meshesha MK, Bentwich Z. The role of helminth infection and environment in the development of allergy: a prospective study of newly-arrived ethiopian immigrants in Israel. PLoS Negl Trop Dis. 2016;10:e0004208.
- Webb EL, Nampijja M, Kaweesa J, Kizindo R, Namutebi M, Nakazibwe E, et al. Helminths are positively associated with atopy and wheeze in Ugandan fishing communities: results from a cross-sectional survey. Allergy. 2016;71:1156-69.
- Souza VM, Sales IR, Peixoto DM, Costa VM, Rizzo JA, Silva AR, et al. Giardia lamblia and respiratory allergies: a study of children from an urban area with a high incidence of protozoan infections. J Pediatr (Rio J). 2012;88:233-8.
- Mallol J, Solé D, Baeza-Bacab M, Aguirre-Camposano V, Soto-Quiros M, Baena-Cagnani C; et al. Regional variation in asthma symptom prevalence in Latin American children. J Asthma. 2010;47:644-50.
- Solé D, Mallol J, Camelo-NunesI C, Wandalsen GF; Latin American ISAAC Study Group. Prevalence of rhinitis-related symptoms in Latin American children - results of the International Study of Asthma and Allergies in Childhood (ISAAC) phase three. Pediatr Allergy Immunol. 2010;21:e127-36.
- Solé D, Mallol J, Wandalsen GF, Aguirre V; Latin American ISAAC Phase 3 Study Group. Prevalence of symptoms of eczema in Latin America: results of the International Study of Asthma and Allergies in Childhood (ISAAC) Phase 3. J Investig Allergol Clin Immunol. 2010;20:311-23.
- Heinzerling L, Mari A, Bergmann KC, Bresciani M, Burbach G, Darsow U, et al. The skin prick test – European standards. Clin Transl Allergy. 2013;3:3.
- Méndez C. Estudio nacional de crecimiento y desarrollo humano de la República de Venezuela. Caracas: Proyecto Venezuela; 1996.
- Endara P, Vaca M, Platts-Mills TA, Workman L, Chico ME, Barreto ML, et al. Effect of urban vs. rural residence on the association between atopy and wheeze in Latin America: findings from a case-control analysis. Clin Exp Allergy. 2015;45:438-47.
- Leonardi-Bee J, Pritchard D, Britton J. Asthma and current intestinal parasite infection: systematic review and meta-analysis. Am J Respir Crit Care Med. 2006;174:514-23.
- Cooper PJ, Chico ME, Vaca MG, Sandoval CA, Loor S, Amorim LD, et al. Effect of early-life geohelminth infections on the development of wheezing at 5 years of age. Am J Respir Crit Care Med. 2018;197:364-72.
- Jansson SA, Protudjer JL, Arnlind Heibert M, Bengtsson U, Kallström-Bengtsson I, Marklund B, et al. Socioeconomic evaluation of well-characterized allergy to staple foods in adults. Allergy 2014;69:1241-7.
- Thakur N, Martín M, Castellanos E, Oh SS, Roth LA, Eng C, et al. Socioeconomic status and asthma control in African American youth in SAGE II. J Asthma. 2014;51:720-8.
- Hamid F, Wahyuni S, van Leeuwen A, van Ree R, Yazdanbakhsh M, Sartono E. Allergic disorders and socio-economic status: a study of schoolchildren in an urban area of Makassar, Indonesia. Clin Exp Allergy. 2015;45:1226-36.
- Alcantara-Neves NM, Veiga RV, Ponte JC, da Cunha SS, Simões SM, Cruz ÁA, et al. Dissociation between skin test reactivity and anti- aeroallergen IgE: Determinants among urban Brazilian children. PLoS One. 2017;12:e017408.
- Wördemann M, Díaz RJ, Heredia LM, Collado Madurga AM, Ruiz Espinosa A, Prado RC, et al. Association of atopy, asthma, allergic rhinoconjunctivitis, atopic dermatitis and intestinal helminth infections in Cuban children. Trop Med Int Health. 2008;13:180-6.
- Gallmeier K, Becker E, Kirsten A, Wölke G, Manuwald O, Meyer H, et al. Prediction of new-onset asthma and nasal allergy by skin prick test and RAST in a cohort of adults. Eur Respir J. 2014;43:92-102.
- Nxasana N, Baba K, Bhat V, Vasaikar S. Prevalence of intestinal parasites in primary school children of Mthatha, eastern cape province, South Africa. Ann Med Health Sci Res. 2013;3:511-6.
- Chin YT, Lim YA, Chong CW, Teh CS, Yap IK, Lee SC, et al. Prevalence and risk factors of intestinal parasitism among two indigenous sub-ethnic groups in Peninsular Malaysia. Infect Dis Poverty. 2016;5:77.
Comentarios
Este artículo aún no tiene comentarios.






