Prevalencia del síndrome metabólico en niños de Comodoro Rivadavia
Andrés Quezadaa, J Garcíaa, M A Rodrígueza, G M Poncea
aUniversidad Nacional de la Patagonia San Juan Bosco. Facultad de Ciencias Naturales. Centro Regional de Investigación y Desarrollo Científico-Tecnológico (CRIDECIT). Comodoro Rivadavia. Argentina.
Correspondencia: A Quezada. Correo electrónico: andresquezada3@yahoo.com.ar
Cómo citar este artículo: Quezada A, García J, Rodríguez MA, Ponce GM. Prevalencia del síndrome metabólico en niños de Comodoro Rivadavia. Rev Pediatr Aten Primaria. 2019;21:e179-e191.
Publicado en Internet: 31-10-2019 - Número de visitas: 8820
Resumen
Introducción: la salud es esencial para el crecimiento social. En los últimos años, el énfasis está focalizado en la prevención primaria. En este contexto, el síndrome metabólico (SM) no es ajeno a esta situación, si se tienen en cuenta las consecuencias cardiovasculares, circulatorias o metabólicas que se pueden originar. La infancia constituye el momento oportuno para poder intervenir, ya que se pueden establecer pautas y medidas correctivas. Objetivo: el objetivo del presente trabajo fue obtener la prevalencia de SM en niños de Comodoro Rivadavia (Argentina), de tal manera que se pueda aportar información que sirva para establecer estrategias preventivas.
Materiales y métodos: se estudiaron 317 niños (174 mujeres y 143 varones), de edades entre 6 y 11 años, que concurrían habitualmente a centros barriales y a tres escuelas de Comodoro Rivadavia. Con consentimiento informado de los padres, fueron pesados y medidos, se recabaron datos de tensión arterial y circunferencia de cintura y se les extrajo una muestra de sangre para evaluar, triglicéridos, colesterol-HDL y glucemia.
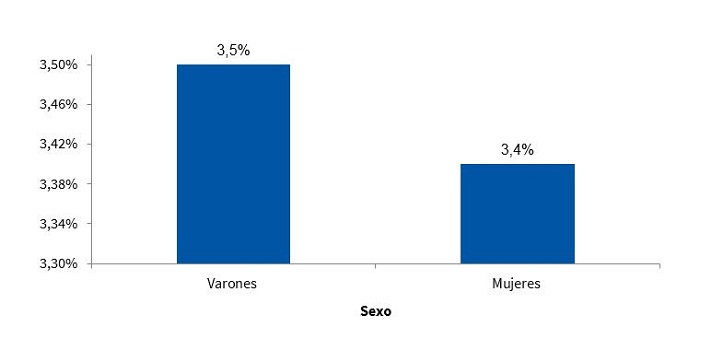
Resultados: teniendo en cuenta los criterios del Adult Treatment Panel III (ATP III) modificados por Cook, la prevalencia de SM en la muestra estudiada fue del 3,50% para los varones y del 3,40% para las mujeres, no encontrándose una diferencia estadísticamente significativa de acuerdo con el sexo. Se encontraron valores de circunferencia de cintura aumentada, hipertrigliceridemia e hipertensión arterial y valores disminuidos de HDL.
Conclusiones: estos resultados preliminares indican la necesidad de profundizar los estudios para detectar precozmente este síndrome en la edad pediátrica y así evitar el desarrollo de enfermedades crónicas en el futuro.
Palabras clave
● Síndrome metabólicoINTRODUCCIÓN
La humanidad ha experimentado grandes cambios que influyen de manera directa en su estilo de vida, por lo que la dinámica salud-enfermedad que se conocía hasta hace poco tiempo ha ido variando lenta y progresivamente hacia un desequilibrio donde nuevas situaciones de enfermedad son cada vez más comunes, lo cual representa un importante desafío desde el punto de vista epidemiológico. Es por eso por lo que la epidemiología, como ciencia, ha cobrado suma importancia en la clínica médica, ya que, gracias a los estudios realizados en este campo ha permitido no solo describir nuevas problemáticas en el ámbito de la salud, sino también identificar cuáles son los componentes etiológicos1. El síndrome metabólico (SM), como emergente epidemiológico, en las últimas décadas ha sido estudiado ampliamente por sus implicancias en la salud de los seres humanos, principalmente en los adultos. Se puede definir como un conjunto de factores de riesgo o anormalidades metabólicas presentes en un individuo que se asocian fuertemente a eventos tales como enfermedad cardiovascular o diabetes mellitus del tipo 22. Su prevalencia es preocupante debido al constante incremento a lo largo del tiempo, con perspectivas futuras poco alentadoras.
Cuando se trata de poblaciones pediátricas, aumenta la probabilidad de que estos eventos se desarrollen a edades más tempranas, por lo que resulta fundamental poder hacer la detección del SM en el momento oportuno, ya que en esta etapa de la vida es posible todavía implementar medidas correctivas que eviten consecuencias irreversibles3. El SM se caracteriza por la acumulación de adiposidad en la zona abdominal, generando una saturación de la grasa visceral4, que conlleva no solo a una situación de sobrepeso o de obesidad, sino también al posible desarrollo de un conjunto de anormalidades metabólicas características. Entre ellas, destacan el aumento de insulina en sangre, intolerancia a la glucosa, dislipemia por aumento de los triglicéridos y colesterol de baja densidad (LDL), acompañado de la disminución del colesterol de alta densidad (HDL) e hipertensión arterial5, hiperuricemia, alteraciones hemorrágicas y de la fibrinólisis, como así también de un estado proinflamatorio reconocido clínicamente por el aumento de la concentración plasmática de la proteína C reactiva (PCR)6.
Existen autores que postulan que el comienzo del SM se da en la infancia7. Es por eso por lo que se han establecido criterios para niños que, si bien difieren entre sí, son útiles en la consulta clínica pediátrica a la hora de determinar factores de riesgo. Dentro de los más usados se encuentran los criterios modificados del ATP III8, de la Organización Mundial de la Salud (OMS)9 y la International Diabetes Federation (IDF)10. Algunos de los trabajos de investigación más usados en estudios epidemiológicos y que han aportado datos en referencia a la modificación de valores de adultos de ATPIII son los de Cook11, Ferranti12 y Weiss13.
MATERIALES Y MÉTODOS
Se desarrolló un estudio descriptivo de corte transversal. La población diana fue aquella integrada por niños de ambos sexos, residentes en Comodoro Rivadavia, de edades entre 6 y 11 años. Se consideró población accesible a todos los niños que concurrieron a tres escuelas primarias de educación pública y dos centros asistenciales dependientes de la Municipalidad de Comodoro Rivadavia (Argentina), durante los ciclos lectivos comprendidos entre 2009 y 2011. Para participar del estudio de forma voluntaria, se tuvieron en cuenta los siguientes criterios de selección:
- De inclusión: niños entre 6 y 11 ± 0,5 años; padres que dieran el consentimiento informado por escrito; niños que dieran su asentimiento.
- De exclusión: haber estado internado el año previo al desarrollo de este estudio; presentar alguna patología aguda en el momento del estudio; presentar antecedentes de enfermedad crónica, renal, hepática o tiroidea; haber recibido medicamentos que pudieran afectar el metabolismo energético o lipídico seis meses antes del estudio.
Se realizó un muestreo no probabilístico consecutivo de los niños que cumplían con los criterios mencionados. Para determinar el tamaño muestral (N), se empleó el siguiente cálculo matemático:
N = (Z / A)2 / p (1-p),
donde Z es el coeficiente que representa un nivel de confianza del 95% y equivale a 1,96, A simboliza la precisión deseada y equivale a 0,02, y p representa la prevalencia esperada de SM utilizando como valor el 3%, a partir de considerar los trabajos de Pedrozo et al.14. De este cálculo surgió un total a muestrear de 279 niños. Contemplando la posibilidad que pudiesen existir problemas en la recolección completa de las muestras, se consideró admitir más voluntarios, por lo que la muestra total incluyó 317 voluntarios, 174 mujeres (54,9%) y 143 varones (45,1%).
Se definió la presencia de SM teniendo en cuenta los criterios del ATP III modificados por Cook11 para la población pediátrica.
Para categorizar la muestra de acuerdo con el índice de masa corporal (IMC) se utilizaron los criterios de la OMS9 (Z - IMC). Los puntos de corte fueron: obesidad Z - IMC ≥2; sobrepeso Z - IMC ≥1 y <2; normopeso Z - IMC <1 y ≥-1.
Para determinar la obesidad abdominal, se utilizó la medida de la circunferencia de la cintura (CC), empleando para ello una cinta métrica no extensible. Se consideró como sitio de medición la mitad de la distancia que separa la última costilla de la cresta iliaca, utilizando los puntos de corte propuestos en las tablas de percentiles de los Centers for Disease Control and Prevention (CDC)15: sobrepeso/obesidad P CC ≥90; normopeso P CC <90.
Determinaciones bioquímicas
Para las determinaciones bioquímicas se extrajo una muestra de sangre venosa previo ayuno de 12 horas. Se separó la muestra en dos tubos, uno con fluoruro de sodio anticoagulante para la posterior separación del plasma y determinación de la glucemia y otro tubo seco para la determinación de HDL y triglicéridos (TG).
- Glucemia (G): se determinó por el método enzimático de la glucosa oxidasa-peroxidasa16. HDL: se determinó por el método enzimático directo, previa separación precipitando selectivamente las lipoproteínas de baja y muy baja densidad (LDL y VLDL) mediante el agregado de ácido fosfotúngstico en presencia de iones magnesio. Se midió la HDL sobrenadante empleando el sistema enzimático colesterol oxidasa/peroxidasa17.
- TG: se determinó por el método enzimático de la glicerolfosfato oxidasa-peroxidasa18. Para descartar enfermedad renal, hepática y tiroidea se determinó creatinina, hepatograma y tirotropina, respectivamente.
En todos los casos, para realizar las mediciones se empleó un espectrofotómetro Metrolab 2300 plus Wiener lab Randon Clinical Analyzer. La exactitud y precisión de las determinaciones bioquímicas fueron evaluadas a partir del control de calidad comercial Standatrol S-E nivel 3 (suero liofilizado para control de precisión en química clínica) de Wiener Laboratorios SAIC, y fue procesado en forma conjunta con las muestras.
Medición de la presión arterial (PA)
Se midió con un tensiómetro semidigital OM-ROM HEM-431 validado por la Sociedad Europea de Hipertensión Arterial para esta finalidad19. Antes de la evaluación, el niño permaneció sentado con la espalda apoyada en el respaldo, con las piernas descruzadas, y el brazo derecho descubierto relajado y apoyado a la altura del corazón. El extremo inferior del manguito se colocó a 2 cm por encima del pliegue del brazo. Se indicó al niño que no hablara mientras se inflaba y desinflaba el manguito. Se obtuvieron inicialmente tres tomas de PA, separadas por un minuto cada una de ellas. Si el niño no había estado sentado previamente en la sala de espera, se aguardó cinco minutos antes de iniciar la primera toma. De las tres tomas, se promediaron la segunda y la tercera para determinar la presión arterial media o promedio (PAM). Esta es la que se tuvo en cuenta para considerar si el niño se encontraba normotenso o hipertenso en la consulta. Cuando se observó una diferencia entre las dos últimas presiones sistólicas de más de 10 mmHg, o de más de 5 mmHg en las dos últimas presiones diastólicas, se realizaron nuevas tomas, y en este caso para obtener la PAM se consideraron las dos últimas. Como valores de corte se utilizaron los establecidos por el ATP III, empleando las tablas de percentiles propuestas por la OMS9.
Determinaciones de SM
Se definió la presencia de SM teniendo en cuenta los criterios del ATP III modificados por Cook11 para la población pediátrica, que considera la coexistencia de tres o más de los siguientes factores de riesgo que se muestran en la Tabla 1.
| Tabla 1. Factores de riesgo asociados al síndrome metabólico | |
|---|---|
| Criterio ATP III | Niños y niñas |
| Aumento de triglicéridos | ≥110 mg/dl |
| HDL bajo | ≤40 mg/dl |
| Obesidad abdominal: CC | ≥P90 |
| Glucemia en ayunas | ≥110 mg/dl |
| Presión arterial | ≥P90 |

Variables no relevantes
Mediante el empleo de una encuesta semiestructurada y validada, se recabaron los siguientes datos:
- Actividad física. Se indagó sobre la actividad física extraescolar que realizaban los niños voluntarios. Se determinaron los grados de actividad física global en los últimos siete días, para lo cual se utilizó el formato corto del International Physical Activity Questionnaire (IPAQ)20. En la versión corta del IPAQ, es posible categorizar las actividades en función de la intensidad de estas, y de acuerdo con ellas clasificar a los sujetos como inactivos, irregularmente activos y regularmente activos, según los siguientes criterios:
- Inactivos: personas que no hayan caminado o realizado otra actividad física de intensidad moderada o vigorosa los últimos siete días, durante al menos diez minutos seguidos. Todos aquellos niños que no realizaban actividad física corresponden a esta categoría.
- Regularmente activos: personas que hayan caminado o realizado otra actividad física de intensidad moderada, con una duración acumulada de al menos 30 minutos al día, en esfuerzos mínimos de diez minutos seguidos, durante cinco días o más en los últimos siete días, o que hayan realizado actividades vigorosas con una duración acumulada de al menos 20 minutos seguidos durante tres días o más en los últimos siete días. Pertenecen a esta categoría aquellos niños que, aparte de la actividad física escolar, realizaban actividad física extraescolar.
- Irregularmente activos: personas que hayan caminado o realizado otra actividad física de intensidad moderada o vigorosa con una duración acumulada diaria de al menos diez minutos, pero que no cumplían con todos los criterios para ser regularmente activos. Todos aquellos niños que se limitaron a realizar solo la actividad física del colegio se encuentran en esta categoría.
- Horas de permanencia frente a pantalla: se interrogó sobre la cantidad de minutos/horas que en promedio los niños realizaban actividades tales como mirar televisión, jugar en el ordenador o equipos similares en los últimos siete días. Se consideró un valor de corte de dos horas diarias como el tiempo suficiente para la recreación de acuerdo con lo establecido por la Asociación Americana de Pediatría21,22 y diversos trabajos científicos23,24.
Análisis estadístico descriptivo
Los resultados descriptivos se expresaron como mediana, cuartilo 25 (Q25) y 75 (Q75), dada la distribución no paramétrica de las variables analizadas25.
Análisis estadístico analítico
Para evaluar si existían diferencias entre los grupos (varones y mujeres) en variables clínicas y de laboratorio se empleó el test o el método de Wilcoxon-Man-Whitney, de acuerdo con la distribución de la variable continua. Se realizó un análisis univariado para determinar la asociación entre las variables de estudio y la presencia de sobrepeso u obesidad. Para variables continuas se utilizó la correlación de Spearman (rank-order correlation) y para las categóricas el método de χ2. Se trabajó con una significancia estadística de 0,05. El paquete informático utilizado fue el programa Stata 11.0 (Stata Corp LP, College Station, Texas)25.
El presente estudio contó con el aval del comité de ética del hospital público local y se encuadra bajo las normas éticas internacionales de Helsinki.
RESULTADOS
Características antropométricas, metabólicas y de presión arterial
En la Tabla 2 se observan las características de la población infantil estudiada según el sexo.
| Tabla 2. Distribución antropométrica en función del sexo (n = 317) | |||
|---|---|---|---|
| Varones (n = 143) | Mujeres (n = 174) | Total (n = 317) | |
| Mediana (Q25-Q75) | |||
| Edad (años) | 8,92 (7,52-10,5) | 9,17 (7,66-10,4) | 9,00 (7,58-10,4) |
| IMC (kg/m2) | 18,4 (17,0-21,1) | 18,8 (16,4-22,8) | 18,6 (16,7-22,1) |
| CC (cm) | 65,0 (58,1-73,8) | 68,0 (60,0-80,0) | 66,0 (59,0-77,0) |

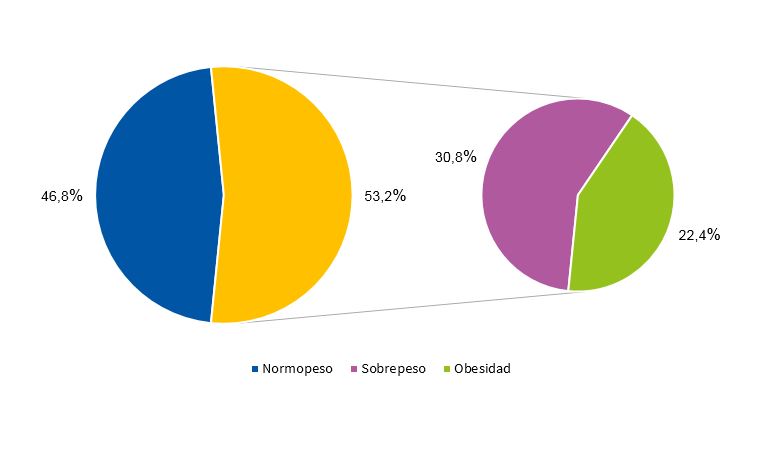
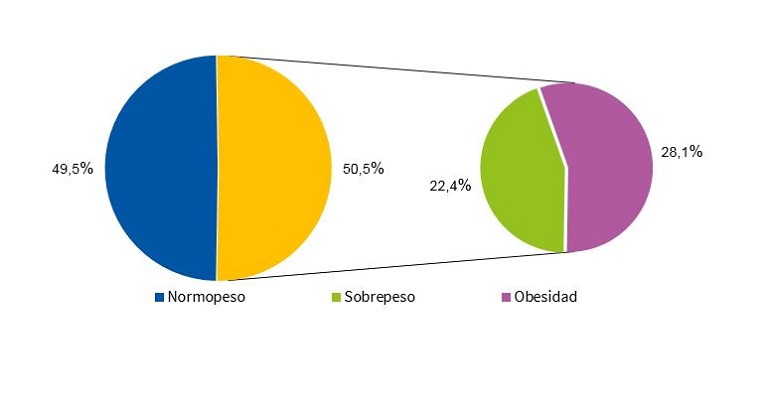
Las Figs. 1 y 2 muestran la distribución porcentual del IMC en función del sexo, de acuerdo con los criterios de la OMS9.
Las Figs. 3 y 4, muestran el percentil de la CC de acuerdo con el criterio de los CDC15 en varones y mujeres, respectivamente.
| Figura 3. Distribución porcentual del percentil de la circunferencia de la cintura varones de acuerdo con el criterio de los CDC (n = 143) |
|---|
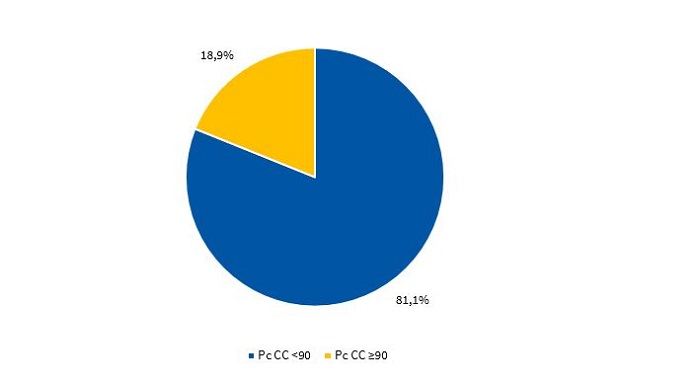 |

| Figura 4. Distribución porcentual del percentil de la circunferencia de la cintura en mujeres de acuerdo con el criterio del CDC (n = 174) |
|---|
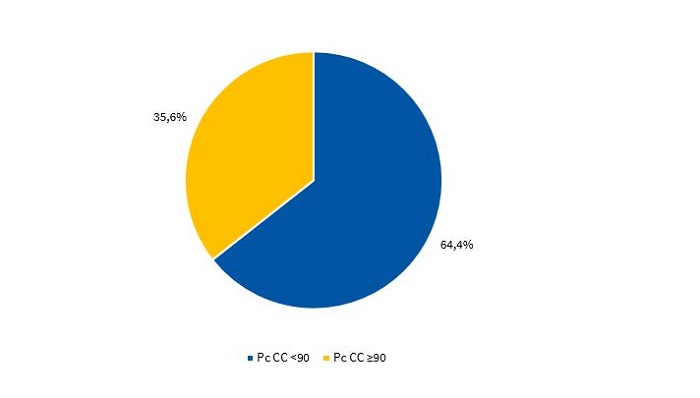 |

Factores de riesgo de síndrome metabólico
La frecuencia de aparición de los factores de riesgo (FR) que componen el SM (criterio ATP III modificado11) en varones y mujeres se puede apreciar en las Figs. 5 y 6, respectivamente.
| Figura 5. Frecuencia de aparición de factores de riesgo del síndrome metabólico en varones (n = 143) |
|---|
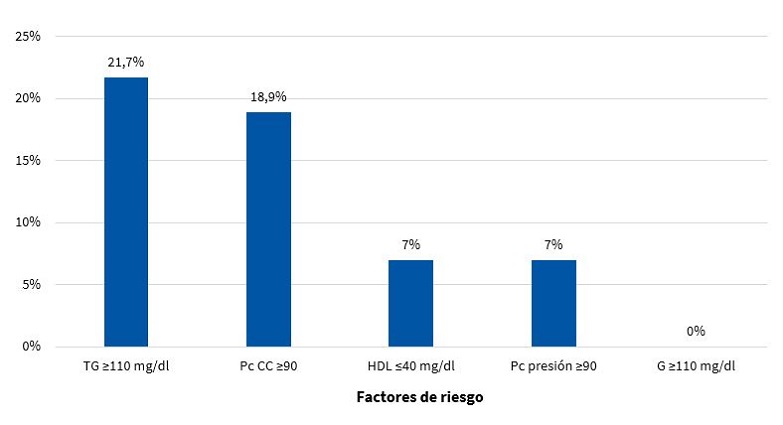 |

| Figura 6. Frecuencia de aparición de factores de riesgo del síndrome metabólico en mujeres (n = 174) |
|---|
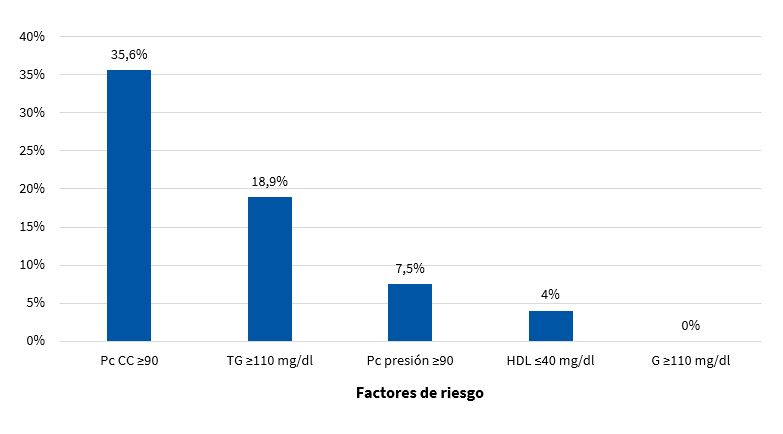 |

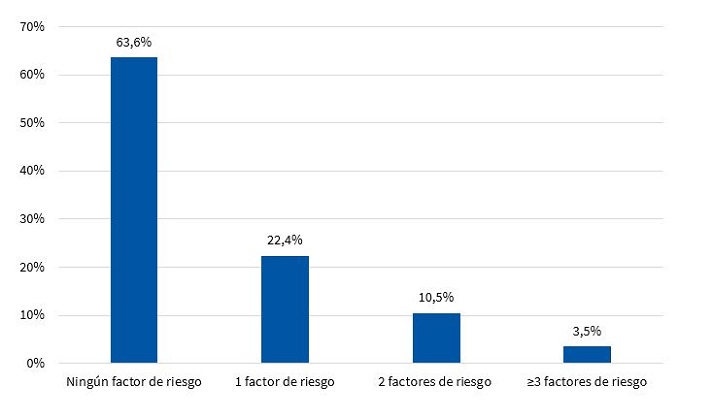
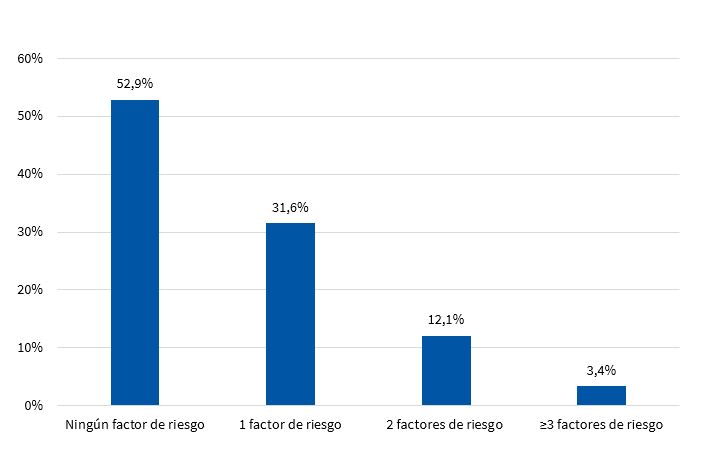
En las Figs. 7 y 8 se muestra la distribución porcentual del número de FR para SM en varones y mujeres respectivamente.
Prevalencia de síndrome metabólico
En la Fig. 9 se observa la prevalencia de SM en función del sexo, en la población estudiada.
| Figura 9. Prevalencia del síndrome metabólico según criterios del ATP III modificados por Cook11 (n = 317) |
|---|
 |

Factores ambientales
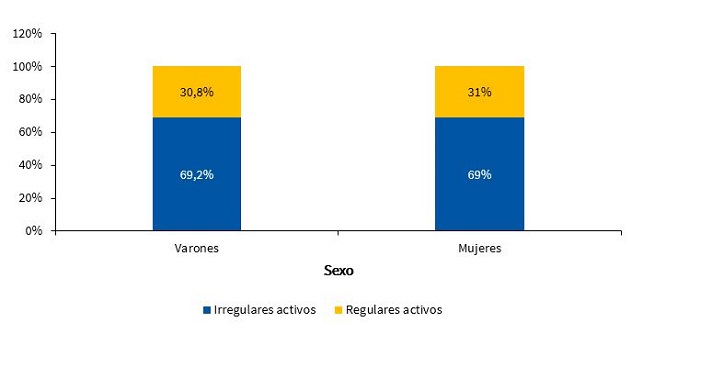
Además, en la Fig. 10, se describe la distribución porcentual del tipo de actividad física realizada según el cuestionario IPAQ20, en función del sexo.
| Figura 10. Distribución porcentual de acuerdo con el sexo y al tipo de actividad física realizada semanalmente (n = 317) |
|---|
 |

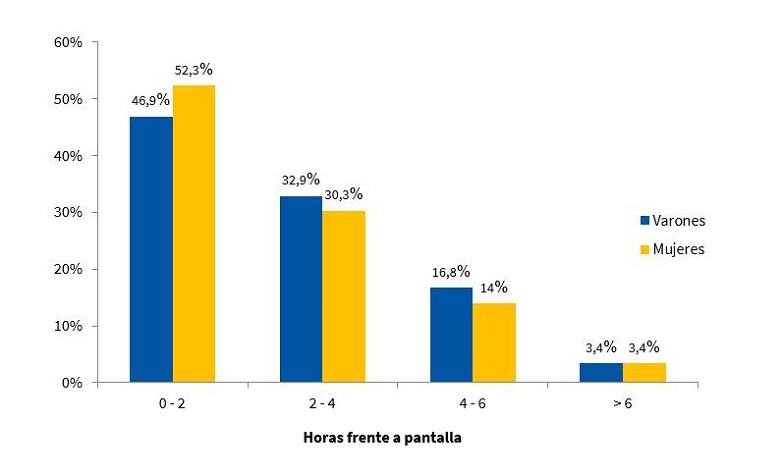
En relación con la permanencia frente a pantallas (televisión, videojuegos, teléfonos móviles, etc.) en la Fig. 11 se observa su distribución en función del sexo y cantidad de horas diarias.
| Figura 11. Distribución porcentual de acuerdo con el sexo y a la cantidad de horas de permanencia frente a pantallas de televisor, ordenador o videojuego durante el día (n = 317) |
|---|
 |

DISCUSIÓN
El diagnóstico del SM en la edad adulta es dificultoso, ya que no existe un consenso entre los distintos organismos internacionales respecto a los criterios que lo definen26. En la edad pediátrica, se suma la complicación de los puntos de corte utilizados, tanto en la investigación como en el diagnóstico clínico del niño, dado que en general son modificaciones de los valores del adulto. Entre los organismos más consultados para el abordaje del tema, se encuentran el ATP III y la IDF. Con respecto al primero de ellos, Cook11, Ferranti12 y Weiss13, son los que, sin dudas, han aportado más datos para la población infantil. Los tres investigadores coinciden en que, al igual que en el caso de los adultos, para diagnosticar SM deben coexistir al menos tres factores de riesgo en el individuo. Sin embargo, hay diferencia en cuanto a los puntos de corte y al indicador utilizado. Distintas investigaciones muestran prevalencias diferentes en función de los criterios empleados. Aquellas que utilizaron la propuesta de Ferranti han detectado prevalencias más altas que las que emplearon las de Cook y Weiss, respectivamente. Esto se debe principalmente a que los criterios de Ferranti son mucho más estrictos26. Debido a estas diferencias planteadas en poblaciones pediátricas, los criterios de Cook, que son ampliamente utilizados en estudios epidemiológicos, se convirtieron en los propuestos para el presente trabajo. La prevalencia de SM encontrada fue de 3,50% para los varones y de 3,40% para las mujeres, no encontrándose una diferencia estadísticamente significativa según el sexo (Fig. 9). Esta situación es concordante con lo reportado en Posadas, Misiones, en una población de 11 a 14 años, donde la prevalencia fue del 2,50%. Además, las cifras son semejantes a las de un estudio realizado en infantes venezolanos de iguales características (3,70%)27. En ese trabajo, la totalidad de la población estudiada presentó al menos un factor de riesgo, situación que no se observó en Comodoro Rivadavia, donde el 63,6% de los varones y el 52,9% de las mujeres no mostraron factores de riesgo (Figs. 7 y 8). Otros trabajos reportaron prevalencias de 5,1% (Medellín, Colombia)28 y de 2,2% (Mérida, Venezuela)29.
Al comparar los niños con y sin SM, se observaron diferencias estadísticamente significativas en relación con la presencia de cuatro de los cinco FR. En el caso de la CC se vio, como era de esperar, medianas mayores en el grupo que presentaba SM (p <0,01). El aumento del perímetro de cintura es un indicador que refleja un aumento en la cantidad de grasa visceral, favoreciendo la liberación de ácidos grasos libres que activan mecanismos promotores de aterosclerosis. De igual manera, a partir de la liberación de IL1, IL6 y TNFα, se estimula la producción de PCR reactiva a nivel hepático y del activador del plasminógeno tipo 1, lo cual genera procesos protrombóticos e inflamatorios, además del depósito de ácidos grasos libres en el músculo, que llevan a resistencia a la insulina (RI)30,31. Por lo tanto, cuando aumenta la CC, tal como ocurre en los niños que presentan SM, existe un mayor riesgo de diabetes, enfermedad cardiovascular32,33 o RI34.
En cuanto al metabolismo lipídico, los resultados demostraron que existían valores más elevados de TG y más bajos de HDL (p <0,01) en la población con SM. Esto resulta comparable a lo reportado por Eyzaguirre et al., quien realizó estudios similares en niños y adolescentes35.
Otro de los FR que se encuentra relacionado al SM es la PA. Existen nexos fisiopatológicos que la asocian con la obesidad, la RI y las alteraciones de la función renal36. En la muestra de estudio se observaron diferencias entre grupos para ambas presiones arteriales (p <0,05).
Con respecto a los niños que no presentaron SM, muchos de ellos tuvieron al menos un FR, lo cual resulta un dato importante que hay que tener en cuenta desde el punto de vista preventivo. Considerando que a esta edad los FR son modificables, es de esperar que, debido a la variabilidad que presentan con el tiempo, desaparezcan o se incrementen en función del estilo de vida. En el presente estudio, se observó que el 32,9% de los varones (Fig. 7) y el 43,7% de las mujeres (Fig. 8) presentaron 1 y 2 FR, hecho importante que se debe tener en cuenta, ya que si bien no son niños que presentan SM, existe la posibilidad de que, en condiciones desfavorables, puedan llegar a tenerlo.
En el presente estudio resulta alarmante la prevalencia de sobrepeso y obesidad, independientemente del indicador utilizado. Aproximadamente la mitad de los niños presenta esta condición. Ya que la causa de la obesidad es multifactorial, es importante detectar aquellas situaciones que promueven un ambiente obesogénico.
Generalmente, en las escuelas, el estímulo de educación física suele ser reducido e insuficiente, debido a las políticas educativas. La Fig. 10 muestra que más de la mitad de los niños estudiados, independientemente del sexo, se limitan a la propuesta curricular de la institución educativa, que suele ser de dos estímulos semanales (80 minutos) de actividad física. De esta forma, se constituyen en una población irregularmente activa de acuerdo con las categorías definidas por el IPAQ. Esta situación se agrava si se tiene en cuenta que la actividad escolar no es permanente. Al categorizar en función del sexo, el 69,2% de los varones y el 69,0% de las mujeres solo realizaban la actividad que proponía la escuela (Fig. 10).
Además, se observó que el 53,1% de los varones y el 47,7% de las mujeres permanecían más de dos horas por día frente a pantallas (Fig. 11). Se ha demostrado que existe asociación entre la cantidad de horas frente a cualquier tipo de pantallas, la obesidad y los factores de riesgo mencionados37.
CONCLUSIONES
El diagnóstico del SM en la infancia a partir de los FR existentes resulta difícil por la variedad de criterios que existen, pero también por la variabilidad de los componentes de este que presentan comportamientos distintos a los del adulto. Cuando existe SM, hay una tendencia de arrastre hacia la edad adulta, favoreciendo la aparición de las enfermedades cardiovasculares o de la diabetes tipo 2.
El SM, como emergente epidemiológico, se encuentra presente no solo en la edad adulta, sino también en las poblaciones pediátricas. En la ciudad de Comodoro Rivadavia y a partir de los datos obtenidos en el presente trabajo, se encontró que la prevalencia fue del 3,50% para los varones y del 3,40% para las mujeres, no encontrándose una diferencia estadísticamente significativa de acuerdo con el sexo.
Si bien la prevalencia de obesidad abdominal fue más alta en mujeres que en varones, esto no implicó una mayor prevalencia de SM en ellas.
Todos los casos de SM se presentaron en niños y en niñas con sobrepeso u obesidad.
Más de la mitad de la población no realizaba actividad física extraescolar además de permanecer por más de dos horas al día frente a pantallas, escenario típico del sedentarismo.
Existen FR para SM modificables en la población estudiada tales como: escasa actividad física y excesiva permanencia frente a pantallas.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS
ATP III: Adult Treatment Panel III · CC: circunferencia de la cintura · CDC: Centers for Disease Control and Prevention · FR: factores de riesgo · G: glucemia · HDL: colesterol de alta densidad · IDF: International Diabetes Federation · IMC: índice de masa corporal · IPAQ: International Physical Activity Questionnaire · LDL: colesterol de baja densidad · OMS: Organización Mundial de la Salud · PA: presión arterial · PAM: presión arterial media · PCR: proteína C reactiva · Q25: cuartilo 25 · Q75: cuartilo 75 · RI: resistencia a la insulina · SM: síndrome metabólico · TG: triglicéridos · VLDL: colesterol de muy baja densidad.
BIBLIOGRAFÍA
- Folch JJM, Folch BCM, Silvera MR, Cuervo DG, Jiménez JV, Jiménez DR. La comunicación en salud como aspecto clave en la vigilancia epidemiológica. Rev Med Electrón. 2016;38:635-7.
- Contreras F, Hernández P, Mata C, Hernández C. Síndrome metabólico y diabetes mellitus tipo 2 en población adulta. Los salías, Edo. Miranda-Venezuela. Síndrome Cardiometabólico. 2015;5:19-26.
- Herrera OA. Síndrome metabólico en la infancia, un enfoque para la Atención Primaria. Rev Cubana Pediatr. 2015;87:82-91.
- Gutiérrez Hervás AI, Rizo Baeza MM, Martínez Amorós N, Cortes Castell E. Presión sistólica, obesidad abdominal y grasa corporal, predictores del síndrome metabólico en preescolares españoles. Nutr Hosp. 2015;31:2109-14.
- Arslanian S, Suprasongsin C. Insulin sensitivity, lipids and body composition in childhood: is “syndrome X” present? J Clin Edocrinol Metab. 1996;81:1058-62.
- Grundy SM, Brewer HB Jr, Cleeman JI, Smith SC Jr, Lenfant C; American Heart Association; National Heart, Lung, and Blood Institute. Definition of metabolic syndrome: Report of the National Heart, Lung, and Blood Institute/American Heart Association conference on scientific issues related to definition. Circulation. 2004;109:433-8.
- Bitsori M, Kafatos A. Dysmetabolic syndrome in childhood and adolescence. Acta Paediatr. 2005;94:995-1005.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001;285:2486-97.
- De Onis M, Onyango AW, Borghi E, Siyam A, Nishida Ch, Siekmann J. Development of a WHO growth reference for school –aged children and adolescents. Bull World Health Organ. 2007;85:660-7.
- The IDF consensus worldwide definition of the metabolic syndrome. En: International Diabetes Federation [en línea] [consultado el 29/10/2019. Disponible en www.idf.org/e-library/consensus-statements/60-idfconsensus-worldwide-definitionof-the-metabolic-syndrome.html
- Cook S, Weitzman M, Auinger P, Nguyen M, Dietz WH. Prevalence of a metabolic syndrome phenotype in adolescents: findings from the third National Health and Nutrition Examination Survey, 1988-1994. Arch Pediatr y Adolesc Med. 2003;157:821-7.
- Ferranti SD, GauvreauuK, Ludwig DS, Neufeld EJ, Newburger JW, Rifai N. Prevalence of the metabolic syndrome in american adolescents. Circulation. 2004;110:2494-7.
- Weiss R, Dziura J, Burgert TS, Tamborlane WV, Taksali SE, Yeckel CW, Caprio S. Obesity and the metabolic syndrome in children and adolescents. New Engl J Med. 2004;350:2362-74.
- Pedrozo W, Castillo Rascón M, Bonneau G, Ibáñez de Pianesi M, Castro Olivera C, Jiménez de Aragón S. Síndrome metabólico y factores de riesgo asociados con el estilo de vida de adolescentes de una ciudad de Argentina, 2005. Rev Panam Salud Pública. 2008;24:149-60.
- Kuczmarski RJ, Ogden CL, Guo SS, Grummer-Strawn LM, Flegal KM, Mei Z, et al. 2000 CDC growth charts for the United States: methods and development. Vital Health Stat. 2002;1-190.
- Glicemia enzimática. En: Fundación Wiener Laboratorios SAIC [en línea] [consultado el 29/10/2019]. Disponible en www.wiener-lab.com.ar/VademecumDocumentos/Vademecum%20espanol/glicemia_enzimatica_sp.pdf
- HDL colesterol. En: Fundación Wiener Laboratorios SAIC [en línea] [consultado el 29/10/2019]. Disponible en www.wiener-lab.com.ar/VademecumDocumentos/Vademecum%20espanol/hdl_colesterol_ft_sp.pdf
- TG color. En: Fundación Wiener Laboratorios SAIC [en línea] [consultado el 29/10/2019]. Disponible en www.wiener-lab.com.ar/VademecumDocumentos/Vademecum%20espanol/tg_color_gpo_pap_aa_liquida_sp.pdf
- O’Brien E, Waeber B, Parati B, Staessen J, Myers MG. Blood pressure measuring devices: recommendations of the European Society of Hypertension. BJM. 2001;322:531-6.
- Pate RR, Pratt M, Blair SN, Haskell WL, Macera CA, Bouchard C, et al. Physical activity and public health: a recommendation from the Centers for Disease Control and Prevention and the American College of Sports Medicine. JAMA. 1995;273:402-7.
- Ruiz Vicente D, Salinero JJ, González Millán C, Soriano ML, Pastor TG, Theirs C, et al. Descripción de la práctica de actividad física, habilidades motrices básicas y composición corporal en niños y jóvenes de espectro autista. Diferencias por sexo. Retos. 2015;28:61-5.
- Reyes-Gómez U, Sánchez-Chávez NP, Reyes-Hernández U, Reyes-Hernández D, Carbajal-Rodríguez L,. La televisión y los niños: II obesidad. Bol Clin Hosp Infant Edo Son. 2006;23:25-30.
- Rossi RR. La obesidad infantil y los efectos de los medios electrónicos de comunicación. Redalyc. 2006;8:95-8.
- Olivares C, Bustos N, Lera L, Zelada ME. Estado nutricional, consumo de alimentos y actividad física en escolares mujeres de diferente nivel socioeconómico de Santiago de Chile. Rev Med Chile. 2007;135:71-8.
- Pagano M, Gauvreau K. Fundamentos de Bioestadística. 2.ª ed. International Thomson Editores; 2001.
- Chaila MZ, Fabio S, Quiroga E, Sánchez de Boeck N, Namur M, D’urso M, et al. Prevalencia de síndrome metabólico en niños y adolescentes según diferentes criterios diagnósticos y su correlación con niveles de leptina y adiponectina. Rev Argent Endocrinol Metab. 2012;49:103-14.
- Pires Rodríguez MDC, Nava Arias AV, Lanzilli P. Síndrome metabólico: prevalencia y factores de riesgo en escolares. Arch Venez Pueric Pediatr. 2009;72:47-52.
- Ochoa GMA, Arteaga RA. Prevalencia del síndrome metabólico en niños y adolescentes escolarizados del área urbana de la ciudad de Medellín. Iatreia. 2008;21:260-70.
- Reyes MV, Mederico M, de Valeri MP, Briceño Y, Zerpa Y, Gómez Pérez R. Síndrome metabólico en escolares y adolescentes de la ciudad de Mérida-Venezuela: comparación de resultados utilizando valores de referencia locales e internacionales (estudio CREDEFAR). Endocrinol Nutr. 2014;61:474-85.
- Stanley TL, Grinspoon SK. Effects of growth hormone-releasing hormone on visceral fat, metabolic, and cardiovascular índices in human studies. Growth Horm IGF Res. 2015;25:59-65.
- Andersson DP, Lofgren P, Thorell A, Arner P, Hoffstedt J. Visceral fat cell lipolysis and cardiovascular risk factors in obesity. Horm Metab Res. 2011;43:809-15.
- Despres JP. Cardiovascular disease under the influence of excess visceral fat. Crit Path Cardiol. 2007;6:51-9.
- Ruiz AJ, Aschner PJ, Puerta MF, Study Cristancho RA. IDEA study (International Day for the Evaluation of Abdominal Obesity): Primary care study of the prevalence of abdominal obesity and associated risk factors in Colombia. Biomedica. 2012;32:610-6.
- Morales A, Balza M, González M, Piña M, Zeman P, García D. Primeras curvas de percentiles de la circunferencia de cintura en un grupo de adolescentes del Estado Lara, Venezuela. Med Interna (Caracas). 2010;26:174-81.
- Eyzaguirre F, Silva R, Román R, Palacio A, Cosentino M, Vega V, et al. Prevalencia de síndrome metabólico en niños y adolescentes que consultan por obesidad. Rev Med Chile. 2011;139:732-8.
- Cordero A, Moreno J, Alegría E. Hipertensión arterial y síndrome metabólico. Rev Esp Cardiol. 2005;5:38-45.
- Aradillas García C, de la Cruz Mendoza E, Torres Ruvalcaba B, Montreal Escalante E, Torres Rodríguez L, Goldaracena Azuara M. El impacto de la televisión sobre la prevalencia del síndrome metabólico en población infantil de San Luis Potosí. Rev Fac Med UASLP. 2008;33:10-8.
Comentarios
Este artículo aún no tiene comentarios.