Vol. 14 - Num. 55
Documento de consenso
Documento de consenso sobre etiología, diagnóstico y tratamiento de la otitis media aguda
F del Castillo Martína, Fernando Baquero Artigaob, T de la Calle Cabrerac, MV López Roblesd, J Ruiz Canelae, Santiago Alfayate Miguélezf, F Moraga Llopb, Cristina Calvo Reyb
aSociedad Española de Infectología Pediátrica (SEIP).
bSociedad Española de Infectología Pediátrica (SEIP). España.
cSociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP).
dSociedad Española de Urgencias Pediátricas (SEUP).
eAsociación Española de Pediatría de Atención Primaria (AEPap).
fSección de Infectología Pediátrica. Hospital Clínico Universitario Virgen de la Arrixaca. Murcia. España.
Cómo citar este artículo: del Castillo Martín F, Baquero Artigao F, de la Calle Cabrera T, López Robles MV, Ruiz Canela J, Alfayate Miguélez S, et al. Documento de consenso sobre etiología, diagnóstico y tratamiento de la otitis media aguda. Rev Pediatr Aten Primaria. 2012;14:195-205.
Publicado en Internet: 06-08-2012 - Número de visitas: 78935
Resumen
Se presenta el documento de consenso sobre otitis media aguda (OMA) de la Sociedad Española de Infectología Pediátrica (SEIP), la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP), la Sociedad Española de Urgencias Pediátricas (SEUP) y la Asociación Española de Pediatría de Atención Primaria (AEPap).
Se analizan la etiología de la enfermedad y los posibles cambios de esta después de la introducción de la vacunas antineumocócicas 7-valente, 10-valente y 13-valente. Se hace una propuesta diagnóstica basada en la clasificación de la OMA en confirmada o probable. Se considera OMA confirmada si hay coincidencia de tres criterios: comienzo agudo, signos de ocupación del oído medio (u otorrea) y signos o síntomas inflamatorios, como otalgia o intensa hiperemia timpánica, y OMA probable cuando existan solo dos criterios. Se propone como tratamiento antibiótico de elección la amoxicilina oral en dosis de 80 mg/kg/día repartidas cada ocho horas. El tratamiento con amoxicilina-ácido clavulánico en dosis de 80 mg/kg/día se indica si el niño es menor de seis meses, en lactantes con clínica grave (fiebre >39 ºC o dolor muy intenso), cuando haya historia familiar de secuelas óticas por OMA o un fracaso terapéutico de la amoxicilina.
Palabras clave
● Amoxicilina ● Etiología ● Otitis media aguda ● SintomatologíaNota:
Artículo publicado simultáneamente con Anales de Pediatría: del Castillo Martín F, Baquero Artigao F, de la Calle Cabrera T, López Robles Mv, Ruiz Canela J, Alfayate Miguélez S, et al. Documento de consenso sobre etiología, diagnóstico y tratamiento de la otitis media aguda. An Pediatr (Barc). 2012;77 (11):345.e1-345.e8. Disponible en: http://dx.doi.org/10.1016/j.anpedi.2012.05.026
INTRODUCCIÓN
La otitis media aguda (OMA) en la infancia es una de las enfermedades más frecuentes y la principal causa de prescripción de antibióticos en los países desarrollados1. Además, algunos estudios2 encuentran un sobrediagnóstico de este cuadro en los niños y, por tanto, un uso excesivo de antibioticoterapia, con sus consecuencias tanto en efectos secundarios como en aumento de las resistencias bacterianas. Este es el motivo de que en los últimos años se hayan publicado numerosos artículos y guías clínicas acerca del diagnóstico preciso y el tratamiento adecuado de la otitis media en la infancia.
Según la sistemática de otros documentos de consenso, vamos a añadir la fuerza de la recomendación (A: buena evidencia; B: moderada evidencia; C: poca evidencia) y la calidad de la evidencia científica (I: ensayos controlados aleatorizados; II: estudios bien diseñados, pero no aleatorizados; III: opiniones de expertos basadas en la experiencia clínica o en series de casos) de las medidas propuestas, siguiendo la calificación de la Infectious Disease Society of America.
ETIOLOGÍA DE LA OTITIS MEDIA AGUDA
Microbiología e influencia de las vacunas
Los agentes bacterianos más frecuentes causantes de OMA en nuestro medio antes de la introducción de la vacuna antineumocócica eran3 Streptococcus pneumoniae (S. pneumoniae) (35%), Haemophilus influenzae (H. influenzae) no tipificable (25%), Streptococcus pyogenes (3-5%), Staphylococcus aureus (1-3%) y Moraxella catarrhalis (M. catarrhalis) (1%). Otros microorganismos menos frecuentes como causa de OMA en los niños sanos son Escherichia coli, Pseudomonas aeruginosa y anaerobios, y muy excepcionales, Mycoplasma pneumoniae, Chlamydia y algunos hongos. Por causas no aclaradas, entre un 20 y un 30% de los cultivos de los exudados de la cavidad media del oído son estériles.
No obstante, es bien conocido que las vacunas antineumocócicas conjugadas disminuyen la colonización nasofaríngea por los serotipos que incluyen, al mismo tiempo que facilitan el aumento de la colonización por serotipos no vacunales4-7, lo cual puede modificar las frecuencias antes indicadas. En un reciente análisis del Centro Nacional de Microbiología de Majadahonda sobre los aislamientos de neumococo en muestras de exudado ótico obtenidas entre los años 2001 y 2009, se observó8 una disminución significativa de los serotipos vacunales (del 62,9% en 2001 al 10,6% en 2009) y un incremento de los no vacunales, en especial del 3, el 6A y el 19A (este último mostró el mayor incremento, pasando del 9,5 al 35,5%). Globalmente, en la última década, el 68% de las OMA estuvieron causadas por serotipos no incluidos en la vacuna heptavalente, y el 43% de ellas fueron por el serotipo 19A9.
La erradicación de los serotipos vacunales de la nasofaringe por la vacuna conjugada heptavalente crea un nicho ecológico que no solo es ocupado por los serotipos no vacunales, sino también por otros competidores biológicos, especialmente por H. influenzae5. Se ha demostrado un incremento de las otitis por este microorganismo en poblaciones con altas tasas de vacunación antineumocócica10 y en algunos estudios ha resultado ser la principal bacteria causante de OMA, por delante del neumococo (56-57% frente al 31%). Se desconoce si este es un fenómeno generalizado y permanente.
Muy recientemente se han desarrollado dos nuevas vacunas antineumocócicas conjugadas que pueden influir en estos datos: la 10-valente (Synflorix®), que añade a los serotipos de la vacuna heptavalente el 1, el 5 y el 7F, y la 13-valente (Prevenar-13®), que suma a los anteriores los serotipos 3, 6A y 19A. Ambas han sido aprobadas para la prevención de la enfermedad neumocócica invasiva y de la OMA por neumococo en los niños de seis semanas a cinco años de edad.
Una de las características más interesantes de la vacuna 10-valente es que los serotipos de neumococo están conjugados con la proteína D, una lipoproteína que contienen la mayoría de las cepas de H. influenzae, lo cual confiere protección frente a los dos principales patógenos causantes de OMA. En un ensayo clínico aleatorizado y doble ciego, la vacuna demostró una eficacia del 33,6% frente a cualquier OMA, del 57,6% frente a las producidas por serotipos incluidos en la vacuna y del 35,6% frente a la causada por H. influenzae11.
No hay estudios sobre la eficacia de la vacuna 13-valente en los niños con OMA. Comparadas ambas nuevas vacunas, la 13-valente carece de efecto protector frente a H. influenzae, pero incluye serotipos de neumococo emergentes en la OMA, especialmente el 19A. Un estudio reciente ha demostrado una reducción en la colonización nasofaríngea por el serotipo 19A en niños con OMA inmunizados con la vacuna 13-valente, en comparación con los vacunados con la 7-valente12.
Otro problema importante de los patógenos de la OMA es su diferente comportamiento en la cavidad del oído medio. La persistencia en el exudado ótico en niños no tratados con antibióticos después de 2-5 días es de más del 80% para S. pneumoniae, alrededor del 50% para H. influenzae y del 21% para M. catarrhalis13. Esto significa que S. pneumoniae es el patógeno principal en la OMA y la bacteria con menor erradicación espontánea del oído medio.
Más controvertida es la participación de los virus en la OMA. Desde los trabajos de Klein y Teele14 en la década de 1970, se acepta que una infección viral de las vías respiratorias supone un factor favorecedor para la otitis media, pero no es su causa. Sin embargo, investigaciones posteriores encuentran entre un 3 y un 13% de aislamientos virales exclusivos en la OMA15. A pesar de ello, no se ha aceptado plenamente que los virus tengan un papel etiológico en la OMA, más aún cuando no ha podido demostrarse su replicación en la cavidad media del oído.
Resistencia antibiótica
Según datos del último estudio de sensibilidad a los antimicrobianos utilizados en la comunidad en España (SAUCE), la resistencia global del neumococo a la penicilina es de un 23%, con un 0,9% de las cepas con alta resistencia (CMI ≥ 2 ug/ml)16. Las tasas de resistencia son más altas en los niños (27%) y en los aislamientos del oído medio (31%). Estas cifras son las más bajas de la última década y en los últimos años se ha observado una significativa disminución de los aislamientos resistentes; descenso que ha sido más acusado en la población pediátrica. Las causas probablemente son múltiples, pero la introducción de la vacunación antineumocócica se considera una de las más importantes, por haber conseguido disminuir los serotipos más resistentes.
Según datos del Centro Nacional de Microbiología8, la tasa de resistencia a la penicilina (51%) y a la eritromicina (45%) en la OMA neumocócica se ha mantenido relativamente estable en los últimos diez años. Además, se ha evidenciado un incremento significativo de la resistencia a la amoxicilina (el 8% en 2001 frente al 24% en 2009), de forma paralela al incremento de la resistencia a este antibiótico en el serotipo 19A (el 0% en 2001 frente al 38% en 2009). El 19A es en la actualidad el principal serotipo resistente a los antimicrobianos, con tasas de resistencia en la OMA y la mastoiditis del 60% a la penicilina, del 76% a la eritromicina y del 36% a la cefotaxima17, y en la OMA recurrente o persistente, del 78% a la amoxicilina, del 88% a la eritromicina y del 33% a la cefotaxima.
Respecto a H. influenzae, diversos trabajos realizados en Estados Unidos han observado una mayor producción de betalactamasas en los aislamientos de OMA de niños que han recibido la vacunación antineumocócica9,10, si bien esto no se ha constatado en nuestro país, donde solo un pequeño porcentaje de los aislamientos de H. influenzae en niños con OMA son productores de estas enzimas. En el último estudio SAUCE, un 16% de los aislamientos son productores de betalactamasas, cifra que ha disminuido significativamente en los últimos años16. La disminución en la producción de betalactamasas por H. influenzae puede estar relacionada con el menor consumo de antibióticos en la población18.
DIAGNÓSTICO DE LA OTITIS MEDIA AGUDA
El diagnóstico de OMA en la infancia se basa en la clínica y la exploración otoscópica. Las dificultades que presenta se deben a múltiples factores, principalmente a la inespecificidad de los síntomas (que aumenta cuanto más pequeño es el niño) y a la dificultad de la otoscopia (conducto auditivo estrecho y tortuoso, paciente poco colaborador, etc.). Con el fin de mejorar la precisión del diagnóstico, hay que intentar basarse en parámetros lo más objetivos posible, definiendo una serie de criterios clínicos y otoscópicos.
Definición y formas clínicas
Para abordar mejor el diagnóstico (y posteriormente la actitud terapéutica), es preciso definir la otitis media como la presencia de exudado en la cavidad media del oído19. Según la clínica acompañante y las características del exudado, puede dividirse en:
- OMA: presencia sintomática de exudado en el oído medio (generalmente mucopurulento). Es el cuadro al que nos vamos a referir principalmente y se diferencian varias presentaciones:
- OMA esporádica: episodios aislados.
- OMA de repetición: episodios repetidos, a su vez clasificada en:
- OMA persistente: reagudización de los síntomas de la OMA en los primeros siete días tras finalizar tratamiento (se consideran el mismo episodio).
- OMA recidivante (recaída verdadera): reaparición de los síntomas después de siete días de curada (se consideran episodios diferentes).
- OMA recurrente: tendencia a contraer OMA, con infecciones respiratorias de vías altas. Se define como al menos tres episodios en seis meses o al menos cuatro en un año.
- Otitis media con exudado o subaguda (mal llamada otitis media serosa): presencia de exudado en el oído medio de manera asintomática (salvo hipoacusia de transmisión). Suele ocurrir tras una OMA, pero en el 90% de los casos se resuelve espontáneamente. Si persiste más de tres meses, se denomina otitis media crónica con exudado.
- Otitis media crónica con exudado: ocupación del oído medio durante más de tres meses.
Clínica
La otalgia es el dato clínico más específico de OMA20, pero en los niños pequeños es difícil valorar el dolor, por lo que podríamos considerar “equivalentes de otalgia” a la presencia de irritabilidad o llanto intenso (sobre todo de aparición nocturna tras unas horas de sueño)21. La otorrea aguda (purulenta) es muy sugestiva de OMA. Aunque se observan síntomas catarrales en el 70-90% de las OMA, tienen escaso valor discriminativo. Suele haber otros síntomas inespecíficos, como fiebre, vómitos y rechazo del alimento, pero estos datos clínicos por sí solos, en niños menores de tres años (en quienes la otalgia es poco valorable), no nos permiten diferenciar una OMA de una infección respiratoria de vías altas22. El signo del trago, aunque es más típico de la otitis externa, en los lactantes, cuyo conducto auditivo externo es cartilaginoso, también suele ser positivo en la OMA. La aparición de conjuntivitis junto con OMA se ha asociado clásicamente a infección por H. influenzae.
Exploración
- General: deben buscarse signos de bacteriemia-sepsis, como decaimiento, mal estado general, postración y alteración de la perfusión cutánea. También deben explorarse los signos meníngeos y neurológicos por la posibilidad de complicación intracraneal.
- Regional: la OMA suele acompañarse de procesos inflamatorios de las vías respiratorias altas, o puede producir complicaciones regionales, por lo que hay que explorar las fosas nasales, la orofaringe y las regiones cervical y mastoidea.
- Local (otoscopia): después de ver la “poca especificidad” de los datos clínicos, los hallazgos de la otoscopia son fundamentales para un diagnóstico preciso de OMA23. Por tanto, es muy importante poder explorar el tímpano, extrayendo si fuera preciso el cerumen o las secreciones que puedan obstruir el conducto auditivo externo. En la otoscopia podemos observar:
Con la otoscopia neumática (poco accesible en nuestro medio, en las consultas de Pediatría, pero muy recomendada en las guías americanas) puede objetivarse una disminución de la movilidad del tímpano, lo cual aporta datos “objetivos” de que hay exudado en la cavidad media y aumenta, por tanto, la precisión del diagnóstico.
Exploraciones complementarias
Aunque no suelen ser necesarias para el diagnóstico de OMA, en algunos casos deben realizarse pruebas complementarias ante la sospecha de complicaciones (sepsis, meningitis, mastoiditis...): análisis de sangre (hemograma, fórmula y reactantes de fase aguda), hemocultivo, punción lumbar o tomografía computarizada de cráneo y hueso temporal.
Habitualmente, no se requieren estudios microbiológicos, pero son recomendables el cultivo y el antibiograma de la otorrea espontánea (si aparece). En algunos casos seleccionados, puede ser conveniente tomar la muestra por miringotomía o timpanocentesis, por ejemplo en la OMA que no responde al tratamiento y en la recidivante o complicada21.
Criterios diagnósticos de otitis media aguda
Según el consenso sobre otitis media de la American Academy of Pediatrics/American Academy of Family Physicians de 2004, el diagnóstico debe basarse en tres criterios25:
- Comienzo agudo de los síntomas.
- Signos otoscópicos de ocupación del oído medio: abombamiento, neumatoscopia patológica u otorrea.
- Presencia de signos o síntomas inflamatorios (otalgia o intensa hiperemia del tímpano).
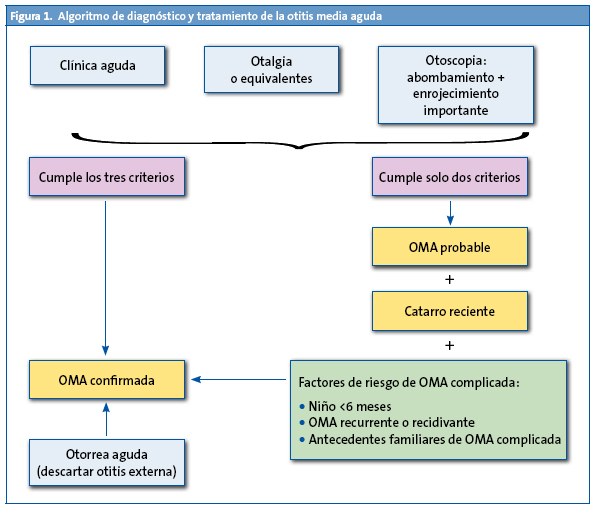
Sin embargo, su aplicación estricta puede dejar fuera casos de posibles OMA, por lo que, en 2007, el consenso sobre OMA de la Asociación Española de Pediatría y de Otorrinolaringología19 dice que cuando se cumplan los tres criterios se denomine “OMA confirmada”, pero si solo hay otalgia evidente sin otoscopia posible (por ejemplo, dificultad técnica manifiesta o cerumen imposible de extracción), o por el contrario, la otoscopia es muy significativa y la otalgia no es clara o confirmada (edad del niño, incertidumbre de los familiares, etc.), el consenso propone que se denomine “OMA probable”. Y si se acompaña de catarro de vías altas reciente, junto con factores de mal pronóstico evolutivo (OMA en un niño menor de seis meses, OMA recidivante o recurrente, o antecedentes familiares de primer grado con secuelas óticas por OMA), la OMA probable se considerará “OMA confirmada” (Fig. 1).
TRATAMIENTO DE LA OTITIS MEDIA AGUDA
Tratamiento sintomático
El tratamiento de elección tras el diagnóstico es la analgesia (IA)25. Suele ser suficiente ibuprofeno o paracetamol por vía oral a las dosis habituales, pero el ibuprofeno muestra un perfil de actuación mejor debido a su doble acción analgésica y antiinflamatoria1. Si no hay respuesta y el dolor es muy intenso, debe plantearse la timpanocentesis19.
Tratamiento antibiótico o conducta expectante
Durante los últimos años, ha surgido una controversia sobre si es preciso el tratamiento de todas las OMA con antibióticos. Estos fármacos se han administrado ampliamente en esta enfermedad con dos fines: evitar las complicaciones y mejorar los síntomas. La complicación grave más frecuente es la mastoiditis26, que ha disminuido de una manera drástica con el uso de la antibioticoterapia27. Un gran estudio28 sobre mastoiditis tras la OMA encuentra que, sin antibiótico, la OMA evoluciona a mastoiditis en 3,8 casos de cada 10 000 episodios, y con antibiótico en 1,828. Es necesario tratar 4831 casos de OMA para prevenir un caso de mastoiditis. No obstante, en fechas recientes se ha descrito un aumento de la incidencia de mastoiditis aguda, posiblemente relacionada con los cambios epidemiológicos ocurridos en las cepas de neumococo en los últimos años29,30, aunque algunos autores no observan este incremento31. No se conoce bien la influencia de la antibioticoterapia sobre otras complicaciones excepcionales, como son la parálisis facial, la laberintitis y la meningitis. En cuanto a la complicación más leve, que es la otitis media con exudado, no se han demostrado beneficios a largo plazo con el tratamiento antibiótico32.
Por otra parte, cerca del 90% de los casos de OMA pueden ser considerados como una enfermedad autolimitada. Numerosos estudios en los últimos años han puesto de manifiesto la buena evolución de la mayoría de las OMA tratadas solo con analgesia, aunque esto depende en gran parte del microorganismo causante. La curación espontánea de las OMA producidas por M. catarrhalis es de más del 75% de los casos, por H. influenzae del 50% y por neumococo tan solo del 17%13. Puesto que únicamente se complica un pequeño porcentaje de las OMA, el objetivo debe ser tratar precozmente el pequeño subgrupo de niños con mala evolución o factores de riesgo.
En cuanto al problema del uso masivo de antibióticos en los niños, hay que tener en cuenta que la OMA ha sido la causa más frecuente de prescripción de estos fármacos en la infancia y ha contribuido de manera muy importante al aumento de las resistencias entre los patógenos respiratorios33, por lo que la tendencia debe ser restringir su uso en la medida de lo posible. Los últimos informes sobre resistencias a los antimicrobianos en España, sobre todo de patógenos respiratorios, muestran una disminución, asociada, entre otros factores, a un uso más racional de la antibioticoterapia empírica16.
Todos estos motivos expuestos, junto a los efectos secundarios de los antibióticos, sustentan la actitud actual de conducta expectante con vigilancia estrecha ante un diagnóstico de OMA, y posponer el tratamiento antibiótico para los casos de mala evolución (los que no hayan mejorado en 48-72 horas)34-37 (IA). Al adoptar esta postura, el médico debe asegurarse la posibilidad de seguimiento del paciente1,19,25.
Grupos de riesgo de mala evolución: tratamiento antibiótico inmediato
Hay evidencia (IA) de que ciertos grupos de niños se benefician del tratamiento antibiótico inmediato al diagnóstico, por su mayor riesgo de mala evolución y por la mejor respuesta a los antibióticos en la OMA grave19,37-40:
- Los menores de dos años, y sobre todo de seis meses, por el mayor riesgo de complicaciones y de recurrencias. Además, en este grupo de edad la curación espontánea es poco frecuente (AI)38.
- Los que presenten OMA grave (fiebre >39 ºC o dolor muy intenso), otorrea u OMA bilateral41. En estos niños se ha confirmado que el beneficio del tratamiento antibiótico precoz es mayor (IA)37.
- Los que tengan antecedentes de OMA recurrente o persistente, o familiares de primer grado con secuelas óticas por enfermedad inflamatoria19.
Elección del antibiótico
Debe tenerse en cuenta el patógeno más probable y su grado de resistencia a los antimicrobianos. Hay que cubrir ante todo el neumococo, por ser el microorganismo con menor porcentaje de curaciones espontáneas y mayor número de complicaciones.
El antibiótico de primera elección es la amoxicilina en dosis altas (80-90 mg/kg al día repartidos cada 8 horas) (IIB). A estas dosis tiene un buen efecto bactericida y llega bien al oído medio1,25,42.
Sin embargo, en los últimos años, desde la introducción de las vacunas antineumocócicas conjugadas, H. influenzae no tipificable productor de betalactamasas tiene cada vez más relevancia, sobre todo en las OMA recurrentes o persistentes43. Además, se calcula que una de cada ocho o nueve otitis producidas por esta bacteria no responde a la amoxicilina44,45. Por tanto, en los niños con riesgo de mala evolución, en quienes se pretende cubrir todo el espectro de microorganismos probables25, y también en los casos de fracaso terapéutico con amoxicilina, debe pautarse como primera elección amoxicilina-ácido clavulánico (8:1) en dosis de 80-90 mg/kg/día de amoxicilina.
En resumen, se indicaría amoxicilina-ácido clavulánico (8:1) en los siguientes casos (IIB):
- Menores de seis meses.
- Clínica grave en niños menores de dos años.
- Antecedentes familiares de secuelas óticas por OMA frecuentes.
- Fracaso terapéutico con amoxicilina.
Tanto la amoxicilina como la amoxicilina-ácido clavulánico, según los conocimientos actuales, se administran preferiblemente tres veces al día. Sin embargo, en situaciones de mal cumplimiento terapéutico o cuando las circunstancias del paciente lo requieran, pueden dosificarse cada 12 horas, ya que, por razones farmacodinámicas, altas dosis de amoxicilina espaciadas 12 horas permiten mantener buenas concentraciones en el foco infeccioso46.
Otros antibióticos
Las cefalosporinas, sobre todo la cefuroxima axetilo, cubren todo el espectro excepto los neumococos resistentes a la penicilina, por lo que constituyen la alternativa en caso de alergia no anafiláctica a las penicilinas40. Si hay intolerancia gástrica al inicio del cuadro, puede empezarse el tratamiento con una dosis de ceftriaxona intramuscular de 50 mg/kg al día, continuando con el tratamiento por vía oral en las siguientes 24 horas1,25. En el caso de que la intolerancia persista, puede mantenerse la dosis diaria de cefriaxona hasta tres días, lo que equivale al tratamiento completo.
Las tasas de resistencia del neumococo a los macrólidos son cada vez más altas, hasta del 30-50% en España16, por lo que deben excluirse del tratamiento, salvo en casos de alergia grave con reacción anafiláctica a la penicilina.
Duración del tratamiento
En la OMA, clásicamente se ha recomendado una pauta larga, de siete a diez días. Sin embargo, algunos estudios han demostrado que puede utilizarse una pauta corta, de cinco días, en OMA no graves en niños mayores de dos años sin factores de riesgo47 (IA). Deben completarse los diez días de tratamiento en los menores de seis meses, en la OMA grave, si hay antecedentes de OMA recurrente y si es una recaída temprana (OMA persistente)19.
Protocolo de tratamiento de la otitis media aguda
- Niños menores de dos meses (IIIC): la OMA se considera una enfermedad grave en estos niños por su riesgo de complicaciones, la inmunosupresión relativa del huésped y la posibilidad de distintos microorganismos causantes (infecciones por gramnegativos48). Se recomienda ingreso hospitalario y, si es posible, timpanocentesis con toma de muestra de exudado ótico para cultivo42.
- Si el niño presenta fiebre o afectación del estado general, el tratamiento será por vía intravenosa con cefotaxima o amoxicilina-ácido clavulánico en dosis estándar, para pasar a la vía oral cuando mejore.
- Si no están presentes los mencionados síntomas, el tratamiento será con amoxicilina-ácido clavulánico por vía oral en dosis altas, y se mantendrá la observación durante dos o tres días, hasta el alta.
- Niños de dos a seis meses de edad (IA): es el grupo con mayor probabilidad de complicaciones y de OMA de repetición. Se recomienda amoxicilina-ácido clavulánico en dosis de 80-90 mg/kg al día, en 2-3 tomas, durante diez días.
- Niños entre seis meses y dos años de edad:
- Un diagnóstico cierto de OMA es indicación de tratamiento antibiótico desde el inicio (IA). Si los síntomas son leves a moderados, se empleará amoxicilina en dosis de 80-90 mg/kg al día durante siete a diez días, en dos o tres tomas. Si los síntomas son graves, se administrará de inicio amoxicilina-ácido clavulánico en dosis altas de amoxicilina.
- Si el diagnóstico es dudoso, se valorará iniciar la antibioticoterapia cuando haya factores de riesgo (OMA de repetición, antecedentes familiares) o afectación grave. En el resto de los casos, se realizará una evaluación en 24-48 horas.
- Niños mayores de dos años:
- Si hay afectación grave o factores de riesgo, el tratamiento consistirá en amoxicilina en dosis de 80-90 mg/kg al día, en dos o tres tomas, durante 7-10 días (IA)41.
- Si la afectación es leve (fiebre <39 ºC, dolor poco intenso) y no hay antecedentes personales ni familiares de riesgo, se pautará tratamiento analgésico y se reevaluará al niño en 48 horas. Si los síntomas persisten o empeoran, se iniciará la antibioticoterapia con amoxicilina en dosis de 80 mg/kg al día y se mantendrá durante cinco días (IIIC).
- Fracaso terapéutico (IIIC): se considera fracaso cuando, a las 48-72 horas del inicio del tratamiento antibiótico, el cuadro clínico no ha mejorado. La actitud será sustituir la antibioticoterapia inicial1,3,25:
- Si era amoxicilina, se sustituirá por amoxicilina-ácido clavulánico (8:1) en dosis de 80-90 mg/kg al día en dos o tres tomas.
- Si era amoxicilina-ácido clavulánico (8:1), se pautará ceftriaxona intramuscular en dosis única de 50 mg/kg al día, durante tres días (AI). La ceftriaxona es un fármaco de uso hospitalario, por lo que obliga al seguimiento del tratamiento desde el hospital.
- Si fracasa el tratamiento con ceftriaxona, están indicados el control por el Servicio de Otorrinolaringología y la realización de timpanocentesis para toma de muestra para cultivo y tratamiento guiado por el antibiograma (IIIC).
- Alergia a las penicilinas:
- Con antecedentes de reacción alérgica no anafiláctica: cefuroxima axetilo en dosis de 30 mg/kg al día, en dos tomas25,38 (IIIC).
- Si el antecedente es de alergia grave con reacción anafiláctica: claritromicina en dosis de 15 mg/kg al día en dos tomas durante siete días, o azitromicina en dosis de 10 mg/kg al día en una toma el primer día, seguida de 5 mg/kg al día en una toma durante cuatro días más, con seguimiento estrecho por la posibilidad de mala evolución. Si esta se produjera, se realizará seguimiento por el Servicio de Otorrinolaringología, con timpanocentesis y tratamiento guiado por el antibiograma. En caso de fracaso del tratamiento con macrólidos, una alternativa es el levofloxacino por vía oral (IIIC) en dosis de 10 mg/kg cada 12 horas en los niños de seis meses a cinco años de edad, y de 10 mg/kg cada 24 horas en los mayores de cinco años (dosis máxima, 500 mg)49,50. Debe considerarse que no existe presentación de levofloxacino en jarabe (se aconseja explicar a la familia las razones y la idoneidad de esta medicación). El ciprofloxacino no es útil en la OMA por su baja actividad frente al neumococo.
CONFLICTO DE INTERESES
Fernando del Castillo, Fernando Baquero y Cristina Calvo han participado en el Estudio Heracles, patrocinado por Pfizer. Fernando Baquero ha colaborado como ponente en conferencias patrocinadas por Pfizer y GSK. El resto de autores declaran no presentar conflicto de intereses.
ABREVIATURAS: AEPap: Asociación Española de Pediatría de Atención Primaria • OMA: otitis media aguda • SAUCE: sensibilidad a los antimicrobianos utilizados en la comunidad en España • SEIP: Sociedad Española de Infectología Pediátrica • SEPEAP: Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria • SEUP: Sociedad Española de Urgencias Pediátricas.
BIBLIOGRAFÍA
- Baquero-Artigao F, Del Castillo F. La otitis media aguda en la era de la vacunación antineumocócica. Enferm Infecc Microbiol Clin. 2008;26:505-9.
- Garbutt J, Jeffe DB, Shackelford P. Diagnosis and treatment of acute otitis media: an assessment. Pediatrics. 2003;112:143-9.
- del Castillo F, García-Perea A, Baquero-Artigao F. Bacteriology of acute otitis media in Spain: a prospective study based on tympanocentesis. Pediatr Infect Dis J. 1996;15:541-3.
- Dagan R, Givon-Lavi N, Zamir O, Sikuler-Cohen M, Guy L, Janco J, et al. Reduction of nasopharyngeal carriage of Streptococcus pneumoniae after administration of a 9-valent pneumococcal conjugate vaccine to toddlers attending day care centers. J Infect Dis. 2002;185:927-36.
- Bogaert D, Veenhoven RH, Sluijter M, Wannet WJW, Rijkers GT, Mitchell TJ, et al. Molecular epidemiology of pneumococcal colonization in response to pneumococcal conjugate vaccination in children with recurrent acute otitis media. J Clin Microbiol. 2005;43:74-83.
- Frazão N, Brito-Avô A, Simas C, Saldanha J, Mato R, Nunes S, et al. Effect of the seven-valent conjugate pneumococcal vaccine on carriage and drug resistance of Streptococcus pneumoniae in healthy children attending day-care centers in Lisbon. Pediatr Infect Dis J. 2005;24:243-52.
- Revai K, McCormick DP, Patel J, Grady JJ, Saeed K, Chonmaitree T. Effect of pneumococcal conjugate vaccine on nasopharyngeal bacterial colonization during acute otitis media. Pediatrics. 2006;117:1823-9.
- Fenoll A, Aguilar L, Vicioso MD, Giménez MJ, Robledo O, Granizo JJ. Increase in serotype 19A prevalence and amoxicillin non-susceptibility among paediatric Streptococcus pneumoniae isolates from middle ear fluid in a passive laboratory-based surveillance in Spain, 1997-2009. BMC Infect Dis. 2011;11:239.
- Block SL, Hedrick J, Harrison CJ, Tyler R, Smith A, Findlay R, et al. Community-wide vaccination with the heptavalent pneumococcal conjugate significantly alters the microbiology of acute otitis media. Pediatr Infect Dis J. 2004;23:829-33.
- Casey JR, Pichichero ME. Changes in frequency and pathogens causing acute otitis media in 1995–2003. Pediatr Infect Dis J. 2004;23:824-8.
- Prymula R, Peeters P, Chrobok V, Kriz P, Novakova E, Kaliskova E, et al. Pneumococcal capsular polysaccharides conjugated to protein D for prevention of acute otitis media caused by both Streptococcus pneumoniae and non-typable Haemophilus influenzae: a randomised double-blind efficacy study. Lancet. 2006;367:740-8.
- Cohen R, Levy C, Bingen E, Koskas M, Nave I, Varon E. Impact of 13-valent pneumococcal conjugate vaccine on pneumococcal nasopharyngeal carriage in children with acute otitis media. Pediatr Infect Dis J. 2012;31:297-301.
- Pichichero ME. Assesing the treatment alternatives for acute otitis media. Pediatr Infect Dis J. 1994;13:S27-S34.
- Klein JO, Teele DW. Isolation of viruses and mycoplasmas from middle ear effusions: a review. Ann Otol Rhinol Laryngol. 1976;85(Suppl 25):140-4.
- Ruuskanen O, Arola M, Heikkinen T, Ziegler T. Viruses in acute otitis media: increasing evidence for clinical significance. Pediatr Infect Dis J. 1991;10:425-7.
- Pérez-Trallero E, Martín-Herrero JE, Mazón A, García-Delafuente C, Robles P, Iriarte V, et al. Antimicrobial resistance among respiratory pathogens in Spain: latest data and changes over 11 years (1996-1997 to 2006-2007). Antimicrob Agents Chemother. 2010;54:2953-9.
- Picazo J, Ruiz-Contreras J, Casado-Flores J, Giangaspro E, del Castillo F, Hernández-Sampelayo T, et al.; Heracles Study Group. Relationship between serotypes, age, and clinical presentation of invasive pneumococcal disease in Madrid, Spain, after introduction of the 7-valent pneumococcal conjugate vaccine into the vaccination calendar. Clin Vaccine Immunol. 2011;18(1):89-94.
- García-Cobos S, Campos J, Cercenado E, Román F, Lázaro E, Pérez-Vázquez M, et al. Antibiotic resistance in Haemophilus influenzae decreased, except for beta-lactamase-negative amoxicillin-resistant isolates, in parallel with community antibiotic consumption in Spain from 1997 to 2007. Antimicrob Agents Chemother. 2008;52:2760-6.
- del Castillo F, Delgado A, Rodrigo C, Cervera J, Villafruela MA, Picazo JJ. Consenso nacional sobre otitis media aguda. An Pediatr (Barc). 2007;66:603-10.
- Castellarnau FE. Otitis. En: Benito FJ, Luances FC, Mintegui FS, Pou FJ. Tratado de urgencias en pediatría, 2.a ed. Madrid: Ergón; 2011. p. 309-33.
- del Castillo F, Baquero F, García MJ, Méndez A. Otitis media aguda. En: Protocolos diagnóstico-terapéuticos de la AEP: Infectología pediátrica. 2008. [en línea] [consultado el 23/04/2012]. Disponible en http://www.aeped.es/sites/default/files/documentos/oma.pdf
- Laine MK, Tähtinen PA, Ruuskanen O, Huovinen P, Ruohola A. Symptoms or symptom-based scores cannot predict acute otitis media at otitis-prone age. Pediatrics. 2010;125:e1154-61.
- Coker TR, Chan LS, Newberry SJ, Limbos MA, Suttorp MJ, Shekelle PG, et al. Diagnosis, microbial epidemiology, and antibiotic treatment of acute otitis media in children. A systematic review. JAMA. 2010;304:2161-9.
- Shaikh N, Hoberman A, Kaleida PH, Rockette HE, Kurs-Lasky M, Hoover H, et al. Otoscopic signs of otitis media. Pediatr Infect Dis J. 2011;30:822-6.
- American Academy of Pediatrics Subcommittee on Management of Acute Otitis Media. Diagnosis and management of acute otitis media. Pediatrics. 2004;113:1451-65.
- Gower D, McGuirt WF. Intracranial complications of acute and chronic infectious ear disease: a problem still with us. Laryngoscope. 1983;93:1028-33.
- Migirov L, Duvdevani S, Kronenberg J. Otogenic intracranial complications. Acta Otolaryngol. 2005;125:819-22.
- Thompson PL, Gilbert RE, Long PF, Saxena S, Sharland M, Wong IC. Effect of antibiotics for otitis media on mastoiditis in children: a retrospective cohort study. Pediatrics. 2009;123:424-30.
- Dudkiewicz M, Livni G, Kornreich L, Nageris B, Ulanovski D, Raveh E. Acute mastoiditis and osteomyelitis of the temporal bone. Int J Pediatr Otorhinolaryngol. 2005;69:1399-405.
- Picazo J, Ruiz-Contreras J, Casado J, Giangaspro E, del Castillo F, Hernández-Sampelayo T, et al. Relationship between serotypes, age, and clinical presentation of invasive pneumococcal disease in Madrid, Spain, after introduction of the 7-valent pneumococcal conjugate vaccine into the vaccination calendar. Clin Vaccine Immunol. 2011;18:89-94.
- Groth A, Enoksson F, Hermansson A, Hultcrantz M, Stalfors J, Stenfeldt K. Acute mastoiditis in children in Sweden 1993-2007 - No increase after new guidelines. Int J Pediatr Otorhinolaryngol. 2011;75:1496-501.
- American Academy of Family Physicians; American Academy of Otolaryngology-Head and Neck Surgery; American Academy of Pediatrics Subcommittee on Otitis Media with Effusion. Otitis media with effusion. Pediatrics. 2004;113(5):1412-29.
- Picazo JJ, Betriu C, Rodríguez-Avial I, Azahares E, Ali Sánchez B. Vigilancia de resistencias a los antimicrobianos: estudio VIRA. Enferm Infecc Microbiol Clin. 2002;20:503-10.
- Stevanovic T, Komazec Z, Lemajic-Komazec S, Jovic R. Acute otitis media: to follow-up or treat? Int J Pediatr Otorhinolaryngol. 2010;74:930-3.
- Johnson NC, Holger JS. Pediatric acute otitis media: the case for delayed antibiotic treatment. J Emerg Med. 2007;32;279-84.
- McCormick DP, Chonmaitree T, Pittman C, Saeed K, Friedman NR, Uchida T, et al. Nonsevere acute otitis media: a clinical trial comparing outcomes of watchful waiting versus immediate antibiotic treatment. Pediatrics. 2005;115;1455-65.
- Rovers MM, Glasziou P, Appelman CL, Saeed K, Friedman NR, Uchida T, et al. Predictors of pain and/or fever at 3 to 7 days for children with acute otitis media non treated initially with antibiotics: a meta-analysis of individual patient data. Pediatrics. 2007;119:579-85.
- Hoberman A, Paradise JL, Rockette HE, Shaikh N, Wald ER, Kearney DH, et al. Treatment of acute otitis media in children under 2 years of age. N Engl J Med. 2011;364:105-15.
- Tahtinen PA, Laine MK, Huovinen P, Jalava J, Ruuskanen O, Ruohola A, et al. A placebo-controlled trial of antimicrobial treatment for acute otitis media. N Engl J Med. 2011;364:116-56.
- del Castillo F. Otitis media aguda: criterios diagnósticos y aproximación terapeútica. An Esp Pediatr. 2002;56 Suppl. 1:40-7.
- Marchissio P, Bellussi L, Di Mauro G, Doria M, Felisati G, Longhi R, et al. Acute otitis media: from diagosis to prevention. Summary of the Italian guideline. Int J Pediatr Otorhinolaryngol. 2010;74:1209-16.
- Gould JM, Matz PS. Otitis media. Pediatr Rev. 2010;31:102-16.
- Ito M, Hotomi M, Maruyama Y, Hatano M, Sugimoto H, Yoshizaki T, et al. Clonal spread of beta-lactamase-producing amoxicillin-clavulanate-resistant strains of non-typeable Haemophilus influenzae among young children attending a day care in Japan. Int J Pediatr Otorhinolaryngol. 2010;74:901-6.
- Klein JO. Antimicrobial therapy issues facing pediatricians. Pediatr Infect Dis J. 1995;14:415-19.
- Sox CM, Finkelstein JA, Yin R, Kleinman K, Lieu TA. Trends in otitis media treatment failure and relapse. Pediatrics. 2008;121:674-9.
- Isla A, Trocóniz IF, Canut A, Labora A, Martín-Herrero JE, Pedraz JL, et al. Evaluación farmacocinética/farmacodinámica de agentes antimicrobianos para el tratamiento de la otitis media aguda en España. Enferm Infecc Microbiol Clin. 2011;29:167-73.
- Kozyrskyj Al, Hildes-Ripstein GE, Longstaffe SE, Wincott JL, Sitar DS, Klassen TP, et al. Treatment of acute otitis media with a shortened course of antibiotics: a meta-analysis. JAMA.1998;279:1736-42.
- Berkun Y, Nir-Paz R, Ami AB, Klar A, Deutsch E, Hurvitz H. Acute otitis media in the first two months of life: characteristics and diagnostic difficulties. Arch Dis Child. 2008;93:690-4.
- Grimprel E, Cohen R. Levofloxacin in children. Arch Pediatr. 2010;17:S129-32.
- Moraga Llop FA, Cabañas Poy MJ. Guía de antiinfecciosos en pediatría. Madrid: Sanofi Pasteur MSD; 2010.




