Vol. 14 - Num. 53
Grupo PrevInfad/PAPPS Infancia y Adolescencia
Prevención y cribado de la ferropenia en lactantes
Francisco Javier Sánchez Ruiz-Cabelloa, Grupo PrevInfad/PAPPS Infancia y Adolescenciab
aPediatra. CS Zaidín Sur. Granada. España.
bJosé María Mengual Gil (coord.).
Correspondencia: FJ Sánchez. Correo electrónico: jsanchezrc@gmail.com
Cómo citar este artículo: Sánchez Ruiz-Cabello FJ, Grupo PrevInfad/PAPPS Infancia y Adolescencia. Prevención y cribado de la ferropenia en lactantes. Rev Pediatr Aten Primaria. 2012;14:75-82.
Publicado en Internet: 16-04-2012 - Número de visitas: 25834
Resumen
La ferropenia es un problema frecuente en el lactante. Distintos estudios relacionan la ferropenia con potenciales efectos sobre el neurodesarrollo, aunque aún no existe evidencia suficiente. La mayoría de organizaciones no recomiendan la suplementación universal en lactantes sanos nacidos a término, aunque hay consenso en suplementar si hay factores de riesgo. También es tema de controversia el cribado de la ferropenia en el lactante, mientras algunas organizaciones lo recomiendan solo a grupos de riesgo, otras entidades, proponen el cribado universal. El objetivo de este artículo es revisar las necesidades de hierro durante el primer año, así como las recomendaciones de los principales comités.
Palabras clave
● Anemia ● Ferropenia ● Lactante ● Prevención y controlNota:
bGrupo PrevInfad (AEPap): F. J. Soriano Faura (coord.), J. Colomer Revuelta, O. Cortés Rico, M. J. Esparza Olcina, J. Galbe Sánchez-Ventura, J. García Aguado, A. Martínez Rubio, M. Merino Moína, C. R. Pallás Alonso, J. Pericas Bosch, F. J. Sánchez Ruiz-Cabello.
DEFINICIONES
El déficit de hierro es la deficiencia nutricional más prevalente en los niños. El déficit subclínico de hierro es especialmente común en la primera infancia.
El estado nutricional del hierro se determina utilizando diversos marcadores, como los niveles de hemoglobina (Hb), ferritina, protoporfirina eritrocitaria libre, transferrina y receptor de la transferrina1-3.
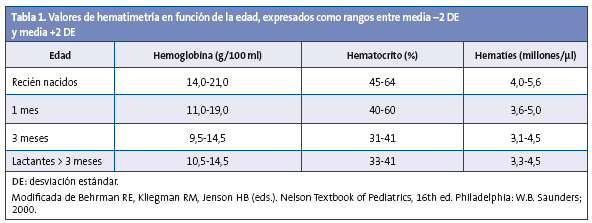
La anemia ferropénica se define cuando las cifras de Hb están por debajo de 2 desviaciones estándar (DE) de la media para la edad y el sexo (Tabla 1), y a su vez se acompañan de ferropenia manifiesta que conlleva decremento de la ferritina (< 10 ng/ml), de la saturación de transferrina y del contenido de hemoglobina reticulocitaria (CHr)1,4.
REQUERIMIENTOS DE HIERRO DURANTE LA LACTANCIA
En los primeros seis meses de vida, la fuente principal de hierro es el hierro fetal almacenado en las últimas semanas de gestación y el liberado por la Hb fetal durante las dos primeras semanas de vida.
El peso al nacer, los suplementos prenatales de hierro y el tiempo que se tarda en pinzar el cordón umbilical influyen en el hierro total al nacer5,6. Hasta hace pocos años, la práctica habitual en el manejo del tercer estadio del parto ha sido el pinzamiento precoz del cordón umbilical. Este procedimiento, muy extendido en todo el mundo occidental, carece de pruebas que lo sustenten y va en contra de lo que acontece en el resto de los mamíferos, en los que el recién nacido no se separa de la placenta hasta que el cordón umbilical deja de latir. En los últimos años han aparecido numerosos estudios que muestran los beneficios y los riesgos de retrasar el pinzamiento del cordón umbilical. En un cuidadoso metaanálisis publicado en 2007, que incluía 15 ensayos clínicos y un total de 1912 recién nacidos a término, los autores concluyeron que se dispone de adecuada evidencia para aconsejar el retraso de, al menos, dos minutos en el pinzamiento del cordón umbilical. Este retraso conlleva beneficios significativos para el niño, que van más allá del periodo neonatal, ya que se muestra una diferencia significativa en la frecuencia de anemia de los dos a los tres meses de edad (riesgo relativo [RR]: 0,53; intervalo de confianza del 95% [IC 95%]: 0,40-0,70), con un insignificante incremento en la frecuencia de taquipnea transitoria e hiperbilirrubinemia. En una revisión Cochrane realizada en 2008, los autores concluyen que el retraso del pinzamiento del cordón dos o tres minutos no incrementa el riesgo de hemorragia posparto y puede tener ventajas para el niño, porque mejora sus depósitos de hierro a los tres y a los seis meses de edad. Esto tiene especial valor en los países en los que el acceso a una buena nutrición es difícil7,8.
Otro factor que influye en la concentración de ferritina al nacer es la presencia de patología materna, como anemia, hipertensión o diabetes. Durante el periodo postnatal el aumento ponderoestatural se asocia al aumento de la hemoglobina y de la mioglobina, y esto influye en las mayores necesidades de hierro.
En el prematuro coinciden una serie de circunstancias que favorecen el desarrollo de ferropenia: menores depósitos, menor supervivencia de los hematíes (40-60 días), mayor velocidad de crecimiento (con el consiguiente aumento de la masa eritrocitaria), escasa respuesta eritropoyética a la anemia y las frecuentes extracciones practicadas durante su hospitalización.
Los requerimientos de hierro varían en gran medida según la edad del lactante. Así, se estima que a partir del nacimiento se requieren 0,27 mg/día y a partir de los cuatro meses los requerimientos aumentan a 0,78 mg/día. Las recomendaciones actuales de ingesta de hierro en los niños de 6 a 12 meses ascienden a 11 mg/día5,6.
PREVALENCIA
El déficit de hierro es una de las carencias nutricionales más frecuentes, constituyendo la deficiencia nutricional de mayor prevalencia en la primera infancia en los países desarrollados. Se calcula que 1000 millones de individuos en el mundo tienen carencia de hierro, por lo que la Organización Mundial de la Salud (OMS) la considera un problema de salud pública mundial.
En el estudio del National Health and Nutrition Examination Survey (NHANES) de 1999-2000 se refirió una prevalencia máxima de ferropenia, con o sin anemia, del 9 al 16% en chicas adolescentes, y del 7% en niños pequeños durante el periodo de rápido crecimiento cerebral.
En España, en 2002, un estudio llevado a cabo en Navarra refirió una prevalencia de ferropenia del 9,6% en lactantes sanos de 12 meses y de anemia ferropénica del 4,3%9.
EVOLUCIÓN NATURAL. EVIDENCIA-EFECTIVIDAD DE LA DETECCIÓN PRECOZ. POSIBILIDAD DE MEJORA PRONÓSTICA
En la evolución natural de la anemia ferropénica se pueden diferenciar tres estadios sucesivos: en primer lugar disminuyen los depósitos, posteriormente aparece la ferropenia y finalmente disminuye la Hb. La deficiencia de hierro es considerada un factor de riesgo para la anemia ferropénica.
Existe buena evidencia, obtenida de estudios aleatorizados controlados y de estudios longitudinales, de que los suplementos de hierro, en sus distintas formas (fórmulas reforzadas, cereales, etc.), previenen la anemia ferropénica, pero existe poca evidencia de que aporten beneficios para la salud, al menos en niños sin factores de riesgo.
En cuanto a los beneficios de la suplementación en niños de riesgo, hay buena evidencia (estudios controlados aleatorizados) de que los aportes de hierro mejoran el crecimiento y los parámetros somatométricos y analíticos.
La anemia ferropénica se ha asociado con alteraciones de la conducta y del desarrollo en estudios a corto y a largo plazo. En una revisión Cochrane sobre si el tratamiento de la anemia ferropénica mejoraba el desarrollo psicomotor, se concluyó que había insuficiente evidencia para confirmar la hipótesis y que la relación causa efecto no podía ser demostrada. El U.S. Preventive Services Task Force (USPSTF), en la revisión de 2006, informó también de que había escasa evidencia (estudios contradictorios) de que el tratamiento de la anemia ferropénica beneficiara el desarrollo psicomotor10-17.
No hay pruebas en cuanto a problemas médicos, efectos adversos o secundarios en relación con aportes suplementarios de hierro, de forma que no hay suficientes datos para pensar que el aporte de hierro predisponga a gastroenteritis, síntomas intestinales, cólico, mayor susceptibilidad a infecciones, etc.18-21.
FÓRMULAS REFORZADAS
Hay estudios que demuestran que el déficit de hierro y la anemia ferropénica se reducen con fórmulas reforzadas o lactancia materna y cereales con hierro a partir del sexto mes, en comparación con fórmulas no reforzadas.
Hay estudios enmascarados con doble ciego que muestran que las fórmulas reforzadas reducen el déficit de hierro y la anemia ferropénica. No obstante, también hay estudios que apenas demuestran cambios en las cifras hemáticas con las fórmulas reforzadas, y otros autores discuten cuál sería el aporte óptimo con estas fórmulas.
En Europa, según la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN), las fórmulas de inicio deben aportar no menos de 7 mg de hierro por litro y las de continuación entre 7-14 mg/l. En EE. UU., las fórmulas reforzadas suelen tener 10-12 mg de hierro por litro, y las no reforzadas, entre 1,1 y 1,5 mg/l.
Un 28-38% de los lactantes de nueve meses de edad, alimentados con fórmulas no reforzadas, tienen anemia, prevalencia que se reduce drásticamente con fórmulas reforzadas (hasta el 0,6%). Las fórmulas con concentraciones medias de hierro (4-7 mg por litro), si bien pueden no aumentar tanto los depósitos orgánicos, no dan diferencias en las cifras de Hb respecto a las que tienen más hierro.
En general, se sabe que en los últimos años ha disminuido la prevalencia de la anemia ferropénica, debido fundamentalmente al aumento del nivel socioeconómico y a la utilización de fórmulas reforzadas, cereales con hierro y alimentación complementaria rica en hierro22-26.
CRIBADO
No hay una prueba única de cribado (“patrón oro”) para la detección de la anemia ferropénica. La Hb es la prueba de elección para el cribado de anemia, pero para demostrar el déficit de hierro sería necesario determinar además la ferritina sérica y la proteína C reactiva (PCR). La saturación de transferrina y el CHr son también buenos marcadores de ferropenia, pero quedarían en un segundo plano por motivos de coste-beneficio y aplicabilidad, ya que habitualmente no hay disponibilidad para determinar el CHr.
La Hb y el hematocrito tienen una especificidad y sensibilidad del 25 y del 73%, respectivamente, para demostrar la anemia ferropénica. Se pueden determinar en sangre capilar, aunque sus cifras son algo más variables que en sangre venosa.
La ferritina sérica con PCR sería la prueba de elección para determinar la ferropenia.
La saturación de transferrina es un buen marcador de eritropoyesis deficitaria en hierro y se mantiene en valores fiables a pesar de la coexistencia con una infección.
El CHr muestra una buena correlación con la saturación de transferrina, ya que ambos parámetros identifican la segunda fase de la deficiencia de hierro.
El valor predictivo positivo (VPP) del cribado se incrementa en zonas de prevalencia de anemia superiores al 10%, así, si la prevalencia es menor del 10%, el VPP es bajo.
Se recomienda el cribado de anemia ferropénica en todos los prematuros de menos de 1500 g. No se recomienda cribado en niños sin factores de riesgo ni segundo cribado en población de alto riesgo con un primer cribado normal5,27-31 (Tablas 2 y 3).

APORTES DE HIERRO
Recomendaciones generales
- La recomendación de lactancia materna exclusiva hasta los seis meses forma parte de la prevención primaria de la anemia ferropénica.
- En caso de no amamantar, se recomiendan sucedáneos de leche materna reforzados con, al menos, 7 mg/l de hierro.
- Se recomienda añadir alimentación complementaria rica en hierro a partir del sexto mes de vida en lactantes a término con lactancia materna, para asegurar unos aportes de 1 mg/kg/día de hierro.
Recomendaciones específicas sobre aportes de hierro5,27-34
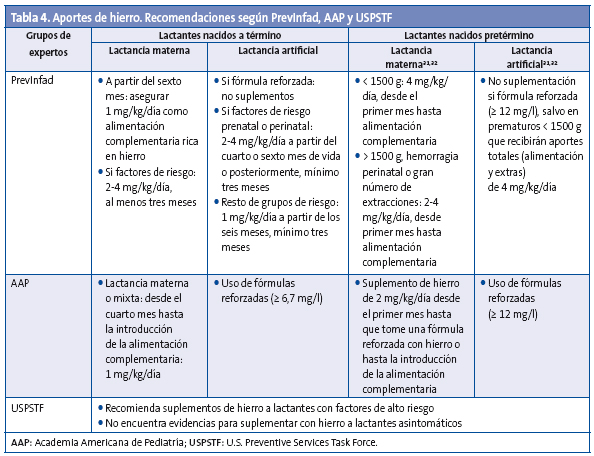
No hay evidencias para suplementar con hierro oral como medicamento a la población sin riesgo (Tabla 4).
Lactantes a término alimentados con lactancia materna
La OMS recomienda la lactancia materna exclusiva durante los primeros seis meses de vida y la Academia Americana de Pediatría (AAP) la recomienda durante un mínimo de cuatro meses y preferentemente durante seis.
La progresiva disminución de los depósitos motiva que, a partir del sexto mes, las fuentes exógenas de hierro cobren una gran importancia en la prevención de la ferropenia. De hecho, la lactancia materna exclusiva más allá de seis meses se ha asociado con un aumento de riesgo de la anemia por déficit de hierro. La leche materna tiene baja cantidad de hierro (entre 0,2 y 0,4 mg/l), pero su biodisponibilidad es alta.
La alimentación complementaria puede aportar una ingesta suficiente de hierro a través de alimentos ricos en hierro hem (carnes, aves de corral, pescado) y no hem (legumbres). Además, debe hacerse hincapié en los alimentos que pueden mejorar la absorción y utilización del hierro, como frutas, verduras y tubérculos, que son buenas fuentes de vitaminas A, C y ácido fólico. Igualmente, deben conocerse los factores que pueden dificultar la absorción del hierro. Aún no está clara la biodisponibilidad del hierro de los cereales reforzados, por la presencia de inhibidores de la absorción.
Es importante retrasar la introducción de leche de vaca para después del primer año de vida, porque, aunque contiene algo más de hierro que la leche materna, su biodisponibilidad es muy baja y además interfiere con la absorción del hierro de otros alimentos.
Para PrevInfad, los lactantes con lactancia materna exclusiva deberían recibir, a partir de los seis meses, unos aportes totales de 1 mg/kg/día de hierro mediante alimentación complementaria rica en hierro, a menos que tengan algún factor de riesgo, en cuyo caso deben recibir 2-4 mg/kg/día a partir del sexto mes de vida, durante un mínimo de tres meses. En niños con lactancia mixta también se recomiendan unos aportes de 1 mg/kg/día a partir del sexto mes, en forma de alimentación complementaria rica en hierro.
Las recomendaciones de otros grupos son diversas: la AAP recomienda que, a partir de los cuatro meses de edad, los lactantes alimentados con lactancia materna exclusiva complementen con 1 mg/kg por día de hierro oral hasta que se introduzca la alimentación complementaria. Para el USPSTF existe evidencia de grado B para suplementar con hierro a lactantes de alto riesgo, mientras que la evidencia es insuficiente para hacerlo de forma universal.
En general se recomienda el uso de gotas de sulfato ferroso o vitaminas con hierro, en una sola dosis al día.
Lactantes a término alimentados con lactancia artificial
En estos lactantes se recomienda utilizar fórmulas suplementadas, desaconsejándose las de bajo contenido en hierro (menos de 7 mg/l). La gran mayoría de las fórmulas utilizadas en nuestro medio se adaptan a las recomendaciones de la ESPGHAN y tienen un adecuado contenido en este metal (7-14 mg/l), sin que esto suponga efectos secundarios digestivos. Con fórmulas de más de 7 mg/l de hierro se ingiere al menos 1 mg/kg/día, ingesta mínima recomendada por la AAP, por lo tanto no se recomiendan suplementos si un lactante es alimentado con estas fórmulas.
Para PrevInfad tampoco hay que suplementar si el lactante toma leche reforzada. En niños con factores de riesgo asociados (Tabla 2), se actuará según el grupo de riesgo.
Lactantes pretérmino alimentados con lactancia materna
Los prematuros sanos deben recibir aportes de hierro desde el primer mes de vida hasta que tomen alimentación complementaria rica en hierro, a una dosis de 4 mg/kg/día si el peso al nacimiento fue inferior a 1500 g y de 2-4 mg/kg/día si el peso fue mayor de 1500 g (mayor dosis a menor edad gestacional).
Se recomienda el uso de suplementos orales en forma de sulfato ferroso o soluciones de complejos de polisacáridos con hierro trivalente.
Lactantes pretérmino alimentados con lactancia artificial
Los recién nacidos prematuros alimentados con una fórmula estándar para prematuros (14,6 mg/l de hierro) o una normal (8-13 mg/l) reciben aproximadamente 1,5 a 2,2 mg/kg/día de hierro con la fórmula pero, a pesar de los aportes de hierro que estas contienen, se estima que el 14% de los recién nacidos prematuros desarrollarán ferropenia entre los cuatro y los ocho meses de edad.
PrevInfad, al igual que otros grupos como la AAP o la ESPGHAN, recomienda una ingesta mínima de hierro de 2 mg/kg/día, que se consigue con las fórmulas artificiales que tengan un contenido de hierro igual o superior a 12 mg/l.
No se recomienda la suplementación de hierro para prematuros que reciban una fórmula reforzada con ≥ 12 mg/l de hierro. Si el niño toma fórmula de inicio, se descontará, en la cantidad de hierro a suplementar, 1,5 mg/kg/día que proporciona la leche. Los prematuros de menos de 1500 g recibirán aportes extras hasta llegar a un total de 4 mg/kg/día, descontando aproximadamente 1,5 mg/kg/día como aportes de la alimentación, manteniéndose hasta que reciban alimentación complementaria variada.
RESUMEN DE LAS RECOMENDACIONES PREVINFAD
Cribado
- No se recomienda el cribado universal de anemia ferropénica.
- Se recomienda el cribado de anemia ferropénica en todos los prematuros menores de 1500 g.
- No hay evidencias para recomendar un segundo cribado en niños con factores de riesgo con un primer cribado normal.
Recomendaciones generales sobre aportes de hierro
- Recomendar lactancia materna exclusiva hasta los seis meses forma parte de la prevención primaria de la anemia ferropénica.
- En caso de no amamantar, se recomendarán sucedáneos de leche de madre reforzados con > 7 mg/l.
- Se recomienda añadir alimentación complementaria rica en hierro en lactantes a término con lactancia materna a partir del sexto mes de vida (para asegurar aportes de 1 mg/kg/día).
Recomendaciones específicas sobre aportes de hierro
- No hay evidencias para suplementar a la población sin riesgo.
- Se recomiendan suplementos en prematuros y lactantes de riesgo.
ABREVIATURAS: AAP: Academia Americana de Pediatría • CHr: contenido de hemoglobina reticulocitaria • DE: desviación estándar • ESPGHAN: European Society for Paediatric Gastroenterology, Hepatology and Nutrition • Hb: hemoglobina • IC 95%: intervalo de confianza del 95% • NHANES: National Health and Nutrition Examination Survey • OMS: Organización Mundial de la Salud • PCR: proteína C reactiva • RR: riesgo relativo • USPSTF: U.S. Preventive Services Task Force • VPP: valor predictivo positivo.
BIBLIOGRAFÍA
- Domellof M, Dewey KG, Lonnerdal B, Cohen RJ, Hernell O. The diagnostic criteria for iron deficiency in infants should be reevaluated. J Nutr. 2002;132:3680-6.
- Monteagudo E, Dalmau J, Carreras C. Deficiencia de hierro en lactantes. Acta Pediatr Esp. 1999;57:145-50.
- Lafuente P. Anemia y deplección de depósitos de hierro en lactantes sanos de 12 meses de edad. An Esp Pediatr. 1992;37:24-8.
- Freire WB. Iron-deficiency anemia: PAHO/WHO strategies to fight it. La anemia por deficiencia de hierro: estrategias de la OPS/OMS para combatirla. Salud Publica Mex. 1998;40(2):199-205.
- Baker RD, Greer FR. Committee on Nutrition American Academy of Pediatrics. Diagnosis and Prevention of Iron Deficiency and Iron-Deficiency Anemia in Infants and Young Children (0-3 Years of Age). Pediatrics. 2010;126:1040-50.
- American Academy of Pediatrics. Committee on Nutrition. Iron balance and requirements in infancy. Pediatrics. 1969;43:134-42.
- Hutton E, Hassan E. Late vs Early Clamping of the Umbilical Cord in Full-term Neonates. Systematic Review and Meta-analysis of Controlled Trials. JAMA. 2007;297:1241-52.
- McDonald SJ, Middleton P. Effect of timing of umbilical cord clamping of term infants on maternal and neonatal outcomes. Cochrane Database of Systematic Reviews 2008;(2):CD004074.
- Durá Travé T, Díaz Vélaz L. Prevalencia de la deficiencia de hierro en lactantes sanos de 12 meses de edad. An Esp Pediatr. 2002;57(3):209-14.
- Lozoff B, Smith J, Liberzon T, Argul-Barroso R, Jiminez E. Longitudinal analysis of cognitive and motor effects of iron deficiency in infancy. Pediatr Res. 2004;55:23A.
- Logan S, Martins S, Gilbert R. Iron therapy for improving psychomotor development and cognitive function in children under the age of three with iron deficiency anemia. Cochrane Database Syst Rev. 2001;(2):CD001444
- Guesry P. The role of nutrition in brain development. Prev Med. 1998;27:189-94.
- Mendelsohn AL, Dreyer BP, Fierman AH, Rosen CM, Legano LA, Kruger HA, et al. Low-level lead exposure and behavior in early childhood. Pediatrics. 1998;101(3):E10.
- Ruff HA, Markowitz ME, Bijur PE, Rosen JF. Relationships among blood lead levels, iron deficiency, and cognitive development in two-year-old children. Environ Health Perspect. 1996;104(2):180-5.
- Lozoff B, Wolf AW, Jimenez E. Iron-deficiency anemia and infant development: effects of extended oral iron therapy. J Pediatr. 1996;129(3):382-9.
- Williams J, Wolff A, Daly A, MacDonald A, Aukett A, Booth IW. Iron supplemented formula milk related to reduction in psychomotor decline in infants from inner city areas: randomised study. BMJ. 1999;318(7185):693-7.
- Moffatt ME, Longstaffe S, Besant J, Dureski C. Prevention of iron deficiency and psychomotor decline in high-risk infants through use of iron-fortified infant formula: a randomized clinical trial. J Pediatr. 1994;125:527-34.
- Heresi G, Pizarro F, Olivares M, Cayazzo M, Hertrampf E, Walter T, et al. Effect of supplementation with an iron-fortified milk on incidence of diarrhea and respiratory infection in urban-resident infants. Scand J Infect Dis.1995;27(4):385-9.
- Oski FA. Iron-fortified formulas and gastrointestinal symptoms in infants: a controlled study. Pediatrics. 1980;66:168-70.
- Nelson SE, Ziegler EE, Copeland AM, Edwards BB, Fomon SJ. Lack of adverse reactions to iron-fortified formula. Pediatrics. 1988;81:360-4.
- Reeves JD, Yip R. Lack of adverse side effects of oral ferrous sulfate therapy in 1-year-old infants. Pediatrics. 1985;75:352-5.
- American Academy of Pediatrics. Committee on Nutrition. Policy Statement. Iron Fortification of Infant Formulas. Pediatrics.1999;104:119-23.
- American Academy of Pediatrics, Committee on Nutrition. Iron supplementation for infants. Pediatrics. 1976;58:765-8.
- American Academy of Pediatrics. Committee on Nutrition. Iron-fortified infant formulas. Pediatrics.1989;84:1114-5.
- Fomon SJ, Ziegler EE, Serfass RE, Nelson SE, Frantz JA. Erythrocyte incorporation of iron is similar in infants fed formulas fortified with 12 mg/L or 8 mg/L of iron. J Nutr. 1997;127(1):83-8.
- Walter T, Pino P, Pizarro F, Lozoff B. Prevention of iron-deficiency anemia: comparison of high and low-iron formulas in term healthy infants after six months of life. J Pediatr. 1998;132(4):635-40.
- Green M, Palfrey JS. Bright Futures: Guideline for Health Supervision of Infants, Children, and Adolescents. Pocket Guide (2nd ed.). 2002. American Academy of Family Physicians [en línea] [consultado el 20/02/2012]. Disponible en www.brightfutures.org/pocket/index.html
- National Committee Canadian Pediatrics Society: Meeting the iron needs of infants and young children: an update. Can Med Assoc J. 1991;144:1451-3.
- Mudra Kohli-Kumar. Screening for Anemia in Children: AAP Recommendations-A Critique. Pediatrics. 2001;108(3):56.
- Sánchez-Ruiz Cabello FJ y Grupo PrevInfad. Prevención y detección de la ferropenia. Rev Pediatr Aten Primaria. 2004;6:463-7.
- Helfand M, Freeman M, Nygren P, Walker M. Screening for Iron Deficiency Anemia in Childhood and Pregnancy: Update of 1996 USPSTF Review. Evidence Synthesis No. 43 (prepared by the Oregon Evidence-based Practice Center under Contract No. 290-02-0024.) Rockville, MD: Agency for Healthcare Research and Quality; 2006.
- ESPGHAN Committee on Nutrition: Feeding Preterm Infants After Hospital Discharge. A Commentary by the ESPGHAN Committee o Nutrition. J Pediatr Gastroenterol Nutr. 2006;42:596-603.
- Schanler RJ. Post-discharge nutrition for the preterm infant. Acta Paediatr Suppl. 2005;94:68-73.
- Wang CJ, McGlynn EA, Brook RH, Leonard CH, Piecuch RE, Hsueh SI, et al. Quality-of-care indicators for the neurodevelopmental follow-up of very low birth weight children: results of an expert panel process. Pediatrics. 2006;117:2080-92.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.





