Vol. 11 - Num. 16
Endocrinología pediátrica
Enfermedades frecuentes del tiroides en la infancia
Susana Ares Seguraa, J Quero Jiménezb, G Morreale de Escobarc
aPediatra. Servicio de Neonatología. Hospital Infantil La Paz. Madrid. España.
bCatedrático de Pediatría. Universidad Autónoma de Madrid. Jefe de Servicio, Servicio de Neonatología. Hospital Infantil La Paz. Madrid. España.
cUniversidad Autónoma de Madrid. Instituto de Investigaciones Biomédicas Alberto Sols. Consejo Superior de Investigaciones Científicas. Madrid. España.
Cómo citar este artículo: Ares Segura S, Quero Jiménez J, Morreale de Escobar G. Enfermedades frecuentes del tiroides en la infancia. Rev Pediatr Aten Primaria. 2009;11 Supl 16:s173-s204.
Publicado en Internet: 31-10-2009 - Número de visitas: 558997
Resumen
La aparición de alteraciones de la función tiroidea en los niños es muy frecuente. Parece que hay datos suficientes para asegurar que el seguimiento de las hormonas tiroideas, al menos durante la infancia, es muy útil para evitar posibles problemas a largo plazo. Por tanto, cualquier beneficio potencial sería mayor que los posibles efectos dañinos. En los controles de salud de los niños, siempre debe investigarse la presencia de signos de sospecha de disfunción endocrinológica. En esta especialidad tan vinculada a los procesos de crecimiento y desarrollo, donde los signos de casi todas sus patologías son muy discretos en su comienzo, debe agudizarse al máximo la observación, ya que es importante el diagnóstico precoz para que los tratamientos resulten eficaces y puedan evitar las secuelas de la enfermedad. Solo si se investiga, la mayoría de las enfermedades endocrinológicas pueden ser descubiertas tempranamente. Únicamente el pediatra puede contribuir al diagnóstico precoz. La interpretación de normalidad/anormalidad del proceso de crecimiento y desarrollo del niño, es una herramienta de gran utilidad durante la infancia. En la etapa de estudio, así como en la de tratamiento, una vez confirmada la enfermedad, el pediatra debe integrar el equipo ampliado de atención del niño. El pediatra por su parte, en estrecha comunicación con el grupo especializado, conducirá a la familia y al paciente en su nueva condición de enfermo crónico.
Palabras clave
● Bocio ● Desarrollo psicomotor ● Función tiroidea ● Tiroiditis ● TiroxinaIntroducción
El tiroides es una glándula situada en la parte anterior del cuello, responsable de la secreción de las hormonas tiroideas: tiroxina o T4, y triyodotironina o T3 (figura 1).
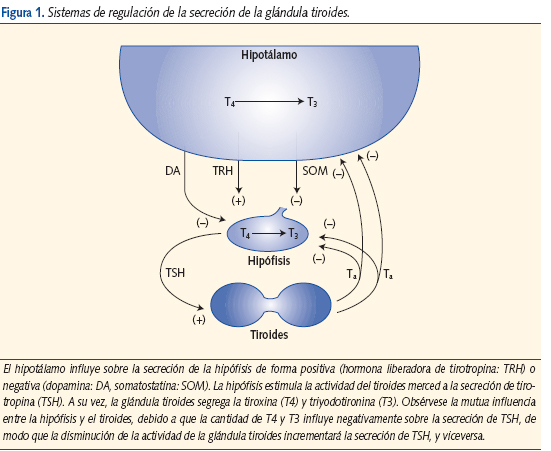
Estas hormonas regulan aspectos importantes del crecimiento, el desarrollo y las funciones de las células y órganos de nuestro organismo a lo largo de toda la vida, incluidas las neuronas de nuestro cerebro. Su secreción está controlada por otra hormona, la hormona tirotropa o TSH, que es segregada por la hipófisis, situada en la base del cráneo, cuya función es promover y estimular la función y secreción del tiroides. Este control toma la forma de una retroalimentación negativa: cuando la secreción de tiroides (T4 y T3) disminuye, se estimula compensatoriamente la secreción de TSH; y viceversa, cuando la secreción de T4 y T3 aumenta, la secreción de TSH disminuye. Por este motivo, en los análisis de sangre que normalmente se realizan para estudiar la función tiroidea, el aumento de TSH sugiere que la función del tiroides está disminuida. La glándula tiroides por su tamaño y ubicación, puede explorarse por palpación. Cuando la función tiroidea está patológicamente deprimida, aparece hipotiroidismo, y cuando la función tiroidea está patológicamente incrementada, el hipertiroidismo1-4.
Embriología
El tiroides es la primera glándula endócrina que aparece durante el desarrollo embrionario. Se puede identificar a los 16-17 días de gestación como un esbozo endodérmico medial en la cara ventral de la faringe, entre los arcos branquiales 1 y 2. En su proceso de proliferación y diferenciación celular, este divertículo tiroideo se profundiza ventralmente en el mesénquima mesobranquial, manteniéndose en continuidad con el epitelio del piso faríngeo por un pedículo llamado conducto tirogloso. Este conducto se oblitera en estadios posteriores del desarrollo para desaparecer posteriormente. Una parte del conducto tirogloso puede persistir y mantenerse permeable en cualquier altura de su trayecto, originando el quiste tirogloso. Los eventos críticos de la morfogénesis de la glándula tiroides se llevan a cabo durante los 2 primeros meses de la gestación. Por lo tanto, la mayoría de sus alteraciones estructurales –agenesia o disgenesia– dependen de complicaciones ocurridas durante esa etapa. Se han descripto alteraciones genéticas responsables de estos cuadros.
Biosíntesis de las hormonas tiroideas y su liberación a la circulación general
Las células parafoliculares de la glándula tiroides producen calcitonina, hormona vinculada con el metabolismo fosfocálcico. Las células foliculares o tirocitos sintetizan T3 y T4 mediante un complejo mecanismo. Estas dos últimas hormonas, una vez liberadas a la circulación general, son transportadas por proteínas específicas hasta los tejidos donde ejercen su acción metabólica. En este proceso de biosíntesis y liberación hormonal se dan una serie de pasos:
Incorporación del yodo a la glándula tiroides
El yodo es el elemento fundamental para la síntesis de las hormonas tiroideas e ingresa al organismo con los alimentos y el agua. Los requerimientos diarios de yodo son pequeños, pero si la ingesta se mantiene en niveles muy bajos mucho tiempo puede ocurrir una disminución de la síntesis hormonal. Los tirocitos tienen capacidad para concentrar el yodo, almacenarlo en la tiroglobulina (Tg) y regular su liberación y secreción como hormona activa, según las necesidades del organismo. Las células tiroideas no diferencian entre el yodo natural y sus isótopos radioactivos. Por eso, estos últimos se usan para realizar estudios funcionales de la glándula o con fines terapéuticos para destruir tejidos tiroideos hiperfuncionantes o metástasis de tumores tiroideos diferenciados. También se puede utilizar el tecnecio 99 para identificar la presencia de tejido tiroideo, porque es semejante al yodo en su carga iónica y en su volumen. Cuando el mecanismo de captación del yodo está genéticamente alterado, los pacientes desarrollan hipotiroidismo y bocio.
Síntesis de Tg
Glicoproteína sintetizada en los ribosomas de los tirocitos, empaquetada en vesículas en el aparato de Golgi y vertida finalmente a la luz folicular. Todo este proceso es controlado por la TSH. Los defectos congénitos en la síntesis de Tg complican el proceso de la hormonogénesis y provocan hipotiroidismo.
Incorporación del yodo a las tiroglobulinas
En la interfase membrana apical coloide, el yodo se une a los tirosilos de la Tg en un proceso catalizado por una peroxidasa. Se constituyen así las monoyodotirosinas (MIT) y las diyodotirosinas (DIT). Por reacciones de acoplamiento entre estos compuestos, se forman las hormonas tiroideas T3 y T4, que quedan incorporadas a la molécula de Tg. Existen sustancias sintéticas o naturales y defectos genéticos, que interfieren en este proceso de organificación del yodo. Este fenómeno se utiliza como un recurso terapéutico en cuadros de hiperfunción tiroidea, como el metimazol, o puede generar cuadros de hipotiroidismo.
Liberación de las hormonas tiroideas
La Tg yodada –reserva de T3, T4 y yodo– se almacena en el coloide. Cuando el tirocito es estimulado por la TSH se engloban pequeñas porciones de coloide desde la luz folicular hacia el citoplasma, donde los lisosomas fagocitan la envoltura de las vesículas y las proteasas liberan todos los aminoácidos yodados: MIT, DIT, T3 y T4. Las hormonas tiroideas pasan a la sangre y los residuos MIT y DIT son desyodados, reutilizándose el yodo al incorporarlo a otra molécula de Tg. Defectos congénitos en estas desyodinasas impiden la reutilización, el yodo se pierde por la orina y en áreas con baja ingesta de yodo puede aparecer hipotiroidismo.
Transporte
La T4 y la T3 circulan en la sangre en parte como moléculas libres (T4 libre y T3 libre) y en parte unidas a proteínas específicas (T4 total), la TBG (thyroxine-binding globulin) es la más importante por ser la de mayor afinidad. Las cifras circulantes de TBG pueden estar aumentadas o disminuidas por diferentes situaciones, lo que a su vez aumenta o disminuye los valores totales de hormonas tiroideas circulantes, con mantenimiento de la fracción libre que preserva el eutiroidismo. Son las formas libres las que ingresan a las células para ejercer su acción.
Mecanismos de acción de las hormonas tiroideas
La T4 es una prohormona que debe desyodinarse a T3 para fijarse a los receptores nucleares de las células y ejercer su acción. Las reacciones de desyodinación no ocurren al azar. Se conocen tres desyodinasas que se diferencian por los tejidos en los que predominan, su preferencia de sustrato, requerimiento de cofactores, etc. Las más importantes son la tipo II y la tipo III. Desyodinasa tipo II: transforma la T4 a T3 y se encuentra distribuida principalmente en el sistema nervioso central, hígado, riñón y en los tejidos periféricos. La concentración de desyodinasa tipo II es inversamente proporcional a la concentración de T4. Constituye un mecanismo de protección de los tejidos más lábiles –por ejemplo el sistema nervioso– ante una situación de hipotiroidismo. Desyodinasa tipo III: inactiva la T3 y la T4 por conversión a sus metabolitos inactivos. Aumenta cuando hay un exceso de concentración de T4 en los tejidos. Constituye un mecanismo de protección contra el hipertiroidismo.
Las hormonas tiroideas producen sus efectos biológicos controlando la expresión de los genes sensibles a ellas. Las fracciones libres ingresan al citoplasma celular donde la T4 es desyodada para originar T3. Esta es trasladada de manera activa al núcleo celular donde se une a los receptores específicos y ejerce su acción.
Acciones de las hormonas tiroideas
La T3 acelera la transcripción del ADN con formación del ARN mensajero y ribosómico, activando la síntesis proteica, actúa sobre las mitocondrias favoreciendo los mecanismos de transporte de electrones en la cadena respiratoria para la formación de ATP, y sobre diversas etapas del metabolismo hidrocarbonado, de los lípidos y de las vitaminas. Los receptores de las hormonas tiroideas están ampliamente distribuidos en todo el organismo. Las hormonas tiroideas cumplen un papel relevante en los procesos metabólicos básicos, y, por ello, las condiciones de exceso o déficit hormonal se expresan con repercusión sobre todos los órganos. Participan en los procesos de crecimiento y desarrollo de todos los tejidos. A nivel neurológico intervienen en la gliogénesis, en la mielinización y desarrollo de las sinapsis interneuronales y en los procesos de proliferación y diferenciación celular. De esta manera se explica el profundo daño neurológico irreversible que padecen los niños con hipotiroidismo durante los primeros 24-36 meses de vida, por tratarse de una etapa crítica para el crecimiento y desarrollo de ese tejido. El crecimiento y la maduración del tejido óseo son marcadamente dependientes de las hormonas tiroideas. El enlentecimiento del crecimiento durante la infancia es uno de los indicadores que obliga a la investigación del hipotiroidismo entre sus causas etiológicas. A nivel hepático influye sobre la actividad de sus enzimas. Los recién nacidos con hipotiroidismo suelen presentar ictericia indirecta prolongada. Cumplen también un rol importante sobre la termogénesis, la secreción y acción de la hormona de crecimiento, y la síntesis y secreción de otras hormonas.
Regulación de la función tiroidea
La biosíntesis de las hormonas tiroideas es controlada por complejos mecanismos extrínsecos –eje hipotálamo-hipófiso-tiroideo– e intrínsecos o autorreguladores por la propia tiroides.
Síntesis, secreción y acción de la TSH
La TSH se sintetiza y secreta en las células tirotropas de la hipófisis, a su vez modulado por la hormona hipotalámica liberadora de tirotrofina (TRH). Ejerce su acción uniéndose a su receptor específico en la membrana basal del tirocito. Estimula la captación de yodo y la síntesis de Tg, su yodación y las reacciones de acoplamiento, la endocitosis de la Tg yodada y su proteólisis, y finalmente la liberación de las hormonas tiroideas. Si la estimulación de la glándula tiroides por la TSH se mantiene de manera crónica con niveles superiores a los normales, se produce una hiperplasia glandular y bocio.
Mecanismo de retroalimentación negativa
La secreción central de TSH y TRH aumenta o disminuye en respuesta a concentraciones disminuidas o aumentadas de las hormonas tiroideas en la circulación general. Su aumento frena la secreción de TSH y, por el contrario, su disminución estimula su síntesis y secreción. Los valores de TSH se vinculan con las cifras circulantes de T4 y no con las de T3. Esto es de gran interés clínico, porque explica el cuadro bioquímico de valores bajos de T4 acompañados de TSH elevado sin modificación de la T3 circulante, ni signos clínicos de hipotiroidismo. Es el inicio de hipofunción, el diagnóstico resulta un hallazgo precoz. Estos mecanismos sirven para poner en marcha una respuesta compensadora de la glándula tiroides, en su intento por normalizar los valores de las hormonas periféricas. De aquí surge el concepto de que la hormona más sensible para presumir una hipofunción de la glándula tiroides en su inicio es la determinación de TSH. En algunos estados patológicos se producen anticuerpos antirreceptor de TSH, con capacidad para desplazar a la tirotrofina de su sitio de unión específico en el tirocito y ocupar su lugar. Algunos anticuerpos tienen acción estimuladora, ocasionando un hipertiroidismo, y otros ocupan el lugar de la TSH pero sin capacidad para activar el receptor, por lo que se genera un cuadro de hipotiroidismo. Son mecanismos involucrados en las enfermedades inmunológicas que comprometen a la glándula tiroides.
Mecanismo de autorregulación de la glándula tiroides
La glándula tiroides tiene su propio mecanismo de autorregulación destinado a limitar la cantidad de yodo que capta y la cantidad de hormona tiroidea que sintetiza. El objetivo es controlar la secreción hormonal en situaciones de aumento brusco de la disponibilidad de yodo circulante, como la absorción de yodo a través de la piel (antisépticos), ingesta de medicamentos que contengan yodo, exposición a contrastes radio-opacos. En estos casos se deprime la respuesta de las células tiroideas a la TSH, disminuyendo la síntesis de Tg, su yodación y la liberación de hormonas tiroideas. Este efecto se conoce como fenómeno de Wolff-Chaikoff. Una glándula normal es capaz de escapar luego a este efecto inhibitorio y restablecer la producción hormonal en cifras semejantes a las previas al bloqueo. Evita así el hipertiroidismo inicial por exceso de yodo y el hipotiroidismo por mantenimiento prolongado del bloqueo. Existen situaciones fisiológicas como la prematurez, o patológicas como alteraciones enzimáticas subclínicas, en las que no funcionan los mecanismos que permiten escapar del efecto Wolff-Chaikoff. En estos casos un exceso de yodo puede conducir a hipotiroidismo y bocio5-8.
Función tiroidea en la etapa fetal y sus probables alteraciones
Papel de la placenta
La placenta es un órgano muy importante en el metabolismo tiroideo fetal. Es impermeable a la TSH, permeable para T3 y T4 y permite el paso de yodo, de los anticuerpos antitiroideos y antirreceptor de TSH y de las drogas antitiroideas. Se describen a continuación cada una de estas situaciones.
Paso transplacentario de las hormonas tiroideas
En las primeras semanas de vida la madre suministra al feto hormonas tiroideas en cantidad útil para la etapa más crítica de su multiplicación neuronal (10-12 semanas). El tiroides fetal tiene actividad funcional a partir de la 20.ª semana de gestación. A partir de la semana 22-24 las hormonas tiroideas producidas por el feto son importantes para el normal desarrollo del sistema nervioso, pero las hormonas maternas son imprescindibles hasta el final del embarazo9.
Efectos del yodo
El tiroides fetal es altamente sensible al yodo, porque aún no están maduros sus mecanismos autorreguladores. Responde a la exposición al yodo bloqueando la formación hormonal y a veces falla su posibilidad de interrumpir dicha inhibición. Se debe tener presente el riesgo que implica la exposición materna a productos yodados durante el embarazo: yodo radioactivo, estudios contrastados con yodo o medicamentos que los contengan (óvulos antisépticos, jarabes expectorantes, antisépticos dermatológicos).
Acción de los anticuerpos antitiroideos
Los anticuerpos antitiroideos y antirreceptores de TSH pueden atravesar libremente la barrera placentaria y fijarse a los receptores del tiroides fetal afectando su función, ya sea estimulándola o inhibiéndola de acuerdo al tipo de anticuerpos predominantes. La enfermedad autoinmune tiroidea materna puede generar, durante el embarazo y en el momento del nacimiento, un hipertiroidismo o hipotiroidismo transitorio fetal o del recién nacido, cuya duración dependerá de la vida media de tales anticuerpos.
Acción de las drogas antitiroideas
Las drogas que se utilizan en el tratamiento del hipertiroidismo también atraviesan la placenta, produciendo en la tiroides fetal el mismo efecto inhibidor de la síntesis hormonal que en el tiroides materno. Sin embargo, el tratamiento con tales drogas debe mantenerse en una mujer embarazada con hipertiroidismo, porque la afección sin tratamiento provoca graves consecuencias hemodinámicas para el feto. Además, el paso a la circulación fetal de estas drogas es útil para el tratamiento in útero de un eventual hipertiroidismo, que puede desarrollar el feto por el pasaje transplacentario de los anticuerpos tiroestimulantes maternos. Las drogas antitiroideas deben emplearse durante el embarazo en su menor dosis útil. Una dosis hasta 15-20 mg de metimazol por día no produce hipotiroidismo en el feto y previene su hipertiroidismo.
Función tiroidea en el recién nacido
En los primeros minutos de la vida postnatal se producen una serie de modificaciones fisiológicas en la función tiroidea del recién nacido, como parte de la adaptación al estrés que implica el nacimiento. La TSH aumenta alcanzando valores máximos a los 30 minutos del nacimiento (80-100 microU/ml), para descender en los días siguientes llegando a valores inferiores a los 20 microU/ml a las 48 horas de vida. El cribado neonatal de hipotiroidismo congénito, donde se determina la TSH, se realiza a las 48 horas de vida, porque de esta manera es posible distinguir entre el ascenso fisiológico y el anormal de TSH. La T3 y T4 aumentan acompañando a la TSH, y se mantienen en cifras altas durante el primer mes de vida y aún durante los 2-4 meses siguientes. El eje tirotrófico en prematuros: la mayoría presentan una etapa con concentraciones bajas de T4 y T4 libre, que se conoce como hipotiroxinemia de la prematuridad. Pero los valores de T4 pueden aparecer bajos con TSH normal debido a la inmadurez10-12.
Hipotiroidismo
Situación clínica y analítica resultante de la disminución de la actividad biológica de las hormonas tiroideas a nivel tisular, por disminución de la producción hormonal a nivel hipotálamo-hipofisario o tiroideo o por resistencia a su acción.
El diagnóstico del hipotiroidismo congénito debe ser realizado por métodos analíticos, ya que los síntomas clínicos son inespecíficos y solamente están presentes en un escaso porcentaje de casos en el primer mes de vida. Los programas de detección precoz del hipotiroidismo congénito han permitido la instauración de tratamiento precoz, previniendo las posibles secuelas neurológicas y mentales derivadas de un tratamiento tardío. En España, el programa se puso en marcha en el año 1978, alcanzando un porcentaje de cobertura del 96,7% en el año 1989. Los programas de detección precoz del hipotiroidismo congénito han permitido precisar su incidencia en los países desarrollados, siendo actualmente de un caso por cada 2.500-3.000 recién nacidos. Es más frecuente en el sexo femenino que en el masculino (2:1), y se acentúa en la raza hispánica (relación 3:1).
Más allá del período neonatal, el hipotiroidismo puede presentarse como un conjunto de signos y síntomas con o sin bocio, un síndrome de hipotiroidismo moderado en el que predomina el retraso del crecimiento, un síndrome de hipotiroidismo subclínico o hipotiroidismo compensado (elevación de los niveles de TSH asociada a concentraciones de T4 dentro de los límites de la normalidad en ausencia de síntomas claros de hipotiroidismo), y enfermedad tiroidea autoinmunitaria en ausencia de alteración de la función tiroidea (anticuerpos antitiroideos positivos sin alteraciones de TSH, hormonas tiroideas, ni síntomas claros de hipotiroidismo). El hipotiroidismo hipotálamo-hipofisario congénito es poco frecuente (1/ 50.000-100.000 recién nacidos). La elevación tardía de la TSH se observa en 1/100.000 recién nacidos. El déficit congénito de TBG (T4 baja con TSH normal) aparece en 1/5.000-10.000 recién nacidos. La hipotiroxinemia transitoria neonatal (T4 baja con TSH normal) aparece en el 50% de los recién nacidos pretérmino menores de 30 semanas y en el 25% de todos los recién nacidos pretérmino. La incidencia de hipotiroidismo neonatal transitorio (T4 baja con TSH elevada) varía geográficamente en relación a la ingesta de yodo. Es baja en áreas suficientes en yodo (Norteamérica, Japón: 1/ 50.000 recién nacidos), y más alta en áreas con deficiencia como Bélgica (1/600 recién nacidos) y Alemania central (1/100 recién nacidos). La incidencia de hipotiroidismo congénito transitorio de etiología autoinmune es de 1/30.000 recién nacidos. El síndrome de resistencia generalizada a la hormona tiroidea es muy poco frecuente. Se han descrito unos 300 casos, el 35% en niños menores de 10 años. El hipotiroidismo primario adquirido afecta al 6% de los escolares; las causas más frecuentes son el déficit de yodo y la enfermedad tiroidea autoinmune (tiroiditis linfocitaria crónica) que afecta al 1-2% de los niños entre 11 y 18 años, con una proporción de afectación del sexo femenino/masculino de 6:1.
El hipotiroidismo es el cuadro resultante de la síntesis insuficiente de las hormonas tiroideas. Puede estar generado por alteraciones a distintos niveles del eje tirotrófico, originando diferentes formas clínicas con diversos grados de repercusión funcional. Hipotiroidismo primario: alteración de la glándula tiroides. Hipotiroidismo secundario: afectación de la secreción de TSH en la hipófisis. Hipotiroidismo terciario: está comprometida la liberación de TRH en el hipotálamo. Hipotiroidismo periférico: falla la respuesta de los receptores celulares a las hormonas tiroideas. El hipotiroidismo primario constituye la enfermedad endocrinológica más frecuente de la infancia. Las formas hipotálamo-hipofisarias son poco frecuentes y generalmente se asocian a otras deficiencias hormonales, siendo estas las que destacan y conducen al diagnóstico. Su expresión clínica es más leve que en los primarios y tienen menor riesgo de daño neurológico. La resistencia periférica a las hormonas tiroideas es todavía menos frecuente. A su vez cada una de estas formas de hipotiroidismo, se categorizan de acuerdo al momento de inicio de la enfermedad: hipotiroidismo congénito si está presente desde el nacimiento e hipotiroidismo adquirido cuando se expresa más allá de la etapa neonatal.
Hipotiroidismo congénito primario
El hipotiroidismo congénito primario (HC) representa la enfermedad tiroidea más relevante de la etapa neonatal, por la gravedad que implica y por su alta frecuencia de presentación. En la tabla I se resumen las principales etiologías.

Las disgenesias tiroideas son la causa más frecuente de hipotiroidismo y, generalmente, son esporádicas. Son alteraciones del desarrollo embrionario de la glándula tiroides. Existen tres tipos: la agenesia o atireosis (10%), no se detecta la glándula; la hipoplasia (20%), la glándula es de tamaño pequeño, y la ectopia (40-60%) cuando el tiroides (generalmente hipoplásico) está situado fuera de su localización habitual (sublingual…). Es tres veces más frecuente en niñas.
La ectopia tiroidea es siete veces más frecuente que la atireosis. No se conocen las causas de las disgenesias tiroideas. De modo excepcional aparecen en varios miembros de una familia. Esta incidencia familiar (3-4% de los casos) sugiere la participación de factores genéticos, que se han ido identificando en los últimos años. También se han propuesto causas infecciosas (una infección aguda o crónica sería la responsable de la aplasia) y autoinmunes (un proceso autoinmune materno con transmisión pasiva de anticuerpos bloqueantes del crecimiento tiroideo al feto). Las inmunoglobulinas bloqueantes del crecimiento tiroideo podrían producir hipotiroidismo primario congénito permanente al actuar conjuntamente con otros factores ambientales, como infecciones víricas o bacterianas in útero o deficiencia de yodo.
Las dishormonogénesis: grupo de errores del metabolismo en los que está alterado algún paso en la síntesis de hormonas tiroideas (10-25%). Se trata de un grupo de errores congénitos del metabolismo, de herencia autosómica recesiva, en los que está alterado alguno de los pasos necesarios para la biosíntesis de las hormonas tiroideas. Afecta por igual a ambos sexos y suele haber consanguinidad de los padres. La producción defectuosa de hormonas tiroideas aumenta la producción de TSH hipofisaria, que produce un bocio compensador que puede desarrollarse en cualquier momento desde el nacimiento hasta la edad adulta Pueden ser causas hipotálamo/hipofisarias (déficit de TRH, déficit de TSH); causas carenciales (deficiencia de yodo durante el embarazo [cretinismo]) y causas periféricas (resistencia periférica de los tejidos a las hormonas tiroideas).
Hipotiroidismo primario transitorio
Defecto en la síntesis de hormonas tiroideas por alguna causa transitoria: por exceso de yodo, como la administración de desinfectantes yodados (povidona yodada) en el parto y al recién nacido, la administración de contrastes yodados en el período neonatal (contrastes radiográficos, angiocardiografía, colocación de catéteres…), por paso transplacentario de fármacos o anticuerpos antitiroideos, por deficiencia de yodo en el recién nacido, por prematuridad o por causas idiopáticas.
Manifestaciones clínicas del hipotiroidismo congénito primario
Los niveles bajos de la hormona tiroidea sin tratamiento pueden causar daños en el desarrollo mental (retraso mental) y falta de crecimiento. El hipotiroidismo congénito es una causa evitable de retraso mental. El hipotiroidismo presenta una variedad de manifestaciones. La mayoría de los niños hipotiroideos recién nacidos tienen una apariencia normal. Solo un 5% de los niños pueden ser sospechados por sus manifestaciones clínicas. De ahí la necesidad del screening sistemático neonatal para su detección precoz. La afección es inaparente o presenta signos inespecíficos mínimos durante los primeros días de vida (tabla II), pero librada a su evolución natural, estos se van acentuando hacia el final del primer mes y en los meses siguientes.

Diagnóstico del hipotiroidismo congénito primario
- Pruebas de detección neonatales: son el único medio de diagnóstico precoz. Se realizan sobre muestras secas de sangre que se recogen a las 48 horas de vida. En España la prueba de cribado para la detección de HC se realiza mediante la cuantificación de TSH en sangre capilar. Esta prueba tiene una sensibilidad alta (< 1% de falsos negativos) pero su especificidad es baja y ante un resultado anómalo hay que ser cauteloso y verificarlo. Constituye una de las pocas causas prevenibles de retardo mental. El tratamiento debe instaurarse lo antes posible, idealmente durante la primera semana de la vida. Cada día de demora en su comienzo, implica un incremento del riesgo de retardo mental. El tratamiento revierte los síntomas e impide el ulterior deterioro del sistema nervioso central, pero no resuelve el daño neurológico ya producido por la enfermedad. El pediatra debe tener siempre presente que el HC es una urgencia pediátrica. Sin embargo, no se debe descartar la posibilidad de que un niño padezca la enfermedad por el hecho de contar con un resultado de pesquisa neonatal negativo. Ese resultado sólo confirma que la enfermedad no está presente en el momento en el que la muestra fue tomada, pero existen situaciones en las que el hipotiroidismo puede expresarse más adelante. Por este motivo, en algunos países está prevista la repetición de la evaluación en los niños prematuros y en algunos casos como en los hijos de madre hipertiroidea. Si durante el primer mes de vida aunque la evaluación neonatal sea negativa para HC si aparecieran signos sugestivos de hipotiroidismo, se deberá realizar determinaciones séricas de hormonas tiroideas para establecer o descartar el diagnóstico.
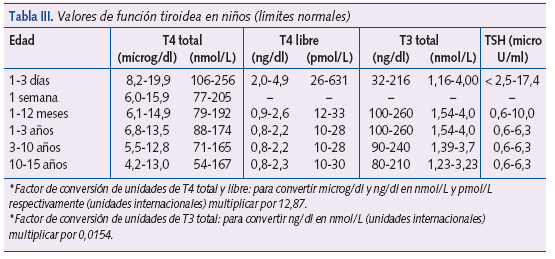
- Exploraciones complementarias: repetir los estudios tiroideos en sangre (T4, T4L y TSH, Tg y T3), (valores normales en la tabla III). Realizar gammagrafía tiroidea para valorar la anatomía del tiroides, su localización y estado funcional. Si la TSH es baja se recomienda efectuar una prueba de estimulación de TRH para determinar si el hipotiroidismo es secundario a una disfunción hipotalámica o hipofisaria. Valorar la edad ósea (radiografía de rodilla).
Tratamiento del hipotiroidismo congénito primario
Debe instaurarse lo antes posible al diagnóstico y en unidades de Endocrinología infantil. Se administra L-tiroxina (T4) a dosis de 10-15 microgramos/kg/ día vía oral una vez al día. La dosis necesaria disminuye con la edad y debe ser individualizada. Conseguir un correcto equilibrio terapéutico: el primer control (T4 y TSH) se realizará a las 2 semanas y el segundo a las 4 semanas. Posteriormente, es conveniente realizar controles cada 1-2 meses durante el primer semestre y cada 3-6 meses hasta los 3 años y a partir de entonces cada 6 meses. Realizar siempre una determinación 1 mes después de un cambio de dosis. Las concentraciones de T4 deben mantenerse en el rango superior de la normalidad. En niños menores de 1 año, es muy difícil lograr concentraciones de TSH en valores normales. Si las concentraciones de T4 y T4L son adecuadas, es mejor tener la TSH ligeramente elevada (10-20 mU/L durante el primer año de vida).
Control del niño con hipotiroidismo congénito primario
Los pacientes detectados deber ser seguidos conjuntamente entre una unidad de Endocrinología infantil y el pediatra. Control clínico: seguimiento del crecimiento (peso, talla, perímetro cefálico), así como de signos y síntomas que puedan sugerir hipo- o hiperfunción tiroidea. Control bioquímico: es imprescindible que las concentraciones de TSH se normalicen lo antes posible. Maduración ósea: al diagnóstico, al año de vida y posteriormente cada año si el crecimiento es normal. Desarrollo psicomotor: realizar un control al año de vida, y posteriormente cada año, considerándose imprescindibles los controles a los 1, 2, 4, 6, 8 años y al final de la escolarización. Evaluación de la visión y la audición, y de las necesidades de educación especiales.
Alteraciones tiroideas en la etapa neonatal
Recién nacido hijo de madre hipertiroidea. Hipotiroidismo congénito autoinmune transitorio
El recién nacido hijo de una madre que ha padecido un hipertiroidismo durante el embarazo generalmente tiene una función tiroidea normal. Pero hay que considerar las siguientes alteraciones, derivadas tanto de la enfermedad de base de la madre como del tratamiento que esta haya recibido: desnutrición, por la disfunción hemodinámica de la placenta producida por la enfermedad materna o por el hipertiroidismo que el feto pudo haber padecido intra útero. Hipertiroidismo transitorio: por pasaje transplacentario de anticuerpos tiroestimulantes. Hipotiroidismo transitorio: secundario al metimazol, cuando la dosis fue superior al nivel de seguridad. Craneosinostosis: poco frecuente, pero con graves consecuencias neurológicas. La duración de los síntomas depende de la vida media del metimazol o de los anticuerpos maternos que circulan en el recién nacido. Los niños con hipertiroidismo neonatal pueden presentar exoftalmía, bocio, febrícula, taquicardia, mal progreso de peso, inquietud e hiperorexia. Cuando el hipertiroidismo se mantiene más de lo esperable, debe presumirse la presencia de anomalías genéticas activantes del receptor de TSH. Su incidencia e intensidad depende directamente del título de anticuerpos y variará en cada embarazo. El 50% de los niños con hipotiroidismo autoinmune neonatal presentan anticuerpos que persisten durante los primeros meses en el 30% de los casos. El control del hijo de una madre hipertiroidea debe iniciarse en la etapa prenatal. Una frecuencia cardíaca superior a 160 latidos por minuto en el monitoreo fetal, debe sugerir el diagnóstico de hipertiroidismo y puede requerir intervención terapéutica. En todo recién nacido hijo de una madre hipertiroidea deben investigarse las disfunciones señaladas y realizar determinaciones séricas de hormonas tiroideas. Una madre hipertiroidea tratada con 15 y 20 mg/día de metimazol debe mantener su lactancia materna. Esa dosis no provoca disfunción tiroidea en el niño. No obstante este debe ser controlado periódicamente. El hipertiroidismo neonatal es una urgencia pediátrica, porque pone en riesgo la vida del niño. Su presunción merece consulta especializada, y tras su confirmación debe recibir tratamiento.
Alteraciones tiroideas adquiridas
Hipotiroidismo adquirido primario (HAP)
El hipotiroidismo puede manifestarse a cualquier edad como un cuadro adquirido, con distinto modo de expresión y consecuencias de acuerdo a la etapa madurativa que esté cursando el niño o el adolescente. Puede aparecer HAP yatrogénico postradioterapia cuando la dosis supera los 10-20 Gy, tras el tratamiento del hipertiroidismo con yodo radioactivo y postiroidectomía. El depósito de cristales de cistina (cistinosis) y la infiltración tumoral (leucemia, histiocitosis) del tejido tiroideo producen hipotiroidismo. Las etiologías también son diferentes en las distintas edades (tabla IV).

HAP en los 2 primeros años
Las alteraciones estructurales de la glándula y las alteraciones enzimáticas siguen siendo en este período las causas más frecuentes. Cuando el tejido tiroideo es muy pequeño, está ausente o la producción hormonal está muy comprometida, la enfermedad se manifiesta de manera congénita. Cuando, por el contrario, tiene capacidad para cubrir las necesidades del niño, el eutiroidismo se mantiene por un tiempo variable. Esta situación se extiende hasta que, por el incremento de la superficie corporal, la producción hormonal resulta insuficiente. Ello puede ocurrir durante los primeros meses de la vida o más adelante a los dos, tres o más años. A partir de entonces la TSH se eleva por encima de lo normal en respuesta a los niveles bajos de hormonas tiroideas circulantes, lo que aumenta el volumen del resto tiroideo tratando de normalizar la función. Así, puede aparecer un bocio en algunos pacientes con alteraciones enzimáticas de la síntesis hormonal, o crecimiento del tejido tiroideo disgenético, generando un abultamiento en el dorso de la lengua, en la línea media del cuello o en la base del mismo, según se trate de un tiroides ectópico o de una hipoplasia de la glándula tiroides ubicada en su lugar anatómico normal. En esta edad sigue vigente el riesgo de daño irreversible del sistema nervioso central y por eso esta enfermedad debe sospecharse rápidamente después de su comienzo, atendiendo a sus signos mínimos. El más frecuente es el enlentecimiento de la progresión de la talla. Si el cuadro progresa sin tratamiento, los signos y síntomas se manifiestan de un modo solapado e insidioso, agravándose progresivamente en la medida que la situación permanece sin diagnóstico. Esperar a que el paciente presente los signos característicos de la afección, es sinónimo de llegar tarde al tratamiento. Cuando en un control de salud se detecta un descenso anormal en la progresión de la talla, debe presumirse un hipotiroidismo adquirido entre las etiologías a estudiar. El diagnóstico y tratamiento del hipotiroidismo es una urgencia durante los dos primeros años de la vida, porque el período crítico de crecimiento y maduración del sistema nervioso central se extiende hasta esa edad.
HAP entre los 2 y 5 años de edad
Cuando el cuadro se inicia después de los dos años, su efecto sobre el sistema nervioso central es menor y, en general, todos los síntomas son reversibles con el tratamiento. Es importante no interpretar el bocio como un tumor lingual o como un quiste tirogloso, sin realizar los estudios correspondientes. Su resección podría extirpar el único resto tiroideo funcionante, con las mismas consecuencias clínicas que una atireosis. En todo tumor de la línea media del cuello hay que realizar una centellografía con tecnecio o yodo para certificar o descartar la presencia de tejido tiroideo a ese nivel. Si corresponde a una disgenesia tiroidea, concentrará el trazador administrado y si se trata de un quiste tirogloso, el tiroides se dibujará en su ubicación normal. La disgenesia tiroidea no debe resecarse. Su volumen se reducirá una vez instaurado el correspondiente reemplazo hormonal.
HAP después de los 5 años de edad
A partir de esta edad empiezan a aparecer las enfermedades inmunológicas como etiología más importante, que se acentúa en los años próximos a la pubertad. En la enfermedad tiroidea de causa inmunológica, están presentes diversos tipos de anticuerpos contra el receptor de TSH con distinta actividad biológica. De acuerdo al tipo de anticuerpos predominantes será la expresión clínica de la enfermedad. Por otra parte, pueden ser de expresión tardía.
Bocio multinodular o bocio simple es una de las causas más frecuentes de bocio en la proximidad de la etapa puberal y puede manifestarse con distintos grados de compromiso de la producción hormonal, según el momento evolutivo de la enfermedad. Cuando el bocio depende de alteraciones enzimáticas siempre se acompaña de hipotiroidismo. Los anticuerpos son positivos en la gran mayoría de los pacientes. En un escaso porcentaje de pacientes con enfermedad inmunológica se compromete la función tiroidea sin ocasionar bocio. En general, no hay reconocimiento de síntomas de hipotiroidismo por parte del paciente y su familia. Sin embargo, es frecuente que en el examen clínico se evidencien signos de la afección. Se debe tener presente que las enfermedades tiroideas autoinmunes se presentan con mayor frecuencia que en la población general en las siguientes situaciones clínicas: diabetes insulino-dependiente, síndrome de Down, síndrome de Turner, vitíligo, enfermedad celíaca y enfermedades autoinmunes que afectan a otros órganos. Las alteraciones de la función tiroidea se presentan frecuentemente a lo largo de la vida de las personas con síndrome de Down13 y, si no son tratadas, comprometen seriamente su desarrollo y calidad de vida. Por ello es fundamental conocer los aspectos más importantes del cribado (análisis periódicos), diagnóstico, clínica y tratamiento de estos procesos.
El pediatra debe investigar afecciones inmunológicas de la glándula tiroides cuando controla pacientes que padecen alguna de las enfermedades referidas.
Hipotiroidismo primario adquirido autoinmune
Los autoantígenos tiroideos principales son el receptor de TSH, la peroxidasa tiroidea y la Tg. Los autoanticuerpos generados por los linfocitos B son predominantemente subclases IgG: anticuerpos antirreceptor de TSH bloqueantes (TSH-Rb), que atraviesan la placenta y pueden ser responsables de hipotiroidismo congénito transitorio. Son detectables en el 20% de las tiroiditis de Hashimoto; anticuerpos antiperoxidasa tiroidea (TPO), se detectan en el 85-90% de los pacientes con enfermedad tiroidea autoinmune, son los responsables de la alteración de la glándula, no producen hipotiroidismo neonatal aunque pueden atravesar la placenta; anticuerpos anti-Tg presentes en el 50-60% de los pacientes con hipotiroidismo autoinmune. No son patogénicos de la tiroiditis autoinmune; anticuerpos contra el segundo antígeno del coloide, no son patogénicos de enfermedad tiroidea autoinmune. Están presentes en el 50% de los pacientes.
En la etiopatogenia de la enfermedad tiroidea autoinmune interrelacionan también factores ambientales o exógenos (infecciones, estrés) como desencadenantes, así como factores genéticos (historia familiar positiva) y constitucionales (edad, sexo). La incidencia de la enfermedad tiroidea autoinmune es proporcional a la cantidad de yodo contenido en la dieta. El exceso de yodo origina una antigenicidad aumentada de los antígenos yodados y un aumento de la incidencia de tiroiditis autoinmune.
Hipotiroidismo por alteraciones en el aporte de yodo
Déficit de yodo
El yodo es un elemento traza esencial para la síntesis de hormonas tiroideas. Las necesidades de yodo son variables a lo largo de la vida (tabla V), representan la cantidad de yodo liberado por las hormonas tiroideas en los tejidos periféricos y no recuperado por la glándula tiroides.

Cuando la ingesta de la madre durante el embarazo y la lactancia es correcta, la leche humana contiene cantidades adecuadas de yodo14-17. El contenido en yodo de las fórmulas infantiles no debe ser inferior al de la leche humana, ni superar los 45 mcg/ 100 kcal (20 mcg/dl). Un 20% de la población mundial vive en regiones de riesgo de padecer déficit de yodo. Cuando el aporte de yodo está por debajo de un nivel crítico (< 50 mcg/día), disminuye el contenido de yodo en el tiroides, se produce una aceleración de todas las etapas del metabolismo intratiroideo del yodo, un bajo nivel de yodación de la Tg y una reducción de la síntesis de yodotironinas. El patrón de hormonas tiroideas se caracteriza por lo siguiente: T4 baja, TSH elevada y T3 normal o elevada. La estimulación crónica de TSH da lugar al bocio. En la infancia es mucho más intensa la aceleración de la mayoría de las etapas de la cinética del yodo, y el bocio no constituye un mecanismo de adaptación favorable. En el feto las consecuencias del déficit intenso de yodo son catastróficas. Las deficiencias neurológicas son más graves que las que resultan de un hipotiroidismo congénito esporádico y se inician en una edad temprana, durante el primer trimestre de la gestación. En el embarazo, la carencia de yodo deprime la función tiroidea materna (T4 baja, T3 normal) y fetal. Los embriones y fetos son deficitarios de T4 y van siéndolo cada vez más de T3. El tiroides fetal no puede compensar la falta de T4 y T3 al no disponer de yodo, afectándose de forma grave e irreversible el desarrollo cerebral, aunque se inicie el tratamiento inmediatamente. Solo la profilaxis yodada administrada antes del comienzo de la gestación es efectiva. En las zonas de bocio endémico la carencia de yodo más grave da lugar al cretinismo endémico. En el recién nacido la carencia de yodo puede producir hipotiroidismo congénito transitorio, con elevaciones transitorias de la TSH, detectadas en los programas de detección precoz del hipotiroidismo congénito, que obligan a una segunda llamada en los programas de screening. La aparición de este trastorno funcional en el período neonatal se relaciona con la inmadurez del desarrollo, sobre todo de la glándula tiroides, y por ello se presenta con más frecuencia en niños prematuros. La prevalencia varía geográficamente. En Europa puede suponer el 25% de los recién nacidos con hipotiroidismo.
Exceso de yodo
Puede bloquear la función tiroidea al producir el efecto Wolf Chaikoff, la inhibición de la yodación de Tg, la disminución de la síntesis de hormonas tiroideas y el consiguiente aumento de la secreción de TSH. El recién nacido a término y especialmente el pretérmino absorben con gran avidez el yodo transcutáneamente, incluso con piel íntegra, por lo que los compuestos yodados (como el antiséptico povidona yodada) no deben ser utilizados en perinatología6-8.
Otras causas de hipotiroidismo adquirido
Enfermedades autoinmunes, tiroiditis subaguda de De Quervain (posible etiología vírica), tiroiditis linfocitaria crónica o de Hashimoto (etiología autoinmune, la más frecuente), infecciones, procesos inflamatorios (tiroiditis bacteriana, absceso), traumatismos o tumores craneales, radiación y/o cirugía de tumores de cabeza y cuello. Las manifestaciones clínicas son variables (tabla VI).

El hipotiroidismo se caracteriza por concentraciones bajas de T4 total y libre, concentraciones elevadas de TSH en el hipotiroidismo de causa tiroidea, descendidas en el hipotiroidismo hipofisario y variables en el hipotiroidismo terciario. Las concentraciones de T3 suelen ser bajas pero, pueden ser normales. Si existe alguna alteración hormonal solicitar: anticuerpos antitiroideos (anti-Tg, antiperoxidasas y anti-TSH), radiografía de rodilla o muñeca izquierda (edad ósea) y ecografía tiroidea. La glándula tiroidea está en localización normal y de tamaño variable. Existe una morfología característica en las tiroiditis. Derivar al especialista si existen alteraciones para realizar otras pruebas (TBG, gammagrafía, test de perclorato, test de TSH, biopsia). Valorar la deficiencia de yodo en la alimentación (medir yodo en orina). El hipotiroidismo requiere tratamiento con tiroxina durante un período de tiempo variable. Iniciar el tratamiento precozmente. En el control bioquímico la adecuación del tratamiento debe realizarse con determinaciones de T4 y TSH a las 6-8 semanas del inicio y cada 6-12 meses.
Tiroiditis
Incluye un grupo heterogéneo de procesos de distintas etiologías en las que se produce la destrucción de la estructura normal del folículo tiroideo.
Tiroiditis aguda
También llamada piógena, rara en niños. Producida por bacterias, hongos y parásitos: Staphilococcus aureus, Streptococo neumoniae, Salmonella, E. Coli, Haemophilus influenciae, meningococos, Pneumocistis carinii. Las vías de infección son variables: por continuidad de infecciones próximas, vía hemática en sépsis, fístulas o conducto tirogloso. Manifestaciones clínicas: fiebre, dolor en el cuello y a la deglución. Palpación dolorosa en la zona y eritema cutáneo. Diagnóstico: hemograma con leucocitosis y desviación a la izquierda. Función tiroidea: variable. Punción aspiración con aguja fina (PAFF) (de elección para el diagnóstico) para citología y cultivo. Tratamiento: ingreso y antibioterapia vía parenteral. En algún caso puede producirse hipotiroidismo permanente.
Tiroiditis subaguda de De Quervain
Producida por el virus del sarampión, gripe, Epstein-Barr, tiene mayor prevalencia en verano (Coxsackie) y se han comunicado múltiples casos coincidiendo con epidemias de parotiditis. Manifestaciones clínicas: suele existir un período prodrómico con febrícula, astenia, disfagia, mialgias. Posteriormente se produce dolor intenso en cuello que se puede irradiar a la mandíbula u oídos, eritema cutáneo. Fiebre y malestar general. Hemograma con leucocitosis y desviación izquierda. VSG elevada. Función tiroidea: las concentraciones de hormonas tiroideas varían dependiendo de la fase en la que se encuentre el proceso. En la fase inicial en más del 50% de los casos se produce una tirotoxicosis por liberación masiva de hormonas tiroideas (elevación de T4). Los anticuerpos antitiroideos (antimicrosomales y antitiroglobulina) están elevados. La Tg sérica está siempre elevada en la tiroiditis subaguda, por lo que su determinación puede ser útil en casos dudosos. Así, unas concentraciones normales de Tg en un niño con dolor cervical, excluye una tiroiditis subaguda. Prueba de captación de yodo: disminuida como consecuencia de la inflamación de la glándula. Tratamiento: en la fase inicial debe ser sintomático, con antiinflamatorios que reducen el dolor y la fiebre. En pacientes con mucho dolor se puede añadir prednisona oral (1-2 mg/kg/día) 2-3 semanas y disminuir progresivamente la dosis. En caso de hipertiroidismo sintomático puede utilizarse betabloqueantes como el propanolol. Si se produce hipotiroidismo en la fase de recuperación debe tratarse con L-tiroxina (durante 2-3 meses). Pronóstico: tras la fase aguda de hipertiroidismo se restaura espontáneamente la situación de eutiroidismo. Un pequeño número de pacientes presenta hipotiroidismo residual.
Tiroiditis de Hashimoto (tiroiditis linfocítica crónica) (TLC)
Proceso autoinmune que se caracteriza por infiltración linfocitaria folicular de la glándula tiroides y destrucción del tejido tiroideo funcional. Algunos pacientes tienen anticuerpos negativos en la primera evaluación y después de 3-6 meses se hacen positivos.
Más frecuente en niñas. Su incidencia es elevada en el síndrome de Down y en el síndrome de Turner. Tiene una predisposición familiar (HLA DR4, DR5, DR3, B8) y se asocia a otros procesos autoinmunes.
Manifestaciones clínicas: bocio (55-65% de los casos) y/o hipotiroidismo: hipocrecimiento, obesidad... Función tiroidea: pueden aparecer varios patrones bioquímicos, hipotiroidismo subclínico (T4 y T4L normales con TSH elevada), hipotiroidismo (T4 y T4L disminuidas con TSH elevada) y hipertiroidismo (raro), llamado hashitoxicosis. Diagnóstico: anticuerpos antitiroglobulina y antimicrosomales. Isótopos: la gammagrafía tiroidea presenta afectación difusa pero irregular. Ecografía: aumento del tamaño tiroideo, con zonas de folículos dilatados. Punción aspiración con aguja fina (PAFF): muestra infiltración linfocitaria patognomónica de la enfermedad. No tiene tratamiento etiológico. Tratamiento con L-tiroxina en todos los casos.
Bocio
Aumento del volumen de la glándula tiroides, que excede el tamaño de la falange terminal del pulgar del paciente (OMS)18,19. Es un hallazgo relativamente frecuente en Pediatría (4-6% de niños escolares), siendo más frecuente en niñas y puede acompañarse o no de hipo- o hipertiroidismo.
El tamaño y características del bocio se determinan mediante palpación y, de manera más precisa, por ecografía. La clasificación de la OMS está basada en el tamaño (tabla VII). La exploración de la glándula tiroides se debe incluir en todas las revisiones pediátricas.

El bocio puede ser difuso: deficiencia de yodo (bocio endémico), bocio simple (idiopático), tiroiditis de Hashimoto, enfermedad de Graves-Basedow, adenoma hipofisario secretor de TSH, dishormonogénesis familiar, ingestión de bociógenos, algunos fármacos (yodo, litio, ácido paraaminosalicílico, fenilbutazona, tionamidas). Las madres en tratamiento con fármacos antitiroideos pueden producir bocio en los lactantes alimentados con leche materna. O bocio multinodular.
Frecuentemente son asintomáticos (hipo- o normofuncionantes) y se diagnostican por palpación. Hacer una anamnesis y exploración completas. Antecedentes familiares. Diagnóstico: función tiroidea y anticuerpos antitiroideos (algoritmo diagnóstico en figura 2), ecografía tiroidea. Si se sospecha bocio asociado a tiroiditis, determinar anticuerpos antitiroideos. Si son negativos, descartar bocio por dishormonogénesis (captación de yodo y descarga con perclorato).
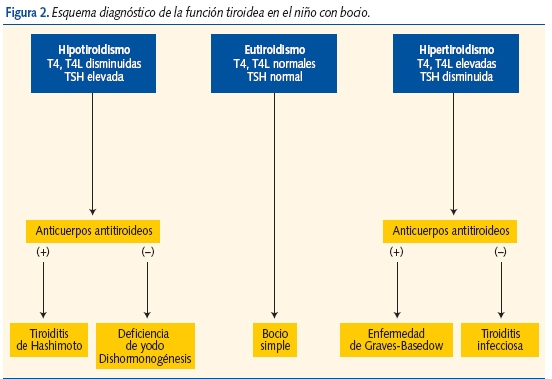
Si existen alteraciones, remitir para gammagrafía y biopsia por punción (PAAF). Medir excreción de yodo en orina (tabla VIII). Tratamiento según la etiología. En caso de bocio endémico iniciar tratamiento con L-tiroxina y asegurarse de que la ingesta de yodo es adecuada (aumentar la cantidad de pescado, sal yodada…) según las recomendaciones diarias de yodo.

Hipertiroidismo
Situación clínica resultante del exceso de hormonas tiroideas libres en la circulación general. Es autoinmune y su aparición está facilitada por ciertos factores desencadenantes entre los que se encuentra el estrés emocional. Para algunos autores el bocio tóxico difuso (enfermedad de Graves) y la TLC serían extremos del espectro clínico de una misma enfermedad. Los anticuerpos estimulantes del receptor de TSH se unirían al mismo, activándolo y provocando un aumento de la captación de yodo, de la síntesis hormonal y de la liberación de hormonas tiroideas. La edad de aparición coincide con la referida para la TLC, con mayor frecuencia de presentación en la pubertad y años siguientes. Presentación clínica variable (generalmente los signos se instalan poco a poco). En ocasiones, el cuadro pasa desapercibido mucho tiempo antes de que se realice la consulta. Es frecuente que presenten alteraciones en la concentración y en la conducta, que originan dificultades de aprendizaje y en la relación con sus pares. Con la progresión del cuadro aparece temblor fino que altera la escritura, dificultades para dormir (lo que compromete aún más el rendimiento diurno), intolerancia al calor, y alteraciones cardiovasculares (taquicardia, pulso saltón, hipertensión sistólica con aumento de la diferencial y palpitaciones). La piel aparece caliente en tronco, y húmeda especialmente en el dorso de las manos. Como consecuencia del hipermetabolismo estos pacientes ingieren mucha cantidad de alimentos, aunque descienden progresivamente de peso. Sin embargo, en algunos casos con natural tendencia al sobrepeso, no se produce el adelgazamiento característico. En ocasiones aparecen exoftalmos como consecuencia de la acción de determinadas inmunoglobulinas sobre los tejidos orbitales. La mayoría de los pacientes presentan bocio. Diagnóstico: fácil cuando están presentes todos los síntomas. Pero una vez más su detección temprana implica un desafío para el pediatra, cuando la consulta está motivada por los signos iniciales. El hipertiroidismo en la infancia es una entidad poco frecuente. En el recién nacido hijo de madre con Graves-Basedow (paso transplacentario de anticuerpos TSI). En el niño y adolescente las enfermedades autoinmunes: enfermedad de Graves-Basedow, tiroiditis de Hashimoto, neoplasias tiroideas, síndrome de McCune-Albright (anticuerpos negativos), hipersecreción de TSH (puede asociarse a tumor hipofisario que secrete también GH y prolactina), ingestión de hormonas tiroideas (Tg baja y captación nula por el tiroides). Evolución: los riesgos de esta enfermedad dependen del hipermetabolismo al que el paciente está sometido. Librada a su evolución natural podría progresar hasta una consunción extrema incompatible con la vida. En esta afección, como en el hipotiroidismo, hay que considerar la alteración en la calidad de vida a la que se ven sometidos estos niños y jóvenes. Es frecuente, especialmente durante la etapa puberal, que las familias lleguen a la consulta preocupadas por las alteraciones de la conducta y el desempeño escolar. Hasta ese momento la hiperorexia y el adelgazamiento suelen interpretarse como parte de los cambios físicos puberales, y las diferencias en la conducta y en el rendimiento escolar como dependientes del ingreso a la adolescencia. Se debe sospechar esta enfermedad cuando se perciban cambios bruscos en la conducta y en el rendimiento escolar en niños que han presentado un comportamiento normal hasta ese momento. Debe investigarse la presencia de hipertiroidismo cuando se detecten signos cardiovasculares tales como: taquicardia, hipertensión arterial o palpitaciones sin causa aparente.
Enfermedad de Graves-Basedow
Es la causa más frecuente de hipertiroidismo en la infancia. Surge por mecanismos autoinmunes que incluyen la producción de inmunoglobulinas contra antígenos del tiroides, tejidos orbitarios y dermis. Afecta más a niñas que a niños y su incidencia aumenta con la edad, con una predisposición genética, asociándose al sistema HLA, y puede aparecer asociada a otras enfermedades autoinmunes. Los signos y síntomas de sospecha: bocio palpable difuso y simétrico (90% casos), nerviosismo, irritabilidad, insomnio, taquicardia, temblor, HTA sistólica, intolerancia al calor, pérdida de peso, diarrea, fatiga, disminución de la atención, fracaso escolar, alteraciones menstruales, amenorrea, debilidad muscular, reflejos osteotendinosos exaltados, aceleración del crecimiento con aceleración de la edad ósea, signos de oftalmopatía: retracción del párpado, inyección conjuntival, diplopía, dolor, lagrimeo, proptosis, edema periorbitario, signos de dermopatía (rara en niños): piel edematosa y “engrosada”, edema tibial. Pruebas de laboratorio: aumento de T4, T3, T4L, Tg, y TSH indetectable. Existe positividad de varios anticuerpos según la etiología (tabla IX).

La respuesta de TSH a TRH (test de Tiregan) está disminuida. No es imprescindible su realización. Solicitar una radiografía de muñeca izquierda (edad ósea), y ecografía tiroidea (opcional). En la gammagrafía tiroidea está muy aumentada la captación de yodo radiactivo. Otras pruebas a realizar: test del perclorato, punción-aspiración (PAAF). El tratamiento se debe realizar en una unidad especializada. Generalmente precisan medicación con fármacos antitiroideos (propiltiouracilo, metimazol y carbimazol). Se administra propanolol en la fase aguda para disminuir los síntomas clínicos. El tratamiento con yodo radioactivo obtiene los mismos resultados pero debido al riesgo de leucemia y cáncer se utiliza poco en Pediatría. En algunos casos es necesario el tratamiento quirúrgico. El seguimiento de la función tiroidea se debe hacer cada 4-6 meses. El tratamiento médico se retira si el paciente se ha mantenido eutiroideo al menos durante 4 años. Si hay recaída se valorará tratamiento con yodo o cirugía.
Nódulo tiroideo (NT)
Masas localizadas, claramente diferenciadas dentro del tejido tiroideo, que pueden ser únicas o múltiples. En niños son poco frecuentes (< 1,5%). En la historia clínica buscar si existen antecedentes de radiación del cuello.
Es una lesión focal hiperplásica de la glándula tiroides con características diferentes a las del parénquima adyacente. Muchas enfermedades tiroideas benignas o malignas, de etiología genética, infecciosa o inmunológica pueden presentarse como un nódulo. El desafío para el pediatra ante esta consulta, es establecer la diferencia entre un proceso benigno y maligno que le permita definir la conducta a seguir. El bocio multinodular y la tiroiditis linfocitaria crónica son las causas más frecuentes. Otras etiologías: el absceso tiroideo, quistes, tumores (adenoma, carcinoma, linfoma, metástasis…). Frecuentemente son asintomáticos (hipo- o normofuncionantes) y se diagnostican por palpación. El nódulo maligno suele ser duro y acompañarse de adenopatías. En algunos casos de cáncer de tiroides, el compromiso del parénquima pasa desapercibido durante mucho tiempo o puede no dar expresión clínica, hasta que se hace evidente el abultamiento provocado por una adenopatía metastásica en la región laterocervical próxima a la glándula. En estas situaciones el diagnóstico tardío agrava el pronóstico de la enfermedad.
En general, el tratamiento temprano permite una buena evolución, aunque en los últimos años se ha detectado una mayor agresividad de la afección. Todo nódulo de tiroides o una adenopatía laterocervical próxima a la glándula, sin características inflamatorias francas y sin una causa evidente, debe obligar a la presunción de una enfermedad tiroidea maligna. Es una urgencia pediátrica. El cáncer de tiroides es una enfermedad que diagnosticada tempranamente puede tener una resolución favorable mediante la asociación de tratamiento quirúrgico y la administración de yodo radioactivo. La importancia radica en la posibilidad de que se trate de un carcinoma tiroideo y requiere una cuidadosa y completa evaluación.
Carcinoma tiroideo
El cáncer endocrinológico más frecuente es el del tiroides, que representa el 1% de todos los cánceres en la población general; entre el 3 y el 6,3% de los pacientes con carcinoma tiroideo son niños, constituyendo el 0,5% de los tumores infantiles, y es más frecuente en niñas20. En la infancia el carcinoma de tiroides es una entidad poco frecuente.
Aunque el único factor etiológico constatado es la radiación de cabeza, cuello o columna cervical, hay otros posibles factores de riesgo: genéticos o síndrome de enfermedad endocrina múltiple familiar, tiroiditis linfocítica crónica, estrógenos, déficit de yodo e hipertirotropinemia. Se han descrito casos de carcinoma papilar en relación con síndromes genéticos conocidos: síndrome de Gardner y carcinoma de colon familiar.
Los carcinomas tiroideos se clasifican en diferenciados y anaplásicos o indiferenciados. Son diferenciados: adenocarcinoma papilar, adenocarcinoma folicular y carcinoma medular. El anaplásico puede ser de células pequeñas, de células gigantes o carcinosarcoma. Otros cánceres en la glándula tiroides: linfomas, sarcomas, carcinomas epidermoides de células escamosas, fibrosarcomas y metastásicos. En la infancia los carcinomas papilares de tiroides presentan algunas características peculiares: mayor frecuencia de metástasis (especialmente pulmonares) y de recurrencias, además de mejor pronóstico. El crecimiento generalmente es lento, las metástasis son precoces en los ganglios linfáticos cervicales, siendo poco frecuentes las hematógenas.
La forma de presentación clínica más frecuente durante la infancia consiste en la aparición de un nódulo tiroideo21,22, observado hasta en el 75% de los casos. Entre el 19 y 24% de los pacientes con nódulos tiroideos tienen un carcinoma. Las adenopatías cervicales están presentes en el 30-90% de los pacientes en el momento del diagnóstico. Las metástasis pulmonares pueden, en ocasiones, ser la primera evidencia de enfermedad; estas ocurren con mayor frecuencia durante la infancia, mientras que las metástasis óseas y cerebrales predominan en adultos. Las pruebas complementarias son imprescindibles para realizar el diagnóstico: ecografía y gammagrafía tiroideas, gammagrafía corporal total, punción aspirativa con aguja fina. Los estudios de función tiroidea tienen escaso valor en el diagnóstico del carcinoma de tiroides, puesto que los pacientes se encuentran casi siempre eutiroideos. La histopatología es el único método diagnóstico definitivo20-22.
Aunque existen diferentes modalidades terapéuticas, el tratamiento del carcinoma de tiroides en niños es principalmente quirúrgico. Existe controversia sobre la extensión adecuada de la cirugía; sin embargo, la tiroidectomía total (respetando las glándulas paratiroideas) más linfadenectomía de los ganglios afectados es el tratamiento de elección. Después de la tiroidectomía total y el tratamiento ablativo con radioyodo, todos los pacientes requieren dosis supresivas de levotiroxina de por vida, manteniendo frenada la TSH a niveles indetectables, puesto que el carcinoma tiroideo es dependiente de la TSH para su crecimiento. La quimioterapia y radioterapia externas son modalidades terapéuticas que en muy pocas ocasiones aportan algún beneficio en el manejo del cáncer tiroideo durante la infancia. Los niños diagnosticados y tratados por un carcinoma tiroideo deben ser objeto de un seguimiento cuidadoso, para detectar los casos de enfermedad persistente o recurrente, evaluar la eficacia de la terapia supresora con levotiroxina y controlar las posibles complicaciones del tratamiento. Las evaluaciones serán trimestrales durante el primer año postquirúrgico, semestrales entre el segundo y quinto año y posteriormente anuales. La determinación de los niveles de Tg se considera un método sensible para detectar recurrencias o metástasis. Por otro lado, se realizan controles periódicos de los niveles de TSH para constatar que el tratamiento con levotiroxina es suficientemente supresivo. Asimismo, se evaluarán posibles complicaciones del tratamiento, como el hipoparatiroidismo postquirúrgico y la lesión del nervio laríngeo recurrente.
Bibliografía
- Pombo M. Tratado de Endocrinología pediátrica (3.ª ed.). Madrid: MacGraw-Hill Interamericana; 2002.
- Argente J, Carrascosa A, Gracia R. Tratado de Endocrinología pediátrica y de la adolescencia (1.ª ed.). Rodríguez Editores Médicos SA.; 1995.
- Diéguez C, Yturriaga R. Alteraciones tiroideas en el recién nacido. En: Ares S, Morreale G, Quero J. Monografía Tiroides. Madrid: MacGraw-Hill; 2007.
- Behrman RE, Nelson WE. Pruebas de laboratorio y sus valores normales en lactantes y niños. En: Behrman RE, Nelson WE (eds.). Nelson Textbook of Pediatrics (15th ed.). Philadelphia: Interamericana; 1997. p. 1535-64.
- Ares S, Pastor I, Quero J, Morreale de Escobar G. Thyroid complications, including overt hypothyroidism, related to the use of non-radiopaque silastic catheters for parenteral feeding in prematures requiring injection of small amounts of an iodinated contrast medium. Acta Pediatr. 1995;84:579-81.
- Ares S, Quero J, Morreale de Escobar G, Spanish Preterm Thyroid Group. Iodine during the neonatal period: too little, too much? J Pediatr Endocrinol Metab. 2007;20 Suppl 1:163-6.
- Delange F, Canoine JP, Abrassart C, Bourdoux P. Topical iodine, breastfeeding and neonatal hypothyroidism (letter). Arch Dis Child. 1988;63:106.
- Arena Ansotegui J, Emparanza Knorr JI. Iodine antiseptics are not harmless. An Esp Pediatr. 2000;53(1):25-9.
- Morreale de Escobar G, Ares Segura S. The hypothyroxinemia of prematurity. J Clin Endocrinol Metab. 1998;83:713-5.
- Ares Segura S, Escobar Morreale H, Quero Jiménez J, Durán S, Presas MJ, Herruzo R, Morreale de Escobar G. Neonatal hypotyroxinemia: effects of iodine intake and premature birth. J Clin Endocrinol Metab. 1997;82:1704-12.
- Ares S, García P, Quero J, Morreale de Escobar G. Parameters of thyroid function in premature infants born at 25-30 weeks of gestation. J Clin Pediatr Endocrinol. 2004;17(3):510.
- Ares S, García P, Quero J, Morreale de Escobar G. Parameters of thyroid function in premature infants born at 25-30 weeks of gestation and their relation to pathology and medication during the neonatal period. J Clin Ped Endocrinol. 2004;17(3): 511.
- Rooney S, Walsh E. Prevalence of abnormal thyroid function in a Down’s syndrome population. Ir J Med Sci. 1997;166:80-2.
- Ares S, Quero J, Morreale de Escobar G. Neonatal iodine deficiency: clinical aspects. J Pediatr Endocrinol Metab. 2005;18:1257-64.
- Ares Segura S, Quero Jiménez J, Durán S, Presas MJ, Herruzo R, Morreale de Escobar G. Iodine content of infant formulas and iodine intake of premature babies: high risk of iodine deficiency. Arch Dis Child. 1994;71:184-91.
- Ares S, García P, Quero J, Morreale de Escobar G. Iodine intake and urinary excretion in premature infants born after less than 30 weeks of gestation. J Clin Ped Endocrinol. 2004;17(3):509.
- Ares S, Quero J, Morreale de Escobar G. Neonatal iodine deficiency: clinical aspects. J Pediatr Endocrinol Metabol. 2005;18:1257-64.
- Delange F. Optimal iodine nutrition during pregnancy, lactation and the neonatal period . Int J Endocrinol Metab. 2004;2:1-12.
- WHO, UNICEF, ICCIDD. Assessment of the iodine deficiency disorders and monitoring their elimination. Geneva: WHO (WHO/NHD/01.1); 2001. p. 107.
- Ardito G, et al. Thyroid tumors in children and adolescents: preoperative study. Eur J Pediatr Surg. 2001;11(3):154-7.
- Dottorini ME. Differentiated thyroid carcinoma in childhood. Rays. 2000;25(2):245-55.
- La Quaglia MP, et al. Differentiated thyroid cancer: clinical characteristics, treatment and outcome in patient under 21 years of age who present with distant metastases. A report from the Surgicaf Discipline Committ (Children’s Cancer Group). Pediatr Surg. 2000;35(6):955-9.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
Comentarios
Este artículo aún no tiene comentarios.





