Vol. 16 - Num. 23
Flashes pediátricos AEPap
Test de detección rápida en infecciones ORL y respiratorias: utilidad en la consulta
César García Veraa, S Afayate Miguélezb, A Bengoa Gorosabelb, Pilar Cocho Gómezc
aPediatra. CS José Ramon Muñoz Fernández. Zaragoza. España.
bPediatra. CS Sagasta-Ruiseñores. Zaragoza. España.
cPediatra. Centro Salud Segovia 3. Segovia. España.
Cómo citar este artículo: García Vera C, Afayate Miguélez S, Bengoa Gorosabel A, Cocho Gómez P. Test de detección rápida en infecciones ORL y respiratorias: utilidad en la consulta. Rev Pediatr Aten Primaria. 2014;(23):49-59.
Nota:
Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención Primaria.
Es conocido que la principal causa de consultas en Pediatría, tanto en el ámbito de la Atención Primaria como en la urgencia hospitalaria, son las enfermedades infecciosas. Y dentro de estas, las más frecuentes son, sin duda, las que afectan a las vías respiratorias. Cualquier herramienta que permita precisar el diagnóstico de estos procesos, va a ser de gran utilidad para un abordaje integral de estos pacientes, incluyendo una utilización más racional de los antibióticos.
Además, las peculiaridades de las consultas de Atención Primaria condicionarían que estas pruebas cumplieran una serie de criterios de inmediatez del resultado, escaso coste y alta validez de la prueba, esenciales cuando se quiere generalizar su utilización en el amplio sector de la asistencia comunitaria.
En los últimos años han aparecido una serie de pruebas que permiten aproximarnos al diagnóstico etiológico en un tiempo corto y que se pueden realizar en la consulta por el mismo profesional que ha prestado la asistencia clínica. Son los llamados test de diagnóstico rápido (TDR), point-of-care test en denominación anglosajona. La incorporación de una test a la práctica diaria en la consulta debería de guiarse por una serie de criterios que garanticen su efectividad en ese nivel. Jiménez Alés basándose en las recomendaciones para la evaluación de pruebas diagnósticas de Mahutte, propone el cumplimiento del siguiente cuestionario antes de incorporar una herramienta diagnóstica a la dotación de un facultativo de Atención Primaria1:
- ¿Se puede realizar la prueba de forma confiable?
- ¿Se ha evaluado la prueba en una población apropiada?
- ¿Se usó un “patrón oro” como referencia para evaluar la prueba?
- ¿Se eligió un punto de corte apropiado para optimizar sensibilidad y especificidad?
- ¿Cuál es el cociente de probabilidad positivo y negativo?
- ¿Hasta qué punto es aplicable la prueba en una población específica?
- ¿Cuál es el balance entre el coste de la enfermedad y el coste del test?
Atendiendo a este planteamiento, este artículo va a intentar valorar si algunos de los TDR propuestos para infecciones respiratorias son útiles en la consulta de Pediatría de Atención Primaria en nuestro país. En concreto, existen TDR muy desarrollados y comercializados para detectar la infección en mucosas de Streptococcus β-hemolítico del grupo A (SBGA), virus de la gripe y virus respiratorio sincitial (VRS) e incluso en sangre capilar para la infección por el virus de Epstein-Barr (VEB).
Además, existen otras pruebas diagnósticas en desarrollo para Mycoplasma pneumoniae y otras de menor interés en Pediatría, como las existentes para Legionella pneumophila, así como pruebas que aproximan el diagnóstico de una infección grave como las determinaciones rápidas de proteína C reactiva o de procalcitonina, que escapan al objetivo de esta ponencia.
Tampoco se expondrá la prueba de detección de antígeno neumocócico en orina (podría realizarse también en otros fluidos) por su deficiente especificidad, ya que no distingue entre un paciente con neumonía grave o un paciente portador de neumococo (más del 50% de los niños pequeños) e incluso un paciente recientemente vacunado con vacuna conjugada.
TEST DE DETECCIÓN RÁPIDA DE ANTÍGENO ESTREPTOCÓCICO
La faringoamigdalitis es una de las principales entidades dentro de los procesos infecciosos en la infancia. Entre ellas, las producidas por SBGA son de especial importancia porque serían prácticamente las únicas susceptibles de ser tratadas con antibióticos. Esta cuestión es debatida en la actualidad ya que dos guías de práctica clínica (NICE y SIGN) consideran innecesario tratarlas, salvo que produzcan una afectación importante del estado del paciente, mientras que el resto de las guías de práctica clínica más recientes basadas en la evidencia sobre el tema prefieren hacer un diagnóstico etiológico precisamente para reconocer las faringoamigdalitis estreptocócicas (FAS) dentro del total de faringoamigdalitis y tratarlas con antimicrobianos2.
En nuestro país, unos 16 millones de consultas médicas anuales en toda la población serían por odinofagia en general, siendo un 20% del total de las consultas pediátricas y dando cuenta del 55% del total de prescripciones antibióticas en este grupo de edad3.
Según el metaanálisis de Shaikh, la etiología de la faringitis en países desarrollados en niños menores de 18 años sería por SBGA en un 37% de los casos (intervalo de confianza del 95% [IC 95%]: 32 a 43; 14 estudios, n=68 731 niños) y en menores de cinco años en un 24% de los casos (IC 95%: 21 a 26; 3 estudios, n=964 niños). Pero hay que considerar que en estas cifras está incluida la posibilidad de que se trate de niños portadores del germen (el 12% de los niños menores de 18 años sanos (IC 95%: 9 a 14; 18 estudios, n=9662 niños); el 4% de los menores de cinco años (IC 95%: 1 a 7; 4 estudios, n=1036 niños), de manera que aunque se detecte en las amígdalas no necesariamente ha de ser el responsable del cuadro clínico4. Así pues, la gran mayoría de las faringoamigdalitis en la infancia van a ser de etiología vírica y solo precisarán tratamiento sintomático.
Si hay que tratar con antibiótico solamente las causadas por SBGA, será importante precisar su diagnóstico. Contamos para ello con datos clínicos y pruebas analíticas. Hay que saber que la clínica y los datos de la exploración física nos van a aportar muy poco para separar las FAS del resto. Ningún síntoma aislado, ni siquiera la presencia de pus en la amígdala, ofrece un cociente de probabilidad positivo como para superar un 50% de probabilidad de FAS.
Incluso las escalas de predicción clínica (las más utilizadas son las de Centor y McIsaac –esta última añade un punto más, por la edad, a la anterior–), y como puede comprobarse en la Tabla 1, solamente ofrecen una aproximación al diagnóstico (cumpliendo el máximo de puntuaciones solamente un 62% serán auténticas FAS). La utilidad de estas debería ser, por tanto, seleccionar a los pacientes a los que luego apliquemos pruebas diagnósticas.
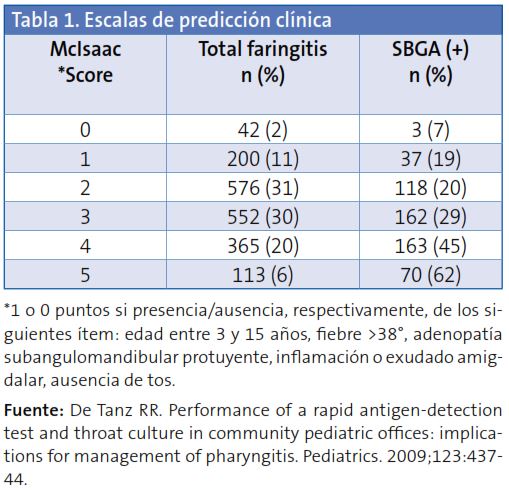
Para la confirmación diagnóstica se sigue utilizando como gold standard (patrón oro) el cultivo tradicional de muestra obtenida mediante hisopado de amígdala y faringe posterior. Su resultado se puede demorar hasta 48 horas (si es positivo puede detectarse crecimiento bacteriano a partir de las 18 horas, pero la negatividad no puede confirmarse hasta transcurridas 48 horas), y tiene como ventajas el que nos facilita poder conocer el antibiograma (fundamentalmente para valorar la resistencia a macrólidos, ya que no hay S. pyogenes resistentes a penicilina) y el que puede permitir distinguir entre distintos Streptococcus β-hemolíticos (los de grupo C y G suponen hasta un 15% de FAS en adultos, pero menos de un 5% en niños) u otras bacterias. Con todo, todavía no hay un método estandarizado de forma internacional para la investigación mediante cultivo de S. pyogenes, y no son siempre los mismos medios de cultivo o de toma de muestras los utilizados por los distintos laboratorios. No obstante, y respondiendo a la tercera pregunta del cuestionario, todos los estudios sobre TDR de antígeno frente a SBGA se hacen comparando con el cultivo tradicional.
Desde los años 1980, se han ido desarrollando TDR basados en la detección del antígeno carbohidrato específico de la pared celular de Streptococcus β-hemolítico exclusivamente del grupo A. Los más recientes basados en inmunoanálisis óptico presentan una precisión diagnóstica muy próxima a la del cultivo (84 a 99% de sensibilidad y 95 a 99% de especificidad), además de disponer del resultado en plazos ahora muy cortos (5-10 minutos). Asimismo, los costes se han reducido mucho, y en este momento (diciembre de 2013) los últimos de inmunoanálisis óptico cuestan a precio de mercado entre 1 y 3 &eur; cada test. En este caso, y en respuesta a la cuarta pregunta del cuestionario, el resultado es dicotómico en función de la presencia o ausencia de antígeno detectado con las distintas técnicas. No parece, por tanto, que el punto de corte elegido pueda condicionar los resultados.
Hay suficientes estudios como para conocer los cocientes de probabilidad de la prueba (quinta pregunta). En global, tanto para adultos como para niños, el cociente de probabilidad positivo del test es de 22,21 (IC 95%: 15,20 a 32,63) y el negativo de 0,15 (IC 95%: 0,13 a 0,18). Pero, calculado el mismo cociente para niños menores de 15 años con puntuaciones de McIsaac entre 3 y 5 (en el segmento de edad en el que se propone la realización del TDR el positivo sería de 23,54 [IC 95%: 14,66 a 38,90] y el negativo 0,23 [IC 95%: 0,28 a 0,19]). Recordar que cocientes positivos mayores de 10 suponen una aproximación postprueba favorable al diagnóstico muy próxima al 100%, mientras que valores menores de 0,1 del cociente negativo suponen una probabilidad de exclusión del diagnóstico postprueba también próxima al 100% (de aquí el debate de realizar o no cultivo de control en los TDR negativos).
En relación con la sexta cuestión, la mayor validez del test se ha demostrado en la población de más riesgo de FAS, seleccionada previamente por criterios clínicos. Los estudios que investigan el sesgo de selección han comprobado que las fluctuaciones en sensibilidad y especificidad del test según los diferentes signos o síntomas presentes, lo hacen más preciso en las poblaciones con más probabilidad de padecer FAS (sensibilidad 49,4 [IC 95%: 41,3 a 57,4] en puntuaciones de McIsaac de 0 a 2; sensibilidad 77,7 [IC 95%: 73,3 a 81,7] en puntuaciones de 3 a 5). Por ello la recomendación de realizar TDR solamente cuando se cumplan unos criterios suficientes en escalas de predicción.Al disminuir la prevalencia (el caso de las FAS en niños menores de tres años) varían los valores predictivos positivo y negativo del test, y parece razonable sugerir algún criterio extra a esta edad que aumente la probabilidad preprueba del test (exantema escarlatiniforme, petequias en paladar…).
Para evitar resultados erróneos es esencial realizar bien la técnica de hisopado, ya que a una mala recogida se pueden atribuir la mayoría de falsos negativos en la prueba. Está demostrado que la cantidad de antígeno condiciona más los resultados del TDR que los del cultivo tradicional. El volumen de antígeno recogido importa. La recomendación es que se realice un toque en cada amígdala con giro del hisopo de 180° y un tercero en faringe posterior con la misma maniobra. Es importante evitar el contacto con mucosa bucal y lingual y con la saliva. Bien realizada la toma, la sensibilidad y especificidad de los más recientes test son suficientes como para recomendar su amplia utilización. En la mayoría de guías que proponen su uso, se añade la obligatoriedad de realizar cultivo de confirmación en los casos de TDR negativo, pero la más reciente del Institute for Clinical Systems Improvement (ICSI), EE. UU. 2013ya no ve necesaria la realización de cultivo tradicional en los casos de TRDA negativo y recomienda realizar exclusivamente el test en la consulta. Respondiendo a la primera pregunta del cuestionario planteado al principio del artículo, con el adiestramiento debido la prueba sí puede ser realizada de forma confiable en Atención Primaria pediátrica (tanto por parte de pediatras como por enfermería). Además, en respuesta a la segunda pregunta del cuestionario, hay suficientes estudios que han evaluado el TDR de antígeno estreptocócico en población de Atención Primaria pediátrica, como para asumir su utilidad en los pacientes de nuestro medio.
Aunque la FAS en general es una enfermedad de escasos costes directos, su frecuencia en Pediatría y los costes indirectos hacen que determine importantes gastos al sistema sanitario. Para responder a la séptima cuestión, un estudio realizado desde la perspectiva de nuestro sistema sanitario (Sistema Nacional de Salud español) y publicado en 20115, analizando seis diferentes estrategias de abordaje de la faringitis pediátrica (tratar con antibiótico todo, tratar en función de una escala clínica, TDR a todos, TDR a todos más cultivo en los negativos, cultivo a todos, y TDR tras cribado mediante escala clínica –test de Centor ≥3–) concluye que las dos últimas estrategias son más efectivas y menos costosas que las cuatro primeras. El coste promedio por paciente para la estrategia de cultivo a todos fue de 86,04 &eur;, mientras que para la de TDR tras score clínico fue de 48,78 &eur;. La estrategia más efectiva fue el cultivo a todos, pero la más coste-efectiva fue la realización del TDR tras cribado mediante test de Centor. Hay que señalar que no se analiza la opción de realizar cultivo tradicional tras cribado mediante escala clínica, pero con un TDR de buena sensibilidad y especificidad y al coste económico valorado en el estudio (2,67 &eur; por cada TDR frente a 5,43 &eur; por cada cultivo tradicional), parece improbable que esta opción supere en coste-efectividad a la de TDR tras cribado.
En resumen y respecto a la dotación de las consultas de Pediatría de Atención Primaria con TRDA se puede concluir que:
- Favorece y contribuye a un uso racional de los antibióticos al evitar el uso de los mismos en procesos en los que no están indicados.
- Disminuye los costes optimizando la utilización de recursos diagnósticos y terapéuticos.
- Aumenta el nivel de calidad de la atención prestada a los pacientes.
- Aumenta la seguridad del paciente al establecer de forma rápida la necesidad o no de tratamiento, evitando los problemas originados por una inadecuada prescripción: efectos adversos en el paciente y resistencias bacterianas en la población.
Por todo ello, el Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención primaria recomienda que este método diagnóstico sea incorporado a las consultas de Pediatría en este nivel asistencial.
TEST DE DETECCIÓN RÁPIDA DEL VIRUS DE LA GRIPE
El virus de la gripe es un virus ARN de la familia Orthomyxoviridae, con dos principales tipos, A y B, definidos por la nucleoproteína presente en la nucleocápside. Ambos tipos tienen glicoproteínas que se asientan en la membrana de envoltura: la hemaglutinina (HA) y la neuraminidasa (NA), son los antígenos responsables de las variaciones antigénicas. Existe un tercer tipo de virus gripal C que no produce patología en los seres humanos. Estos virus tienen una alta capacidad para sufrir variaciones antigénicas, lo que les otorga una especial transcendencia desde el punto de vista epidemiológico.
En los periodos epidémicos, la carga de la enfermedad recae sobre todo en la población <14 años con una tasa de ataque que dobla a la población adulta, siendo un vector importante en la transmisión de la enfermedad. También hay que tener en cuenta el especial riesgo en lactantes y niños con enfermedades subyacentes (enfermedad pulmonar crónica y cardiopatía, etc.).
El diagnóstico definitivo se realiza por el aislamiento del virus por cultivo y en los últimos años por técnicas de biología molecular, reacción en cadena de la polimerasa(PCR), la cual aumenta significativamente la sensibilidad y especificidad en el diagnóstico de las infecciones reduciendo mucho el tiempo requerido con otras pruebas. De momento precisa de equipos y personal especializado y tienen un alto coste.
Los TDR más desarrollados para la detección en la consulta de virus influenza son los basados en inmunoanálisis. Existen dos grupos según lo que detectan:
- Anticuerpos conjugados a la nucleoproteína viral, detectados por un cambio de color.
- Detección de la neurominidasa del virus, mostrada por un cambio de color.
Sus principales ventajas son que permiten hacer el diagnóstico de infección en tiempo real, ayudando en la decisión de instaurar tratamiento antiviral, en el caso de que se decida que lo precisa, de forma precoz en la misma visita. También permitirá de forma temprana establecer medidas de higiene preventiva en el entorno del paciente. Como desventaja principal, que la sensibilidad y especificidad son variables según el método y generalmente inferiores a métodos convencionales como visualización directa y cultivos.
Es importante tener en cuenta que la adecuación de las muestras se debe monitorizar cuidadosamente antes de empezar a realizar pruebas rápidas. El tipo de muestra que se debe recoger será distinta según el test con que se cuente. Según los estudios previos y las fichas técnicas, el lavado-aspirado nasofaríngeo es el método más rentable. También se debe considerar que el periodo para la recogida de la muestra es limitado. El mejor momento para practicar el test rápido está entre las 12 y las 48 horas del inicio de la sintomatología, y siempre en los cuatro primeros días. Antes de las 12 horas puede haber falsos negativos.
Los diferentes tipos de test disponibles pueden consultarse la tabla que muestra el documento del Grupo de Patología Infecciosa en su documento sobre este tema6.
Las pruebas rápidas son diferentes en algunos aspectos importantes:
- Algunas pueden identificar los virus de la influenza A y B y diferenciarlos.
- Otras pueden identificar los virus de la influenza A y B pero no pueden diferenciarlos.
- Algunas pruebas se pueden usar con una variedad de muestras, pero la exactitud de las pruebas puede variar según el tipo de muestra recolectado (por ejemplo, hisopado faríngeo versus lavado nasal).
Existen numerosos estudios sobre los test rápidos por el gran interés que suscitaron, sobre todo en el año 2009 con la pandemia AN1 H1. En febrero de 2012 Chartrand publicó un metaanálisis en el que incluye 159 estudios que comparan los resultados de test rápidos. A pesar de que los autores resaltan que estos estudios presentan algunas deficiencias metodológicas, concluyen que la gripe puede ser confirmada pero no excluida a través del uso del test rápido y que la sensibilidad varía entre las distintas poblaciones, siendo mayor en los niños que en los adultos y para la gripe A que para la influenza B7. Tanto la Food and Drug Administration en una nota titulada, “Performance and Cautions in Using Rapid Influenza Virus Diagnostic Tests” y recientemente los Centers for Disease Control and Prevention (CDC) en su web han realizado unas puntualizaciones sobre la necesidad de interpretar los resultados de las pruebas teniendo en cuenta el periodo epidémico en el que se realiza. Cuando la prevalencia de la enfermedad es relativamente baja, el valor predictivo positivo (VPP) es bajo y es más probable que se den resultados falsos positivos. Por el contrario, el valor predictivo negativo (VPN) es alto y es más probable que los resultados negativos sean verdaderos. Sin embargo, cuando la prevalencia de la enfermedad es relativamente alta, el VPN es bajo y hay mayor probabilidad de que los resultados de las pruebas sean falsos negativos, mientras que el VPP es alto y es más probable de que los resultados positivos sean verdaderos.
Siguiendo el cuestionario propuesto tenemos los siguientes datos para este test:
1. ¿Se puede utilizar la prueba de forma confiable?
Los TDR para influenza están diseñados para su uso en la cabecera del enfermo y por personal sanitario sin formación específica en técnicas de laboratorio. Para mejorar su precisión se deben guardar las siguientes precauciones:
- Se necesita un entrenamiento inicial tanto en la recogida de muestra, en la realización del test y en la interpretación. Hay cursos de entrenamiento (www.jointcommision.com) y tutoriales de cómo realizar la recogida de muestras.
- Realizar el test cuando la replicación del virus es lo suficientemente elevada como para que el test lo detecte: entre el segundo y el cuarto día de síntomas.
- Seguir fielmente las instrucciones del fabricante: muestra requerida, pasos indicados en la técnica, tiempo para dar el resultado, la interpretación del test y la fecha de caducidad.
- Conocer el estado epidémico para valorar la fiabilidad del test, la prevalencia de la enfermedad va a determinar el valor predictivo positivo y negativo.
Según los protocolos publicados por la Organización Mundial de la Salud y por los CDC en el ámbito clínico, estos test siempre se realizaran cuando clínicamente se cumplan los criterios diagnósticos de ILI (Influenza like illness) y además se considere que van a influir en la toma de decisiones sobre pautas diagnósticas y terapéuticas.
2. ¿Se ha evaluado la prueba en población adecuada?
Se han realizado múltiples estudios en población adulta y pediátrica de forma independiente y en poblaciones mixtas. El metaanálisis mencionado de Chartrandanaliza 119 estudios realizados en diferentes países, la mayoría en el ámbito hospitalario y algunos en el ambulatorio. Cincuenta y cuatro de estos estudios se han realizado en población pediátrica (0-18 años). Los estudios españoles analizados en este metaanálisis son pocos y realizados en Urgencias Hospitalarias.
Solo 28 estudios realizaron el test a la cabecera del enfermo. Se realizaron en pacientes con sospecha de gripe, aunque solo 45 estudios definieron claramente los criterios de inclusión. La mayoría de los estudios (105) se realizaron en la época epidémica. Queda pendiente, por tanto, realizar estudios que evalúen la prueba en el ámbito ambulatorio, que incluyan tanto población sana como enferma y en nuestro país o alguno de nuestro entorno.
3. ¿Se usó un patrón oro como referencia para evaluar la prueba?
Los estudios que han evaluado los TDR para virus gripal determinan la sensibilidad y especificidad de estos comparándolos con las dos pruebas que se consideran patrón oro: cultivo viral y RT-PCR. En los estudios publicados hasta la fecha, realizados en población pediátrica, los TDR han mostrado una sensibilidad baja, del 66,6% (IC 95%: 61,6 a 71,7) y una especificidad elevada, del 98,2% (IC 95%: 97,5 a 98,7). Esto significa que la frecuencia de falsos negativos es alta y por tanto si la clínica es consistente con gripe no se debe descartar el diagnóstico, ni retrasar el tratamiento, si este fuera preciso, por el resultado de la prueba.
4. ¿Se eligió un punto de corte apropiado para optimizar sensibilidad y especificidad?
El resultado de estas pruebas consiste en la aparición de una banda o cambio de color, no dan un resultado numérico. Se trata de una prueba con dos soluciones: positivo o negativo, por tanto es dicotómica y no es una variable cuantitativa que exija realizar curvas ROC para determinar puntos de corte.
5. ¿Cuál es el cociente de probabilidad positivo y negativo?
Con los datos del metaanálisis el cociente de probabilidad positivo es de 34,5 (IC 95%: 23,8 a 45,2) y el de probabilidad negativo es de 0,38 (IC 95%: 0,34 a 0,43). En la población pediátrica, dado que la sensibilidad de los test es ligeramente mayor que en la población general, el cociente de probabilidad positivo es de 36,77 (IC 95%: 24,64 a 55,15) y el cociente de probabilidad negativo es de 0,34 (IC 95%: 0,28 a 0,39).
6. ¿Hasta qué punto es aplicable la prueba en una población específica?
Los valores predictivos positivo y negativo varían según el momento epidémico en que nos encontremos y es otro factor a tener en cuenta al interpretar el resultado de los test. Ya se ha comentado la importancia del momento de prevalencia de la enfermedad en la utilidad del test.
7. ¿Cuál es el balance entre el coste de la enfermedad y el coste del test?
La gripe es una enfermedad que en el momento epidémico supone un coste elevado. La mejor medida para disminuir estos gastos es la vacunación a sectores amplios de la población, como ocurre en nuestro país con la vacunación a la población de riesgo y a amplios sectores productivos. Según el estudio publicado por Rothbergen EE. UU. y que analizó la relación coste-efectividad en el ámbito extrahospitalario, los test rápidos solo son coste-efectivos cuando la probabilidad de gripe es menor del 60%, es decir, fuera de la época epidémica.
El coste económico de estos test no es excesivo, alrededor de 8 &eur; por test. El factor limitante se encuentra en su insuficiente fiabilidad. El uso de esta arma diagnóstica, cuando mejore sus indicadores de fiabilidad, alcanzará niveles razonables de coste-efectividad, ya que disminuirá claramente el uso de otros recursos diagnósticos y terapéuticos.
Podríamos concluir que, a día de hoy, no debería ser una herramienta de la que se dispusiera ampliamente en Atención Primaria. En todo caso parece más eficiente el protocolizar en qué nivel de la atención médica se dispone de estos TDR para determinados pacientes (en este caso parece más lógico no hacer un uso extensivo, y sí dotar a servicios como los de urgencias hospitalarios). Se podría valorar su uso en algunas circunstancias, como en aquellos niños que por su situación (enfermedades crónicas) pudiera estar indicado el tratamiento antiviral, así como en lactantes, sobre todo menores de tres meses, con síndrome febril de etiología no aclarada y en periodo epidémico de gripe. En estos casos puede suponer un descenso en la utilización de pruebas complementarias y en el uso de antibiótico, pero podría realizarse en el servicio de urgencias hospitalario.
TEST DE DETECCIÓN RÁPIDA DE VIRUS RESPIRATORIO SINCITIAL
El VRS es uno de los patógenos respiratorios más importante en todo el mundo, causante de infecciones de vías aéreas bajas sobre todo en lactantes, ancianos e individuos inmunodeprimidos, y para el que hasta el momento no existe vacuna ni tratamiento eficaz. El VRS pertenece a la familia de los Paramixovirus. Es un virus ARN relativamente grande (150-300 nm), con envoltura de doble capa muy frágil. Tiene dos proteínas de superficie denominadas F y G de especial interés, ya que le confieren sus características antigénicas induciendo la síntesis de anticuerpos neutralizantes. En base a sus diferencias antigénicas, se identifican dos grupos principales de VRS, A y B, que se diferencian sobre todo en la glicoproteína G. Las diferentes secuencias de la proteína G dan lugar a seis subgrupos en el grupo A y a tres subgrupos en el B. No se han demostrado diferencias clínicas ni epidemiológicas entre ambos grupos, aunque es posible que haya unas cepas más virulentas que otras. Los subgrupos predominantes pueden cambiar de un año a otro y esto explica la posibilidad de reinfección por distintos subgrupos. Representa una enorme carga para el sistema sanitario, ya que entre el 17 y 31‰ de los infectados requerirán hospitalización, cifras que en España suponen entre 10 000 y 14 000 ingresos/año. Además, el número de niños fallecidos en relación con infecciones por el VRS se ha estimado que estaría en cifras entre 70 y 250 al año.
En la población pediátrica existen patologías de base que condicionan una especial gravedad y factores de riesgo que incrementan la probabilidad de infección. Es altamente contagioso y se presenta, en nuestro entorno, en forma epidémica en los meses fríos (a finales de otoño, invierno e inicios de primavera), siendo excepcional en los meses cálidos. El 50% de los lactantes de un año y más del 95% de los de dos años tienen evidencias serológicas de haber pasado una infección por VRS.
De cara al diagnóstico de la infección, el lavado-aspirado nasofaríngeo es el tipo de muestra que presenta mayor rendimiento.
El cultivo fue considerado como el patrón oro para la demostración del virus durante mucho tiempo, siendo sustituido en la actualidad por técnicas moleculares (PCR) que han revolucionado los procedimientos diagnósticos en virología. Las técnicas moleculares son más sensibles que el cultivo y se pueden realizar en un corto periodo de tiempo, pero son más caras y no están disponibles en todos los centros. En los últimos años se ha generalizado el uso de técnicas de detección de antígenos virales más rápidas (resultados entre 15 y 30 minutos) y menos costosas. Guías de práctica clínica como la de la SIGN9 hacen referencia a que los test virales rápidos han demostrado ser coste-efectivos, reduciendo la estancia hospitalaria, el uso de antibióticos y el número de estudios microbiológicos realizados.
Los TDR de antígenos virales para VRS han sido rápidamente aceptados y generalizados para uso en laboratorios de referencia por su disponibilidad en cualquier punto, su rapidez (menos de 30 minutos), coste y por no necesitar personal especialmente entrenado.
Por esta razón es la técnica diagnóstica más usada en todo el mundo, suponiendo, por ejemplo, las dos terceras partes de los resultados del seguimiento del VRS en EE. UU. en 2011.
Existen tres tipos: inmunocromatografía, enzimoinmunoanálisis e inmunoanálisis óptico. Tienen un principio común, que es que se produce un cambio de color en el substrato cuando la muestra nasofaríngea del paciente contiene proteínas virales.
Respondiendo a la primera cuestión, son fáciles de realizar en la consulta de Atención Primaria, aunque precisan de buen adiestramiento en la técnica del lavado-aspirado nasofaríngeo. Con respecto a la segunda, de los pocos estudios publicados, se muestra como una técnica planteada para el estudio en el ámbito del niño hospitalizado. No los hay en Atención Primaria por ser una enfermedad cuyas opciones diagnósticas y terapéuticas no se van a modificar por conocer su etiología. La Guía de Práctica Clínica sobre Bronquiolitis Aguda del Sistema Nacional de Salud10, con una fuerza de recomendación B, no recomienda la realización sistemática de un test de detección de virus en la valoración de los pacientes con bronquiolitis aguda, porque no modifica su tratamiento. Establece también, con una fuerza de recomendación A, que los test para VRS pueden ser útiles para establecer cohortes hospitalarias cuando no es posible aislar a los pacientes. En relación con la tercera cuestión, los TDR frente a VRS sí han sido debidamente valorados en su comparación con los cultivos de virus o con las más sensibles pruebas moleculares (PCR). El cociente de probabilidad positivo oscila entre 7,00 y 9,00 mientras que el negativo da valores entre 0,33 y 0,11.
Con respecto a la sexta cuestión relativa a su aplicabilidad en nuestro medio, parece claro que se trata de una prueba probada y validada en el ámbito hospitalario, por lo que deberían realizarse investigaciones orientadas a fundamentar la validez y utilidad de los TDR de VRS en Atención Primaria. No podemos valorar entonces, de forma rigurosa, su validez y utilidad en este nivel.
Por último, y en relación a la última cuestión, aunque el precio actual por test no es excesivo (6-8 &eur; por determinación), parece que está pendiente de establecerse su coste-efectividad en el ámbito de la Atención Primaria. La Guía de SIGN establece el coste-efectividad de estas pruebas, pero en el ámbito de los laboratorios de referencia y de la Atención Hospitalaria.
En resumen, el documento que sobre esta prueba ha elaborado el Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención Primaria (AEPap) valora como fortalezas del test que es rápido y se puede realizar en cualquier lugar, que no precisa personal entrenado especialmente, que disminuye el uso de test rápidos de estreptococo, que permite implementar medidas de control (sobre todo en la prevención de la infección nosocomial), que permite la disminución de tratamientos antibióticos empíricos, que ayuda a reducir las exploraciones complementarias, que no es caro y que ayuda a reducir la estancia media hospitalaria11. Como debilidades, su pobre sensibilidad frente a otras técnicas, y que, además, esta sensibilidad disminuye más fuera de la temporada epidémica. Por ello, respecto a la utilidad de este test concluye que, de forma general, no es necesario el uso de TDR del antígeno VRS para diagnosticar la bronquiolitis en AP, ya que no implica cambios en el tratamiento ni en el pronóstico de la enfermedad. Precisa que solamente en aquellos lactantes con una situación clínica en la que la realización de procedimientos, el ingreso hospitalario o la prescripción de antibióticos sea altamente probable, el uso de pruebas de diagnóstico rápido podría resultar útil. Pero hay que establecer en qué nivel de la asistencia sanitaria es más coste-efectivo que se lleve a cabo esta prueba.
TEST DE DETECCIÓN RÁPIDA DEL VIRUS DE EPSTEIN-BARR
El VEB es el responsable de la mononucleosis infecciosa clásica. Además, fue el primer virus del que se demostró que tenía potencial oncogénico. Su célula diana, a la que invade, es el linfocito B, lo que genera una respuesta de linfocitos T contra los B invadidos, que provoca días después del inicio de la clínica el paso a una fase de latencia. La primoinfección por el virus determina la respuesta de anticuerpos heterófilos no específicos dirigidos contra hematíes de carnero (detectables mediante el test de Paul Bunell) y caballo. En su mayoría son del tipo IgM y permiten el diagnóstico en aproximadamente el 90% de los pacientes con mononucleosis infecciosa. La detección de otros anticuerpos dirigidos contra antígenos específicos del virus permiten también el diagnóstico etiológico: es el caso de la demostración de IgM e IgG frente al antígeno de la cápside (VCA). También es útil la detección de anticuerpos contra antígenos que se han producido en la célula infectada por el virus de la hepatitis B, como son el antígeno precoz (EA, early antigen), el antígeno nuclear (EBNA, Epstein-Barr nuclear antigen) y el antígeno de membrana. Existen test diagnósticos rápidos mediante técnica de inmunocromatografía que detectan los anticuerpos heterófilos IgM en muestra de sangre capilar. Las limitaciones son las propias del Pul Bunell, es decir, que puede haber falsos negativos en la primera semana de la enfermedad (es mucho más segura su positividad a partir de los siete días del inicio de los síntomas) y que bastantes niños menores de cuatro años no van a tener anticuerpos heterófilos detectables. Los kits que ofrecen esta tecnología dan el resultado en 5-15 minutos con un precio por determinación que oscilaría entre 3 y 5 €. La sensibilidad y especificidad es próxima al 99% si el patrón oro es el Paul Bunell, pero por las limitaciones de este la sensibilidad oscila entre el 60 y el 90% y la especificidad es del 95% para el diagnóstico de mononucleosis infecciosa12. Hay muy poca experiencia de su utilización en Atención Primaria; su utilidad podría estar en los casos de faringoamigdalitis (estreptocócica o no) que independientemente del tratamiento antibiótico persista con fiebre tras 3-4 días. Hay que tener en cuenta que no son raras las coinfecciones por SBGA y VEB.
Recientemente, un grupo del Hospital Clínico de Valencia13 ha desarrollado un test rápido mediante técnica de inmunofiltración que detecta IgM en sangre capilar contra la proteína ZEBRA (proteína que se expresa durante el ciclo lítico de la célula invadida ya desde el inicio y que desempeña un papel esencial en la transactivación de varios genes del VEB en la célula hospedadora). Aunque falta por ser probada en población pediátrica de Atención Primaria, la sensibilidad del test en general es del 92,5% y la especificidad del 97,3%, y, lo que es más importante, principalmente en niños menores, su sensibilidad para diagnosticar mononucleosis infecciosas por el virus con anticuerpos heterófilos negativos es del 86,2%. No obstante, ha de completarse el estudio de esta prueba en el ámbito de la Atención Primaria para valorar su rendimiento.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: AEPap: Asociación Española de Pediatría de Atención Primaria • CDC: Centers for Disease Control and Prevention • FAS: faringoamigdalitis estreptocócicas • IC 95%: intervalo de confianza del 95% • PCR: reacción en cadena de la polimerasa • SBGA: Streptococcus β-hemolítico del grupo A • TDR: test de diagnóstico rápido • VEB: virus de Epstein-Barr • VPN: valor predictivo negativo • VPP: valor predictivo positivo • VRS: virus respiratorio sincitial.
BIBLIOGRAFÍA
- Jiménez Alés R, Serrano Rodríguez L, Borrego González G. Uso juicioso de pruebas complementarias en Atención Primaria. Vox Paediatrica. 2010;17:28-32.
- García Vera C. Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención Primaria. Utilidad del test rápido de detección de antígeno estreptocócico (TRDA) en el abordaje de la faringoamigdalitis aguda en Pediatría. Enero 2014 [en línea]. Disponible en: www.aepap.org/grupos/grupo-de-patologia-infecciosa/contenido
- Romero Vivas J, Sánchez A, Corral O, Rubio M, Picazo JJ. Estudio de las infecciones pediátricas en el medio extrahospitalario. Rev Esp Pediatr. 1994;(Supl 63):112-6.
- Shaikh N, Leonard E, Martin JM. Prevalence of streptococcal pharyngitis and streptococcal carriage in children: a meta-analysis. Pediatrics. 2010;126:e557-64.
- Giráldez-García C, Rubio B, Gallegos-Braun JF, Imaz I, Gonzalez-Enríquez J, Sarria-Santamera A. Diagnosis and management of acute pharyngitis in a paediatric population: a cost-effectiveness analysis. Eur J Pediatr. 2011;170:1059-67.
- Bengoa A, Cocho P, Alfayate S. Grupo de Patología Infecciosa AEPap. Test de detección rápida de virus de gripe. 24 de enero de 2014 [en línea]. Disponible en: www.aepap.org/grupos/grupo-de-patologia-infecciosa/contenido/documentos
- Chartrand C, Leeflang MM, Minion J, Brewer T, Pai M. Accuracy of rapid influenza diagnostic tests: a meta-analysis. Ann Intern Med. 2012;156:500-11.
- Rothberg MB, Fisher D, Kelly B, Rose DN. Management of Influenza Symptoms in Healthy Children. Cost-effectiveness of Rapid Testing and Antiviral Therapy. Arch Pediatr Adolesc Med. 2005;159:1055-62.
- Scottish Intercollegiate Guidelines Network. A national clinical guideline. Bronchiolitis in children. 2006 [en línea]. Disponible en: www.sign.ac.uk/
- Grupo de Trabajo de la Guía de Práctica Clínica sobre Bronquiolitis Aguda. Fundació Sant Joan de Déu (coord.). Guía de Práctica Clínica sobre Bronquiolitis Aguda. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social. Agència d’Avaluació de Tecnologia i Recerca Mèdiques; 2010 [en línea]. Disponible en www.guiasalud.es/GPC/GPC_463_Bronquiolitis_compl.pdf
- Alfayate S, Bengoa A, Cocho P. Grupo de Patología Infecciosa AEPap. Test de detección rápida del virus sincitial respiratorio. Enero de 2014 [en línea]. Disponible en: www.aepap.org/grupos/grupo-de-patologia-infecciosa/contenido/documentos
- De la Flor i Brú J. Test de diagnóstico microbiológico rápido en la consulta de Pediatría de Atención Primaria. Pediatr Integral. 2014;XVIII37-43.
- Bravo D, Muñoz-Cobo B, Costa E, Clari MA, Tormo N, Navarro D. Evaluation of an immunofiltration assay that detects immunoglobulin M antibodies against the ZEBRA protein for the diagnosis of Epstein-Barr virus infectious mononucleosis in immunocompetent patients. Clin Vaccine Immunol. 2009;16:885-8.
Comentarios
Este artículo aún no tiene comentarios.




