Prevención de la enfermedad meningocócica por el serogrupo B mediante una vacuna de cuatro componentes
Ángel Gila, D Barrancob, J Batallac, JM Bayasd, M Campinse, Pedro J. Gorrotxategi Gorrotxategif, J Lluchg, Federico Martinón Torresh, M.ª José Mellado Peñai, D Moreno-Pérezj, B Urielk, JA Vázquezl
aFacultad de Ciencias de la Salud. Universidad Rey Juan Carlos. Alcorcón. Madrid. España.
bTécnico de Salud Pública. Madrid. España.
cEspecialista en Medicina Preventiva y Salud Pública. Barcelona. España.
dServicio de Medicina Preventiva. Centro de Vacunación de Adultos. Hospital Clínic. Barcelona. España.
eServicio de Medicina Preventiva y Epidemiología. Hospital Vall d’Hebron. Barcelona. España.
fPediatra. CS Pasaia San Pedro. Pasajes. Guipúzcoa. España.
gEspecialista en Medicina Preventiva y Salud Pública. Valencia. España.
hUnidad de Cuidados Intensivos de Pediatría. Hospital Clínico Universitario de Santiago. Universidad de Santiago de Compostela. Santiago de Compostela. La Coruña. España.
iUnidad de Enfermedades Infecciosas y Tropicales Pediátricas. Servicio de Pediatría. Hospital Carlos III. Madrid. España.
jUnidad de Infectología Pediátrica. Hospital Materno-Infantil Carlos Haya. Málaga. España.
kServicio de Medicina Preventiva. Complexo Hospitalario Universitario de Ourense. Ourense. España.
lLaboratorio de Referencia de Meningococos. Instituto de Salud Carlos III. Madrid. España.
Correspondencia: A Gil. Correo electrónico: angel.gil@urjc.es
Cómo citar este artículo: Gil A, Barranco D, Batalla J, Bayas JM, Campins M, Gorrotxategi Gorrotxategi PJ, et al. Prevención de la enfermedad meningocócica por el serogrupo B mediante una vacuna de cuatro componentes. Rev Pediatr Aten Primaria. 2014;16:108.e55-e74.
Publicado en Internet: 23-06-2014 - Número de visitas: 44339
Resumen
Introducción: la enfermedad meningocócica es una infección grave causada por Neisseria meningitidis, cuyo serogrupo predominante actualmente es el B, para el que ha sido complejo crear vacunas efectivas y, por tanto, difícil modificar o reducir su morbimortalidad. El objetivo de este trabajo ha sido revisar los datos existentes sobre la nueva vacuna 4 CMenB y sus posibles aportaciones en la prevención de esta infección.
Métodos: se realizó una búsqueda de autor dirigida por 12 especialistas relacionados con la Pediatría, Vacunología y Salud Pública, que priorizó 74 publicaciones, para preparar un documento de revisión sobre la vacuna. El documento se trabajó en una reunión presencial y se validó posteriormente mediante correo electrónico.
Resultados: la vacuna 4 CMenB, basada en cuatro componentes (NadA, fHbp, NHBA y OMVnz), se ha diseñado mediante Vacunología inversa. El Meningococcal Antigen Typing System muestra una potencial cobertura del 70-80% de las cepas circulantes en Europa. Los ensayos clínicos demuestran que la vacuna es inmunógena y segura en lactantes, niños, adolescentes y adultos, e induce memoria inmunológica. La incidencia de fiebre es similar a la de las vacunas sistémicas si se administra sola, pero resulta mayor cuando se coadministra con ellas, aunque el patrón de fiebre es predecible y autolimitado. Es compatible con la mayoría de las vacunas incluidas en el calendario sistemático español, pudiendo administrarse simultáneamente con las vacunas hexavalente y pentavalente actualmente disponibles, así como con la vacuna antineumocócica conjugada heptavalente. Aún no hay datos disponibles respecto al uso concomitante con la vacuna antimeningocócica C y las vacunas antineumocócicas de amplio espectro.
Conclusiones: la vacuna 4 CMenB, por el momento, es la única estrategia disponible para prevenir la enfermedad meningocócica por el serogrupo B.
Palabras clave
● Meningitis ● Meningitis meningocócica ● Prevención y control ● Vacunas ● Vacunas antimeningocócicasNota:
Artículo publicado simultáneamente en Anales de Pediatría (An Pediatr.2014;80:259.e1-259.e23).
ENFERMEDAD MENINGOCÓCICA
Definición y conceptos generales
La enfermedad meningocócica es una infección grave causada por Neisseria meningitidis (N. meningitidis) que incluye diversas formas clínicas, como meningitis y sepsis.
Se han identificado 12 serogrupos de N. meningitidis, 6 de los cuales (A, B, C, W135, X e Y) pueden afectar al ser humano, aunque actualmente existe un cierto nivel de controversia en la nomenclatura. La mayoría de ellos son endémicos. Sus datos epidemiológicos y la circulación de serogrupos varían según las áreas geográficas, y todos ellos pueden producir epidemias1.
Las cepas del serogrupo B que causan enfermedad invasiva son más diversas genéticamente que las de otros serogrupos. La infección por meningococo B (MenB) es la principal causa de enfermedad invasiva en países desarrollados, en los que lactantes y adolescentes son las poblaciones más vulnerables a presentar las formas más graves de la enfermedad2.
Epidemiología y carga de la enfermedad
Distribución geográfica y estacional
La mayor parte de los casos de enfermedad meningocócica suceden durante el invierno y el inicio de la primavera2-7. La epidemiología de la enfermedad varía según el área geográfica y el serogrupo8,9. El serogrupo A es responsable de las grandes epidemias en África, mientras que los grupos B y C predominan en países industrializados, siendo los responsables de la mayoría de los casos en Europa y el continente americano. El serogrupo W135 provoca epidemias como la de Arabia Saudí y, a finales de 2012, ha sido motivo de un número importante de casos en países del cinturón africano y en Argentina y Chile10. El serogrupo Y es la causa más común de enfermedad meningocócica en EE. UU. y Colombia, y es muy frecuente en Canadá e Israel. El serogrupo Y ha producido epidemias en Ghana y algún otro país africano2.
La razón de la distinta distribución de los serogrupos a nivel mundial es desconocida, aunque las diferencias inmunitarias en la población y los factores ambientales desempeñan un papel fundamental.
Situación de la enfermedad meningocócica en Europa
Según datos del European Centre for Disease Prevention and Control (ECDC), la incidencia de la enfermedad meningocócica en Europa oscila entre 0,13 y 3,37 casos por 100 000 habitantes (año 2009)9. Los serogrupos que han predominado en la última década del siglo XX en Europa han sido el B y el C9. No obstante, en la última década, la incidencia de enfermedad meningocócica invasiva ha mostrado una reducción importante, debido a la incorporación de las vacunas antimeningocócicas conjugadas C en el calendario de vacunación infantil sistemática en muchos países4 (de 1,9 por 100 000 habitantes a 0,92 por 100 000 habitantes). Por ello, el serogrupo B es el que actualmente predomina en Europa. Este serogrupo suele causar ondas epidémicas de ciclo largo.
La incidencia de la enfermedad meningocócica varía con la edad, con las tasas más altas en lactantes, seguidos de los adolescentes y los adultos jóvenes. Según datos de 2009, en Europa la incidencia en lactantes fue de 15,9 casos por 100 000 habitantes, seguida por la de los niños entre 1 y 4 años (5,4 por 100 000 habitantes) y los adolescentes de 15-19 años (2,0 por 100 000 habitantes)2-4.
El serogrupo B es el causante de la mayor parte de los casos de esta enfermedad en Europa. De los casos notificados de 2009 de los que se disponía del grupo capsular (en total el 88%), el 71% fue producido por el serogrupo B (particularmente en aquellos países que introdujeron vacunas conjugadas para el serogrupo C), el 13% por el serogrupo C y el 4% por el serogrupo Y. Entre 1993 y 1996, el serogrupo B ya había sido causante del 68% de los casos declarados en Europa2-4,11.
En cuanto a la distribución por serogrupos según la edad, gran parte de los casos producidos por el serogrupo B afectan a niños pequeños. El análisis de 4435 casos de enfermedad meningocócica invasiva comunicados en Inglaterra y Gales durante cuatro años (2006-2010) mostró que el 58% de los casos producidos por el serogrupo B ocurrían en niños menores de cinco años y que, en este grupo de edad, el serogrupo B era claramente mayoritario, siendo el responsable del 94% de los casos4.
Situación de la enfermedad meningocócica en España
En nuestro país, la enfermedad meningocócica es de declaración obligatoria, urgente e individual, y se registra por la Red Nacional de Vigilancia Epidemiológica mediante la notificación al Sistema de Enfermedades de Declaración Obligatoria (EDO)12.
Según datos publicados en los boletines epidemiológicos semanales, durante el periodo 2006-2007 la tasa de incidencia de casos declarados (casos confirmados y sospechosos no confirmados) fue de 1,37 por 100 000 habitantes, y descendió a 1,21 por 100 000 habitantes en 201012,13. Sin embargo, aunque se han observado importantes reducciones en las tasas de hospitalización y mortalidad por esta enfermedad durante los últimos años, su morbimortalidad continúa siendo importante en menores de cinco años14.
Existen diferencias entre las tasas de incidencia en las distintas comunidades autónomas. Durante el periodo 2006-2007, algunas comunidades registraron tasas de incidencia de hasta 4,19 por 100 000 habitantes, y en 2009-2010 algunas alcanzaron tasas de hasta 3,33 por 100 000 habitantes12,13. En la Tabla 1 se pueden observar datos de incidencia correspondientes al año 201012.
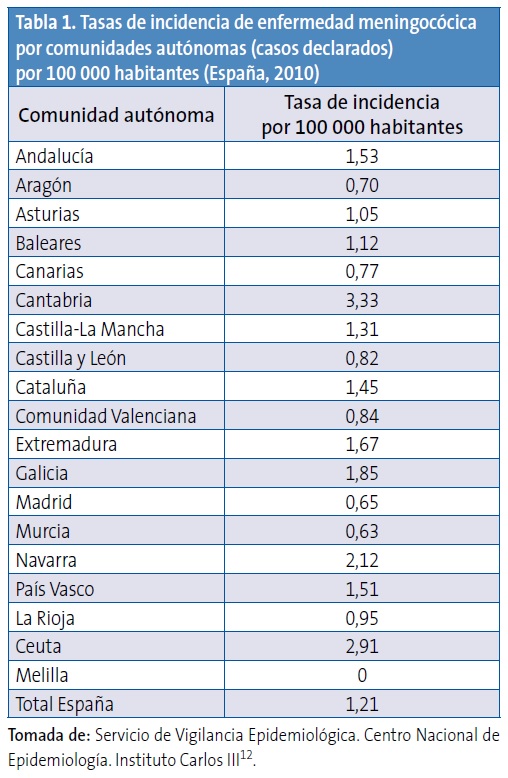
La introducción de la vacuna frente al serogrupo C en el año 2000 ha determinado un cambio importante en la epidemiología de la enfermedad meningocócica en nuestro país, dejando al serogrupo B como el principal responsable de la enfermedad invasiva. Sin embargo, en ausencia de una vacuna efectiva contra el serogrupo B, es difícil modificar o reducir la morbimortalidad por esta enfermedad en nuestro medio. Las tasas de incidencia de casos confirmados durante los últimos años (aproximadamente desde 2006 hasta 2010) han oscilado de 0,17 a 0,12 para el serogrupo C y de 1,12 a 0,69 para el serogrupo B. El descenso del número de casos del serogrupo B que se ha observado, particularmente en el año 2010, es similar al descenso que se ha observado en otros países europeos9. Puede tener su origen en la naturaleza cíclica de la enfermedad2-6 y estar determinado por diversos factores ambientales y conductas asociadas a riesgo2. Esta naturaleza cíclica obliga a mantener una vigilancia estricta que permita generar datos para la utilización potencial de vacunas basadas en formulaciones diferentes, así como monitorizar el impacto de las intervenciones con dichas vacunas. Por ejemplo, en la década de 1975-1985 la enfermedad meningocócica en Galicia alcanzó tasas de 30 casos por 100 000 habitantes15. Del resto de serogrupos (A, W135 e Y) se notifican solo de 10 a 30 casos en toda España, según la temporada (incidencias del 0,02 al 0,06 por 100 000 habitantes)12,13.
Consecuencias de la enfermedad meningocócica
Se estima que entre el 10 y el 14% de los casos de enfermedad meningocócica son letales, y entre un 8 y un 20% de los que sobreviven tienen secuelas neurológicas a largo plazo16. Entre las secuelas asociadas a la meningitis bacteriana y la septicemia meningocócica se encuentran: pérdida auditiva, amputaciones, complicaciones cutáneas, problemas psicosociales, hidrocefalia, problemas neurológicos y de desarrollo e insuficiencia renal16-19.
Es importante considerar el impacto económico y la carga de hospitalización generada por la enfermedad meningocócica en nuestro país. Un estudio sobre las hospitalizaciones y los fallecimientos relativos a la enfermedad meningocócica, basado en los datos de CMBD entre 1997 y 2008, mostró una incidencia anual de hospitalización de 2,33 por 100 000 habitantes14, con un coste anual asociado de más de cinco millones de euros.
Mecanismo de transmisión y manifestaciones clínicas
Estado de portador y transmisión del meningococo
La especie humana es el único reservorio conocido de N. meningitidis, y el tracto respiratorio superior es la principal fuente de infección. La presencia del meningococo en el tracto respiratorio superior puede ser transitoria, producir colonización y, por lo tanto, crear un estado de portador, o desarrollar una enfermedad invasiva16.
La transmisión del meningococo se produce de persona a persona, ya sea a partir de portadores asintomáticos o de enfermos, a través de las secreciones del tracto respiratorio superior16,20. El periodo de incubación es habitualmente de tres o cuatro días, pero puede variar entre dos y siete días. Las personas que no desarrollan la enfermedad en los siete días posteriores a la colonización pueden permanecer como portadores asintomáticos21. Aunque la mayor parte de los estudios de portación asintomática son estudios trasversales, algún estudio con muestras secuenciales de nasofaringe llega a la conclusión de que puede llegar a ser crónica, durar meses, ser intermitente (cepas diferentes colonizando consecutivamente) o simplemente transitoria, durante unos días/semanas22.
La prevalencia de portadores en la población general es muy variable y oscila entre el 0,6 y el 34,4% según varios estudios23-27. La tasa de portadores es superior entre aquellos que viven en áreas confinadas, como guarderías, escuelas, universidades, dormitorios o barracones militares; en las personas expuestas al humo del tabaco de forma activa o pasiva, y en aquellas con enfermedades del tracto respiratorio superior16.
Manifestaciones clínicas
En general, la sepsis y la meningitis son las formas clínicas habituales de la enfermedad meningocócica. Pueden aparecer de forma aislada o presentarse las dos a la vez en el mismo paciente. La sepsis meningocócica se presenta con fiebre, petequias y erupción maculopapular28. La mayoría de las veces, estas lesiones cutáneas aparecen en las primeras 24 horas del inicio de la fiebre28. Un 10-20% de los pacientes puede presentar una sepsis fulminante con púrpura, hipotensión, disfunción miocárdica y, finalmente, fallo multiorgánico en pocas horas, con una elevada mortalidad28.
La meningitis sin sepsis suele presentarse con vómitos, fotofobia, cefalea, rigidez de nuca, alteración variable del nivel de consciencia (desde obnubilación hasta coma) y, en lactantes, fontanela abombada o rechazo del alimento. En la meningitis aislada no suelen aparecer lesiones cutáneas29.
Es preciso tener presente que, en ocasiones, la sintomatología de la enfermedad meningocócica, tanto la sepsis como la meningitis, es inespecífica en las primeras horas y puede confundirse con un proceso infeccioso de etiología viral17,30.
Excepcionalmente, el meningococo puede ocasionar otras formas clínicas, como artritis, neumonía, endocarditis o pericarditis29.
Diagnóstico
El diagnóstico temprano de la meningococemia es particularmente difícil y requiere un elevado grado de sospecha clínica y una confirmación microbiológica por el laboratorio16,31.
La prueba diagnóstica más sensible es la reacción encadena de la polimerasa (PCR), cuyo resultado no se ve afectado por tratamiento antibiótico previo. Se utiliza también para la identificación definitiva de genogrupos (serogrupos) y genosubtipos (serosubtipos), siendo la PCR en tiempo real la más usada.
No obstante, el cultivo de la bacteria de un fluido corporal normalmente estéril, como la sangre o el líquido cefalorraquídeo (LCR), o la tinción de Gram del LCR, aún continúan siendo los métodos más ampliamente utilizados en el medio hospitalario, aunque es importante reseñar que la sensibilidad disminuye ostensiblemente si la muestra se obtiene tras haber iniciado tratamiento antibiótico3,16.
Los métodos que no incluyen cultivos, como el uso de kits comerciales para la detección de antígenos polisacáridos en el LCR, se han desarrollado para facilitar y mejorar el diagnóstico del laboratorio. Estos métodos son rápidos y específicos, y pueden proporcionar un diagnóstico preciso del grupo, pero pueden producir con facilidad falsos negativos y presentan reactividad cruzada con otros serogrupos, especialmente en la enfermedad por el serogrupo B3. Por ello, estos métodos no se incluyen generalmente entre los aceptados para confirmar un caso.
El aislamiento de la bacteria en los frotis nasofaríngeos exclusivamente no tiene valor diagnóstico, tan solo indica una colonización, por lo que no se recomienda su utilización para el diagnóstico de la enfermedad invasiva16.
Tratamiento
La enfermedad meningocócica es una enfermedad potencialmente fatal y debería ser siempre contemplada como una urgencia médica32. El tratamiento antibiótico precoz es uno de los factores más importantes en el pronóstico de la enfermedad; por tanto, se debe empezar el tratamiento en la misma consulta del centro de salud, antes de derivar al paciente al hospital.
La cefotaxima o la ceftriaxona son los antibióticos de elección hasta disponer del resultado del antibiograma16,32.
Durante la hospitalización tan solo está indicado adoptar precauciones para evitar el contacto directo con las secreciones respiratorias (aislamiento de gotas) que pudieran expelerse durante las primeras 24 horas del inicio del tratamiento antibiótico.
Prevención
Quimioprofilaxis
Existen dos tipos de foco de transmisión de la infección: el portador asintomático y el paciente sintomático. Para evitar casos secundarios, se deberá actuar eliminando el estado de portador en aquellos sujetos susceptibles de estar colonizados en su tracto respiratorio superior, como los compañeros de guardería, colegio o domicilio de un afectado31.
El riesgo de contraer la enfermedad a partir de los contactos con un paciente es más alto durante los primeros días de la enfermedad (desde una semana antes del inicio de los síntomas hasta 24 horas después de que el afectado haya iniciado el tratamiento antibiótico adecuado)3,16. La tasa de ataque de la enfermedad meningocócica en las personas en contacto estrecho con pacientes se ha calculado entre 400 y 800 veces mayor que la de la población general. En estos casos, el cultivo faríngeo no es útil para decidir quién debe recibir quimioprofilaxis, por lo que no se recomienda33.
La quimioprofilaxis tiene como objetivo reducir el riesgo de adquirir la enfermedad invasiva erradicando el estado de portador en el grupo de contactos. Esta quimioprofilaxis reduce el riesgo de enfermar de los contactos en más de un 80%. Los antibióticos administrados como quimioprofilaxis tienen el objetivo de eliminar el estado de portador nasofaríngeo y deben administrarse lo antes posible, ya que si han pasado más de 14 días desde el inicio de la enfermedad en el caso índice, es posible que la quimioprofilaxis tenga poco o ningún efecto beneficioso3,16.
Entre los antibióticos recomendados y más utilizados en la práctica clínica, destacan la rifampicina y el ciprofloxacino. También han mostrado eficacia el ofloxacino, la azitromicina (aunque está en discusión su utilidad por las resistencias observadas) y la ceftriaxona16,31.
Dado que los casos secundarios pueden aparecer varias semanas después del contacto con el caso índice, la vacunación antimeningocócica puede ser un gran apoyo a la quimioprofilaxis cuando un brote es causado por un serogrupo para el que se dispone de vacuna33. Sin embargo, no se recomiendan los programas de quimioprofilaxis masiva para el control de grandes brotes de la enfermedad. Diversos factores hacen esta medida poco viable y con pocas probabilidades de éxito, como son las múltiples fuentes de exposición, el prolongado riesgo de exposición, los problemas logísticos y su elevado coste3.
Vacunación
La estrategia de prevención más efectiva para el control de la enfermedad meningocócica es la vacunación3,34. Para conseguir un óptimo impacto en la prevención de esta enfermedad se requiere incorporar estas vacunas de forma temprana a los calendarios de vacunación infantil4.
Tipos de vacunas meningocócicas
Vacunas polisacarídicas no conjugadas. Las primeras vacunas meningocócicas efectivas basadas en el polisacárido capsular purificado de la bacteria se desarrollaron en los años 60 frente a los serogrupos A y C, seguidas por vacunas similares para los serogrupos Y y W135 en los años 80. Estas vacunas han desempeñado un papel destacado en la prevención de la enfermedad durante décadas, pero tienen limitaciones importantes35: no son inmunógenas en lactantes, no inducen memoria inmunológica y no generan protección de mucosas ni, por tanto, inmunidad de grupo34,36. El desarrollo de vacunas conjugadas frente a estos serogrupos ha representado un paso fundamental para consolidar la protección a largo plazo. Sin embargo, disponer de una vacuna protectora para el serotipo B no ha sido posible siguiendo las estrategias basadas en su polisacárido capsular.
Vacunas conjugadas. En los años 90 se desarrollaron vacunas glucoconjugadas contra el serogrupo C y a partir de 1999 se introdujeron en muchos países europeos (primero en Inglaterra y España, y luego progresivamente en el resto), Australia, EE. UU. y Canadá. La conjugación permitió superar las limitaciones de las vacunas polisacarídicas.
Las formulaciones glucoconjugadas multivalentes siguieron a las monovalentes del serogrupo C, y en 2005 se aprobó en EE. UU. la primera vacuna glucoconjugada contra los serogrupos A, C, Y y W135. Actualmente, existen tres vacunas conjugadas tetravalentes para los serogrupos A, C, Y y W135, que se diferencian en la proteína transportadora34,37, si bien en España, por el momento solo dos de ellas están disponibles, como de prescripción médica y uso hospitalario.
Desde diciembre de 2010 se dispone de una vacuna glucoconjugada monovalente para el serogrupo A, desarrollada para controlar la enfermedad por este serogrupo, que tiene una elevada incidencia en el cinturón africano de la meningitis34,37. Esta vacuna surge de una experiencia novedosa que ha sabido aunar el esfuerzo de organismos internacionales, como la Organización Mundial de la Salud, y de la empresa privada, dando como fruto una vacuna que ayudaría a controlar esta enfermedad en una zona donde la escasez y la limitación de recursos dificultan, en gran medida, la solución de grandes problemas de salud, como es el caso de la meningitis por meningococo A.
El uso de vacunas antimeningocócicas conjugadas ha significado un paso decisivo para la prevención de la enfermedad. Quedaría pendiente por el momento el control de la meningitis por el serogrupo B.
Efectividad de las estrategias vacunales. A lo largo del tiempo, diferentes estrategias vacunales han mostrado una buena efectividad para el control de la infección por meningococo. A mediados de los 90, en Europa hubo un incremento de la incidencia de enfermedad invasiva por el serogrupo C. Tras la introducción de las vacunas conjugadas para este subgrupo en los programas de inmunización sistemática de muchos países europeos, la enfermedad por el serogrupo C se redujo drásticamente y se demostró además su capacidad para producir inmunidad de grupo. Esta reducción posvacunal del serogrupo C ha sido la causa del predominio actual del serogrupo B9,36,38.
Datos concretos de países europeos, como el Reino Unido, Holanda o España, demuestran este hecho. En el Reino Unido, el uso de la vacuna conjugada contra el meningococo C (introducida en su calendario de vacunación sistemática infantil en 1999 y con catch up [vacunación de rescate] hasta los 18 años) se asoció a una reducción significativa y mantenida de la enfermedad meningocócica invasiva por este serogrupo, con tasas en 2008-2009 de solo 0,02 por 100 000 habitantes (reducción de 955 casos a 13)36,38.
En Holanda, la vacuna conjugada contra el meningococo C se introdujo en el programa de inmunización sistemática en un esquema de una dosis única a la edad de 14 meses en 2002. Además, se realizó una campaña nacional de catch-up en niños de 1-18 años (cobertura de aproximadamente un 94%) con la misma vacuna39.
En el año 2000 se introdujo en los calendarios vacunales de España a los 2, 4 y 6 meses de edad, juntamente con un programa de catch-up en menores de seis años, ampliado posteriormente a los 18 años, aunque de manera muy heterogénea según las comunidades autónomas y el año de introducción. En lactantes y niños de hasta nueve años de edad, la incidencia de la enfermedad se redujo de 7,04 casos por 100 000 habitantes (1999-2000) a 1,08 por 100 00036. La efectividad del programa ha sido del 95,2% para lactantes y del 97,8% para el de catch-up de los menores de seis años40. La protección de la población ha sido menos pronunciada que en otros países, puesto que la campaña de catch-up se dirigió inicialmente a niños menores de seis años, no incluyendo a los adolescentes, el grupo de edad en el que las tasas de portadores son más altas40. A los cuatro años de la introducción de la vacuna conjugada en el calendario vacunal español, si bien se observó una efectividad del 94%, se detectó también una pérdida de efectividad de la vacuna en aquellos niños vacunados pero que no recibieron una dosis de refuerzo a los 12 meses de vida40. Este hecho llevó a la modificación de la pauta vacunal inicial, retrasando la administración de la tercera dosis a partir del segundo año de vida40.
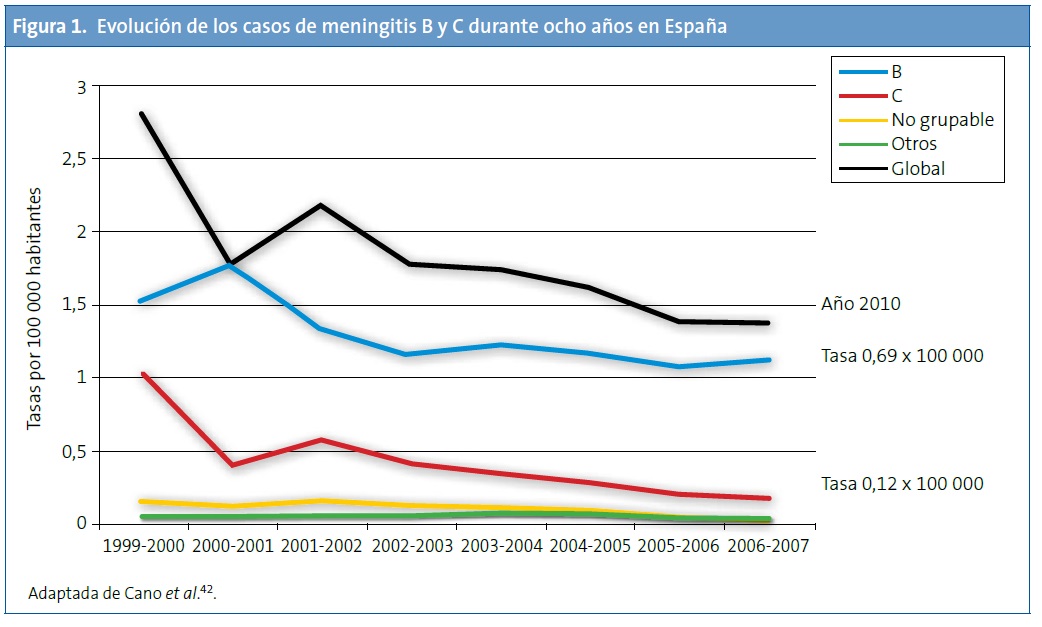
Evolución de los casos de meningitis por serogrupos en España tras la vacunación sistemática frente al serogrupo C. Tras la introducción de la vacuna conjugada (año 2000) se observa que la infección por el serogrupo C ha disminuido significativamente, mientras que la enfermedad por el serogrupo B no se ha modificado y es actualmente la más frecuente (Fig. 1)41. En un periodo de diez años, se ha producido un descenso del 88% en la tasa de incidencia de la meningitis C (temporada 1999-2000 respecto a 2009-2010)12. Asimismo sucede con datos relativos a hospitalización y muerte, habiéndose producido una reducción muy importante de estas tasas14. No obstante, la reducción global en el número de casos es inferior a la que se observa en el Reino Unido u Holanda9, probablemente a causa de unas bajas coberturas de las campañas de catch-up en adolescentes en algunas comunidades autónomas.
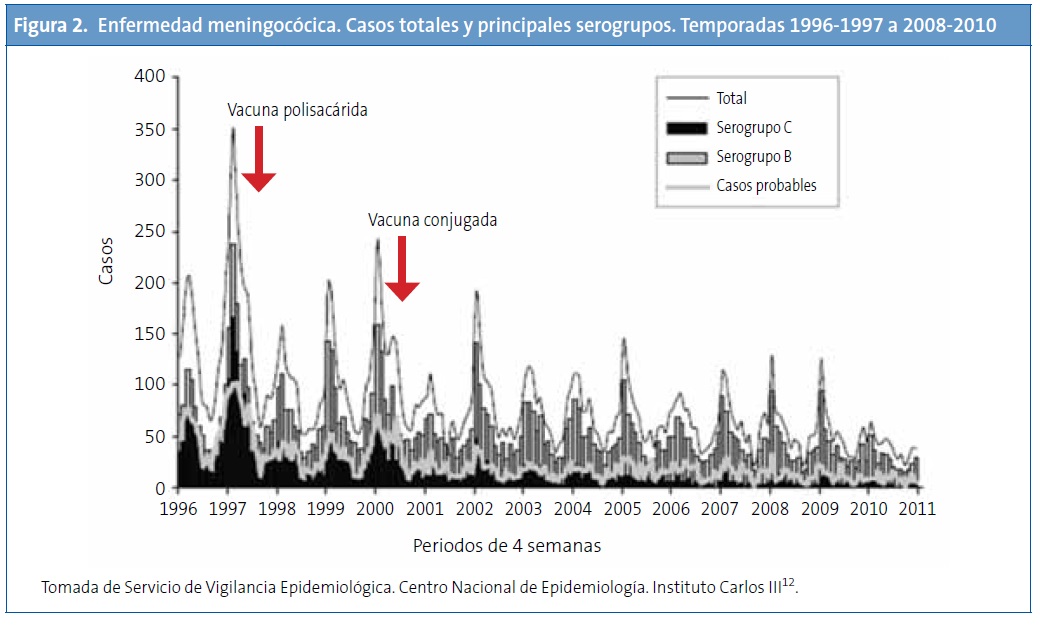
La Fig. 2 muestra también que la introducción de la vacuna conjugada ha reducido los casos producidos por el serogrupo C, mientras que la enfermedad por el serogrupo B ha presentado cambios menores12.
Vacunas contra el serogrupo B
El polisacárido capsular del serogrupo B tiene una elevada similitud antigénica con sacáridos del tejido neuronal humano y es poco inmunógeno en humanos. La utilización de polisacáridos del meningococo del serogrupo B para la fabricación de vacunas está limitada por el riesgo teórico de que estas vacunas vencieran la tolerancia inmunológica e indujeran autoinmunidad. Por ello, las estrategias para desarrollar vacunas para el serogrupo B se han centrado principalmente en antígenos no capsulares3,43.
Vacunas de vesículas de membrana externa (tipo outermembrane vesicle). Los primeros intentos de preparar una vacuna contra el serotipo B de N. meningitidis se hicieron con las vesículas de membrana externa Outer Membrane Vesicle (OMV), que contienen varios antígenos inmunogénicos, incluido un lipooligosacárido y la porina A (PorA). Sin embargo, el lipooligosacárido es una endotoxina para el huésped y, aunque se ha tratado de eliminar mediante detergentes, no se consigue del todo, lo que genera mayor reactogenicidad, por lo que ha sido desechado en la composición de estas vacunas. Así, el principal antígeno de este tipo de vacunas es la PorA44.
Aunque las vacunas basadas en OMV evocan una respuesta inmunológica robusta, la PorA es altamente variable en las cepas del serogrupo B45. Por este motivo, las vacunas basadas en este componente producen una respuesta inmunológica específica de la cepa. Además, en el lactante no es suficientemente inmunógena34,44,46.
Las vacunas tipo OMV son las únicas vacunas actualmente disponibles para controlar las epidemias causadas por una cepa hipervirulenta concreta de MenB y solo proporcionan una protección a corto plazo. Estas vacunas solo son efectivas en epidemias debidas a una cepa que exprese específicamente la PorA contenida en la vacuna.
Se han desarrollado vacunas OMV contra el MenB y se han usado en Cuba (de forma sistemática durante 20 años), en Noruega (en ensayos clínicos controlados), en Nueva Zelanda (en una epidemia)47, recientemente en Normandía (Francia)48 y hace años en Brasil49. Este hecho limita su uso en regiones como Norteamérica o Europa, donde la enfermedad por el serogrupo B se debe a una amplia variedad de serosubtipos36,37,44,45,50,51.
Los estudios con vacunas basadas en OMV muestran que una vacuna con múltiples antígenos probablemente cubrirá un mayor número de cepas de N. meningitidis, facilitando una repuesta inmunológica frente a un mayor número de cepas distintas y, por tanto, una mayor protección contra la enfermedad meningocócica44.
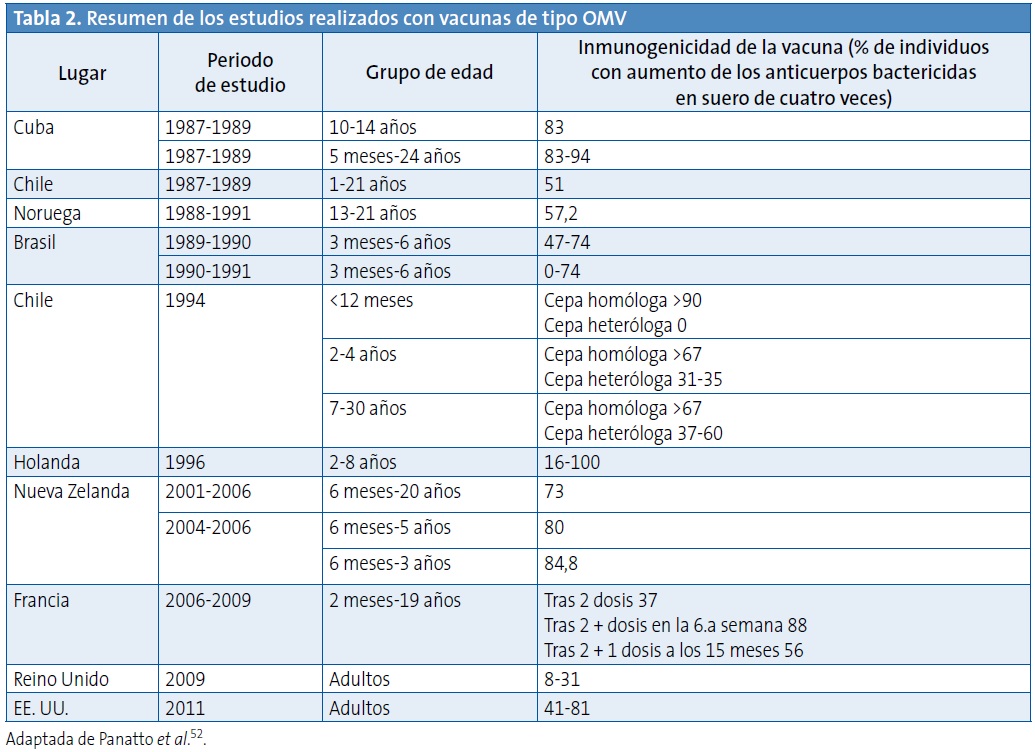
En la Tabla 2 se muestra un resumen de los estudios realizados con vacunas de tipo OMV52.
Vacunas de última generación. La considerable diversidad de las proteínas externas de la membrana que causan la enfermedad del serogrupo B, así como variaciones geográficas y posibles variaciones temporales, podrían limitar la utilidad de vacunas no capsulares3. Como se ha visto previamente, el desarrollo de una vacuna frente al subgrupo B se ha basado en diferentes antígenos candidatos, pero, por el momento, con pocos resultados34.
Vacuna rLP2086. En la actualidad, se están estudiando vacunas basadas en la proteína de unión al Factor H (Factor H binding protein [fHbp]), de la que hay dos familias: A y B. Por tanto, según la composición de las vacunas (conteniendo una o las dos familias de la proteína), estas podrán ser mono- o bivalentes. Se ha observado que la vacuna bivalente (en desarrollo por laboratorios Pfizer)53, compuesta por los dos tipos de fHBP, generó mayor actividad bactericida contra las cepas de MenB que expresaban estos tipos de fHBP que las vacunas monovalentes. El suero inmune de esta vacuna bivalente obtenido de conejos fue testado mediante el ensayo de la actividad bactericida del suero, o serum bactericidal activity (SBA), frente a diversas cepas de MenB, y se neutralizaron 87 de las 100 cepas testadas. El ensayo realizado con suero inmune humano neutralizó 36 de los 45 aislados. El mejor factor predictivo para la neutralización mediante el test de SBA fue el nivel de expresión de fHBP en la superficie in vitro34,54. La vacuna bivalente se encuentra en ensayos clínicos de fase III.
Vacuna 4 CMenB. Novartis Vaccines and Diagnostics ha desarrollado una nueva vacuna contra el serogrupo B, basada en cuatro componentes que, por su carácter novedoso y próxima disponibilidad, es objeto de un apartado específico.
VACUNA DE CUATRO COMPONENTES FRENTE AL MENINGOCOCO B: NUEVO DESARROLLO VACUNAL CONTRA EL MENINGOCOCO DEL SEROGRUPO B
Vacunología inversa
Tradicionalmente, las vacunas se han basado en el cultivo de un microorganismo en el laboratorio y en el aislamiento y posible manipulación de sus componentes. Luego se analiza la capacidad que tiene cada antígeno para inducir una respuesta inmunológica. Este método, además de requerir mucho tiempo para la identificación de antígenos válidos para vacunas, no sirve para vacunas contra patógenos que no tienen antígenos inmunodominantes, como los capsulares o las toxinas.
La Vacunología inversa parte de la secuencia genómica del microorganismo. Esta secuencia es estudiada mediante un software bioinformático específico que analiza marcos abiertos de lectura (Open Reading Frames [ORF]), es decir, genes conocidos y fragmentos de ADN que potencialmente pueden codificar diferentes tipos de proteínas de expresión de la superficie de la bacteria (aun sin conocer su función, regulación, etc.), estableciendo aquellas regiones que pueden tener ciertas funciones. Así, se consigue predecir los antígenos que tienen más probabilidades de ser candidatos para una vacuna. Tras la selección de estos antígenos, se preparan las vacunas con ellos y se testan en modelos animales, para desarrollar posteriormente la vacuna final55,56.
La técnica de la Vacunología inversa tiene la ventaja de que el genoma del microorganismo representa, virtualmente, un listado de todas las proteínas que el patógeno puede expresar en cualquier momento, independientemente de si se expresan in vivo o in vitro. De esta forma, es posible escoger las proteínas que potencialmente se expresan en la superficie, partiendo del genoma en vez del microorganismo55. No obstante, aun con algunas limitaciones (no permite detectar antígenos no proteicos, como los polisacáridos o glucolípidos56,57), ha supuesto un hito de gran impacto en el desarrollo de vacunas proteicas frente a microorganismos complejos.
Diseño de la vacuna de cuatro componentes frente al meningococo B mediante Vacunología inversa
El meningococo del serogrupo B representa el primer ejemplo de un desarrollo de vacunas exitoso mediante la Vacunología inversa56,57. Para preparar la vacuna, primero se realizó un cribado inicial del genoma de una cepa de MenB, que identificó alrededor de 600 ORF. Todos los ORF se amplificaron por PCR y se clonaron en Escherichia coli. En total, se expresaron 350 proteínas recombinantes, que se purificaron y se usaron para inmunizar ratones34,55,58,59.
Tras la inmunización de ratones con estas proteínas, se obtuvo suero que fue analizado mediante diferentes ensayos como el Western blot, para la confirmación de la expresión de las proteínas in vivo y su localización en la membrana externa, y las técnicas de análisis de inmunoabsorción ligada a las enzimas (enzyme-linked immunosorbent assay [ELISA]) y clasificación de células activadas por fluorescencia (fluorescence-activated cell sorter), para verificar su localización en la superficie. Posteriormente, se analizó la actividad bactericida del suero, para conocer la correlación con la protección en humanos. El análisis de inmunogenicidad identificó 28 antígenos proteicos con capacidad de producir anticuerpos bactericidas en suero34,55,58,59.
De estos 28 antígenos, algunos estaban muy conservados en un grupo de cepas de MenB y eran reconocidos por el suero de pacientes convalecientes de enfermedad meningocócica. Para priorizar entre los antígenos seleccionados, se consideró la capacidad de inducir una amplia protección a través de la SBA o la observada por protección pasiva en los ensayos realizados con crías de ratas y ratones. Los tres antígenos que cumplieron estos criterios fueron antígeno de Neisseria de unión a heparina (Neisserial heparin-binding antigen [NHBA]), o antígenos de Neisseria derivados del genoma (genome-derived neisserial antigens [GNA]) 2132, GNA1870 o fHbp y GNA1994 o adhesina A de Neisseria (Neisserial adhesin A [NadA]). Además, también se incluyeron los antígenos GNA1030 y GNA2091 porque indujeron inmunidad protectora en algunos ensayos y se fusionaron con NHBA y fHbp, respectivamente. Sin embargo, ninguno de ellos produjo suficiente respuesta protectora para cubrir todas las cepas probadas. Debido a que la combinación de varios antígenos en una vacuna confiere mejor protección, se combinaron los antígenos principales en una vacuna multicomponente60. La Fig. 3 muestra el proceso de obtención de la vacuna.
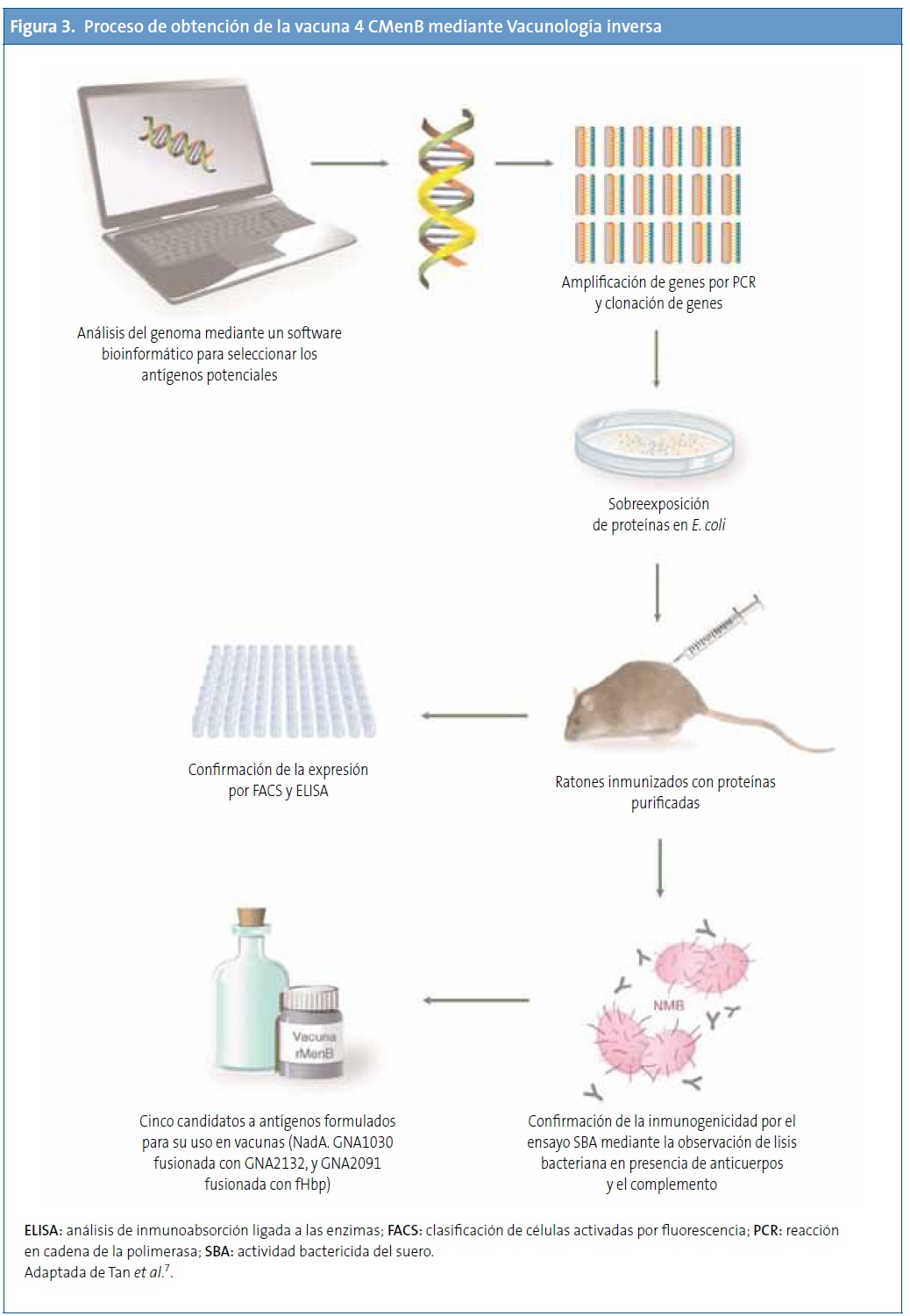
Componentes de la vacuna (antígenos) y dosis de cada componente
Inicialmente, la vacuna se formuló con tres componentes y se llamó vacuna recombinante (rMenB), e incluía los antígenos fHbp, NadA y NHBA. Posteriormente, se añadió la OMV de una cepa de Noruega (OMVnw) y se realizaron algunos ensayos con esta combinación (rMenB + OMVnw). Finalmente, se sustituyó la OMVnw por la cepa de Nueva Zelanda, que proporciona más cobertura, dando lugar a la rMenB + OMVnz o también 4 CMenB, por sus cuatro componentes34.
La vacuna se administra por vía intramuscular con una dosis de 0,5 ml. Contiene34,50,61:
- 50 µg de proteína recombinante de fusión NHBA de Neisseria meningitidis B.
- 50 µg de proteína recombinante NadA de Neisseria meningitidis B.
- 50 µg de proteína recombinante de fusión fHbp de Neisseria meningitidis B.
- 25 µg de OMV de Neisseria meningitidis B cepa NZ98/254, medidas como la cantidad de proteína que contiene el PorA P1.4.
Los componentes NadA, GNA2091-fHbp y NHBA-GNA1030 están absorbidos en 1,5 mg de hidróxido de aluminio, 3,25 mg de cloruro sódico y 10 mM de histidina.
Los antígenos incluidos en la vacuna tienen las siguientes funciones en la bacteria34:
- NadA: existen cinco variantes conocidas (Nad1-Nad5). Su función es promover la adhesión e invasión de las células epiteliales del huésped, por lo que puede tener un papel importante en los portadores de la enfermedad. Además, se une a las células dendríticas derivadas de los monocitos y a los macrófagos, lo que puede mejorar la respuesta inmunológica del NadA tras su ingestión y presentación a los linfocitos. Así, la creación de anticuerpos específicos contra esta proteína podría interferir en la colonización y, por tanto, prevenir el estado de portador, aunque se desconoce todavía el impacto real sobre la condición de portador.
- fHbp: es una lipoproteína de superficie de N. meningitidis y se clasifica según unos autores en tres variantes (1-3) y, según otros, en dos subfamilias (A para las variantes 2 y 3, y B para la variante 1). Esta lipoproteína se une al inhibidor de la vía alternativa al complemento del huésped (Factor H), evadiendo así la acción del complemento y aumentando la supervivencia de la bacteria. In vitro se ha visto que se une también a la enterobactina siderófora de la bacteria. Bloquear esta lipoproteína mejoraría la capacidad de nuestro sistema inmunológico para eliminar el microorganismo.
- NHBA: es una lipoproteína de superficie de N. meningitidis, objetivo de proteasas humanas y meningocócicas que, in vitro, se une a la heparina. En ausencia de la cápsula bacteriana, su unión a la heparina mejora la supervivencia de la bacteria en el suero humano y podría facilitar su unión a tejidos del huésped. No obstante, este antígeno es aún poco conocido.
- OMVnz: las vesículas OMV proceden de una cepa epidémica de Nueva Zelanda, NZ 98/254 (B:4:P1.7-2,4) y fueron utilizadas para la creación de vacunas para hacer frente a una epidemia en ese país62. Sin embargo, su protección es muy específica, ya que se debe principalmente a su antígeno inmunodominante PorA, que es muy variable. Su inclusión en la vacuna 4 CMenB incrementa su inmunogenicidad, además de ofrecer protección para las cepas que expresan el serosubtipo de PorA P1.4.
Para evaluar la inmunogenicidad de cada uno de los componentes proteicos de la vacuna 4 CMenB en los estudios clínicos, se utilizan cepas específicas que expresan exclusivamente uno de los antígenos y no los demás contenidos en la vacuna, con el objetivo de analizar de forma independiente la respuesta a cada uno de los cuatro componentes. En los ensayos clínicos, las cepas utilizadas son 44/76-SL (respuesta fHbp), NZ98/254 (respuesta PorA), 5/99 (respuesta NadA) y M10713 (respuesta NHBA), aunque esta cepa se identificó más tarde y se analizó solo en los estudios más recientes.
Desarrollo clínico y compatibilidad con otras vacunas
A continuación, se muestran 2 tablas (Tablas 3 y 4: ver publicación fuente en http://dx.doi.org/10.1016/j.anpedi.2013.04.013) con la información disponible de los ensayos clínicos realizados con la vacuna 4 CMenB y sus principales resultados34.
El desarrollo clínico de la vacuna muestra que es segura e inmunógena tanto en niños como en adultos, genera memoria inmunológica y es compatible con las vacunas de uso sistemático. Con respecto a la seguridad, en lactantes y niños menores de dos años, las reacciones adversas locales y sistémicas más comúnmente observadas fueron dolor agudo a la presión y eritema en el lugar de inyección, fiebre e irritabilidad. En los estudios clínicos en lactantes, la fiebre aparecía más frecuentemente cuando 4 CMenB se coadministraba con las vacunas sistemáticas que cuando se administraba sola. Cuando 4 CMenB se administró sola, la frecuencia de aparición de fiebre fue similar a la asociada con las vacunas sistemáticas administradas durante los ensayos clínicos. Cuando apareció la fiebre, normalmente siguió un patrón predecible y autolimitado (inicio a las seis horas, pico al segundo día, cese al tercer día), clínicamente poco significativo, y se puede prevenir con la administración profiláctica de paracetamol.
Cobertura vacunal (Meningococcal Antigen Typing System)
Para evaluar el impacto potencial de la vacuna 4 CMenB es necesario:
- Demostrar su inmunogenicidad mediante el ensayo de SBA con el complemento humano (hSBA) y calcular la tasa de protección a partir de los marcadores de protección subrogada aceptados.
- Calcular la cobertura de las cepas (proporción de cepas circulantes causantes de enfermedad en una región o país que son lisadas potencialmente por un suero inmune producido por la vacuna). El potencial de una vacuna frente al serogrupo B radica en este cálculo.
Hasta ahora, la eficacia de las vacunas frente a una enfermedad como esta, de baja incidencia, que impide realizar ensayos clínicos de eficacia por la necesidad de un gran número de participantes, ha sido asumida a través de parámetros subrogados de protección y, en el caso de la enfermedad meningocócica, a través de los resultados obtenidos en ensayos de SBA. Sin embargo, los ensayos de SBA han sido utilizados para demostrar la inmunogenicidad de esta nueva vacuna frente al serogrupo B, enfrentando los sueros de individuos inmunizados con las cuatro cepas de las que se habían obtenido los diferentes antígenos incluidos en la formulación vacunal60. Ahora bien, la realización de ensayos clínicos para medir la eficacia protectora en general, tal y como se ha hecho con vacunas de polisacárido conjugado, no es viable. En el caso de la evaluación de vacunas de polisacárido, el antígeno es común a todas las cepas de ese serogrupo, por lo que los sueros son enfrentados a una única cepa que expresa ese antígeno. En el caso de la vacuna de cuatro componentes frente al serogrupo B, habría que enfrentar cada suero a cientos de cepas que expresaran todas o la gran mayoría de las variantes antigénicas posibles, lo que, sin duda, es inviable.
El Meningococcal Antigen Typing System (MATS) es un método estandarizado y reproducible, que se ha desarrollado para evaluar la cobertura potencial de la vacuna 4 CMenB contra cepas individuales de meningococo, por el que se obtiene el porcentaje de muestras de meningococo que son susceptibles de ser neutralizadas por los anticuerpos inducidos por la vacuna71, aunque podría utilizarse para otras vacunas.
El MATS combina un enzimoinmunoensayo (ELISA) específico frente a cada uno de los antígenos vacunales, detectando diferencias cualitativas y cuantitativas en la expresión de dichos antígenos; se mide, pues, tanto la reactividad cruzada inmunológica como la cantidad de antígenos NHBA, NadA y fHbp expresados. Adicionalmente, se incluye la información del subtipo de PorA para incluir la cobertura potencial también con este antígeno. Los resultados obtenidos con el ELISA se han correlacionado con la lisis de las cepas en el ensayo de SBA, y se ha observado que los aislados que superan un valor de umbral (umbral bactericida positivo [positive bactericidal threshold – PBT]) en la prueba ELISA para cualquiera de los tres antígenos de la vacuna tienen ≥80% de probabilidad de ser neutralizados por el suero inmune en el ensayo de SBA. Aquellas cepas que resultan positivas para dos o más antígenos tienen una mayor probabilidad (96%) de ser lisadas en presencia de sueros de individuos inmunizados. El ensayo de MATS permite analizar grandes paneles de cepas y predecir la cobertura potencial de la vacuna.
Así pues, la cobertura vacunal de cepas se define como la proporción de las cepas circulantes que superan el PBT para, al menos, un antígeno de la vacuna (NadA, NHBA o fHbp) en el MATS o que se corresponden con el serosubtipo de la PorA del componente OMV de la vacuna (P1.4).
El MATS permite monitorizar posibles cambios de la población de MenB endémica en el tiempo, monitorizar la distribución de los antígenos vacunales entre aislados de MenB de portadores o enfermos tras la introducción de la vacuna y detectar la posible emergencia de variantes resistentes a la vacuna71,72. En un estudio realizado con un panel de 1052 cepas de MenB de cinco países europeos (EU5: Alemania, Francia, Inglaterra y Gales, Italia y Noruega), el MATS ha permitido predecir que un 73-87% serían cubiertas por 4 CMenB73. Los datos obtenidos en un estudio similar en España74 muestran una cobertura potencial del 69%, solo ligeramente inferior a la observada en el estudio EU5. Esta diferencia puede estar relacionada con una distribución diferente de las líneas clonales de meningococo asociadas a casos clínicos en España.
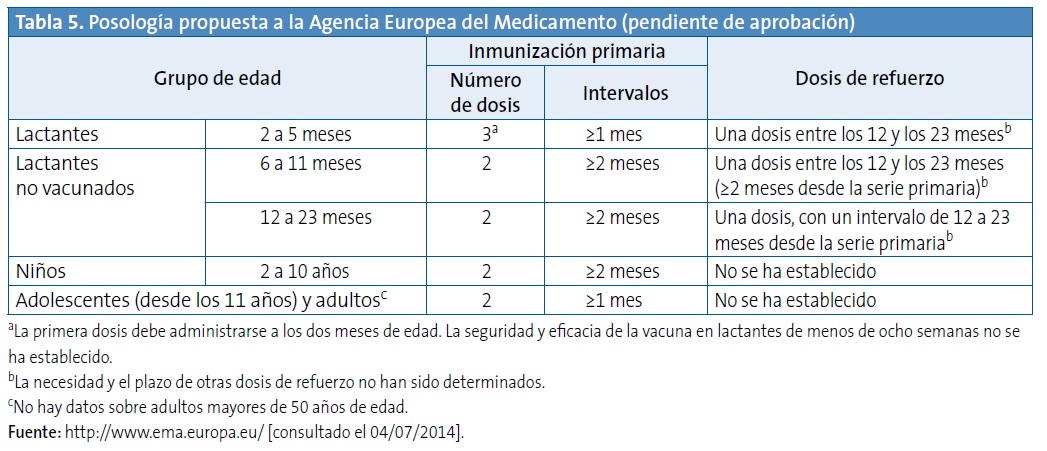
ESTRATEGIA DE VACUNACIÓN RECOMENDADA: POSOLOGÍA PROPUESTA A LA AGENCIA EUROPEA DEL MEDICAMENTO
La Tabla 5 recoge la posología propuesta a la Agencia Europea del Medicamento.
CONCLUSIONES
Las principales conclusiones del grupo de trabajo sobre la vacuna 4 CMenB del documento de consenso son las siguientes:
- La vacuna 4 CMenB es inmunógena y segura en lactantes, niños, adolescentes y adultos, e induce memoria inmunológica.
- La vacuna 4 CMenB tiene una reactogenicidad sistémica (incidencia de fiebre) mayor que las vacunas sistemáticas cuando se coadministra con ellas (aunque similar a las vacunas sistemáticas cuando se administra sola) y el patrón de fiebre es predecible y autolimitado.
- La vacuna 4 CMenB es compatible con la mayoría de las vacunas incluidas en el calendario sistemático español, pudiendo administrarse simultáneamente con las vacunas hexavalente y pentavalente actualmente disponibles, así como con la vacuna antineumocócica conjugada heptavalente. Aún no hay datos disponibles respecto al uso concomitante con la vacuna antimeningocócica C y las vacunas antineumocócicas de amplio espectro.
- La cobertura potencial de la nueva vacuna 4CMenB se estima que está entre el 70 y el 80% de las cepas circulantes en Europa.
- La vacuna 4 CMenB, en el momento actual, es la única estrategia disponible para prevenir la enfermedad meningocócica por el serogrupo B.
CONFLICTO DE INTERESES
D. Barranco D y P. Gorrotxategi Gorrotxategi declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
A. Gil declara haber participado en proyectos docentes y de investigación financiados por los laboratorios Sanofi, Pfizer, Crucell, GSK y Novartis.
J. Batalla ha recibido honorarios del laboratorio Novaris por participar como docente en una sesión de meningitis B.
J. M. Bayas ha recibido honorarios profesionales por conferencias, asesoramiento y participación en grupos de trabajo financiados por GSK, Sanofi Pasteur MSD, Laboratorios Esteve, Novartis y Pfizer. Además, ha sido investigador principal en ensayos clínicos promovidos por GSK y Sanofi Pasteur MSD.
M. Campins declara haber participado en proyectos docentes y de investigación financiados por los laboratorios Sanofi, Pfizer, Crucell, GSK y Novartis.
J. Lluch declara haber participado en proyectos docentes y de investigación financiados por los laboratorios Sanofi, Pfizer, Crucell, GSK y Novartis.
F. Martinón-Torres desarrolla su actividad investigadora gracias a la financiación del Instituto de Salud Carlos III (Intensificación de la actividad investigadora y FISPI1000540) del plan nacional de I+D+I y fondos FEDER.
M. J. Mellado ha recibido financiación para la realización de Cursos de actualización en Vacunas de GSK en 2006-2007, para la realización del Curso de Vacunas de la Asociación Española de Pediatría financiado por Sanofi Pasteur MSD y para la participación en el Foro de Vacunación Pediátrico de Rotavirus y Varicela 2011.
D. Moreno-Pérez ha colaborado en actividades docentes subvencionadas por GSK, Novartis, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GSK y como consultor en Advisory Board de Pfizer y Astra-Zeneca.
B. Uriel ha participado en asesorías para Novartis.
J. A. Vázquez declara que el laboratorio que dirige ha recibido y recibe fondos y ayuda para investigación de Baxter, Novartis, Pfizer, Sanofi-Pasteur, GSK y Laboratorios Esteve a través de diferentes convenios de colaboración.
COLABORACIÓN
El presente trabajo ha sido realizado con la colaboración del laboratorio Novartis Vaccines and Diagnostics.
ABREVIATURAS: ECDC: European Centre for Disease Prevention and Control ’ EDO: Enfermedades de Declaración Obligatoria ’ ELISA: enzyme-linked immunosorbent assay (análisis de inmunoabsorción ligada a las enzimas) ’ fHbp: factor H binding protein (proteína de unión al Factor H) ’ GNA: genome-derived neisserial antigens (antígenos de Neisseria derivados del genoma) ’ LCR: líquido cefalorraquídeo ’ MATS: Meningococcal Antigen Typing System ’ MenB: meningococo B ’ NadA: Neisserial adhesin A (adhesina A de Neisseria) ’ NHBA: Neisserial heparin-binding antigen (antígeno de Neisseria de unión a heparina) ’ OMV: Outer Membrane Vehicle (vesículas de membrana externa) ’ ORF: Open Reading Frames (marcos abiertos de lectura) ’ PBT: Positive Bactericidal Threshold (umbral bactericida positivo) • PCR: reacción encadena de la polimerasa ’ PorA: porina A ’ rMenB: vacuna recombinante frente al meningococo B ’ SBA: serum bactericidal activity (actividad bactericida del suero).
BIBLIOGRAFÍA
- World Health Organization. Meningococcal meningitis factsheet. December 2011 [en línea] [consultado el 18/09/2012]. Disponible en: http://www.who.int/mediacentre/factsheets/fs141/en/index.html
- Harrison LH, Trotter CL, Ramsay ME. Global epidemiology of meningococcal disease. Vaccine. 2009;27 Suppl 2:B51-63.
- Rosenstein NE, Perkins BA, Stephens DS, Popovic T, Hughes JM. Meningococcal disease. N Engl J Med. 2001;344:1378-88.
- Halperin SA, Bettinger JA, Greenwood B, Harrison LH, Jelfs J, Ladhani SN, et al. The changing and dynamic epidemiology of meningococcal disease. Vaccine. 2011;30 Suppl 2:B26-36.
- Schwartz B, Moore PS, Broome CV. Global epidemiology of meningococcal disease. Clin Microbiol Rev. 1989;2 Suppl:S118-24.
- Al-Tawfiq JA, Clark TA, Memish ZA. Meningococcal disease: The organism, clinical presentation, and worldwide epidemiology. J Travel Med. 2010;17 Suppl:3-8.
- Tan LK, Carlone GM, Borrow R. Advances in the development of vaccines against Neisseria meningitidis. N Engl J Med. 2010;362:1511-20.
- World Health Organization. Meningococcal vaccines: WHO position paper, November 2011. Weekly epidemiological record. 2011;47:521-40 [en línea]. Disponible en: http://www.who.int/wer/2011/wer8647.pdf
- European Centre for Disease Prevention and Control. Surveillance of invasive bacterial diseases in Europe 2008/2009. Surveillance reports [en línea] [consultado en noviembre de 2012]. Disponible en: http://www.ecdc.europa.eu/en/publications/Publications/1107 SUR IBD 2008-09.pdf
- Comenzó vacunación preventiva contra la meningitis en Peñalolén. Terra Noticias, 22 de octubre de 2012 [en línea] [consultado en noviembre de 2012]. Disponible en: http://goo.gl/XUsnC0
- World Health Organization. Meningococcal vaccines: WHO position paper. November 2011.
- Servicio de Vigilancia Epidemiológica. Centro Nacional de Epidemiología. Instituto Carlos III. Comentario epidemiológico de las enfermedades de declaración obligatoria y sistema de información microbiológica. España. Año 2010. Bol Epidemiol Sem. 2011;19:100-16.
- Cano R, Garrido M. Enfermedad meningocócica en España. Análisis de la temporada 2006-2007. Bol Epidemiol Sem. 2008;16:73-84.
- Gil-Prieto R, García-García L, Álvaro-Meca A, González-Escalada A, Viguera Ester P, Gil de Miguel A. The burden of hospitalizations for meningococcal infection in Spain (1997-2008). Vaccine. 2011;29:5765-70.
- Boletín Epidemiolóxico de Galicia. A enfermdade meningocócica en Galicia: Tempada 1995/96. 1996; IX.
- Brigham KS, Sandora TJ. Neisseria meningitidis: Epidemiology, treatment and prevention in adolescents. Curr Opin Pediatr. 2009;21:437-43.
- Visintin C, Mugglestone MA, Fields EJ, Jacklin P, Murphy MS, Pollard AJ. Management of bacterial meningitis and meningococcal septicaemia in children and young people: Summary of NICE guidance. BMJ. 2010;340:c3209.
- Edmond K, Clark A, Korczak VS, Sanderson C, Griffiths UK, Rudan I. Global and regional risk of disabling sequelae from bacterial meningitis: A systematic review and meta-analysis. Lancet Infect Dis. 2010;10:317-28.
- Viner RM, Booy R, Johnson H, Edmunds WJ, Hudson L, Bedford H, et al. Outcomes of invasive meningococcal serogroup B disease in children and adolescents (MOSAIC): A case-control study. Lancet Neurol. 2012;11:774-83.
- Orr HJ, Gray SJ, Macdonald M, Stuart JM. Saliva and meningococcal transmission. Emerg Infect Dis. 2003;9:1314-5.
- Department of Health, Victoria, Australia. Infectious diseases. Epidemiology and surveillance [en línea] [consultado en febrero de 2012]. Disponible en: ideas.health.vic.gov.au/bluebook/meningococcal.asp
- Caugant DA, Maiden MC. Meningococcal carriage and disease-population biology and evolution. Vaccine. 2009;27 Suppl2:B64-70.
- Fernández S, Arreaza L, Santiago I, Malvar A, Berron S, Vázquez JA, et al. Impact of meningococcal vaccination with combined serogroups A and C polysaccharide vaccine on carriage of Neisseria meningitidis C. J Med Microbiol. 2003;52:75-7.
- Claus H, Maiden MC, Wilson DJ, McCarthy ND, Jolley KA, Urwin R, et al. Genetic analysis of meningococci carried by children and young adults. J Infect Dis. 2005;191:1263-71.
- Cartwright KA, Stuart JM, Jones DM, Noah ND. The Stonehouse survey: Nasopharyngeal carriage of meningococci and Neisseria lactamica. Epidemiol Infect. 1987;99:591-601.
- Caugant DA, Hoiby EA, Magnus P, Scheel O, Hoel T, BjuneG, et al. Asymptomatic carriage of Neisseria meningitidis in a randomly sampled population. J Clin Microbiol. 1994;32:323-30.
- MacLennan J, Kafatos G, Neal K, Andrews N, Cameron JC, Roberts R, et al. Social behavior and meningococcal carriage in British teenagers. Emerg Infect Dis. 2006;12:950-7.
- Guzman-Cottrill J, Nadel S, Goldstein B. The systemic inflammatory response syndrome (SIRS), sepsis, and septic shock. En: Long SS, Pickering LK, Prober CG (eds.). Principles and practice of pediatric infectious diseases. 3rd ed. Philadelphia: Churchill Livingstone; 2008. p. 99-110.
- Pollard A, Finn A. Neisseria meningitidis. En: Long SS, Pickering LK, Prober CG (eds.). Principles and practice of pediatric infectious diseases. 3rd ed. Philadelphia: Churchill Livingstone Elsevier; 2008. p. 99-110.
- Van den Bruel A, Haj-Hassan T, Thompson M, Buntinx F, Mant D. Diagnostic value of clinical features at presentation to identify serious infection in children in developed countries: a systematic review. Lancet. 2010;375:834-45.
- Van Deuren M, Brandtzaeg P, van der Meer JW. Update on meningococcal disease with emphasis on pathogenesis and clinical management. Clin Microbiol Rev. 2000;13:144-66.
- World Health Organization. Meningococcal meningitis factsheet. December 2010 [en línea] [consultado el 23/10/2010]. Disponible en: http://www.who.int/mediacentre/factsheets/fs141/en/index.html
- American Academy of Paediatrics. Meningococo, infecciones. En: Pickering LK, Baker CJ, Kimberlyn DW, Long SS (dirs.). Red Book: Enfermedades Infecciosas en Pediatria. 28.ª ed. México: Editorial Médica Panamericana; 2011. p. 479-87.
- Bai X, Findlow J, Borrow R. Recombinant protein meningococcal serogroup B vaccine combined with outer membrane vesicles. Expert Opin Biol Ther. 2011;11:969-85.
- Harrison LH, Pelton SI, Wilder-Smith A, Holst J, Safadi MA, Vazquez JA, et al. The Global Meningococcal Initiative: Recommendations for reducing the global burden of meningococcal disease. Vaccine. 2011;29:3363-71.
- Safadi MA, McIntosh ED. Epidemiology and prevention of meningococcal disease: A critical appraisal of vaccine policies. Expert Rev Vaccines. 2011;10:1717-30.
- Yogev R, Tan T. Meningococcal disease: The advances and challenges of meningococcal disease prevention. Hum Vaccin. 2011;7:828-37.
- Kriz P, Wieffer H, Holl K, Rosenlund M, Budhia S, Vyse A. Changing epidemiology of meningococcal disease in Europe from the mid-20th to the early 21st Century. Expert Rev Vaccines. 2011;10:1477-86.
- De Greeff SC, de Melker HE, Spanjaard L, Schouls LM, van Derende A. Protection from routine vaccination at the age of 14 months with meningococcal serogroup C conjugate vaccine in the Netherlands. Pediatr Infect Dis J. 2006;25:79-80.
- Larrauri A, Cano R, García M, Mateo S. Impact and effectiveness of meningococcal C conjugate vaccine following its introduction in Spain. Vaccine. 2005;23:4097-100.
- Grupo de trabajo de enfermedad meningocócica de la ponencia de programa y registro de vacunación. Situación actual de la enfermedad meningocócica en España. Modificación de la pauta de vacunación frente meningitis C. Ministerio de Sanidad y Consumo, 2005.
- Cano R, Garrido M. Centro Nacional de Epidemiología, Instituto de Salud Carlos III. Enfermedad meningocócica en España. Análisis de la temporada 2006-2007. Bol Epidemiol Sem. 2008;16:73-6.
- Abad R, Vázquez JA. Microbiology and public health: new challenges in surveillance and control of meningococcal disease. Enferm Infecc Microbiol Clin. 2012;30:53-5.
- Principi N, Esposito S. Universal protein vaccines against Neisseria meningitidis serogroup B, Streptococcus pneumoniae and influenza. Hum Vaccin. 2011;7:905-12.
- Alcalá B, Salcedo C, Arreaza L, Abad R, Enríquez R, de la Fuente L, et al. Antigenic and/or phase variation of PorA protein in non-subtypable Neisseria meningitidis strains isolated in Spain. J Med Microbiol. 2004;53:515-8.
- Su EL, Snape MD. A combination recombinant protein and outermembrane vesicle vaccine against serogroup B meningococcal disease. Expert Rev Vaccines. 2011;10:575-88.
- O’Hallahan J, McNicholas A, Galloway Y, O’Leary E, Roseveare C. Delivering a safe and effective strain-specific vaccine to control an epidemic of group B meningococcal disease. N Z Med J. 2009;122:48-59.
- Rouaud P, Perrocheau A, Taha MK, Sesboue C, Forgues AM, Parent du Chatelet I, et al. Prolonged outbreak of B meningococcal disease in the Seine-Maritime department, France, January 2003 to June 2005. Euro Surveill. 2006;11:178-81.
- De Moraes JC, Perkins BA, Camargo MC, Hidalgo NT, Barbosa HA, Sacchi CT, et al. Protective efficacy of a serogroup B meningococcal vaccine in Sao Paulo, Brazil. Lancet. 1992;340:1074-8.
- Snape MD, Dawson T, Oster P, Evans A, John TM, Ohene-Kena B, et al. Immunogenicity of two investigational serogroup B meningococcal vaccines in the first year of life: A randomized comparative trial. Pediatr Infect Dis J. 2010;29:e71-9.
- Vázquez JA, Marcos C, Berron S. Sero/subtyping of Neisseria meningitidis isolated from patients in Spain. Epidemiol Infect. 1994;113:267-74.
- Panatto D, Amicizia D, Lai PL, Gasparini R. Neisseria meningitidis B vaccines. Expert Rev Vaccines. 2011;10:1337-51.
- Richmond PC, Marshall HS, Nissen MD, Jiang Q, Jansen KU, Garces-Sanchez M, et al. Safety, immunogenicity, and tolerability of meningococcal serogroup B bivalent recombinant lipoprotein 2086 vaccine in healthy adolescents: A randomised, single-blind, placebo-controlled, phase 2 trial. Lancet Infect Dis. 2012;12:597-607.
- Jiang HQ, Hoiseth SK, Harris SL, McNeil LK, Zhu D, Tan C, et al. Broad vaccine coverage predicted for a bivalent recombinant factor H binding protein based vaccine to prevent serogroup B meningococcal disease. Vaccine. 2010;28:6086-93.
- Serruto D, Adu-Bobie J, Capecchi B, Rappuoli R, Pizza M, Masignani V. Biotechnology and vaccines: Application of functional genomics to Neisseria meningitidis and other bacterial pathogens. J Biotechnol. 2004;113:15-32.
- Rappuoli R. Reverse vaccinology, a genome-based approach to vaccine development. Vaccine. 2001;19:2688-91.
- Moriel DG, Scarselli M, Serino L, Mora M, Rappuoli R, Masignani V. Genome-based vaccine development: A short cut for the future. Hum Vaccin. 2008;4:184-8.
- Pizza M, Scarlato V, Masignani V, Giuliani MM, Arico B, Comanducci M, et al. Identification of vaccine candidates against serogroup B meningococcus by whole-genome sequencing. Science. 2000;287:1816-20.
- Seib KL, Zhao X, Rappuoli R. Developing vaccines in the era of genomics: A decade of reverse vaccinology. Clin Microbiol Infect. 2012;18 Suppl 5:109-16.
- Giuliani MM, Adu-Bobie J, Comanducci M, Arico B, Savino S, Santini L, et al. A universal vaccine for serogroup B meningococcus. Proc Natl Acad Sci U S A. 2006;103:10834-9.
- Toneatto D, Oster P, de Boer AC, Emerson A, Santos GF, Ypma E, et al. Early clinical experience with a candidate meningococcal B recombinant vaccine (rMenB) in healthy adults. Hum Vaccin. 2011;7:781-91.
- Oster P, Lennon D, O’Hallahan J, Mulholland K, Reid S, Martin D. MeNZB: A safe and highly immunogenic tailor-made vaccine against the New Zealand Neisseria meningitidis serogroup B disease epidemic strain. Vaccine. 2005;23:2191-6.
- Findlow J, Borrow R, Snape MD, Dawson T, Holland A, John TM, et al. Multicenter, open-label, randomized phase II controlled trial of an investigational recombinant Meningococcal serogroup B vaccine with and without outer membrane vesicles, administered in infancy. Clin Infect Dis. 2010;51:1127-37.
- Philip J, Snape MD, Robinson H, Kelly S, Pollard AJ, John TM, et al. Bactericidal antibody persistence two years following meningococcal B vaccination at 6, 8, and 12 months in 40-month old children. En: Poster presented at the European Society for Paediatric Infectious Diseases (ESPID) annual meeting. 2012. Poster No 653 [en línea]. Disponible en: www.epostersonline.com/espid2012/?q=node/4811
- Saroey P, Snape MD, John TM, Robinson H, Kelly S, Gossger N, et al. Persistence of bactericidal antibodies following early infant immunisation with serogroup B meningococcal vaccines and immunogenicity of pre-school booster doses-a follow-on study. En: Poster presented at the European Society for Paediatric Infectious Diseases (ESPID) annual meeting. 2012. Poster No 664.
- Gossger N, Snape MD, Yu LM, Finn A, Bona G, Esposito S, et al. Immunogenicity and tolerability of recombinant serogroup B meningococcal vaccine administered with or without routine infant vaccinations according to different immunization schedules: A randomized controlled trial. JAMA. 2012;307:573-82.
- Vesikari T, Esposito S, Kimura A, Kleinschmidt A, Ypma E, Toneatto D, et al. Immunogenicity of an investigational, multicomponent, meningococcall serogroup B vaccine in healthy infants at 2, 4, and 6 months of age. En: Presented at: International Pathogenic Neisseria Conference. 2010. Poster No 180 [en línea]. Disponible en: http://neisseria.org/ipnc/2010/IPNC_2010_abstracts.pdf
- Esposito S, Vesikari T, Kimura A, Ypma E, Toneatto D, Dull P. Tolerability of a three-dose schedule of an investigational, multicomponent, meningococcal serogroup B vaccine and routine infant vaccines in a lot consistency trial. En: Presented at International Pathogenic Neisseria Conference. 2010. Poster No 182 [en línea]. Disponible en: http://neisseria.org/ipnc/2010/IPNC_2010_abstracts.pdf
- Prymula R, Vesikari T, Esposito T, Kohl I, Ypma E, Toneatto D, et al. Catch-up vaccination of healthy toddlers with an investigational multicomponent meningococcal serogroup b vaccine (4 cmenb)-exploration of a two-dose schedule. En: Present at 29th ESPID Meeting. 2011. Poster No 706.
- Santolaya ME, O’Ryan ML, Valenzuela MT, Prado V, Vergara R, Munoz A, et al. Immunogenicity and tolerability of a multicomponent meningococcal serogroup B (4 CMenB) vaccinein healthy adolescents in Chile: a phase 2b/3 randomised, observer-blind, placebo-controlled study. Lancet. 2012;379:617-24.
- Donnelly J, Medini D, Boccadifuoco G, Biolchi A, Ward J, Frasch C, et al. Qualitative and quantitative assessment of meningococcal antigens to evaluate the potential strain coverage of protein-based vaccines. Proc Natl Acad Sci U S A. 2010;107:19490-5.
- Plikaytis BD, Stella M, Boccadifuoco G, Detora LM, Agnusdei M, Santini L, et al. Interlaboratory standardization of the sandwich enzyme-linked immunosorbent assay designed for MATS, a rapid, reproducible method for estimating the strain coverage of investigational vaccines. Clin Vaccine Immunol. 2012;19:1609-17.
- Donnelly J, Medini D, Boccadifuoco G, Biolchi A, Ward J, Frasch C, et al. Estimating the potential strain coverage in Europe of a multicomponent vaccine targeting serogroup b meningococci. En: Oral communication presented at: 11th meeting of The European Meningococcal Disease Society (EMGM). 2011 [en línea]. Disponible en: http://emgm.eu/meetings/emgm2011/abstracts.pdf
- Abad R, Orlandi L, Rigat F, Boccadifuoco G, Comanducci M, Muzzi A, et al. Strain coverage of a meningococcal multicomponent (4 CMenB) vaccine in Spain. En: XVIII International Pathogenic Neisseria Conference. 2012 [en línea]. Disponible en: http://www.conventus.de/index.php?id=ipnc2012-abstracts





